刚毛柽柳ThZFP3基因的耐盐抗旱功能
摘 要:【目的】锌指蛋白(ZFP,Zinc Finger Proteins)是植物中的一类重要的转录调控因子,在植物生长发育、逆境胁迫应答等方面具有重要的作用。通过分析刚毛柽柳Tamarix hispida锌指蛋白基因ThZFP3的耐盐、抗旱功能,为林木抗逆遗传改良提供了理论基础。【方法】在通过蘸花法获得过表达ThZFP3转基因拟南芥;在NaCl和Mannitol(甘露醇)胁迫下,观察转基因和对照拟南芥的萌芽成活率、根长、鲜质量和表型变化;在利用农杆菌瞬时转化体系获得瞬时过表达(OE)、抑制表达(RNAi)和对照(Control)转基因刚毛柽柳,胁迫下分别对三种转基因柽柳进行组织化学染色和抗逆相关生理指标测定,鉴定ThZFP3基因的抗旱、耐盐能力。【结果】在胁迫条件下,转基因拟南芥的萌芽成活率、根长、鲜质量和长势均优于野生型,表明ThZFP3基因可提高转基因拟南芥的抗旱耐盐能力;过表达ThZFP3基因显著增强了刚毛柽柳中POD和SOD的活性,从而减少活性氧(ROS)的积累;过表达ThZFP3基因可以减少刚毛柽柳中MDA的积累、降低电解质渗透率,保护细胞膜的完整。【结论】过表达ThZFP3基因可以提高刚毛柽柳体内ROS清除能力,降低细胞损伤程度,从而提高刚毛柽柳的抗旱耐盐能力。
关键词:刚毛柽柳;CCCH型锌指蛋白;耐盐;抗旱
中图分类号:S718.43 文献标志码:A 文章编号:1673-923X(2024)08-0139-11
基金项目:国家自然科学基金项目(31870665);黑龙江省自然科学基金项目(LH2021C013)。
Salt tolerance and drought resistance function of ThZFP3 gene in Tamarix hispida
HAN Gang, JIA Yuanyuan, ZHU Zhenyu, ZHAO Xin, NIU Yi, WANG Xiaodong, CUI Tianxiang, WANG Chao
(College of Forestry, Northeast Forestry University, State Key Laboratory of Tree Genetics and Breeding, Harbin 150040, Heilongjiang, China)
Abstract:【Objective】Zinc finger proteins are a major class of important transcription regulatory factors in plants, playing important roles in plant growth and development, and stress response. The salt tolerance and drought resistance function of ThZFP3 of Tamarix hispida zinc finger protein gene was analyzed to provide a theoretical basis for genetic improvement of tree resistance.【Method】Arabidopsis thaliana was transformed with ThZFP3 using the floral dip method. The germination survival rate, root length, fresh mass, and phenotypic changes of the transgenic and control A. thaliana were observed under NaCl and mannitol stress. Transient overexpression(OE), inhibited expression (RNAi) and control transgenic Tamarix were obtained using the Agrobacterium transient transformation system. Three transgenic Tamarix plants were histochemically stained and stress-related physiological indexes were measured to identify the drought resistance and salt tolerance of the ThZFP3 gene.【Result】Under stress conditions, the germination survival rate, root length, fresh mass, and growth vigor of transgenic Arabidopsis were superior to wild-type strains, indicating that the ThZFP3 gene improved the drought and salt tolerance of transgenic Arabidopsis. Overexpression of the ThZFP3 gene significantly enhanced the activities of POD and SOD in T. hispida, thereby reducing the accumulation of reactive oxygen species (ROS); Overexpression of the ThZFP3 gene reduced the accumulation of MDA and electrolyte permeability in T. hispida, protecting the integrity of cell membranes.【Conclusion】Overexpression of the ThZFP3 gene can improve the ROS scavenging ability within the body of T. hispida, reduce the degree of cell damage, and thus improve its drought resistance and salt tolerance.
Keywords: Tamarix hispida; CCCH zinc finger protein; salt tolerance; drought resistance
植物在生长过程中会受到干旱、盐碱等多种非生物逆境胁迫的影响[1-2]。在长期进化过程中,植物已经形成了有效的保护机制,大量抗逆基因构成精密的分子调控网络,共同参与调节植物的抗逆性。转录因子作为主要的调控因子,通过调节下游基因的表达来调节植物的抗逆反应,从而使植物感知并适应逆境胁迫。目前,一些转录因子,如AP2/EREBP、bZIP、MYB、NAC、bHLH等,已经被证实在植物逆境胁迫应答过程中发挥重要作用[3]。因此,挖掘并鉴定抗逆相关的转录因子,对于利用基因工程进行植物抗逆遗传改良具有重要意义。
锌指蛋白是包含锌指结构域的一类转录因子。锌指结构域的特征是肽链中氨基酸残基通过结合Zn2+后自我折叠形成的稳定的、短的“手指状”空间结构。锌指蛋白通常由一系列锌指结构组成,具有重复结构的氨基酸模式,相隔特定距离的胱氨酸结合锌指,能与某些DNA、RNA、DNARNA结合,以及与自身或其他锌指蛋白结合[4]。由于其自身的结构特点,可以选择性地结合特异的靶结构,在转录和翻译水平上调控基因的表达,在植物细胞分化、胚胎发育、应激响应等生命过程中发挥重要作用[4]。锌指蛋白家族成员数量庞大,根据ZFP结构中半胱氨酸(Cys)和组氨酸(His)残基的序列和数量,ZFP转录因子分为九个亚家族,即C2H2、C2HC、C2HC5、C3H、C3HC4、C4HC3、Cys4、C6和C8[5]。不同种属间锌指蛋白在锌指结构数量和分布上存在很大差异,这也预示着锌指蛋白转录因子在功能上的多样性和调控机制上的复杂性。
大量研究表明,多种锌指蛋白可以被高盐、干旱、低温以及病原菌等逆境胁迫诱导,参与植物的生物和非生物抗逆胁迫过程[6]。Sun等[7]通过水稻微阵列分析确定了一个含有两个典型的C2H2锌指结构域的锌指蛋白基因(ZFP179),该基因被高盐、干旱等胁迫诱导,说明ZFP179基因参与了植物逆境胁迫的响应过程。与非转基因水稻相比,过表达水稻C2H2锌指蛋白基因OsCTZFP8的转基因植株表现出耐低温表型[8]。拟南芥C2H2型锌指蛋白AtZAT6通过直接结合防御相关基因(EDS1、PAD4、PR1、PR2和PR5)的启动子区域中的TACAAT基序,正调控拟南芥对丁香假单胞杆菌Pseudomonas syringae的抗性[9]。以上研究表明,锌指蛋白在植物应答环境胁迫的过程中发挥了重要的调控作用。目前,对植物锌指蛋白的研究主要集中在C2H2型,其他类型的锌指蛋白受到的关注相对较少,而在木本植物中相关信息更是十分有限。
刚毛柽柳Tamarix.hispida是一种盐生木本植物,可在荒漠、盐碱地上生长,是优良的防风固沙植物[10]。刚毛柽柳具有极强的抗逆能力,其体内蕴藏着大量的抗逆基因资源,是分离抗旱、耐盐基因的理想物种。在前期研究中,本课题组从刚毛柽柳中鉴定了一条响应盐和干旱胁迫的CCCH型锌指蛋白基因ThZFP3[11]。为了进一步明确ThZFP3的生物学功能,本研究将该基因转入拟南芥和刚毛柽柳中,通过比较转基因植株和对照植株在盐和干旱胁迫下的表型及生理指标的差异,探究ThZFP3基因在刚毛柽柳抗旱、耐盐过程中的作用及其参与的生理调节途径。本研究为林木抗逆分子育种提供了理论依据和有效的基因资源。
1 材料与方法
1.1 植物材料
野生型拟南芥和刚毛柽柳组培苗取自东北林业大学林木遗传育种全国重点实验室,在人工气候室内(温度22±2 ℃,光照时间16 h/d,光照强度400 μmol·m-2·s-1,相对湿度(65%~75%)培养。
1.2 植物表达载体与菌株
植物过表达载体pROKⅡ、植物抑制表达载体pFGC5941、大肠杆菌感受态DH5α和根癌农杆菌感受态EHA105保存于东北林业大学林木遗传育种全国重点实验室。
1.3 柽柳ThZFP3基因植物表达载体的构建
根据植物过表达载体pROKⅡ和目的基因ThZFP3的融合特性引入了限制性内切酶SmaⅠ位点,设计引物pROKⅡ-ThZFP3-F和pROKⅡ-ThZFP3-R(表1),以pMD18-T-ThZFP3为模板进行PCR扩增ThZFP3基因,将目的基因连接到经SmaⅠ酶切后的pROKⅡ载体上,转化大肠杆菌,对阳性克隆进行测序鉴定。将测序成功的质粒命名为pROKⅡ-ThZFP3,并利用电击法转化至根癌农杆菌EHA105中备用。
根据植物抑制表达载体pFGC5941和目的基因ThZFP3的融合特性分别设计引物pFGC5941-Cis-ThZFP3-F和pFGC5941-Cis-ThZFP3-R(表1),选择AscⅠ作为酶切位点,用上述方法将ThZFP3正义链基因片段连接到pFGC5941载体上,对阳性克隆进行测序鉴定。将测序成功的质粒命名为pFGC5941-Cis-ThZFP3。设计引物pFGC5941-AntiThZFP3-F和pFGC5941-Anti-ThZFP3-R(表1),选择XbaⅠ作为酶切位点,用上述方法将ThZFP3反义链基因片段连接到pFGC5941-ThZFP3-Cis载体上,对阳性克隆进行测序鉴定。将测序成功的质粒命名为pFGC5941-ThZFP3,并利用电击法转化至根癌农杆菌EHA105中备用。
1.4 ThZFP3转基因拟南芥的获得
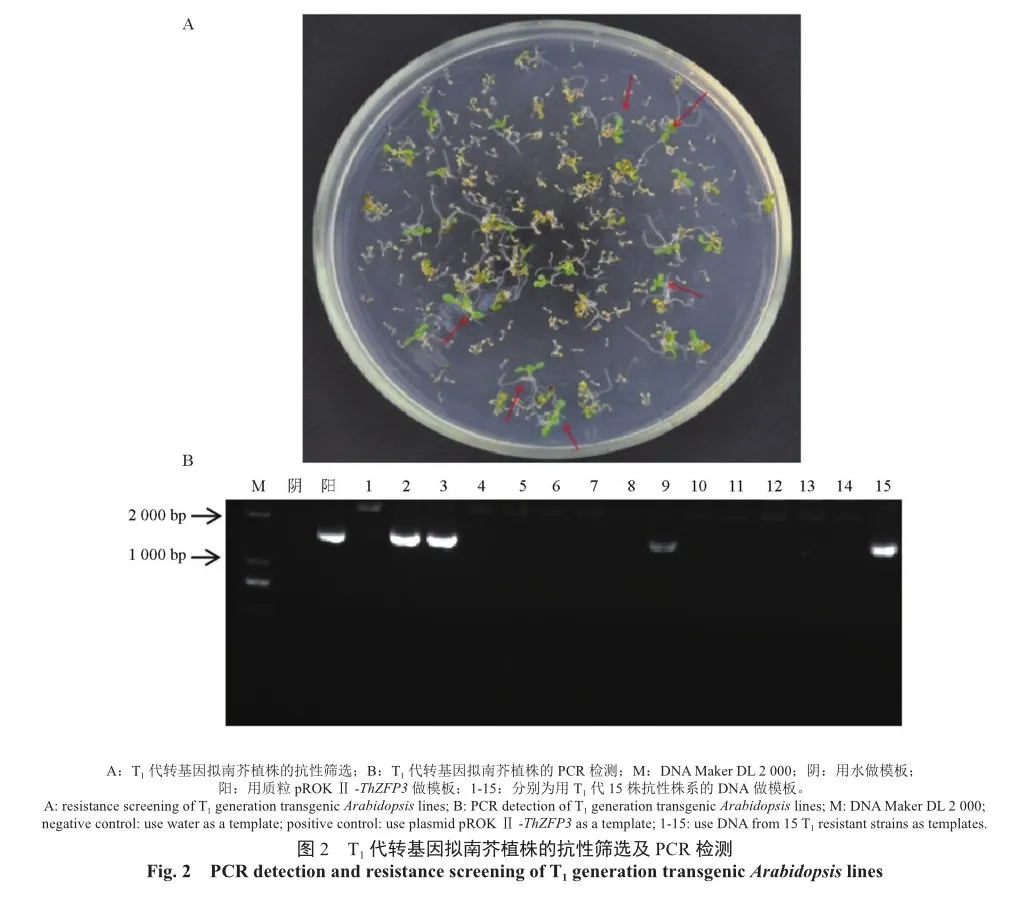
当拟南芥大量开花时用蘸花法侵染盛花期的拟南芥植株,约1个月时收集种子(即为T0代种子)。将种子消毒后在含50 mg/L卡那霉素的抗性培养基上培养2周左右,筛选能够发芽长出真叶并正常生长的阳性转基因幼苗,记为T1代。将T1代拟南芥在人工土壤中培养4周左右,对T1代各转基因拟南芥株系提取DNA进行验证,选取鉴定成功的阳性植株并继续进行T2和T3代转基因拟南芥的培养与筛选,收取T3代纯合种子用于后续试验。
1.5 ThZFP3转基因拟南芥的胁迫处理
首先对野生型和T3代纯合拟南芥种子进行消毒处理,随后在1/2MS固体培养基上播种培养。为了明确拟南芥种子在不同处理条件下的萌芽成活率,分别在含100 mmol/L NaCl及含150 mmol/L Mannitol的抗性培养基上播种培养,每次试验大约用90粒种子,第6天统计拟南芥在不同处理条件下的萌芽成活率。为了进一步对拟南芥各转基因株系进行观察,将在1/2 MS固体培养基上培养6 d左右且长势相同的各株系的幼苗分别转移到上述抗性培养基和人工土壤中竖直培养,7 d后对抗性培养基中各株系在不同处理条件下的根长和鲜质量进行统计。4周左右分别对人工土壤中的拟南芥土培苗进行250 mmol/L NaCl和350 mmol/L Mannitol胁迫处理,并以清水处理作为对照,第7天观察处理后的不同株系的胁迫表型并拍照。
1.6 ThZFP3瞬时表达刚毛柽柳的获得
为了研究ThZFP3基因在瞬时表达刚毛柽柳中的表达情况,取EHA105-pROKⅡ-ThZFP3(OE)、EHA105-pFGC5941-ThZFP3(RNAi)和阳性对照EHA105-pROKⅡ(Control)菌种瞬时侵染4周左右、大小和生长状态一致的刚毛柽柳组培苗,用CTAB法分别在0、12、24、48、72 h对侵染后的过表达(OE)、抑制表达(RNAi)和对照(Control)瞬时转化植株提取总RNA(每个株系植株不少于3株),并用反转录试剂盒将总RNA反转录成cDNA。设计ThZFP3基因定量引物RTThZFP3-F和RT-ThZFP3-R(表1),选取刚毛柽柳Actin(GenBank登录号:FJ618517)和β-tubulin(GenBank登录号:FJ618519)为内参基因[12],引物序列见表1。将cDNA稀释十倍作为模板,进行实时荧光定量RT-PCR,每个样品重复3次,用2-ΔΔCT方法进行基因的相对定量分析[13]。
1.7 非生物胁迫下ThZFP3瞬时表达刚毛柽柳的组织化学染色
根据实时荧光定量RT-PCR的分析结果,在含150 mmol/L NaCl及200 mmol/L Mannitol的抗性培养基上对瞬时浸染后共培养24 h的刚毛柽柳胁迫处理0、1和2 h,以1/2 MS固体培养基上的刚毛柽柳作为对照处理。用蒸馏水将处理后的刚毛柽柳洗涮干净,各处理各时间点各株系各取3棵刚毛柽柳分别放入含100 mL DAB、NBT和Evans blue化学染色液的200 mL锥形瓶中,25 ℃过夜染色。用75%乙醇加醋酸进行过夜脱色、拍照[14]。
1.8 非生物胁迫下ThZFP3瞬时表达刚毛柽柳的生理生化指标测定
根据实时荧光定量RT-PCR的分析结果,在含150 mmol/L NaCl及200 mmol/L Mannitol的抗性培养基上对瞬时侵染后共培养24 h的刚毛柽柳胁迫处理48 h,以1/2 MS固体培养基上的刚毛柽柳作为对照处理。对处理后的刚毛柽柳的生理生化指标如:过氧化物酶(POD)和超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量及电解质渗透率进行测定[14]。
2 结果与分析
2.1 植物表达载体构建及农杆菌转化
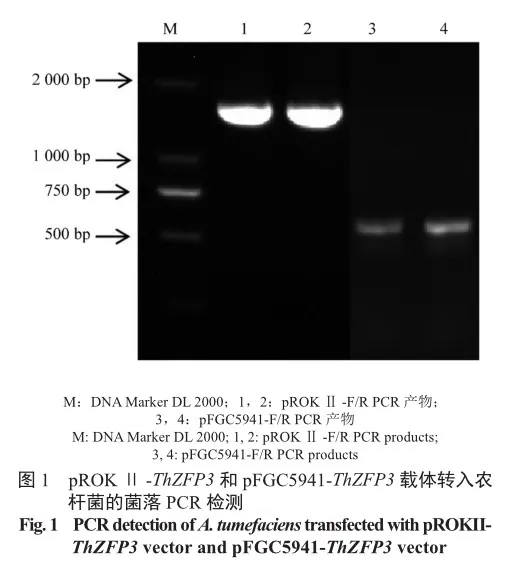
将重组质粒pROKⅡ-ThZFP3和pFGC5941-ThZFP3转入根癌农杆菌EHA105。选取阳性克隆,分别用载体引物进行PCR验证,电泳条带长度与预期长度一致(图1)。提取阳性克隆质粒进行测序,经比对,测序结果与ThZFP3基因序列相同,说明过表达载体pROKⅡ-ThZFP3和抑制表达载体pFGC5941-ThZFP3构建成功。
2.2 ThZFP3转基因拟南芥的抗逆能力分析
2.2.1 过表达ThZFP3转基因拟南芥的获得
用蘸花法将植物过表达载体EHA105-pROKⅡ-ThZFP3转化至野生型拟南芥,即为T0代拟南芥,收取种子。随后在含卡那霉素的1/2MS固体培养基上筛选T1代阳性植株(图2)。选取鉴定成功的阳性植株(OE3和OE15)继续培养到T3代,收取T3代种子用于后续试验。
2.2.2 盐和干旱胁迫下转基因拟南芥的种子萌芽成活率
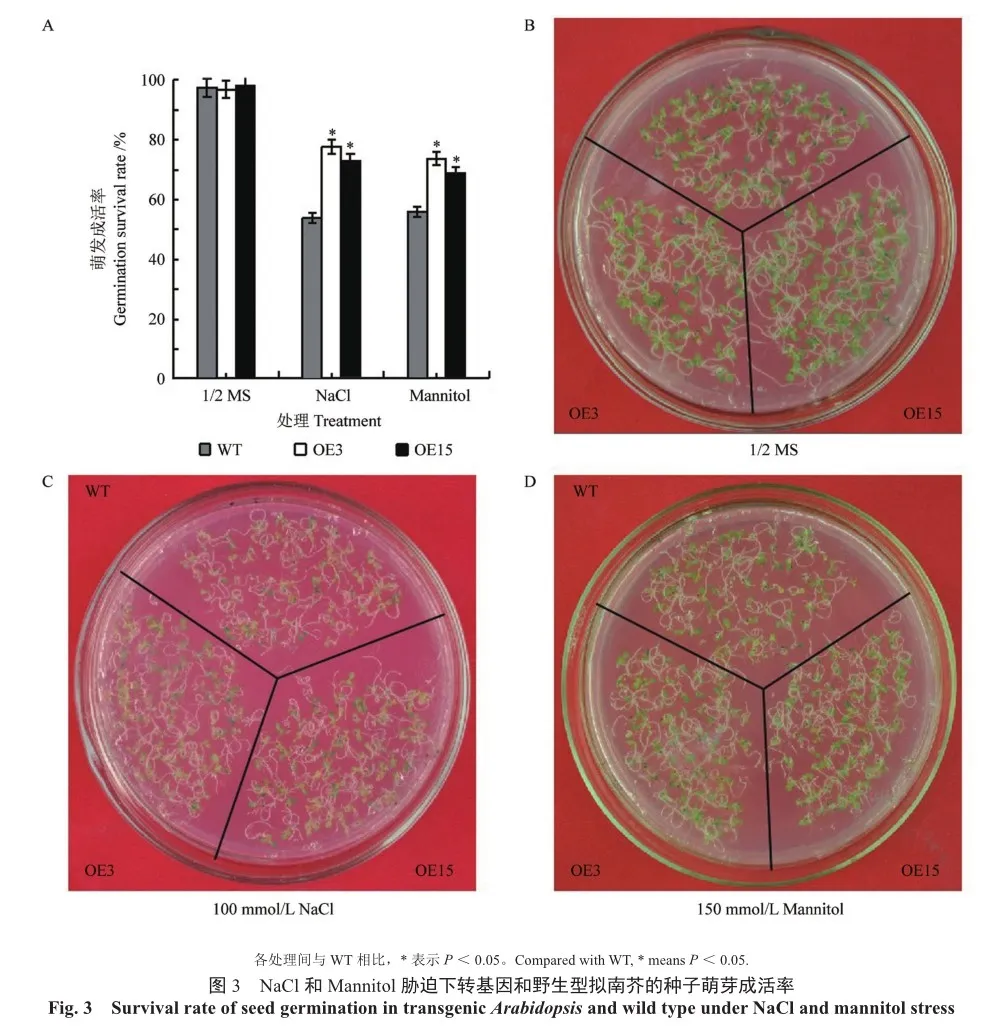
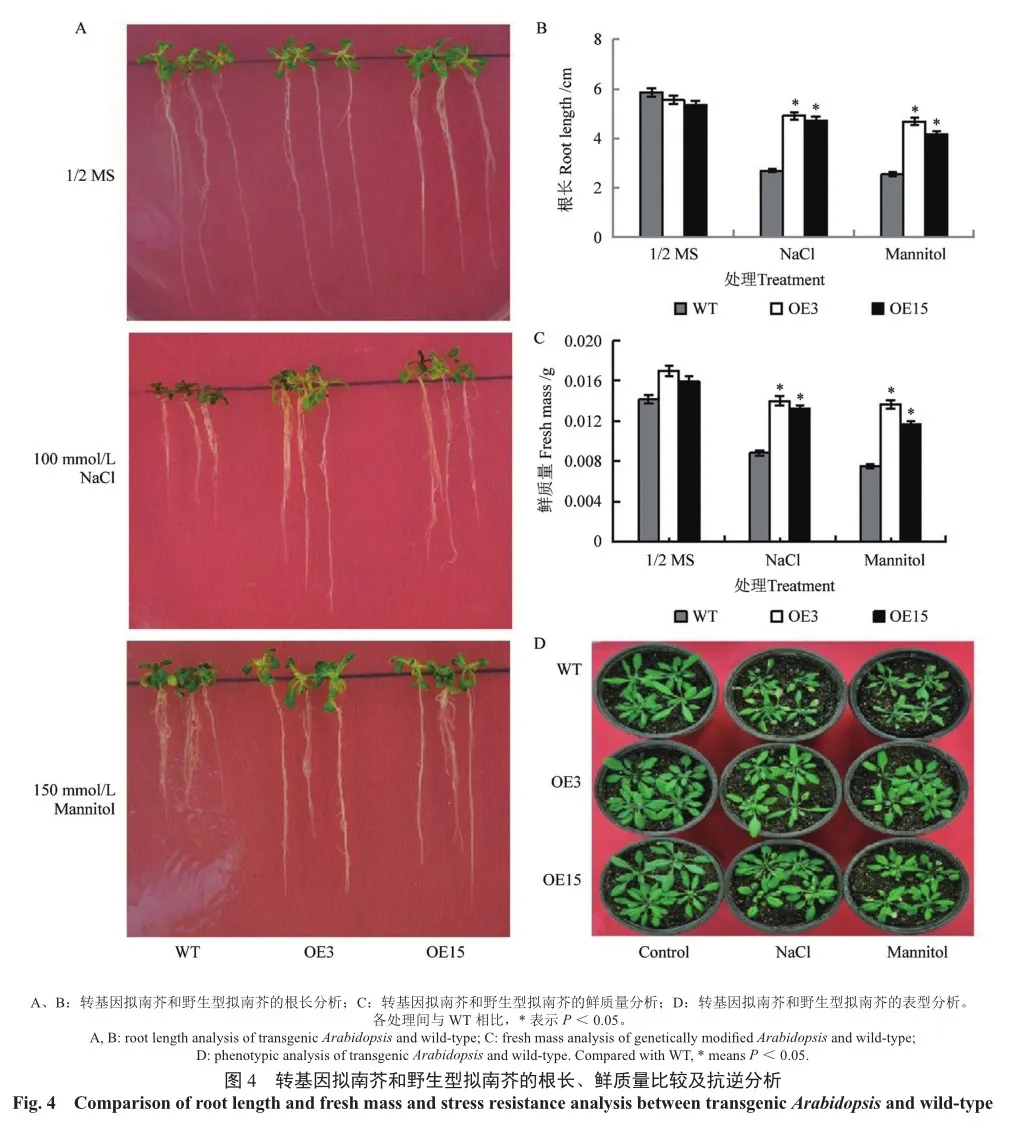
在1/2MS培养基上,转基因拟南芥(OE3和 OE15)与野生型拟南芥(WT)种子的萌芽成活率基本相同。在含有NaCl和Mannitol的1/2 MS固体培养基上,转基因和野生型拟南芥种子都能够萌发。但野生型种子萌发后子叶变黄,逐渐死亡,而转基因拟南芥OE3和OE15两个株系的种子萌芽成活率较高,明显高于WT(图3),表明ThZFP3基因提高了转基因拟南芥种子在盐和干旱胁迫下的萌芽成活能力。
2.2.3 盐和干旱胁迫下转基因拟南芥的生长表型
在正常生长条件下,野生型和转基因拟南芥种子的根长、鲜质量以及植株长势均无显著区别。在NaCl和Mannitol胁迫下,转基因株系OE3和OE15两个株系的植株长势、根长及鲜质量明显强于WT(图4)。研究结果表明,过表达ThZFP3基因提高了转基因拟南芥对盐和干旱胁迫的耐受性。
2.3 ThZFP3在刚毛柽柳中的抗逆生理功能分析
2.3.1 瞬时表达ThZFP3转基因刚毛柽柳的获得
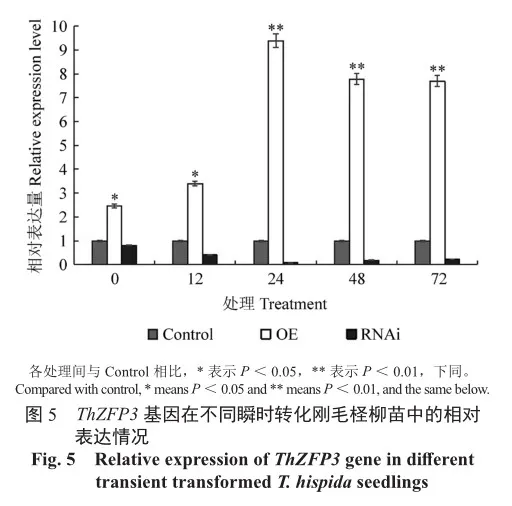
为了进一步研究ThZFP3基因在刚毛柽柳中的抗逆功能,利用瞬时转化技术将pROKⅡ空载体、ThZFP3基因过表达载体和抑制表达载体转入刚毛柽柳中,并以转空pROKⅡ载体的刚毛柽柳植株作为对照。利用实时荧光定量RT-PCR技术检测过表达(OE)、抑制表达(RNAi)和对照(Control)植株中ThZFP3基因的表达情况。相对于对照刚毛柽柳植株,ThZFP3在过表达植株中的相对表达量随着瞬时转化后时间的延长逐渐上升,在24 h达到最高;抑制表达植株中的相对表达量则随时间的延长逐渐降低,在24 h时降至最低(图5)。结果表明,ThZFP3基因在瞬时过表达植株中可实现过量表达,在抑制表达植株中成功被抑制,三种瞬时转化刚毛柽柳植株可作为分析转基因刚毛柽柳抗逆功能的材料。同时,在瞬时转化后24 h,是进行抗逆功能分析的理想时间点,后续试验中在瞬时转化24 h后进行胁迫处理,抗逆生理指标测定。
2.3.2 盐和干旱胁迫下转基因刚毛柽柳ROS水平检测
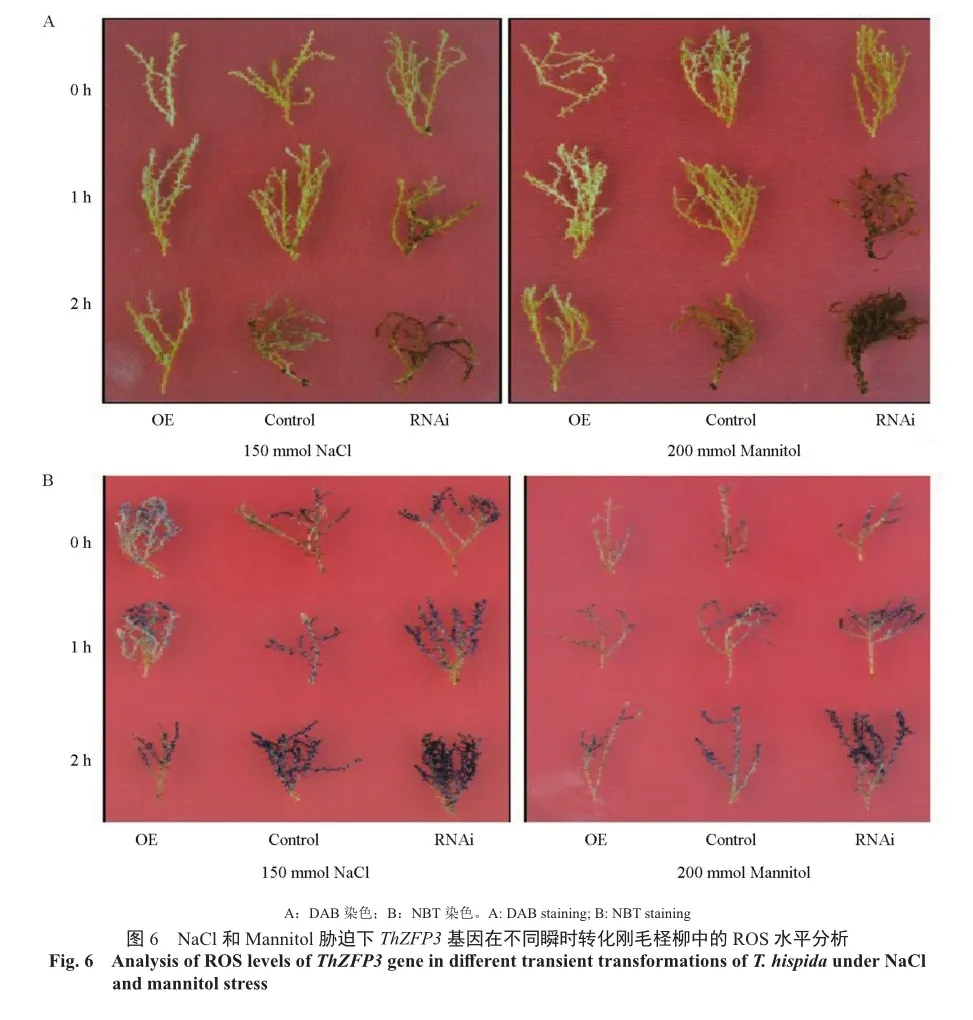
DAB、NBT染色能够反映出刚毛柽柳体内的过氧化氢(H2O2)、超氧阴离子(O2·-)的含量,进而反映出植株体内ROS积累情况。在正常生长条件下,过表达、抑制表达和对照植株基本上没有颜色差异,说明3种株系中的H2O2和O2·-含量几乎相同,细胞内没有过量积累ROS。但在盐、干旱胁迫条件下,相比于对照植株,过表达植株上的颜色相对较浅,抑制表达植株上的颜色相对较深,且随着胁迫时间的延长3种株系上的颜色逐渐变深(图6)。结果表明,过表达ThZFP3基因降低了植株内的H2O2和O2·-含量。
进一步研究转基因和对照刚毛柽柳在盐、干旱胁迫下的过氧化物酶(POD)以及超氧化物歧化酶(SOD)活性。在正常生长条件下,过表达、抑制表达和对照株系的POD、SOD活性基本相同。在盐、干旱胁迫下,3种转基因株系的POD、SOD活性显著提高,相比于对照植株,过表达植株的POD、SOD活性相对较高(图6)。结果表明,过表达ThZFP3基因使刚毛柽柳体内POD、SOD活性增加,ROS清除能力增强,降低了刚毛柽柳由ROS过度积累所导致的氧化损伤。
2.3.3 盐和干旱胁迫下转基因刚毛柽柳的细胞膜受损程度分析
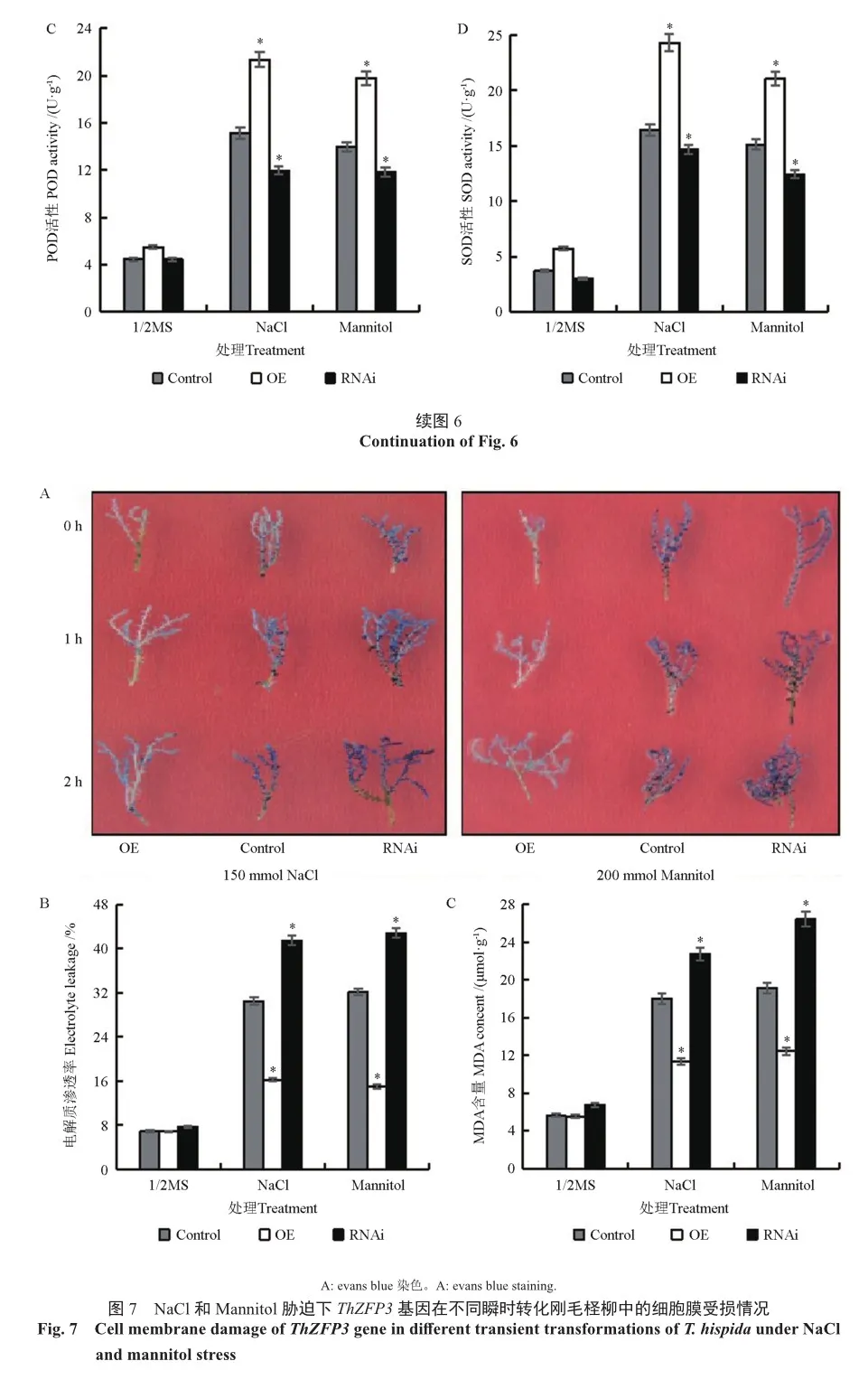
Evans blue染色、丙二醛(MDA)含量和电解质渗透率可以反映细胞膜受损伤情况进而反映植物遭受逆境伤害的程度。在正常生长条件下,3种转基因株系染色区别较小,植株中的MDA含量及电解质渗透率基本相同。在盐和干旱胁迫下,过表达植株上Evans blue染色的蓝色斑点较对照植株上的蓝色斑点少,且颜色较浅(图7);MDA含量及电解质渗透率明显增加,且3种株系中的MDA含量及电解质渗透率差异较大,过表达植株的MDA含量及电解质渗透率明显低于对照植株(图7)。结果表明,过表达ThZFP3基因能够降低逆境胁迫对细胞膜造成的损伤,从而增强刚毛柽柳耐盐、抗旱能力。
3 讨 论
锌指蛋白是植物中一类重要的转录因子,不仅在植物的生长发育过程中发挥作用,也参与调控植物对生物和非生物胁迫的应答过程。Wang等[15]研究了68个拟南芥CCCH型锌指蛋白基因在多种环境刺激下的表达,其中11个IX亚家族基因能够参与植物不同的逆境胁迫响应,如盐、干旱、冷及ABA等。刘佳丽等[16]研究发现水稻中过表达OsZFP6的水稻转基因植株在进行NaHCO3胁迫处理时表现更强耐受性,并且在株高、鲜质量生理指标上过表达OsZFP6植株高于野生型植株。Jan等[17]研究发现水稻基因OsTZF1的表达受高盐和干旱胁迫的诱导,过表达OsTZF1能显著地增强水稻对高盐和干旱的耐性。这些研究结果表明,锌指蛋白家族中部分成员在植物逆境胁迫应答过程中发挥了重要作用。刚毛柽柳是一种具有很强抗逆性的木本植物,已在其体内鉴定了多个具有抗逆功能的转录因子,如ThWRKY、ThbZIP、ThNAC、ThbHLH等[18-21];但是,ZFP转录因子在刚毛柽柳胁迫应答中的功能及作用机制尚不明确。在前期研究中发现,刚毛柽柳ThZFP3基因高度响应盐和干旱胁迫,猜测其可能参与刚毛柽柳的抗逆过程。为了进一步解析ThZFP3基因的生物学功能,本研究成功构建了ThZFP3基因的过表达载体pROKⅡ-ThZFP3并转入拟南芥植株中。在NaCl和Mannitol胁迫处理后,相比于野生型拟南芥,过表达植株的萌芽成活率、根长、鲜质量及长势明显提高,说明ThZFP3基因能增强转基因拟南芥的耐盐和抗旱能力。
逆境胁迫会导致植物体内活性氧(ROS)过度积累,造成组织的氧化损伤。因此,调节体内 ROS平衡对于维持植物在逆境下的正常生长至关重要。抗氧化酶的酶促系统是生物体内清除活性氧的一条有效途径。研究发现,非生物胁迫会诱导过量活性氧(ROS)的产生,植物通过激活酶促和非酶促清除剂,如SOD、POD和CAT等,以清除过量的ROS[22-25]。许多抗逆基因可以通过调节抗氧化酶活性来清除植物中过度积累的ROS,从而提高植物对逆境胁迫的适应性。过表达ThCBL4基因通过增加POD、SOD酶活性来增强转基因刚毛柽柳细胞内活性氧清除能力,从而提高转基因刚毛柽柳的耐盐能力[26]。过表达ZmEREB20的拟南芥中抗氧化酶如SOD、CAT表现出了更高的活性,这有助于植物清除过量积累的ROS,从而减轻了盐胁迫造成的损害[27]。在盐胁迫下,过表达TaZFP1转基因植株的POD、SOD等抗氧化酶活性增加,ROS水平降低,表明转基因植株通过调节细胞ROS稳态来提高植物的耐盐性[28]。本研究利用DAB、NBT染色分析了逆境胁迫下瞬时表达刚毛柽柳体内的ROS水平。盐、干旱胁迫下,相较于对照植株和抑制表达植株,过表达植株内的H2O2含量和O2·-含量相对最低,而POD和SOD活性相对最高,说明过表达ThZFP3可以促进刚毛柽柳体内抗氧化酶活性,降低ROS的积累,提高刚毛柽柳对盐、干旱胁迫的耐受性。
MDA是膜脂过氧化分解的终产物之一,其含量能够反映细胞膜脂过氧化的程度。例如在盐胁迫下,过表达GmMYB84的转基因大豆Glycine max耐盐能力更强,转基因植株MDA含量显著低于野生型,表明对细胞膜的损伤程度较低[29]。Cui等[30]研究发现,过表达番茄MYB49基因的拟南芥株系与野生型拟南芥相比MDA含量较低,MYB49基因通过抑制细胞膜损伤增强植株对干旱和盐的耐受性。同样,细胞膜损伤后,细胞膜透性会发生改变,大量电解质渗出导致电解质渗透率发生变化。例如过表达BpGRAS1基因可以降低白桦在盐胁迫下的电解质渗透率,说明BpGRAS1基因能够保护细胞膜,避免膜损伤[31]。过表达BpHSFA4株系细胞膜受损程度低、电解质外渗少,细胞膜结构的完整性较高[32]。因此,MDA含量和电解质渗透率可以作为细胞膜损伤程度的衡量指标,也间接反映出植物在胁迫下的抗逆能力。本研究通过过表达刚毛柽柳ThZFP3基因发现刚毛柽柳体内MDA含量、电解质渗透率和Evans blue染色强度显著降低,说明过表达ThZFP3基因降低了逆境胁迫对刚毛柽柳细胞膜的损伤,增加了刚毛柽柳的抗旱耐盐能力。以上研究表明,锌指蛋白能够通过提高ROS清除能力以及减少膜脂损伤程度来提高植物在非生物胁迫下的抗逆功能。
本研究通过异源转化拟南芥和瞬时转化柽柳,初步明确了ThZFP3基因的功能。然而,基因在异源表达和同源表达情况下,其功能可能会存在差异;另外,瞬时转化与稳定转化相比,在基因功能研究中也存在一定的局限性。因此,后续研究中将ThZFP3基因稳定转化刚毛柽柳,进一步验证ThZFP3的抗逆功能,并深入研究其调控柽柳耐盐、抗旱的分子机制。
4 结 论
本研究将ThZFP3基因转入拟南芥和刚毛柽柳中,对其耐盐、抗旱功能进行了鉴定。过表达ThZFP3基因提高了转基因拟南芥对盐和干旱胁迫的耐受性。盐和干旱胁迫下,ThZFP3基因能够调节刚毛柽柳体内POD、SOD活性,增强ROS清除能力,降低细胞膜脂过氧化损伤,从而提高刚毛柽柳的耐盐和抗旱能力。本研究为进一步解析柽柳ZFP的抗逆调控机制奠定了基础,并为林木抗逆基因工程育种提供了候选基因。
参考文献:
[1] GUO Y H, YU Y P, WANG D, et al. GhZFP1, a novel CCCHtype zinc finger protein from cotton, enhances salt stress tolerance and fungal disease resistance in transgenic tobacco by interacting with GZIRD21A and GZIPR5[J]. New Phytologist,2009,183(1): 62-75.
[2] 雷珍,戴海英,叶和军,等.轮叶蒲桃对干旱胁迫的生理响应影响研究[J].森林工程,2015,31(5):4-6. LEI Z, DAI H Y, YE H J, et al. Study on the physiological response of Syzygium grijsii to drought stress[J]. Forest Engineering, 2015,31(5):4-6.
[3] LI H, YUE M L, JIANG L Y, et al. Genome-wide identification of strawberry C2H2-ZFP C1-2i subclass and the potential function of FaZAT10 in abiotic stress[J]. International Journal of Molecular Sciences,2022,23(21):13079.
[4] ZHOU Z J, SUN L L, ZHAO Y Q, et al. Zinc finger protein 6(ZFP6) regulates trichome initiation by integrating gibberellin and cytokinin signaling in Arabidopsis thaliana[J]. New Phytologist,2013,198:699-708.
[5] XIE M M, SUN J H, GONG D P, et al. The roles of Arabidopsis C1-2i subclass of C2H2-type Zinc-Finger transcription factors[J]. Genes(Basel),2019,10(9):653.
[6] TANG L L, CAI H, JI W, et al. Over expression of GsZFP1 enhances salt and drought tolerance in transgenic alfalfa (Medicago sativa L.)[J]. Plant Physiology and Biochemistry,2013,71: 22-30.
[7] SUN S J, GUO S Q, YANG X, et al. Functional analysis of a novel Cys2/His2-type zinc finger protein involved in salt tolerance in rice[J]. Journal of Experimental Botany,2010,61(10):2807-2818.
[8] JIN Y M, PIAO R H, YAN Y F, et al. Overexpression of a new zinc finger protein transcription factor OsCTZFP8 improves cold tolerance in rice[J]. International Journal of Genomics,2018,1: 5480617.
[9] SHI H T, WANG X, YE T T, et al. The Cysteine2/Histidine2-type transcription factor ZINC FINGER OF ARABIDOPSIS THALIANA6 modulates biotic and abiotic stress responses by activating salicylic acid-related genes and C-REPEAT-BINDING FACTOR genes in Arabidopsis[J]. Plant Physiolog,2014,165(3): 1367-1379.
[10] 张道远,尹林克,潘伯荣.柽柳属植物抗旱性能研究及其应用潜力评价[J].中国沙漠,2003(3):46-50. ZHANG D Y, YIN L K, PAN B R. Study on drought-resisting mechanism of Tamrix L. and assessing of its potential application[J]. Chinese Desert,2003(3):46-50.
[11] 岳远志,贾园园,刘博雅,等.刚毛柽柳ThZFP3基因的克隆及表达特征分析[J].植物生理学报,2022,58(5):919-928. YUE Y Z, JIA Y Y, LIU B Y, et al. Cloning and expression characteristics of ThZFP3 gene in Tamarix hispida[J]. Chinese Journal of Plant Physiology,2019,58(5):919-928.
[12] 卢惠君,李子义,梁瀚予,等.刚毛柽柳NAC24基因的表达及抗逆功能分析[J].林业科学,2019,55(3):54-63. LU H J, LI Z Y, LIANG H Y, et al. Expression and stress tolerance analysis of NAC24 from Tamarix hispida[J]. Scientia Silvae Sinicae,2019,55(3):54-63.
[13] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J]. Methods,2001,25(4):402-408.
[14] 贾园园.柽柳锌指蛋白基因ThZFP3的功能研究[D].哈尔滨:东北林业大学,2016. JIA Y Y. Study on functional characterization of a zinc finger protein gene ThZFP3 from Tamarix hispida[D]. Harbin: Northeast Forestry University,2016.
[15] WANG D, GUO Y H, WU C G, et al. Genome-wide analysis of CCCH zinc finger family in Arabidopsis and rice[J]. Genomics, 2008,9:44.
[16] 刘佳丽,何明良,刘晨曦,等.水稻盐碱逆境响应锌指蛋白基因OsZFP6表达特性及功能研究[J].植物研究,2020,40(3): 424-432. LIU J L, HE M L, LIU C X, et al. Zinc finger protein OsZFP6 expression features and functions in saline-alkali stress response[J]. Plant Research,2019,40(3):424-432.
[17] JAN A, MARUYAMA K, TODAKA D, et al. OsTZF1, a CCCHtandem zinc finger protein, confers delayed senescence and stress tolerance in rice by regulating stress-related genes[J]. Plant Physiology, 2013,161(3):1202-1216.
[18] JI X Y, NIE X G, LIU Y J, et al. A bHLH gene from Tamarix hispida improves abiotic stress tolerance by enhancing osmotic potential and decreasing reactive oxygen species accumulation[J]. Tree Physiology,2016,36(2):193-207.
[19] ZHENG L, LIU G F, MENG X N, et al. A WRKY gene from Tamarix hispida, ThWRKY4, mediates abiotic stress responses by modulating reactive oxygen species and expression of stressresponsive genes[J]. Plant Molecular Biology Reporter,2013,82(4-5): 303-320.
[20] WANG L Q, LI Z, LU M Z, et al. ThNAC13, a NAC transcription factor from Tamarix hispida confers salt and osmotic stress tolerance to transgenic Tamarix and Arabidopsis[J]. Frontiers in Plant Science,2017,8:635.
[21] JI X Y, LIU G F, LIU Y J, et al. The bZIP protein from Tamarix hispida, ThbZIP1, is ACGT elements binding factor that enhances abiotic stress signaling in transgenic Arabidopsis[J]. Plant Biology,2013,13:151.
[22] NAING A H, KIM C K. Abiotic stress-induced anthocyanins in plants: their role in tolerance to abiotic stresses[J]. Physiologia Plantarum,2021,172(3):1711-1723.
[23] CZARNOCKA W, KARPINSKI S. Friend or foe? Reactive oxygen species production, scavenging and signaling in plant response to environmental stresses[J]. Free Radical Biology and Medicine,2018,122:4-20.
[24] CHOUDHURY F K, RIVERO R M, BLUMWALD E, et al. Reactive oxygen species, abiotic stress and stress combination[J]. The Plant Journal,2017,90(5):856-867.
[25] 王介华,睢金凯,崔令军,等.AMF对盐胁迫下桢楠生长和生理特性的影响[J].中南林业科技大学学报,2023,43(6):51-58. WANG J H, SUI J K, CUI L J, et al. Effects of AMF on the growth and physiological characteristics of Phoebe zhennan under salt stress[J]. Journal of Central South University of Forestry Technology,2019,43(6):51-58..
[26] 邹全程,唐绯绯,刘中原,等.瞬时过表达ThCBL4基因提高刚毛柽柳耐盐能力[J].林业科学研究,2018,31(3):60-67. ZOU Q C, TANG F F, LIU Z Y, et al. A novel calcineurin B-like proteins gene (ThCBL4) improving the salt tolerance in transient overexpression Tamarix hispida[J]. Forestry Research,2018, 31(3):60-67.
[27] FU J Y, ZHU C Y, WANG C, et al. Maize transcription factor ZmEREB20 enhanced salt tolerance in transgenic Arabidopsis[J]. Plant Physiology and Biochemistry,2021,159:257-267.
[28] SUN B G, ZHAO Y J, SHI S Y, et al. TaZFP1, a C2H2 type-ZFP gene of T. aestivum, mediates salt stress tolerance of plants by modulating diverse stress-defensive physiological processes[J]. Plant Physiology and Biochemistry,2019,136:127-142.
[29] ZHANG W, WANG N, YANG J, et al. The salt-induced transcription factor GmMYB84 confers salinity tolerance in soybean[J]. Plant Science,2020,291:110326.
[30] CUI J, JIANG N, ZHOU X X, et al. Tomato MYB49 enhances resistance to Phytophthora infestans and tolerance to water deficit and salt stress[J]. Planta,2018,248(6):1487-1503.
[31] 张群,及晓宇,贺子航,等.白桦BpGRAS1基因的克隆及耐盐功能分析[J].南京林业大学学报(自然科学版),2021,45(5): 38-46. ZHANG Q, JI X Y, HE Z H, et al. Cloning and salt tolerance analysis of BpGRAS1 gene in Betula platyphylla[J]. Journal of Nanjing Forestry University(Natural Sciences Edition),2021,45(5): 38-46.
[32] 刘中原,刘峥,徐颖,等.白桦HSFA4转录因子的克隆及耐盐功能分析[J].林业科学,2020,56(5):69-79. LIU Z Y, LIU Z, XU Y, et al. Cloning and salt tolerance analysis of transcription factor HSFA4 from Betula platyphylla[J]. Scientia Silvae Sinicae,2019,56(5):69-79.
[本文编校:罗 列]

