菊苣TCP基因家族鉴定与分析





摘要:TCP转录因子参与调控植物多种生理过程,包括植物叶片发育、花发育、分枝的形成等方面。菊苣(Cichorium intybus L.)是一种优良牧草,但目前还未有关于其TCP基因家族研究的报道。本研究基于菊苣全基因组数据,利用拟南芥(Arabidopsis thaliana)、生菜(Lactuca sativa L.)TCP基因家族的氨基酸序列,对菊苣TCP基因家族成员进行鉴定筛选,最终得到39个菊苣TCP基因家族成员。接着利用生物信息学方法对这些成员进行分析发现,39个成员不均匀分布在9条染色体上;氨基酸数目为113~498,分子量为12 425.84~56 266.57Da;所有成员分为3个亚家族;均含有保守的basic-helix-loop-helix(bHLH)结构域;顺式作用元件分析发现,菊苣TCP家族成员具有多种激素、非生物胁迫和生长发育响应元件;对CIN类TCP基因在菊苣各组织和高温胁迫下进行表达分析发现,这些成员可能参与菊苣的叶片发育调控且对高温胁迫响应。本研究可以为改良菊苣牧草品质提供理论依据。
关键词:TCP基因家族;菊苣;表达分析;家族分析
中图分类号:Q949.783.5""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2428-12
Chicory TCP Gene Family Identification and Analysis
DU Yang1,2#, ZHANG Zhi-wei3#, LU Shuang1, LIU Xue2, LI Da-yong2,
XU Zhao-yang2, WANG Chen-chen2, ZHANG Bin2*,XU Li-xin1*
(1. College of Prataculture and Grassland, Beijing Forestry University, Beijing 100083, China; 2. Institute of Vegetables,
Beijing Academy of Agriculture and Forestry Sciences, Beijing 100083, China;3. CCTEG Ecological Environment Technology
Co., Ltd, Beijing 100020, China)
Abstract:The TCP gene family is involved in the regulation of a variety of physiological processes in plants,including plant leaf development,flower development,and branch formation. Chicory(Cichorium intybus L.) is an excellent forage,but no studies of its TCP gene family have been reported. Based on the whole genome data of chicory,the amino acid sequences of the Arabidopsis thaliana and Lactuca sativa L. TCP gene families were used to identify and screen the members of the chicory TCP gene family,and finally 39 chicory TCP gene family members were obtained. Then,bioinformatics methods were used to analyze these members and found that 39 members were unevenly distributed on 9 chromosomes. The number of amino acids is 113~498,and the molecular weight is 12 425.84~56 266.57 Da. All members contain conserved TCP domains,namely basic-helix-loop-helix(bHLH) domains,and are divided into 3 subfamilies. The analysis of cis-acting elements showed that members of the chicory TCP family had a variety of hormones,abiotic stress and growth and development response elements. The expression analysis of CIN class TCP genes in chicory tissues and under high temperature stress showed that these members may be involved in the regulation of leaf development and response to high temperature stress in chicory. This study can provide a theoretical basis for improving the quality of chicory forage.
Key words:TCP gene family;Cichorium intybus L.;Expression analysis;Family analysis
菊苣(Cichorium intybus L.),又称欧洲菊苣,起源于地中海地区,是菊科(Asteraceae)菊苣属(Cichorium)多年生草本植物,在20世纪70年代末期,引入我国开始种植。作为饲用牧草,菊苣具有矿物质含量高、营养价值高、适口性好、易消化、生产率高和刈割后再生能力强等优良特性[1-2]。其营养价值类似于苜蓿,含有较高的粗蛋白和能量,矿物质含量甚至高于紫花苜蓿[3]。
TCP(Teosinte branched1/Cycloidea/Proliferating cell factor)基因家族被广泛报道于很多物种,是一类非常重要的基因家族。家族成员均含有一个55~60碱基的TCP保守结构域,即basic-helix-loop-helix(bHLH)结构域[4]。依据这种结构域的差别,可以将TCP家族分为两个亚家族Class Ⅰ和Class Ⅱ,Class Ⅱ进一步分为CIN和CYC/TB1两个亚家族。Class Ⅰ亚族基因的调控作用主要表现在促进植物生长发育,但由于Class Ⅰ家族基因的冗余性导致其单突变体表型较弱甚至无表型,因此对于Class Ⅰ类基因家族的研究较少;Class Ⅱ亚族基因调控作用大多表现在抑制植物生长和细胞增殖[5]。Class Ⅱ亚族中的CIN类基因子集的AtTCP2,AtTCP3,AtTCP4,AtTCP10,AtTCP24均受microRNA319靶向抑制[6]。有研究分析了多毛番茄(S. habrochaites L.)和栽培番茄(S. lycopersicum L.)miR319家族在低温和高温胁迫下的表达特征,证实miR319a,b,c,d参与调控番茄耐高温胁迫[7]。萝卜(Raphanus Sativus L.)[8]和醋栗番茄(Solanum pimpinellifolium L.)[9]中也有类似的报道。
已经在多种物种中鉴定和分析了TCP家族,如烟草[10]、茄子[11]、荔枝[12]、刺槐[13]、紫花苜蓿[14]等。但目前还未见在菊苣中的TCP基因家族报道。TCP家族蛋白广泛参与植物叶片形态建成[15]、胁迫响应[16]、花发育[17]、激素调节[18]等生理生化活动,因此这些转录因子的研究对于提高菊苣的牧草品质、对增强抗逆性有很大的帮助。
在我国,菊苣主要分布在中部和北部地区,而限制菊苣分布的主要因素之一就是温度。菊苣植株生长的最适温度一般在17~20℃之间,幼苗期的植株耐高温能力稍强,生长适温为20~25℃。有研究发现,高温会诱导菊苣抽薹开花[19-20],进而影响其营养物质的产量,降低其作为牧草的品质。因此,本文利用生物信息学的方法对菊苣的TCP蛋白家族成员进行了鉴定筛选并分析,同时进行了高温胁迫下的表达模式分析,以期为研究TCPs对于植物应对高温的作用机理提供理论依据。
1 材料与方法
1.1 试验材料及培养
试验在北京市农林科学研究院蔬菜所(116°42′10.41″ E,39°42′1.35″ N)进行,所用菊苣品种为‘普那’(K017)。挑选饱满种子播种于湿滤纸上,进行萌发;当芽伸长约2 cm时,转到蛭石∶营养土为3∶1比例的基质中;5~6天后转入大棚,自然培养。当菊苣生长至抽薹开花,取其茎、老叶、幼叶、花、萼片和薹上叶;参考相关研究[19],35℃高温培养,取0 h,1 h,4 h,8 h,16 h和24 h的幼嫩叶片,立即放入液氮中速冻,随后转移至-80℃冰箱保存,以备后续实验使用。
1.2 菊苣TCP基因家族鉴定及基本特征分析
在网站(ftp://ftp.agis.org.cn/Inulin_plants/)下载菊苣全基因组数据;在TAIR(https://www.arabidopsis.org)下载拟南芥(Arabidopsis thaliana (L.) Heynh.)TCP成员基因序列、蛋白编码序列和全长氨基酸序列;在数据库Phytozome v13(http://phytozome.jgi.doe.gov/pz/)下载生菜(Lactuca sativa L.) TCP成员基因序列、蛋白编码序列和全长氨基酸序列。本文使用拟南芥和生菜的TCP基因家族成员的基因序列在菊苣全基因组数据库进行blast比对,删掉E值大于1e-16的基因;然后将序列上传至在线分析软件Batch CD-Search(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi),删掉不含TCP保守结构域的基因,最终确定了39个菊苣TCP基因家族成员。利用psRNATaget(https://www.zhaolab.org/psRNATarget/)网站对microRNA319靶基因进行预测。使用TBtools[21]软件获得各成员在染色体上对应的位置信息,并进行可视化作图。利用Prot Param(https://web.expasy.org/protparam/)在线工具对39个TCP蛋白序列进行分析,得出其蛋白分子量、理论等电点、氨基酸数量等理化性质数据。通过在线工具WoLF PSORT(https://wolfpsort.hgc.jp)对39个蛋白序列进行亚细胞定位预测。
1.3 蛋白系统进化分析
使用已下载好的拟南芥TCP家族蛋白、生菜TCP家族蛋白与筛选好的39个菊苣TCP基因家族蛋白序列在MEGA7.0软件中进行系统发育树的构建。构建时,选择ClustalW进行多序列比对,设置参数:邻接法(Neighbor-Joining),Partial Deletion,P-distance,Bootstrap为1000次。
1.4 基因结构,Domain,Motif分析
使用菊苣基因组GFF文件和筛选后的菊苣TCP家族的核苷酸序列,利用TBtools软件进行基因结构的分析。将菊苣39个TCP家族成员蛋白序列上传至在线分析软件Batch CD-Search进行Domain分析;使用在线网站MEME(https://meme-suite.org/meme/tools/meme)进行Motif分析,motif数目设置为10。使用TBtools软件对菊苣TCP家族基因结构、Domain,Motif分析进行可视化作图。
1.5 蛋白质三维结构预测
将确定好的菊苣TCP家族成员蛋白序列依次上传到蛋白质三维结构在线预测网站Swiss-Model(https://swissmodel.expasy.org),得到各成员的蛋白质三维预测结构。
1.6 顺式作用元件分析
在网站下载菊苣全基因组序列与GFF文件,使用TBtools软件,提取每个成员基因序列上游2 000 bp区域的序列。将其上传至在线预测网站PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行预测。使用TBtools软件对预测的结果进行可视化作图。
1.7 荧光定量PCR及数据分析
选择18S作为内参基因,根据各成员CDS序列在在线网站设计引物(表1)。采集菊苣的茎、幼叶、老叶、花、萼片和薹上叶进行RNA提取。RNA提取和实时荧光定量PCR预混液均采用南京诺唯赞公司试剂盒进行,试验方法以说明书为准,RT-qPCR实验以罗氏(Roche)LC480荧光定量PCR仪进行基因表达检测。选用2-ΔΔCt方法[22]进行数据分析,将每一个样本技术重复3次,用“平均值±标准差”表示基因的相对表达量。
2 结果与分析
2.1 菊苣TCP基因家族鉴定及基本特征分析
本研究以拟南芥、生菜TCP蛋白序列为检索序列,基于菊苣全基因组数据,共鉴定出39个菊苣TCP基因(表2)。同时,使用生菜microRNA319基因序列在菊苣基因组中blast出了3个基因。对菊苣TCP基因家族成员和blast出的菊苣microRNA319基因的染色体定位信息,进行可视化作图。39个TCP家族成员在菊苣9条染色体中呈不均匀分布(图1)。其中,3号染色体拥有最多的TCP家族成员,有15个家族成员;4号染色体分布最少,仅有1个家族成员;其余染色体分布2~4个家族成员;microRNA319分布在1号、7号和9号染色体上,其靶基因分布在1号、3号、5号和7号染色体上。按照各成员在染色体上分布的位置顺序进行命名,将39个基因命名为CiTCP1~CiTCP39;microRNA319基因命名为MIR319A,MIR319B和MIR319C。对39个菊苣TCP基因家族成员的理化性质进行分析,结果显示:氨基酸数目为113(CiTCP21)~498(CiTCP30),对应分子量为12 425.84~56 266.57Da;所有成员均为亲水蛋白,且不稳定系数均大于40;等电点介于4.13~10.13,亚细胞定位预测显示除CiTCP8位于细胞质、CiTCP11位于叶绿体、CiTCP28位于线粒体外,其余成员均位于细胞核内(表2)。
2.2 菊苣TCP家族基因蛋白质系统进化分析
本研究利用MEGA7.0软件,对拟南芥、菊苣和生菜中被报道的TCP家族进行系统进化分析。参考拟南芥TCP基因家族的分类,将菊苣TCP家族分为Class Ⅰ和Class Ⅱ两类,其中Class Ⅰ又称PCF亚族,Class Ⅱ可进一步划分为两个亚家族CIN,CYC/TB1。CIN,CYC/TB1亚家族中各有12个菊苣基因,PCF亚家族中则含有15个菊苣基因,是分布最多的亚家族。其中CiTCP13~18不止在染色体上的分布位置聚集,亲缘关系也较为接近,推测其在植物生长发育过程中发挥相似的功能。
2.3 菊苣TCP家族Domain、基因结构、Motif分析
利用TBtools软件与在线工具对菊苣TCP家族进行Domain、基因结构和Motif分析。Domain分析发现,39个家族成员均含有TCP保守结构域或TCP superfamily保守结构域,说明39个成员均能发挥TCP结构功能。基因结构分析结果如图3所示,菊苣TCP家族成员基因结构较简单,其中15个成员有内含子,所有成员均不含UTR区。Motif分析发现,所有的成员均含有Motif 1结构,说明Motif 1是TCP基因家族成员发挥功能的重要结构。Motif 4仅在PCF亚族中出现,Motif 9仅在CYC/TB1亚族中出现,推测其可能是这两个亚家族的特有结构。
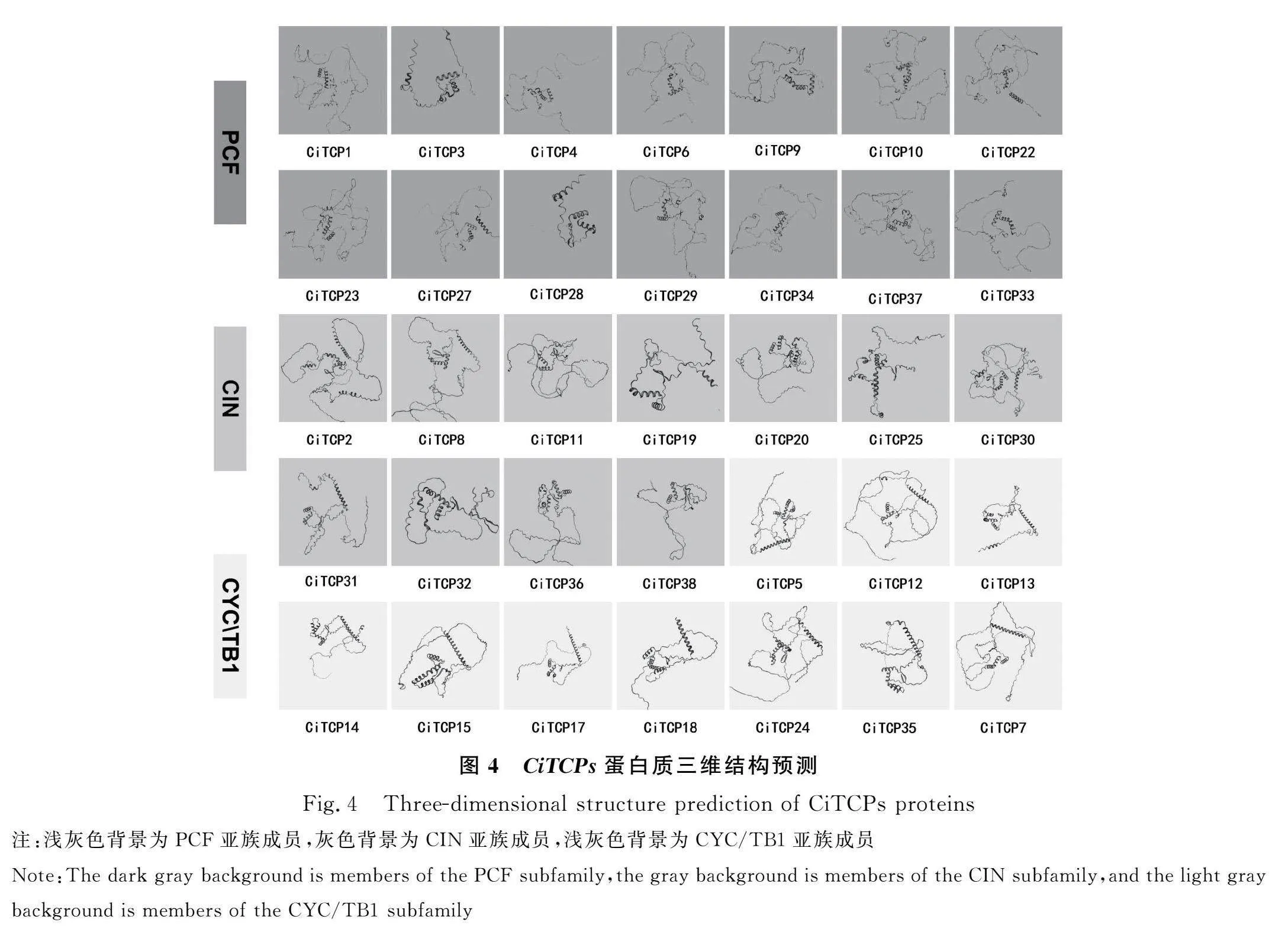
2.4 菊苣TCPs蛋白三维结构预测
上传各成员蛋白序列至Swiss-Model在线工具,预测各成员的蛋白三维结构模型(图4)。其中CiTCP16,CiTCP21,CiTCP26,CiTCP39的蛋白结构预测的GMQE值低于0.4,预测结构不可信。根据预测的结果,TCP家族蛋白均含有非典型的bHLH(basic-helix-loop-lelix)结构。其中PCF作为TCP家族Class Ⅰ类中的分支,明显比另两个亚家族中的成员结构碱性区短,CIN亚族碱性区比CYC/TB1亚族稍短但不明显。
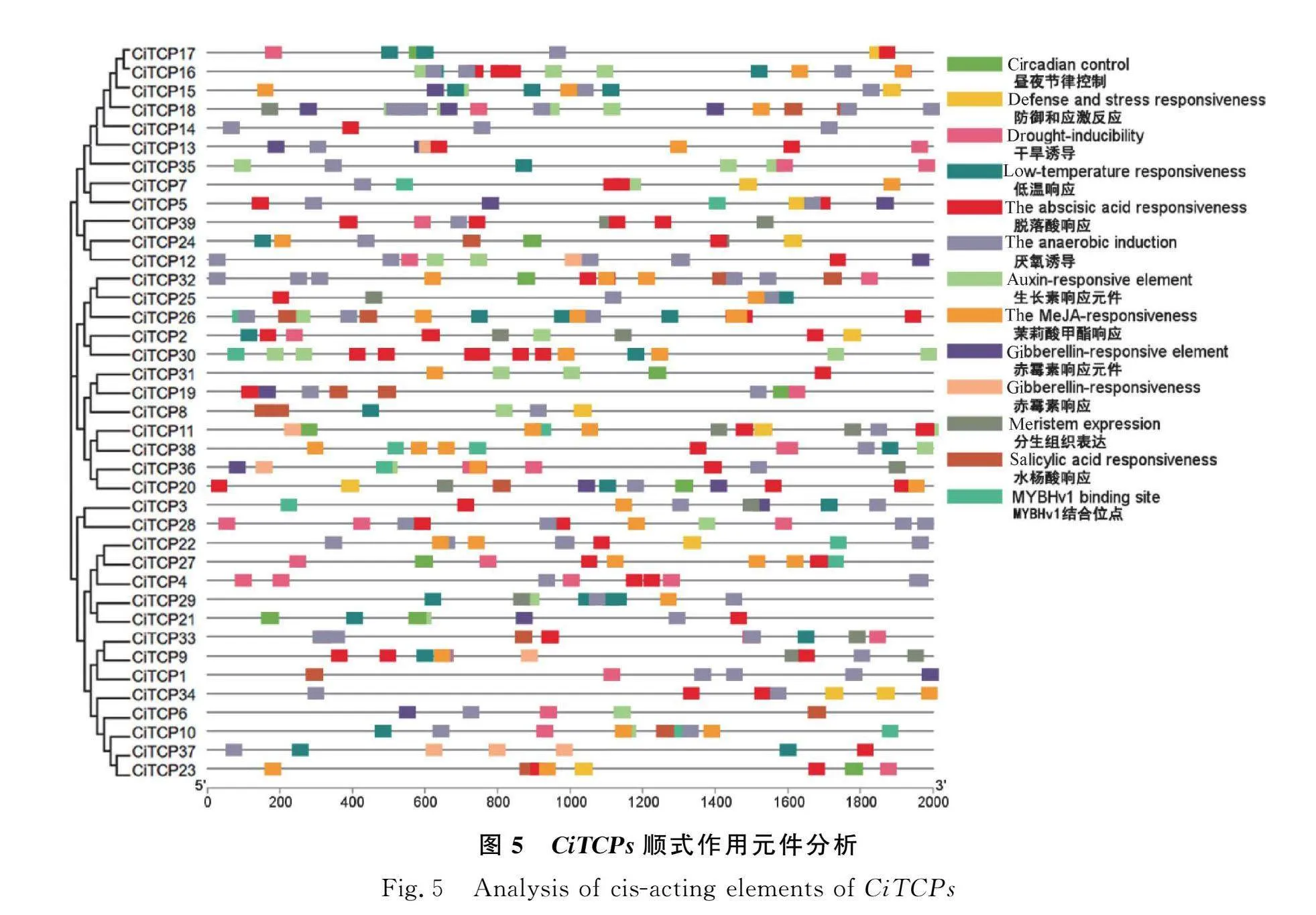
2.5 菊苣TCPs顺式作用元件分析
顺式作用元件在一定程度上可以反映基因的转录调控作用。提取菊苣各成员上游2000 bp序列,上传到PlantCARE网站进行分析,利用TBtools进行作图。结果发现,菊苣TCP家族成员上游启动子区域含有与5种激素有关的作用元件。有脱落酸响应元件(31个成员)、茉莉酸甲酯响应元件(24个成员)、生长素响应元件(19个成员)、赤霉素响应元件(15个成员)、水杨酸响应元件(12个成员)。
在胁迫方面,有厌氧诱导元件(34个成员)、干旱响应元件(21个成员)、低温响应元件(19个成员)、防御和应激作用元件(12个成员)。
在植物生长发育上,鉴定到的元件有昼夜节律控制元件(11个成员)、分生组织表达元件(12个成员)、MYBHv1结合位点作用元件(11个成员)。
综上所述,菊苣TCP家族可能在植物激素调控、生长发育和应对环境胁迫方面发挥作用。
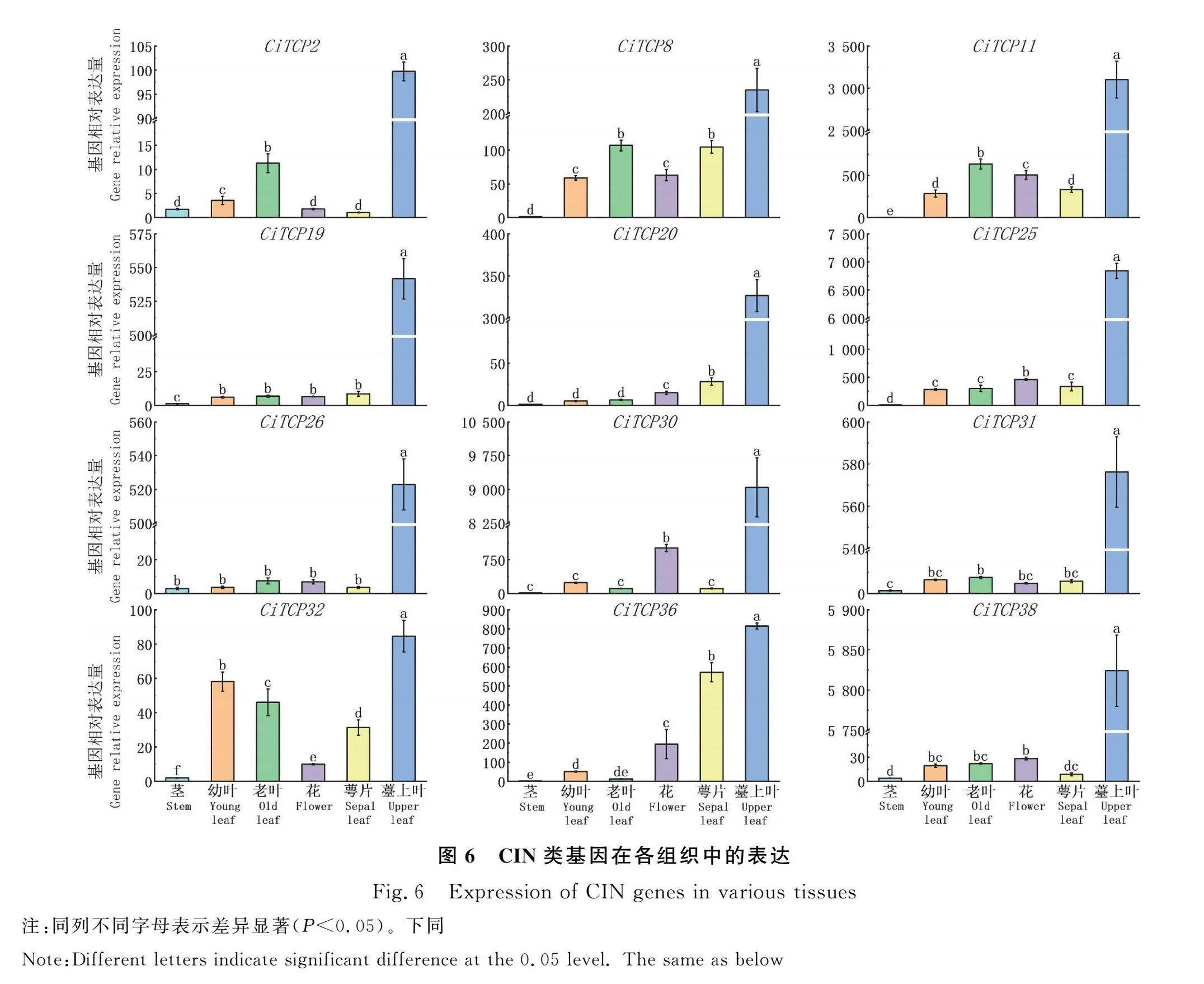
2.6 CIN类基因组织表达模式分析
本文对菊苣TCP基因家族中的CIN亚族中的基因进行了表达分析,结果显示如图6。此子集基因在各组织中的表达量差异较大,各基因在茎的表达量都极低,甚至不表达,在幼叶、老叶、花和萼片中的表达量大不相同。CiTCP25,CiTCP26,CiTCP31,CiTCP38,CiTCP19在幼叶、老叶、花和萼片中的表达量相差不大;CiTCP2在老叶中的表达量较高;CiTCP8在老叶和萼片中的表达量要稍高于幼叶和花;CiTCP11在各部位的表达量相差不大,在老叶和花中的表达量稍高于幼叶和萼片部位的表达量;CiTCP20在萼片中的表达量稍高于幼叶、老叶和花部位的表达量;CiTCP30在花中的表达量明显高于幼叶、老叶和萼片部位的表达量;CiTCP32在花中的表达量低于幼叶、老叶和萼片部位的表达量;CiTCP36在花、萼片中的表达量较高。各成员在薹上叶的表达量均高于在其他部位的表达量,可能与各成员参与叶片发育调控有关。
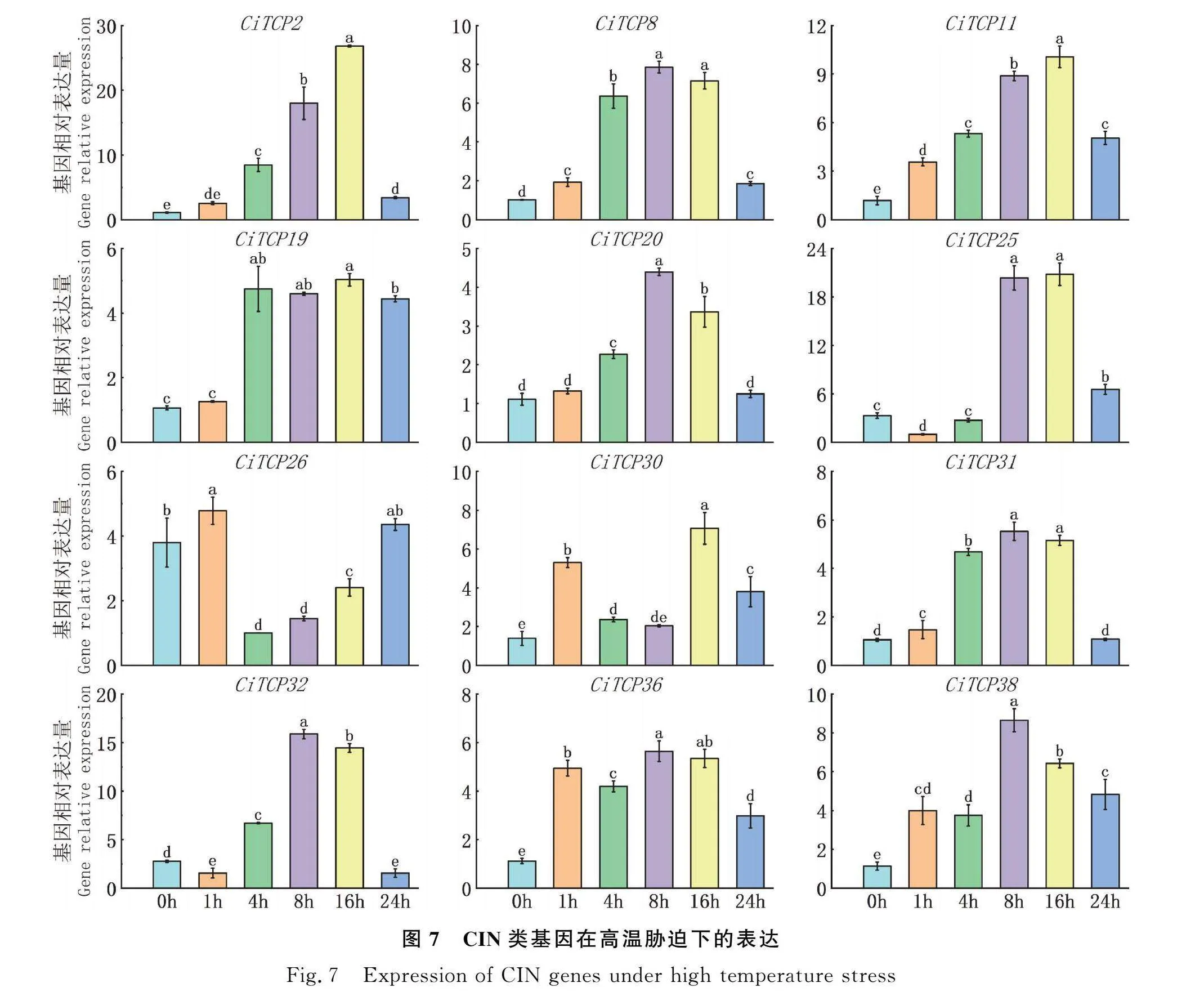
2.7 CIN类基因高温胁迫下的表达模式分析
耐热性较差是限制菊苣分布的重要因素,因而本文对菊苣进行了高温胁迫处理,对CIN亚族中的基因进行了表达分析,结果显示如图7。各基因在高温胁迫下的表达量均有不同程度的升高。除基因CiTCP26,CiTCP30表达量呈现先下降后上升的趋势外,其余成员的表达量呈现缓慢上升后下降的趋势。这种变化区别可能是由于各成员对高温胁迫的不同的响应机制造成的。
3 讨论
3.1 菊苣TCP家族基因的结构特点及功能
本研究在菊苣中鉴定到39个家族成员,与其他植物TCP家族成员[10-14]数量相比偏多,这可能与不同物种之间的基因扩张程度有关[7]。
本研究参考模式植物拟南芥的分类,将菊苣的TCP家族成员分为3个亚类:Class I(PCF),Class II(CIN)和Class II(CYC/TB1),这与前人的研究结果一致。根据蛋白系统进化分析的结果,聚类分析越是相近的基因,说明功能和结构越相似。保守基序的结果显示,在39个CiTCPs基因中,菊苣TCP基因家族的不同亚族之间的保守基序存在差异,基因家族结构上的统一性和变异性,为菊苣TCP家族的转录调控作用提供了多样性。菊苣TCP基因家族包含了大量的顺式作用元件、有5种激素响应元件,胁迫相关响应元件和生长发育相关元件。有研究探讨了栽培番茄和多毛番茄microRNA319在温度胁迫中发挥的功能,高温胁迫下,早期(1 h)miR319a,b,d表达量提高,抑制TCP3,TCP29和TCP2的表达,microRNA319可以提高植物应对温度胁迫的能力[7]。对水稻中TCP5基因的研究发现,其对于植物干旱和盐胁迫有所响应[23]。植物形态结构与植物激素之间的相互作用可以提高植物抗逆性,TCP4可能通过调控主根伸长参与了干旱胁迫响应[24]。这些研究与本文顺式作用元件的结果一致,说明TCP基因家族的表达可能受植物生长发育、激素和环境胁迫的调控。
3.2 菊苣CIN类TCP家族基因的表达特点
TCP基因家族已经被很多研究证实参与植物的生长发育。microRNA319靶基因CiTCP2,CiTCP8,CiTCP25,CiTCP26,CiTCP30和CiTC-P32均为CIN亚族基因,因此本文选择了CIN类基因,对其在不同组织和高温胁迫下的表达模式进行了分析。结果发现各成员在薹上叶组织中的基因表达量均较高;CiTCP2,CiTCP8,CiTCP11,CiT-CP32,CiTCP36在老叶、幼叶、萼片中的表达量也比其他组织高,说明这些基因可能在叶片发育过程中发挥重要作用。AtTCP5参与调控叶边缘形态[25],TCP4可以调控子叶毛状体的发育[26]等研究都说明,这些CIN类的TCP基因可能对叶片的形态构成有重要的调控作用。
王利彬[27]对大豆在高温胁迫应答中的关键转录因子进行了筛选,确定TCP对高温有所响应。在本文中,高温胁迫下大部分成员表达量均上升,在升至最高点后,呈现下降趋势。其中,除CiTCP26,CiTCP30外其余基因表达变化趋势较为相似,变化较为平缓,推测它们应对高温胁迫的响应机制类似。这可能与TCP基因功能存在高度的冗余有关。CiTCP2,CiTCP8,CiTCP25,CiTCP26,CiTCP30和CiTCP32为miR319的靶基因,miR319对于靶基因的调控为负调控[15],番茄中miR319a,b,d在热处理下的表达量呈现由高到低的变化,miR319c表达量下调[7],这与本文中这些基因的表达变化一致。
4 结论
本研究确定了菊苣39个TCP家族成员,并对这些成员基因进行分析,初步探明了其可能会在植物中发挥的功能。接着对CIN类的成员在各组织和高温胁迫下的表达模式进行了探究,结果显示,TCP家族CIN类成员在不同组织中表达各异,主要参与叶片发育调控;各成员均对高温胁迫有不同程度的响应。
参考文献
[1] LANBERT M G,CLARK D A,LITHERLAND A J. Advances in pasture management for animal productivity and health[J]. New Zealand Veterinary Journal,2004,52(6):311-319
[2] KIDANCE A,HOUDIJK J G,ATHANASIADOU S,et al. Effects of maternal protein nutrition and subsequent grazing onchicory(Cichorium intybus) on parasitism and performance of lambs[J]. Journal of Animal Science,2010,88(4):1513-1521
[3] 王若楠,曹升旭,郑飞,等. 菊苣作为饲用牧草的研究与应用[J]. 饲料工业,2018,39(11):19-22
[4] LIN Y F,CHEN Y,HSIAO Y Y,et al. Genome-wide identification and characterization of TCP genes involved in ovule development of Phalaenopsis equestris[J]. Journal of Experimental Botany,2016,67(17):5051-5066
[5] 安琳君. 白桦BpTCP1及BpTCP2基因的功能研究[D]. 哈尔滨:东北林业大学,2020:1
[6] 邵长生,邹春晶,郑慧俊,等. TCP转录因子在植物表皮毛发育调控中的功能[J/OL]. https://kns.cnki.net/kcms2/detail/46.1068.S.20230616.1021.006.html,2023-06-16/2023-09-03
[7] 石潇瀑. 温度胁迫下番茄microRNA319的表达和功能分析[D]. 南京:南京农业大学,2019:47
[8] WANG R,XU L,ZHU X,et al. Transcriptome-wide characterization of novel and heat-stress-responsive micrornas in radish(Raphanus Sativus L.) using next-generation sequencing[J]. Plant Molecular Biology Reporter,2015,33:867-880
[9] ZHOU R,WANG Q,JIANG F,et al. Identification of miRNAs and their targets in wild tomato at moderately and acutely elevated temperatures by high-throughput sequencing and degradome analysis[J]. Scientific Reports,2016,6:33777
[10]张路阳,韩文龙,徐晓雯,等. 烟草TCP基因家族的鉴定及表达分析[J]. 生物技术通报,2023,39(6):248-258
[11]梅文宇,方燕芬,宫超,等. 茄子TCP转录因子的鉴定及胁迫处理下的表达分析[J]. 广东农业科学,2022,49(12):20-33
[12]万鹏龙,李建国,赵明磊. 荔枝TCP家族全基因组鉴定及miRNA靶点分析[J]. https://link.cnki.net/urlid/46.1068.S.20230829.1636.004,2023-08-30/2023-09-03
[13]米跃骐,田彦挺,杨浩,等. 刺槐TCP基因家族鉴定及表达分析[J/OL]. https://link.cnki.net/kcms/detail/46.1068.S.20230505.1238.008.html,2023-05-06/-2023-09-03
[14]魏娜,李艳鹏,马艺桐,等. 全基因组水平紫花苜蓿TCP基因家族的鉴定及其在干旱胁迫下表达模式分析[J]. 草业学报,2022,31(1):118-130
[15]PALATNIK J F,ALLEN E,WU X,et al. Control of leaf morphogenesis by micro RNAs[J]. Nature,2003,425:257-263
[16]MARTIN-TRILLO M,CUBAS P. TCP genes:a family snapshot ten years later[J]. Trends in Plant Science,2010,15(1):31-39
[17]LUCERO L E,UBERTI-MANASSERO N G,ARCE A L,et al. TCP15 modulates cytokinin and auxin responses during gynoecium development in Arabidopsis[J]. The Plant Journal,2015,84(2):267-282
[18]LIN Y F,CHEN Y Y,HSIAO Y Y,et al. Genome-wide identification and characterization of TCP genes involved in ovule development of Phalaenopsis equestris[J]. Journal of Experiment Botany,2016,67(17):5051-5066
[19]MATHIEU A S,CLAIRE.PRILLEUX,JACQUEMIN G,et al. Impact of vernalization and heat on flowering induction,development and fertility in root chicory (Cichorium intybus L var sativum)[J]. Journal of Plant Physiology,2020,254:153272
[20]ANNE-SOPHIE,MATHIEU,BERTRAND,et al. High temperatures limit plant growth but hasten flowering in root chicory (Cichorium intybus) independently of vernalisation[J]. Journal of Plant Physiology,2014,171(2):109-118
[21]CHEN C J,CHEN H,ZHANG Y,et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202
[22]LIVAK K J,SCHMITTGEN T D L. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408
[23]关紫微,曹希雅,张先文,等. 水稻TCP家族的全基因组鉴定及表达分析[J]. 分子植物育种,2022(10):3145-3156
[24]雷其冬. 拟南芥miR319-TCP4调控植物应答干旱胁迫的分子机制研究[D]. 昆明:昆明理工大学,2021:54
[25]YU H,ZHANG L,WANG W,et al. TCP5 controls leaf margin development by regulating KNOX and BEL-like transcription factors in Arabidopsis[J]. Journal of Experimental Botany,2021,72:1809-1821
[26]兰婧秋,秦跟基. ClassⅡTCP转录因子的主要功能和分子调控机制[J]. 中国科学:生命科学,2021,51(11):1542-1557
[27]王利彬. 大豆苗期干旱和高温胁迫应答机制研究及关键转录因子的筛选[D]. 哈尔滨:东北农业大学,2018:112
(责任编辑 闵芝智)

