西氏熊蜂线粒体基因组结构特征及系统发育分析








摘要:本研究利用二代测序技术对西氏熊蜂(Bombus sichelii)的线粒体基因组进行了测序、组装和注释,并对其线粒体基因组的组成、结构特征、基因重排及系统发育等方面进行了生物信息学分析。结果表明:西氏熊蜂线粒体基因组长度为15 711 bp,包含13个蛋白编码基因、22个tRNA基因和2个rRNA基因;线粒体基因组全序列、蛋白编码基因的串联序列、tRNA串联序列、rRNA串联序列的A+T含量均大于80%,表现出明显的碱基偏倚;13 个蛋白编码基因的起始密码子均为ATN,终止密码子为TAA,TAG或T --。tRNA二级结构预测发现,trnS1与其他昆虫具有相同的特征,即缺少DHU臂和DHU环,其余21个tRNA均能形成典型的三叶草结构;系统发育进化分析结果高度支持西氏熊蜂与火红熊蜂(B. pyrosoma)隶属于黑熊蜂亚属(Melanobombus)。本研究首次获得西氏熊蜂线粒体基因组序列,初步鉴定了其线粒体基因组的特征,为进一步对熊蜂线粒体基因组学和系统发育关系的研究奠定了基础。
关键词:西氏熊蜂;线粒体基因组;生物信息学;系统发育分析
中图分类号:S891;Q963""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2408-11
The Mitochondrial Genome Characteristics and Phylogenetic Analysis
of Bombus sichelii
MA Xiao-xuan, LIANG Cheng-bo, LIU Dao-xin, SUN Guo, YAN Jing-yan*
(School of Agriculture and Animal Husbandry, Qinghai University, Xining, Qinghai Province 810016, China)
Abstract:In this study,the mitochondrial genome of Bombus sichelii was sequenced by next-generation sequencing technology,then was assembled and annotated. And the composition,structural characteristics,gene rearrangement and phylogeny of the mitochondrial genome were analyzed by bioinformatics. The results showed that the mitochondrial genome of B. sichelii was 15 711 bp in length,containing 13 protein-coding genes,22 tRNA genes and 2 rRNA genes. The A+T content of the whole mitochondrial genome sequence,the tandem sequence of protein-coding genes,the tandem sequence of tRNA,and the tandem sequence of rRNA were all greater than 80%,showing obvious base bias. The initiation codon of 13 protein-coding genes was ATN,and the stop codons was TAA,TAG,or T--. The secondary structure prediction of tRNAs showed that trnS1 had the same characteristics as other insects. That is,it lacked DHU arm and DHU ring,and the other 21 tRNAs could form a typical clover structure. Phylogenetic findings support the affiliation of B. sichelii and B. pyrosoma to Melanobombus. In this study,the mitochondrial genome sequence of B. sichelii was obtained for the first time,and the characteristics of the mitochondrial genome of Bumblebee were preliminarily identified,which laid a foundation for further research on the relationship between mitochondrial genomics and phylogeny of bumblebees.
Key words:Bombus sichelii;Mitochondrial genome;Bioinformatics;Phylogenetic analysis
熊蜂(Bombus spp.)是膜翅目(Hymenoptera)、细腰亚目(Apocrita)、蜜蜂科(Apidae)、熊蜂属(Bombus)昆虫的总称[1]。熊蜂是众多野生植物的重要传粉者,在高海拔生态系统中,鸟类和蝴蝶的传粉作用逐渐减弱,熊蜂则由于其对高海拔环境的高度适应性、较强的飞行能力和高的花粉传递效率成为主导的传粉者,对维持高海拔生态系统的平衡和稳定至关重要[2-4]。但由于栖息地丧失、环境污染和气候变化等多种因素的影响,许多生境内的熊蜂种类及数量显著降低,目前已经有36种熊蜂被列入国际自然保护联盟濒危物种红色名录[5-8]。我国在近些年的调查中发现,黑足熊蜂(B. atripes)已经从云南省内消失[9],所以熊蜂物种多样性的保护已迫在眉睫。
线粒体基因组(Mitochondrial genome,mtDNA)是在线粒体内发现的小型环状染色体,具有基因进化速率快、母系遗传、高拷贝数、结构简单及易获得等特点,已广泛应用于物种鉴定、种群遗传结构、系统发育和系统地理学等研究领域[10-11]。熊蜂的传统形态学鉴定主要以体色图案为依据,然而,一些不同的熊蜂物种常常出现相似的毛色配置,而同种内不同级型或不同区域的个体间毛色也会存在较大变异,这些都给熊蜂的形态分类和鉴定带来了较大的困难[12]。随着分子生物学技术的快速发展,基于线粒体基因序列等分子标记的熊蜂分类学和遗传学研究日益受到研究人员的关注。其中,COI,Cytb,16S rRNA和微卫星标记等是熊蜂中普遍使用的分子标记,Bertsch[13]和刘苹等[14]利用COI基因明确了明亮熊蜂复合种的分类地位及其分布特性;Pirounakis等[15]利用Cytb基因分析发现B. pascuorum在阿尔卑斯山的13个不同地理分区中存在遗传变异。但由于单一基因所携带的遗传信息较少,所以多基因联合分析在熊蜂研究中日益增加。例如Williams等[16]利用16S rRNA和COI 2种分子标记,对山熊蜂亚属(Alpinobombus)中基于形态学鉴定存在问题的物种进行了综合鉴定;Cwjas等利用线粒体基因标记和微卫星标记,研究了伊比利亚半岛上地熊蜂(B. terrestris)的时空格局[17]。随着高通量测序技术的发展,线粒体基因组序列的获得变得越来越容易,2023年通过对山东和辽宁2个地区的日光蜂(Aphelinus mali)[18]进行线粒体基因组测序分析,发现2个支系之间仅存在历史地理隔离,尚未出现种群间的生殖隔离,证明了2个支系仍然属于同一物种。所以在分子技术不断发展的情况下,利用分子手段比利用形态学鉴定熊蜂更加高效准确。近年来,通过众多学者不断丰富线粒体基因的研究,线粒体基因在物种鉴定、遗传进化等方面的应用价值正逐渐增强。
西氏熊蜂隶属于黑熊蜂亚属,是目前众多学者普遍认同的分类结果,且在我国大部分省份都有分布[2]。2023年胥勋露等[7]在对青藏高原东北部边缘的调查研究中,发现西氏熊蜂是此地区的常见种,广泛分布在 3100~3600 m的高海拔地区,并且西氏熊蜂的访花植物种类涉及范围达到5科11种,其中对菊科(Asteraceae)植物、豆科(Fabaceae)植物等具有明显的访问偏好。近年来,对熊蜂的研究工作主要是集中在形态学鉴定、蜜源植物的调查、种质资源的保护及人工繁育等方面,但对线粒体基因组方面的分子研究尚不完备,其中黑熊蜂亚属仅有火红熊蜂(B. pyrosoma)和B. lapidarius的线粒体基因组数据被记录。鉴于此,本研究首先补充西氏熊蜂线粒体基因组数据,即采用二代测序技术对西氏熊蜂的线粒体基因组测序、组装、注释,然后对其线粒体基因组的组成和结构特征等方面进行分析,丰富熊蜂线粒体基因组的基础研究;最后采用最大似然法(Maximum likelihood,ML)和邻接法(Neighbor-Joining,NJ)构建基于13个亚属熊蜂线粒体基因组全序列的进化树,探讨西氏熊蜂在熊蜂属内的分类地位及各熊蜂亚属间的进化关系,从而为后续的群体遗传学研究提供重要的基础信息。
1 材料与方法
1.1 标本采集
西氏熊蜂样品2021年7月在青海省玉树市(33°11′ N,97°24′ E)采集,浸泡于无水乙醇中并置于-80℃冰箱内,保存在青海大学农牧学院昆虫学实验室。
1.2 线粒体基因组的测序、组装及注释
西氏熊蜂样品送至北京诺禾致源生物科技有限公司构建350 bp的小片段测序文库并在Illumina NovaSeq平台进行高通量测序,测序读长为PE150。利用Getorganelle软件对公司测得的clean reads进行组装,获得西氏熊蜂的线粒体基因组序列[19]。采用MITOS在线服务器(http://mitos.Bioinf.uni-leipzig.de)对西氏熊蜂线粒体基因组序列进行功能注释。将注释结果导入Geneous 9.0.2对比参考序列,手动调整蛋白编码基因起始密码子和终止密码子位置,遵循尽可能少的基因间隔和基因重叠且起始终止密码完整的原则。
1.3 西氏熊蜂的生物信息学分析
采用在线网站CGView Server(http://cgview.ca/)绘制西氏熊蜂线粒体基因组圈图。利用Phylosuite v1.2.2提取并分别计算西氏熊蜂线粒体基因组中各编码基因的碱基组成、AT偏倚(AT-skew)和GC偏倚(GC-skew),其中,碱基偏倚的计算公式为:AT偏倚= (A-T) / (A+T)、GC偏倚= (G-C) / (G+C)。利用Phylosuite v1.2.2和Rstudio 4.3.0分析并绘制蛋白编码基因的相对同义密码子使用度柱状图(Relative synonymous codon usage,RSCU)[20]。采用在线软件MITOS和ARWEN(http://130.235.244.92/ARWEN/)对tRNA基因进行查找及二级结构的预测[21]。对西氏熊蜂和其余11种熊蜂及果蝇(Drosophila yakuba)的线粒体基因组序列,利用在线网站ITOL(https://itol.embl.de)绘制13条序列中37种基因的排列,分析不同基因的重排。
1.4 西氏熊蜂系统发育分析
为研究西氏熊蜂与其他熊蜂的系统发育关系,选取已报道的熊蜂属13个亚属的20条序列作为内群,蜜蜂属的3种昆虫为外群(表1),使用MEGA 10软件中的邻接法和最大似然法构建系统进化树[22]。
2 结果与分析
2.1 西氏熊蜂线粒体基因组的结构特征分析
西氏熊蜂线粒体基因组长度为15 711 bp,包含37个基因,分别为13个蛋白编码基因(protein-coding genes,PCGs)、22个tRNA基因和2个rRNA基因(图1)。其中有9个PCGs和13个tRNA基因在主要编码链(H链)上;4个PCGs、9个tRNA基因和2个rRNA基因在次要编码链(L链)上。
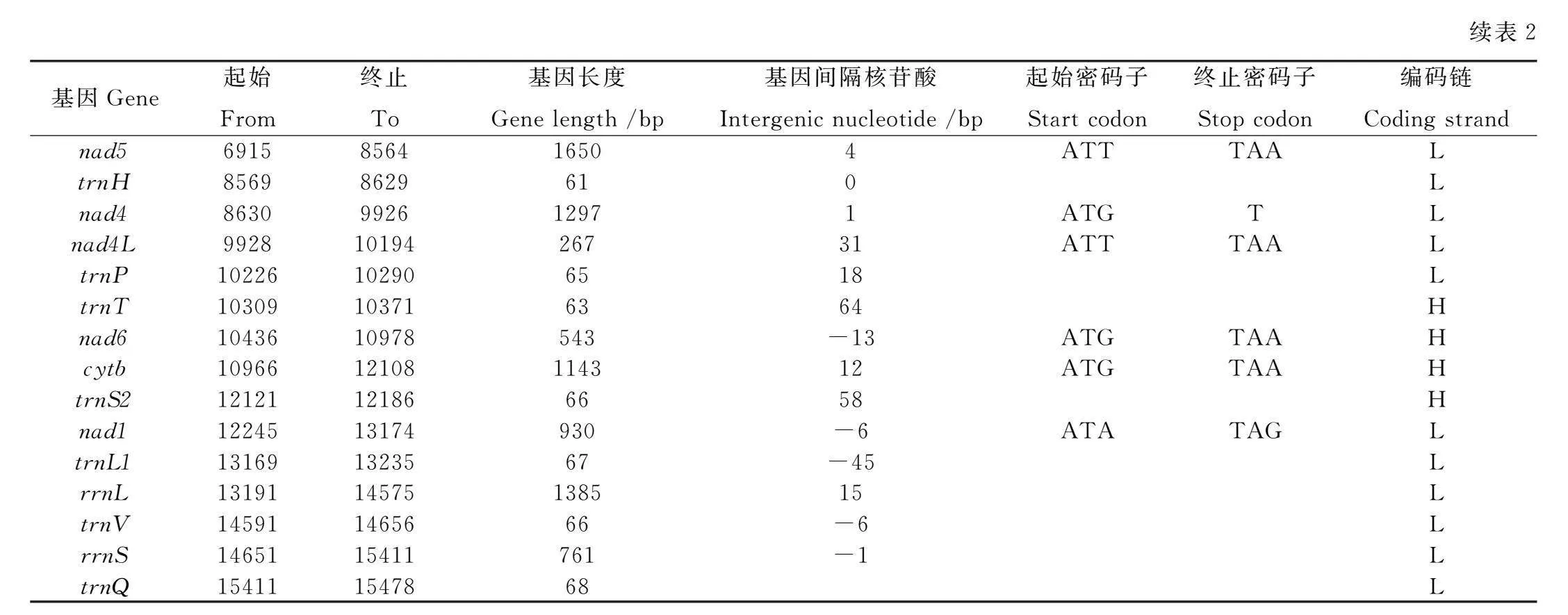
西氏熊蜂的线粒体相邻基因间存在长度不等的基因间隔和基因重叠,本研究共发现21个基因间隔和11个基因重叠,trnY和trnW间基因间隔最长(198 bp),nad4和nad4L间间隔最短(1 bp);在相邻基因的基因重叠中,trnL1和rrnL间基因重叠最长,为45 bp(表2)。
2.2 西氏熊蜂线粒体基因组的碱基组成分析
西氏熊蜂线粒体基因组全序列、蛋白编码基因、tRNA基因和rRNA基因4个数据集的A+T含量分别为85.9%,83.9%,87.2%和86.7%,其中13个蛋白编码基因的A+T含量分别在77%~90.9%之间,其中cox1最低,为77%,nad6最高,达到90.9%(表3)。对每个蛋白编码基因的AT偏倚分析中发现,所有蛋白编码基因都呈现T偏倚,但在GC偏倚分析中4个蛋白编码基因(atp6,cox2,nad2,nad5)呈现C偏倚,cox3和cytb无碱基偏倚,其余7个蛋白编码基因呈现G偏倚。对4个数据集的碱基偏倚分析发现,13个PCGs串联数据集与线粒体基因组全序列的碱基偏倚结果一致,均对T碱基和C碱基具有明显的碱基偏倚;22个tRNAs和2个rRNAs数据集的分析结果却表明对A碱基、G碱基具有明显的碱基偏倚。所以与其他数据集相比,13个PCGs的串联数据集与线粒体基因组的组成特征更加一致。
2.3 西氏熊蜂蛋白编码基因的密码子使用分析
西氏熊蜂13个蛋白编码基因的串联序列总长度为11 022 bp,占全基因组的71.15%,共编码了3 674个氨基酸。氨基酸的百分含量由高到低排列如下:Leu>Ile>Met>Phe>Ser>Asn>Tyr>Lys>Gly>Thr>Val>Pro>Trp>Glu>His>Asp>Ala>Gln>Arg>Cys。其中氨基酸占比最高的是亮氨酸(Leu),为15.16%,半胱氨酸(Cys)占比最少,为0.73%。在相对同义密码子使用度分析中发现,所有氨基酸对第3位碱基是A/U的密码子具有明显使用偏好,如精氨酸(Arg)偏好使用CGA、脯氨酸(Pro)偏好使用CCA、天冬氨酰(Asn)偏好使用AAU、缬氨酸(Val)偏好使用GUU等(图2)。其中13个蛋白编码基因的起始密码子均为ATN,除nad4以不完整的终止密码子T结尾,其余12个蛋白编码基因均以完整的终止密码子(TAA/TAG)结尾。
2.4 西氏熊蜂tRNA二级结构预测分析
西氏熊蜂的线粒体基因组注释得到22个tRNA基因,其中13个位于H链,9个位于L链,单个tRNA基因的序列长度在59~74 bp之间。tRNA基因的二级结构预测结果如图3所示,其中trnS1因缺少1个二氢尿嘧啶臂(DHU臂)和二氢尿嘧啶环(DHU环)不能形成典型的三叶草结构,其余tRNA均能构成典型的三叶草结构,但trnF,trnH,trnN和trnV基因的二级结构中缺少TφC环。22个tRNA中共发现12次G-U碱基错配,分别在trnA,trnC,trnD,trnH,trnI,trnK,trnP,trnL1,trnQ和trnV中各出现1次,trnF中出现2次。
2.5 线粒体基因组的基因重排分析
熊蜂与果蝇的线粒体基因排列相比具有明显不同(图4),其基因重排主要发生在以下6个区域:trnK移位的trnD-trnK基因簇;trnA移位的trnQ-trnA-trnM-trnI基因簇;trnS1移位的trnE-trnS1-trnF基因簇;trnT移位的trnP-trnT基因簇;trnI移位的trnA-trnM-trnI基因簇;trnW移位的trnC-trnY-trnW基因簇。
不同熊蜂亚属与果蝇线粒体基因重排的分析结果如下:
(1)在trnR的移位分析发现,胸熊蜂亚属的trnR移位到trnN的下游,形成trnN-trnR基因簇;巨熊蜂亚属的trnR移位到trnQ的下游,形成trnQ-trnR基因簇,其他5个亚属则为trnR-trnN基因簇。(2)trnT移位到nad6上游,形成trnP-trnT基因簇,这种基因重排在熊蜂亚属、黑熊蜂亚属、阿熊蜂亚属、西熊蜂亚属共4个亚属中均有出现,其他亚属未见此种基因重排。(3)在trnA的移位分析中共发现2种不同的移位现象,一种是在胸熊蜂亚属、假熊蜂亚属、黑熊蜂亚属、西熊蜂亚属的西伯熊蜂和阿熊蜂亚属的克什米尔熊蜂中发现的trnA移位到trnQ下游,形成trnQ-trnA-trnM-trnI基因簇。另一种在熊蜂亚属、阿熊蜂亚属的短头熊蜂和西熊蜂亚属的亚西伯熊蜂中发现的trnA移位到trnM下游,形成trnQ-trnM-trnA-trnI基因簇。(4)在trnI的移位分析中发现,除假熊蜂亚属外其他6个亚属的trnI均移位到nad2上游,形成trnA-trnM-trnI基因簇,而假熊蜂亚属的trnI却移位到trnM上游,形成trnA-trnI-trnM基因簇。
本研究除阿熊蜂亚属和西熊蜂亚属内具有trnA的基因重排,阿熊蜂亚属内的短头熊蜂具有nad2的缺失,其他各亚属内均无线粒体基因重排。西氏熊蜂与同样隶属于黑熊蜂亚属的火红熊蜂的线粒体基因排列顺序一致。通过上述的比较分析,发现熊蜂各亚属间具有较为频繁的基因重排,各亚属内的基因重排不频繁。
2.6 线粒体基因组系统发育分析
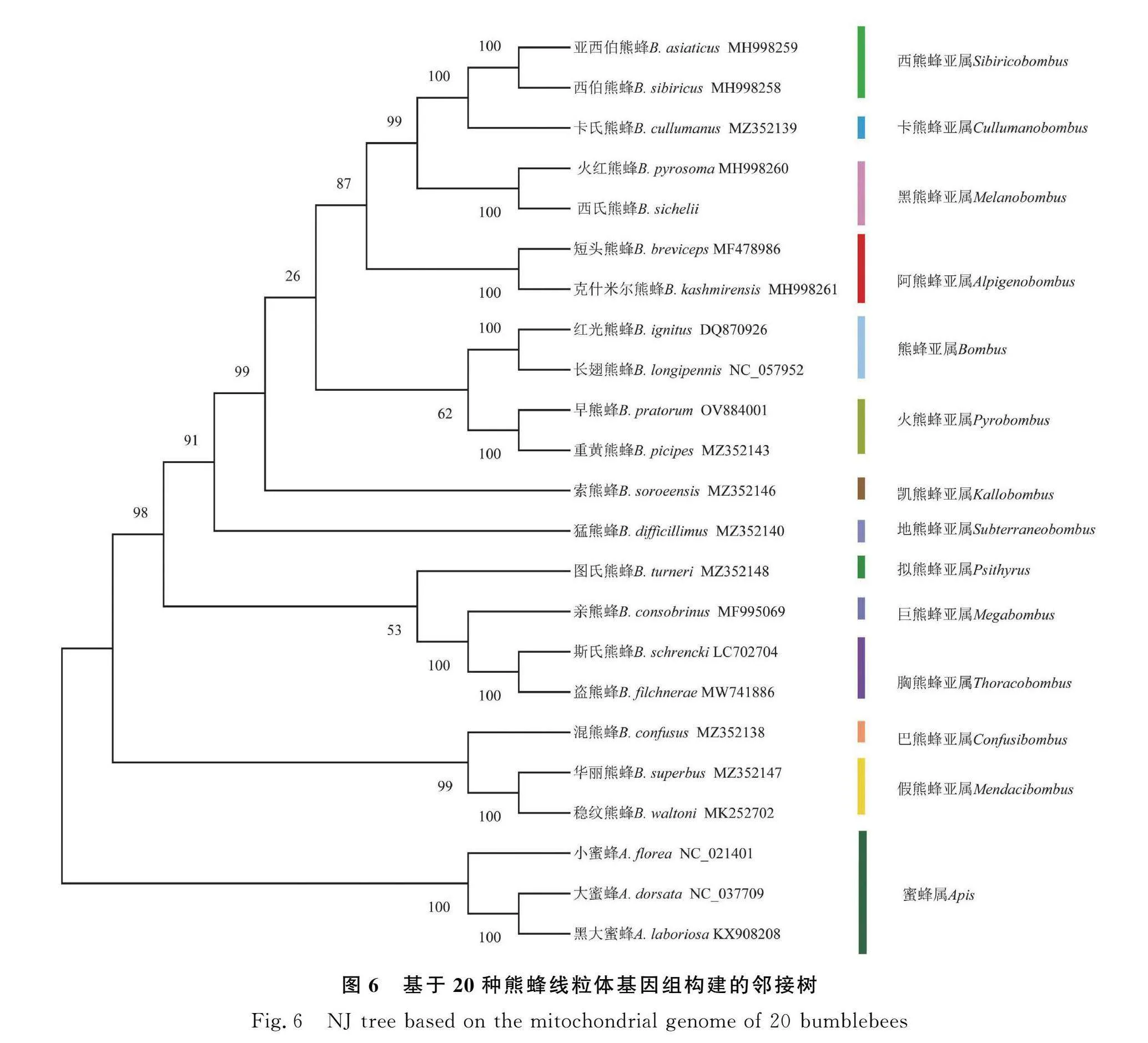
本研究利用最大似然法和邻接法构建基于20种熊蜂线粒体基因组全序列的系统发育树(图5、图6)。2种方法构建的系统发育树均高度支持西氏熊蜂与火红熊蜂共同隶属于黑熊蜂亚属,且支持率为100%。2个系统发育树的拓扑结构对各亚属之间亲缘关系的划分结果不完全相同,但两者均证明假熊蜂亚属(Mendacibombus)和巴熊蜂亚属(Confusibombus)是最先分化的一支。在2个系统发育树上可以看出,远离根部的分支支持率高,对亚属的分类具有100%的支持率;距离根部近的分支节点支持率低,普遍在80%以下。其中地熊蜂亚属在ML发育树中与巨熊蜂亚属(Megabombus)的亲缘关系更近,在NJ发育树中与凯熊蜂亚属(Kallobombus)的亲缘关系更近,由此可见利用线粒体基因组序列对亚属间的亲缘关系划分尚且不够准确。但2个系统发育树的结果均可以看出短脸型的熊蜂亚属(Bombus)、黑熊蜂亚属(Melanobombus)、阿熊蜂亚属(Alpigenobombus)、火熊蜂亚属(Pyrobombus)、西熊蜂亚属(Sibiricytbombus)和卡熊蜂亚属(Cullumanobombus)之间的亲缘关系更近,与长脸型的巨熊蜂亚属(Megabombus)、胸熊蜂亚属(Thoracytbombus)和拟熊蜂亚属(Psithyrus)等亚属亲缘关系相对较远,这与前人根据头部的形态学特征[23]和单基因分子鉴定的结果一致。
3 讨论
西氏熊蜂首次完成线粒体基因组测序及功能注释,其长度为15 711 bp。序列组成分析结果表明,西氏熊蜂线粒体基因组存在明显的碱基偏倚,一方面,与前人所发现的昆虫线粒体基因组具有高A+T含量的特点相一致,西氏熊蜂的线粒体基因组全序列、蛋白编码基因、tRNAs基因、rRNAs基因的A+T含量均大于80%;另一方面,在相对同义密码子的分析中也发现第3位碱基是A/U的密码子具有明显的高使用现象[10]。西氏熊蜂线粒体蛋白编码基因的起始密码子为典型的ATN,终止密码子主要是TAA和TAG,仅nad4是以不完整的终止密码子T结尾,这种使用不完整的终止密码子在其他膜翅目昆虫中也时有发生[24]。西氏熊蜂线粒体基因组的蛋白编码序列全长11 022 bp,共编码氨基酸3647个,其中频率最高的依次为亮氨酸(Leu,15.16%)、异亮氨酸(Ile,13.15%)、蛋氨酸(Met,10.94%)和苯丙氨酸(Phe,10.83%),而频率最低的依次为丙氨酸(Ala,1.42%)、谷氨酰胺(Gln,1.22%)、精氨酸(Arg,1.01%)和半胱氨酸(Cys,0.73%),这种丰度排序与其他膜翅目昆虫中基本一致[25]。
对西氏熊蜂线粒体基因组的tRNA二级结构预测发现,除了trnS1缺少DHU臂和DHU环,其他都呈现典型的三叶草结构,其中trnS1缺臂的现象在后生动物线粒体基因组中普遍存在[26]。本研究在22个tRNA中共发现12次碱基错配,这种错配在tRNA的折叠过程中是被允许的,且在其他后生动物的线粒体中也普遍存在[27]。本研究所发现的碱基错配为G-U错配,有学者认为这种错配可在RNA编辑中校正,并不影响tRNA基因的转运功能[28]。
果蝇线粒体基因组的基因排列顺序一直被认为是昆虫线粒体基因组的原始排列方式[29]。早在上个世纪,研究人员就已经发现,膜翅目昆虫的线粒体基因组比其他目的昆虫存在更为频繁的基因重排,且细腰亚目的基因重排比广腰亚目更多[30]。通过将西氏熊蜂线粒体基因组的基因排列与果蝇比较,结果发现明显的基因重排,且均为tRNA的移位,蛋白编码基因无基因重排。这与前人发现膜翅目线粒体基因组的基因重排主要是tRNA的重排结果一致[31]。而trnR在巨熊蜂亚属内的远距离移位尚不能确定这是否在亚属内普遍发生,在其他亚属的研究中也并没有此类发现。
本研究中,NJ和ML系统发育树的结果均显示,西氏熊蜂与火红熊蜂聚为一支,且与形态学鉴定结果一致均隶属于黑熊蜂亚属。由于在2个系统发育树中,各亚属的亲缘关系不完全一致,但两棵树对远离根部的分支聚类均具有高的支持率(100%),即利用线粒体基因组序列对当前物种亚属的划分是具有高支持率的,符合Willims等[32]基于形态学和线粒体基因片段对各亚属的分类及修订结果。在2个系统发育树中,距离根部近的分支节点普遍在80%以下,其结果对探讨亚属间亲缘关系的准确度不高,这或许是由于熊蜂物种的线粒体基因组序列不充足导致,所以对熊蜂属内更多物种的线粒体基因组进行测序,补充其线粒体基因组数据,对后续探索各亚属间的亲缘关系具有重要意义。
4 结论
本研究获得了西氏熊蜂的线粒体基因组序列,明确了其线粒体基因组组成和结构特征,即线粒体基因组包含37个基因的基本组成,对A/T明显的碱基偏倚等结果。西氏熊蜂线粒体基因组与已报道的膜翅目中大部分昆虫的线粒体基因组相似,且与蜜蜂科昆虫线粒体基因组的一般特征一致。西氏熊蜂的研究结果进一步丰富了熊蜂属的线粒体基因组数据,对西氏熊蜂的分子鉴定和种群遗传学研究以及熊蜂属系统发育关系的深入探讨等具有重要意义。
参考文献
[1] 安建东,黄家兴,WILLIAMS P H,等. 河北地区熊蜂物种多样性与蜂群繁育特性[J]. 应用生态学报,2010,21(6):1542-1550
[2] 黄家兴,安建东. 中国熊蜂多样性、人工利用与保护策略[J]. 生物多样性,2018,26(5):486-497
[3] 蒙艳华,徐环李,陈轩,等. 塔落岩黄芪主要传粉蜂的传粉效率研究[J]. 生物多样性,2007,15(6):633-638
[4] 何亚平,刘建全. 青藏高原高山植物麻花艽的传粉生态学研究[J]. 生态学报,2004,24(2):215-220
[5] 梁程博,王久利,孙国,等. 三江源地区熊蜂物种多样性研究[J]. 草地学报,2022,30(8):2126-2134
[6] 张广硕,丁桂玲,安建东. 熊蜂主要病虫害的发生和危害现状[J]. 应用昆虫学报,2021,58(2):277-288
[7] 胥勋露,常雪梅,曾桂,等. 甘南草原和若尔盖湿地的熊蜂物种资源调查[J]. 西华师范大学学报(自然科学版),2024,45(3):239-245
[8] 刘青青,赫苗花,李飞,等. 不同坡向下高寒矿区混播草地的恢复效果评估[J]. 草地学报,2023,31(9):2834-2842
[9] 梁铖,张学文,黄家兴,等. 云南熊蜂地理区划及物种多样性分析[J]. 应用昆虫学报,2018,55(6):1045-1053
[10]朱国渊,张永科,孔祥东,等. 二斑素瓢虫线粒体基因组全序列测定和分析[J]. 南方农业学报,2023,54(5):1293-1302
[11]ZHANG J Y,ZHANG L P,YU D N,et al. Complete mitochondrial genomes of Nanorana taihangnica and N.yunnanensis (Anura:Dicroglossidae) with novel gene arrangements and phylogenetic relationship of Dicroglossidae[J]. BMC Evolutionary Biology,2018,18(1):26-39
[12]黄家兴. 华北地区熊蜂属(Hymenoptera:Apidae)系统发育的初步研究[D]. 北京:中国农业科学院,2006:2
[13]BERTSCH A. Barcoding cryptic bumblebee taxa:B. lucorum,B. crytarum and B. magnus,a case study[J]. Beitrage Zur Entomol,2009,59(2):287-310
[14]刘苹,黄家兴,吴杰,等. 中国明亮熊蜂复合种的分子鉴定及分布特性[J]. 昆虫学报,2014,57(2):235-243
[15]PIROUNAKIS K,KOULIANOS S,SCHMID-HEMPEL P. Genetic variation among European populations of Bombus pascuorum (Hymenoptera:Apidae) from mitochondrial DNA sequence data[J]. European Journal of Entomology,2013,95(1):27-33
[16]WILLIAMS P H,BEREZIN M V,CANNINGS S G,et al. The arctic and alpine bumblebees of the subgenus Alpinobombus revised from integrative assessment of species’ gene coalescents and morphology (Hymenoptera,Apidae,Bombus)[J].Zootaxa,2019,4625(1):1-68
[17]CEJAS D,DE LA RU′A P,ORNOSA C,et al. Spatial and temporal patterns of genetic diversity in Bombus terrestris populations of the Iberian Peninsula and their conservation implications[J]. Scientific Reports,2021,11(1):22471
[18]SU M,DU L J,ALI M Y,et al. Differences in morphology,mitochondrial genomes,and reproductive compatibility between two clades of parasitic wasps Aphelinus mali (Hymenoptera:Aphelindae) in China[J]. Plos One,2023,18(2):e0279663
[19]郭冉昊,赵淑文,米福贵,等. 直立型半野生大豆叶绿体基因组分析[J]. 草地学报,2023,31(11):3334-3342
[20]郝新艳,赵淑文,刘嘉伟,等. 杂花苜蓿叶绿体基因组特征及系统发育分析[J]. 草地学报,2023,31(6):1665-1672
[21]LIN Y J,CAI L N,ZHAO Y Y,et al. Novel mitochondrial gene rearrangement and intergenic regions exist in the mitochondrial genomes from four newly established families of praying mantises (Insecta:Mantodea)[J]. Insects,2022,13(7):564-564
[22]李瑶瑶,刘云国,刘凌霄,等. 高原鳅属鱼类线粒体全基因组序列结构特征及其系统发育信息[J]. 烟台大学学报(自然科学与工程版),2021,34(1):93-99
[23]CAMERON A S,HINES M H,WILLIAMS H P. A comprehensive phylogeny of the bumble bees (Bombus)[J]. Biological Journal of the Linnean Society,2007,91(1):161-188
[24]赵婉清,李巧,李莹,等. 猎蝽科昆虫线粒体基因组的比较研究[J]. 江苏农业科学,2020,50(12):34-41
[25]彭艳,陈斌,李廷景. 黄侧异腹胡蜂线粒体基因组全序列测定和分析[J]. 昆虫学报,2017,60(4):464-474
[26]WOLSTENHOLME D R. Animal mitochondrial DNA:structure and evolution[J]. International Review of Cytology,1992(141):173-216
[27]陈建琴,张振华,邢雨辉,等. 光滑异装蟹(Heteropanope glabra)线粒体基因组测定及其在系统发生研究中的意义[J]. 南京师大学报(自然科学版),2018,41(4):114-120
[28]韦春梦,陈亚珍,刘静,等. 云南瘤蚱线粒体基因组特征与蚱总科系统发育分析[J]. 南方农业学报,2023,54(5):1303-1316
[29]CLARY D O,WOLSTENHOOLME D R. The mitochondrial DNA molecular of Drosophila yakuba:nucleotide sequence,gene organization,and genetic code[J]. Journal of Molecular Evolution,1985,22(3):252-271
[30]JERMIIN L S,CROZIER R H. The cytochrome b region in the mitochondrial DNA of the ant Tetraponera rufoniger:sequence divergence in Hymenoptera may be associated with nucleotide content[J]. Journal of Molecular Evolution,1994,38(3):282-294
[31]KORKMAZ E M,AYDEMIR H B,TEMEL B,et al. Mitogenome evolution in Cephini (Hymenoptera:Cephidae):Evidence for parallel adaptive evolution[J]. Biochemical Systematics and Ecology,2017(71):137-146
[32]WILLIAMS P H,CAMERON S A,HINES H M,et al. A simplified subgeneric classification of the bumblebee (genus Bombus)[J]. Apidologie,2008,39(1):46-74
(责任编辑 闵芝智)

