我国药用辅料蔗糖标准现状及发展建议

摘要:蔗糖作为一种关键的药用辅料,其在医药领域的应用极为广泛。然而,我国现行的药用辅料蔗糖标准与国际标准之间存在显著差异,这可能影响药品的质量和安全性。本研究旨在深入分析药用辅料蔗糖的基本情况、国内外产品标准的差异、行业发展中存在的问题,并提出相应的发展建议,确立科学合理的药用辅料蔗糖标准对于提升药品质量、保障用药安全具有至关重要的意义。国家药品标准管理部门可进一步细化《中国药典》指标要求,加强指标体系建设;生产企业应加强生产管理,确保生产过程中的质量控制。
关键词:蔗糖,药用辅料,标准
DOI编码:10.3969/j.issn.1002-5944.2024.18.011
0引言
药用辅料在药品制剂中扮演着至关重要的角色,它们不仅为药品提供必要的物理和化学性质,还确保了药品的安全性和有效性。药用辅料蔗糖是常见的药用辅料之一,是药品中重要的矫味剂、赋形剂、黏合剂和保湿剂,其在医药制剂领域的年使用量高达50万-60万吨。根据给药途径的不同,药用辅料蔗糖可分为口服级和注射级两大类。口服级蔗糖主要应用于各类口服制剂的生产,广泛地应用于颗粒剂、片剂、糖浆剂、口服液、膏滋、丸剂等口服制剂中;注射级蔗糖主要作为注射剂的稳定剂和保护剂、疫苗和生物制品中的稀释剂或稳定剂,其各项指标远高于口服级,溢价可达几十倍。
由于我国药用辅料蔗糖生产起步晚,前些年,严格符合《中华人民共和国药品管理法》要求的产品较少,其生产供应无法满足药企的采购需求,因此部分药企直接采购食品级白砂糖,存在药用辅料蔗糖和食品级白砂糖混用现象,这在一定程度上造成了监管困难与市场混乱。近些年,随着我国制糖行业水平的显著提升,高品质的药用辅料蔗糖供给能力得到提升,且随着我国医药行业的法规和监督管理的日益规范,越来越多的制药企业将食品级白砂糖变更为药用辅料蔗糖,以满足更高的药品质量要求。
然而,国内药用辅料蔗糖行业的发展仍面临一些挑战。与食品级蔗糖或国外药用辅料蔗糖标准相比,国内现行标准存在较大差异,这在一定程度上制约了我国医药产业的国际化进程。未来,我国药用辅料蔗糖的标准必将与国际标准接轨,以促进医药产业的健康发展。
本研究通过深入分析药用辅料蔗糖的基本情况、国内外产品标准的差异以及行业发展中存在的问题,旨在提出相应的发展建议。这不仅有助于完善标准体系、维护市场秩序,还将为促进我国医药行业的发展提供重要的指导意义。
1药用辅料蔗糖标准差异对比
药用辅料蔗糖的质量直接关系到药品的安全性和有效性。在我国,药用辅料蔗糖的生产工艺主要包括碳酸法、亚硫酸法和回溶重结晶法三种。回溶重结晶法是基于碳酸法、亚硫酸法所产蔗糖进一步加工而得,理论上其产品质量优于碳酸法及亚硫酸法所产蔗糖。现行的药用辅料蔗糖标准为《中国药典》2020版第一增补本,该标准通过限定比旋度、还原糖分、溶液颜色、硫酸盐、炽灼残渣、钙盐和重金属等指标,规范了药用辅料蔗糖的质量。这些指标的设定旨在确保药用辅料蔗糖的纯度、稳定性和安全性,从而保障最终药品的质量。
1.1我国药用辅料蔗糖标准与食品级蔗糖标准对比
我国药用辅料蔗糖标准(《中国药典》2020版)与食品级白砂糖标准(GB/T 317-2018)各项指标,具体如表1所示。
由上表可知,两个标准的侧重点不一样,《中国药典》对硫酸盐、钙盐、重金属等安全性指标有所要求,但对电导灰分、干燥失重、色值、混浊度、不溶于水杂质、二氧化硫等指标没有要求。在蔗糖分和还原糖等关键指标方面,《中国药典》的标准与食品级白砂糖存在明显差异。蔗糖分是衡量食糖质量的重要指标,反映了糖品中蔗糖的质量分数。《中国药典》规定药用辅料蔗糖的蔗糖分不得低于99.6%,这一标准与一级白砂糖相当,但与优级、精制级白砂糖有较大差距。还原糖分指标同样反映蔗糖的纯度,数值越低,表示还原糖含量越少,蔗糖纯度越高。《中国药典》规定药用辅料蔗糖的还原糖分不得超过0.10%,与一级白砂糖相当,但与优级、精制级白砂糖有明显差距。在颜色指标方面,《中国药典》采用比色法,要求药用辅料蔗糖的颜色不得比黄色4号标准比色液更深,而食品级白砂糖则通过分光光度计检测色值,并将色值进行量化,提供了更为精确的颜色评价。
1.2国内外药用辅料蔗糖标准对比
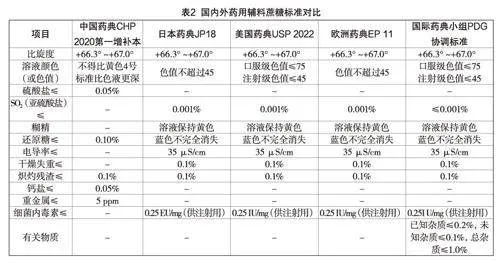
蔗糖作为一种常用的药用辅料,收载于《日本药局方》JP 18版、《美国药典》USP 2022、《欧洲药典》EP 11等国际标准中,但同现行《中国药典》CHP 2020第一增补本有一定的差异,具体如表2所示:
由上表可知,(1)我国药用辅料蔗糖标准对于比旋度、溶液颜色、还原糖等指标的要求较为完备,与国外标准基本持平,尤其是单独对重金属、钙盐指标做了限制,一定程度上提升了药用辅料蔗糖的安全性,但在检测方法上,会有所差异。以溶液颜色为例,《中国药典》对于溶液颜色的检查法收载了三种检查方法:目视法、紫外一可见分光光度法和色差计法。目视法相较于紫外一可见分光光度法,具有操作简便,成本较低的优点,但存在主观误差,对颜色的分辨能力有限的缺点。(2)我国药用辅料蔗糖标准未对亚硫酸盐、电导率、干燥失重及细菌内毒素等指标作出限定。其中,国外药典对于亚硫酸盐指标的检测,利用亚硫酸盐转化酶等三种酶或辅酶进行检测,由于成本较高、采购不便等原因,中国药典中没有亚硫酸盐限量检查的通用方法。(3)除《中国药典》2020年版第一增补本外,国外药典均明确了蔗糖(供注射用)的特殊要求。细菌内毒素是注射级辅料关键指标之一,美国、日本等国家对“口服级”与“注射级”蔗糖都有明显的划分标准,而中国药典中并未找到“注射级”蔗糖的概念,也未对蔗糖的细菌内毒素等关键指标加以限制。(4)国际药典小组协调标准对“有关物质”指标有要求,限定了产品中的杂质含量,也值得引起关注。
2药用辅料蔗糖中的关键指标对药品质量的潜在影响
作为最常用的药用辅料之一,药用辖料蔗糖广泛应用于化药、中药、生物药及各类民族药中。由于各类药品成分、剂型、功效等存在较大差异,蔗糖中的指标控制不佳,可能会影响药品的使用及产品质量。
2.1异物黑点
异物黑点严重制约蔗糖及下游产品的感官,且增加产品加工和质量风险。通常情况下,医药客户直接观察固体蔗糖的感官指标来验收药用辅料,但对于部分高端客户,甚至会要求溶解蔗糖,采用滤膜过滤并用放大镜观察的手段来判断异物含量。这就要求蔗糖生产企业需要采取从源头控制、过程监控、后续预防等措施来控制异物黑点含量。
2.2干燥失重
蔗糖具有一定的吸湿性,在储存过程中极容易发生结块。结块可分为假性结块和真性结块,假性结块需要人工摔包、转仓;真性结块严重制约产品应用,尤其是对于磨粉及溶解的医药企业来说。水分越高,越容易结块,还易滋生微生物、发生流浆现象。目前,部分药用辅料蔗糖生产企业通过熟化仓处理来实现蔗糖表面和内部水分的平衡,从而达到控制蔗糖结块的目的。
2.3电导率
电导率与蔗糖中的水溶性盐类等杂质离子密切相关,纯度与电导率成反比。蔗糖本身不导电,因此,其电导率也在一定程度上反映了其包含的杂质情况。电导率过高,蔗糖中的水溶性盐类可能会在体内发生沉积并影响药品的药效。
2.4色值
蔗糖色素有两类:脂溶性色素会影响药品的澄清度及透亮度;水溶性色素容易被氧化,并会和铁、氨基化合物、蛋白质反应,从而影响产品的安全性、有效性和稳定性。药用辅料蔗糖生产企业可以通过提升澄清工艺,采用离子交换树脂脱色、活性炭吸附、超滤等先进工艺来进一步降低产品色值。
2.5二氧化硫
二氧化硫作为一种强还原剂,广泛地应用于食品和药品的加工中,在生产中起到漂白、防腐、脱色和抗氧化的作用。二氧化硫会降低中药材的活性成分含量,二氧化硫残留过量的产品会导致食用者产生咽喉疼痛、恶心、呕吐等胃肠道反应,并对肝脏有一定的损害。因此,对于药品,尤其是中成药,要重点监控原辅料中的二氧化硫,并监测产品的二氧化硫含量。
3行业发展建议
高标准的约束是确保产品质量和市场秩序的关键。近年来,我国药用辅料行业正朝着规范化和严格化的方向发展。顺应这次改革风潮,将药用辅料蔗糖质量标准加以提升与完善,是解决行业问题的关键所在。可从以下几个方面着手,促进我国药用辅料蔗糖行业的进步。
3.1加强指标体系建设
提升药用辅料蔗糖质量标准的首要任务是加强指标体系的建设。当前,我国药用辅料蔗糖标准所限指标较少,限值要求较低,与国外优质产品相比存在差距。因此,应提高还原糖、溶液颜色(色值)等现有指标的限值要求,同时针对二氧化硫、电导率、干燥失重等欠缺指标进行限制,以进一步保障产品的安全性。通过完善标准体系,可以促进我国行业科技水平和生产力的提升,打破周外垄断局面,推动国内优质产品和龙头企业的诞生。
3.2细化指标要求
在加强指标要求的同时,也要着力于标准的分级化。根据药用辅料蔗糖质量的高低,将产品划分不同等级以区分优劣,不同等级的产品有着各自的应用场景,也有相应的标准来规范。例如,二氧化硫含量低的药用辅料蔗糖相较一般产品更适合儿童使用,可将其划为低硫儿童糖,同时建立对应标准使之规范化。此外,通过限制细菌内毒素等指标,建立“注射级蔗糖”标准体系,明确“口服级”与“注射级”的界限。对于广泛用于中成药中但缺乏标准的糖类,如红糖,也应建立相关标准,将其纳入药用辅料的管理范畴,促进产品的多元化发展。
3.3加强企业管理
主管部门应加强对生产药用辅料蔗糖企业的监管,加大政策宣传和检查力度。鼓励具备生产能力的企业提高企业标准,提升产品质量,争取高附加值市场。同时,加强药用辅料蔗糖市场的监管,对“以次充好”“打擦边球”等行为进行严厉查处,维护市场秩序。
作者简介
岳帅,高级工程师,主要从事药用辅料标准化体系建设研究。
王健,通信作者,高级工程师,主要从事药用辅料标准化体系建设研究。
(责任编辑:张佩玉)

