西那卡塞联合帕立骨化醇对比西那卡塞联合骨化三醇冲击治疗重度继发性甲状旁腺功能亢进的疗效及安全性研究
基金项目:江苏大学临床医学科技发展基金项目(JLY2021024);常州市武进区科技计划(社会发展)项目(WS202102);徐州医科大学附属医院科技发展基金项目(XYFY2021023)
作者简介:许 巍,男,在读博士,主治医师。
DOI:10.19435/j.1672-1721.2024.19.006
【摘要】 目的 探讨西那卡塞联合帕立骨化醇对比西那卡塞联合骨化三醇冲击治疗重度继发性甲状旁腺功能亢进(secondary hyperparathyroidism,SHPT)的疗效及安全性。方法 选择2020年6月—2021年12月江苏大学附属武进医院收治的60例重度SHPT患者,随机分为对照组和观察组,各30例。对照组采用西那卡塞联合骨化三醇冲击治疗,观察组采用西那卡塞联合帕立骨化醇治疗,检测患者治疗前后血清甲状旁腺素(parathyroid hormone,PTH)、血清钙、血清磷指标变化,并监测用药不良反应。结果 治疗后2组患者血清PTH比治疗前下降(P<0.05)。治疗后2组患者血清钙与治疗前比较,差异无统计学意义(P>0.05)。治疗后4周、治疗后8周,2组患者血清磷比治疗前下降(P<0.05)。治疗后12周对照组血清磷比治疗前下降,但差异无统计学意义(P>0.05)。治疗后2组血清PTH及钙比较,差异无统计学意义(P>0.05)。治疗后4周、治疗后8周,2组血清磷对比,差异无统计学意义(P>0.05)。治疗后12周观察组血清磷低于对照组(P<0.05)。2组肌肉疼痛、恶心呕吐、高钙血症、严重低钙血症等不良反应发生率比较,差异均无统计学意义(P>0.05)。结论 拟钙剂联合活性维生素D类似物以及拟钙剂联合活性维生素D冲击治疗均为重度SHPT的有效治疗方案,拟钙剂联合活性维生素D类似物更能有效控制血清磷的升高。2组治疗方案的安全性无差异。
【关键词】 重度继发性甲状旁腺功能亢进;西那卡塞;帕立骨化醇;骨化三醇
文章编号:1672-1721(2024)19-0017-03" " "文献标志码:A" " "中国图书分类号:R582+.1
SHPT是终末期肾病(end-stage renal disease,ESRD)的常见并发症之一[1]。SHPT是由于ESRD患者出现钙磷代谢异常、活性维生素D缺乏、甲状旁腺钙敏感受体表达减少以及骨对PTH抵抗等所诱发[2],主要表现为甲状旁腺组织继发性增生、腺瘤形成及PTH水平升高,使软组织钙化、血管钙化、骨痛、骨折,可影响患者生活质量,增加死亡率[3-5]。对于早期轻度SHPT,药物治疗效果尚可。对于重度SHPT,药物管理难度大,长期控制不佳易导致甲状旁腺明显增生。部分患者由于高龄大、并发症多、心肺功能差、不耐受全身麻醉,难以承受手术治疗,故寻找重度SHPT早期控制良好的药物治疗方案至关重要。目前对于重度SHPT,常用大剂量骨化三醇冲击治疗。骨化三醇作为活性维生素D,会增加高钙血症和高磷血症的风险,增加死亡率。近年来研究显示,拟钙剂及活性维生素D类似物均比传统活性维生素D有效降低PTH水平[6-7],减少了高钙及高磷血症的风险[8-11]。行Meta分析发现,拟钙剂及活性维生素D类似物单药治疗重度SHPT效果仍不满意,部分研究在治疗终点时PTH平均水平仍>600 pg/mL[12]。《中国慢性肾脏病矿物质和骨异常诊治指南》建议,如果拟钙剂、活性维生素D及其类似物单药治疗无法控制PTH在目标范围内,可联合拟钙剂与活性维生素D及其类似物治疗[13]。目前鲜有拟钙剂联合活性维生素D类似物对比拟钙剂联合活性维生素D冲击治疗重度SHPT的临床研究。本研究观察2种联合治疗对重度SHPT的疗效及安全性,现报告如下。
1 资料与方法
1.1 一般资料
采用前瞻性队列研究方法,选取2020年6月—2021年12月江苏大学附属武进医院收治的60例血液透析继发SHPT患者作为研究对象,按随机数字表法将患者分为对照组和观察组,每组30例。2组患者一般资料比较,差异无统计学意义(P>0.05),见表1。观察组有1位患者因肌肉酸痛在4周后停止治疗。本研究符合医学伦理学标准,经医学伦理委员会批准(武医伦理委[2021]57号),患者或家属知情同意。
纳入标准:慢性肾脏病5期,血液透析≥3个月;符合继发SHPT诊断标准,PTH水平>800 pg/mL[13]。排除标准:年龄<18岁或年龄>75岁,有心脏、肝脏等重要脏器功能衰竭;有甲状旁腺手术切除病史。
1.2 治疗方法
所有患者均给予盐酸西那卡塞片[协和发酵麒麟(中国)制药有限公司,国药准字H20184099,25 mg]口服,首次剂量25 mg/d。对照组联合骨化三醇冲击治疗,具体方法为给予骨化三醇(青岛正大海尔制药有限公司,国药准字H20143141,0.5 μg)冲击治疗,起始剂量为4 μg/次,2次/周。观察组联合帕立骨化醇治疗,具体方法为给予患者帕立骨化醇(江苏恒
瑞医药股份有限公司,国药准字H20183043,1 mL∶
5 μg)治疗,起始剂量为0.08 μg/kg,每次透析结束前30 min通过透析管路给药。
所有患者持续治疗12周,药物剂量依据血清PTH、钙、磷检查结果进行调整。所有患者均低磷饮食(每日磷摄入800~1 000 mg),血清磷升高者给予不含钙磷结合剂降磷。患者行血液透析治疗4 h/次,3次/周,均采用费森尤斯4008B型血透机,碳酸氢盐透析,费森尤斯聚砜膜F6透析器,透析液钙离子浓度为1.5 mmol/L,血流量200~250 mL/min。
1.3 观察指标及检测方法
每4周检测1次血清钙、磷、PTH水平,采用OLYMPUS AU5421全自动生化分析仪检测清晨空腹时血清钙、磷水平,采用贝克曼全自动化学发光免疫分析仪检测清晨空腹时血清全段PTH水平。记录患者SHPT治疗12周内出现肌肉疼痛、恶心呕吐、高钙血症、严重低钙血症的不良反应。随访时间为12周。
1.4 统计学方法
所有数据使用SPSS 21.0统计软件进行分析,计数资料以百分比表示,行χ2检验;计量资料以x±s表示,行t检验;P<0.05为差异有统计学意义。
2 结果
2.1 2组患者疗效对比
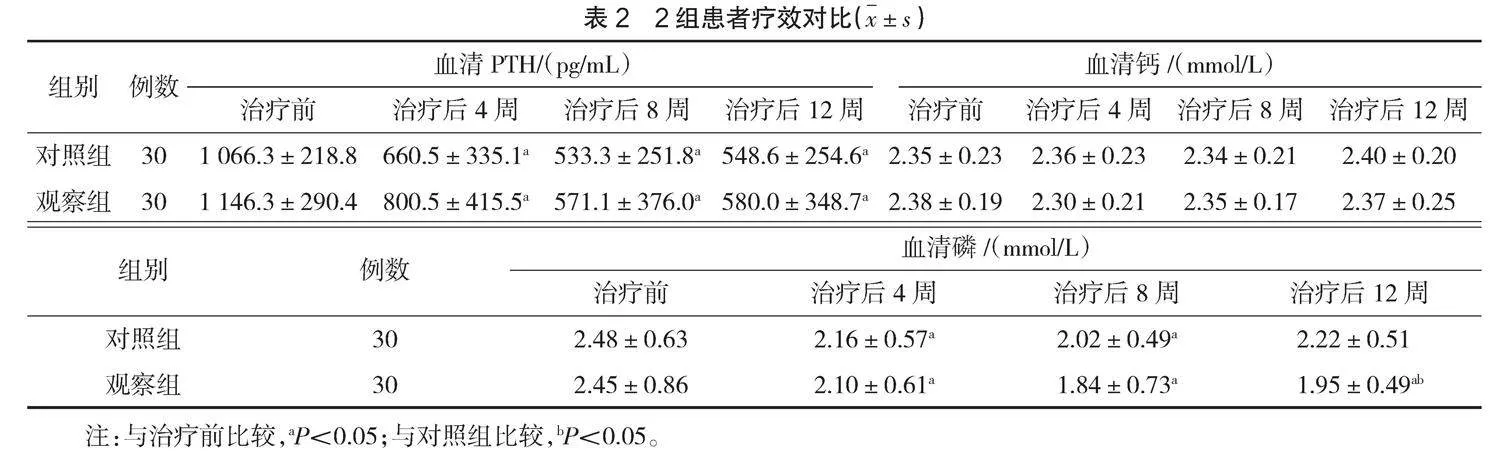
治疗前,2组患者血清PTH、钙、磷水平比较,差异无统计学意义(P>0.05)。治疗后2组患者的血清PTH比治疗前均下降,差异有统计学意义(P<0.05)。治疗后2组患者血清钙与治疗前比较,差异无统计学意义(P>0.05)。治疗后4周及治疗后8周
2组患者血清磷比治疗前下降,差异有统计学意义(P<0.05)。治疗后12周观察组患者的血清磷相比治疗前下降,差异有统计学意义(P<0.05)。治疗后12周对照组患者的血清磷相比治疗前下降,但差异无统计学意义(P>0.05)。治疗后观察组的血清PTH及钙与对照组比较,差异无统计学意义(P>0.05)。治疗后4周及治疗后8周观察组的血清磷低于对照组,但差异无统计学意义(P>0.05)。治疗后12周观察组的血清磷低于对照组,差异有统计学意义(P<0.05)。见表2。
2.2 2组患者不良反应对比
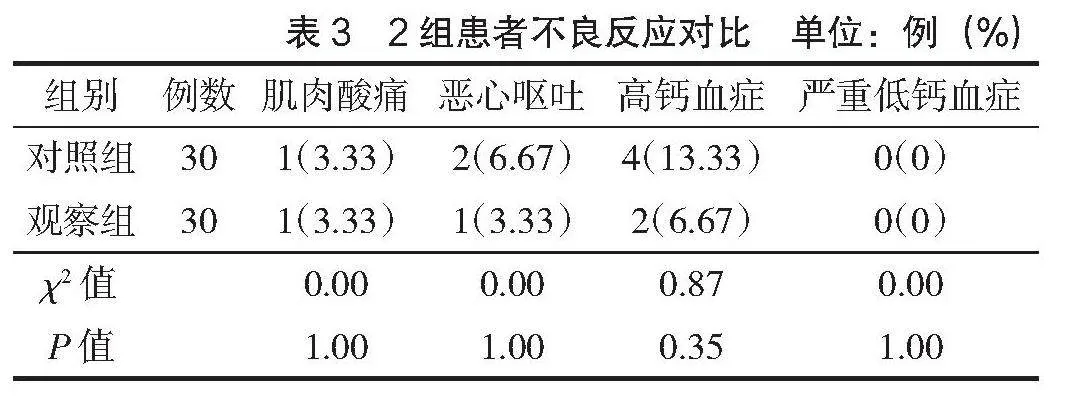
2组肌肉疼痛、恶心呕吐、高钙血症、严重低钙血症等不良反应发生率比较,差异无统计学意义(P>0.05),见表3。
3 讨论
西那卡塞作为拟钙剂,是一种钙离子敏感受体(calcium sensing receptor,CaSR)激动剂,可提高CaSR对细胞外钙的敏感性,抑制PTH的合成及分泌,抑制甲状旁腺增生,不会增加肠道对钙磷的吸收,但增加低钙血症的风险[10-11]。帕立骨化醇是一种维生素D类似物,作用于维生素D受体,抑制PTH的合成及分泌。帕立骨化醇区别于传统活性维生素D的特点是对甲状旁腺亲和力大于肠道,对肠道钙磷吸收的影响更小,减少了高钙及高磷血症的风险[8-9]。拟钙剂与活性维生素D及其类似物作用机制不同。既往有研究显示,拟钙剂与活性维生素D及其类似物联合治疗重度SHPT比单药治疗更有效降低PTH水平[14-16],但目前没有研究对比不同联合治疗的疗效及安全性。
本研究显示,2种联合治疗均为有效的治疗方案,能明显降低重度SHPT患者的血清PTH及磷水平。观察组使用拟钙剂联合活性维生素D类似物治疗重度SHPT,比对照组使用拟钙剂联合传统活性维生素D冲击治疗在血清PTH的控制上没有显示明显的优势,仅在治疗后12周观察组对血清磷的控制有明显优势。相比传统活性维生素D,活性维生素D类似物减少对肠道磷的吸收[8-9],可以解释观察组能更好地管理血清磷。2组患者磷结合剂的使用可能是一个混杂因素。
值得注意的是,2种联合治疗方案在治疗后12周的血清PTH及磷均比治疗后8周有小幅度升高。2组患者在治疗后8周血清PTH及磷有明显的改善,部分患者开始减量拟钙剂、活性维生素D及其类似物、磷结合剂。这可能是2组患者血清PTH及磷出现反跳的原因。
在血清钙控制方面,拟钙剂联合活性维生素D类似物治疗重度SHPT时,血清钙的总体平均水平及高钙血症的发生率相对低,但没有比拟钙剂联合活性维生素D冲击治疗有明显优势。活性维生素D类似物相比传统活性维生素D减少对肠道钙的吸收,但仍有升高血清钙的风险。本研究显示,2组联合治疗均没有出现严重的低钙血症,活性维生素D及其类似物均可弥补单用拟钙剂出现低钙血症的风险。
本研究仍存在一定的缺陷。本研究样本量偏少,可能产生一定的偏倚。患者的饮食情况、磷结合剂使用等因素可能影响研究结果,临床研究难以消除此偏倚因素。
综上所述,拟钙剂联合活性维生素D类似物以及拟钙剂联合活性维生素D冲击治疗均为重度SHPT的有效治疗方案,拟钙剂联合活性维生素D类似物更能有效控制血清磷的升高。2组治疗方案安全性无差异。后续需更多的多中心、随机对照的大样本研究进一步论证。
参考文献
[1] DAVIES E W,MATZA L S,WORTH G,et al.Health state utilities associated with major clinical events in the context of secondary hyperparathyroidism and chronic kidney disease requiring dialysis[J].Health Qual Life Outcomes,2015(13):90.
[2] ISAKOVA T,NICKOLAS T L,DENBURG M,et al.KDOQI US Commentary on the 2017 KDIGO clinical practice guideline update for the diagnosis,evaluation,prevention,and treatment of chronic kidney disease-mineral and bone disorder(CKD-MBD)[J].Am J Kidney Dis,2017,70(6):737-751.
[3] ZHANG L,XING C,SHEN C,et al.Diagnostic accuracy study of intraoperative and perioperative serum intact PTH level for successful parathyroidectomy in 501 secondary hyperparathyroidism patients[J].Sci Rep,2016,5(6):26841.
[4] Kidney Disease:Improving Global Outcomes (KDIGO) CKD-MBD Work Group.KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD)[J].Kidney Int Suppl,2009(113):S1-130.
[5] KOMABA H,TANIGUCHI M,WADA A,et al.Parathyroidectomy and survival among Japanese hemodialysis patients with secondary hyperparathyroidism[J].Kidney Int,2015,88(2):350-359.
[6] LI D,SHAO L,ZHOU H,et al.The efficacy of cinacalcet combined with conventional therapy on bone and mineral metabolism in dialysis
(下转第32页)
(上接第19页)
patients with secondary hyperparathyroidism:a meta-analysis[J].Endocrine,2013,43(1):68-77.
[7] PATEL T V,SINGH A K.Role of vitamin D in chronic kidney disease[J].Semin Nephrol,2009,29(2):113-121.
[8] ROSS EA,TIAN J,ABBOUD H,et al.Oral paricalcitol for the treatment of secondary hyperparathyroidism in patients on hemodialysis or peritoneal dialysis[J].Am J Nephrol,2008,28(1):97-106.
[9] MITTMAN N,DESIRAJU B,MEYER K B,et al.Treatment of secondary hyperparathyroidism in ESRD:a 2 -year-single-center cross-over study[J].Kidney Int Suppl,2010,8(117):S33-36.
[10] BLOCK G A,MARTIN K J,DE FRANCISCO A L,et al.Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis[J].N Engl J Med,2004,350(15):1516-1525.
[11] BLOCK G A,ZEIG S,SUGIHARA J,et al.Combined therapy with cinacalcet and low doses of vitamin D sterols in patients with moderate to severe secondary hyperparathyroidism[J].Nephrol Dial Transplant,2008,23(7):2311-2318.
[12] XU W,GONG L,LU J,et al.Paricalcitol vs. cinacalcet for secondary hyperparathyroidism in chronic kidney disease:a meta-analysis[J].Exp Ther Med,2020,20(4):3237-3243.
[13] 国家肾脏疾病临床中心.中国慢性肾脏病矿物质和骨异常诊治指南[M].北京:人民卫生出版社,2018.
[14] 李长红,赵春艳,蔡天蕊,等.西那卡塞及碳酸镧联合骨化三醇治疗慢性肾衰竭透析患者继发重度甲状旁腺功能亢进的疗效观察[J].黑龙江医药科学,2018,41(1):43-45.
[15] 周妍.两药联用治疗血液透析继发性甲状旁腺功能亢进的临床研究[J].当代医学,2019,25(15):156-157.
[16] 魏培丹,徐石张,陈效,等.帕立骨化醇联合西那卡塞治疗终末期肾衰竭患者甲状旁腺功能亢进的研究[J].中国医学创新,2021,18(13):73-77.
(编辑:许 琪)

