基于表型性状与SSR标记的马铃薯种质资源遗传多样性研究


摘" 要" 为明确176份马铃薯种质资源的遗传多样性,利用24个表型性状和16个SSR标记进行遗传多样性分析。24个表型性状的变异系数区间为10.20%~72.75%,平均为35.50%;多样性指数区间为0.18~" 0.77,平均为0.50;根据24个表型性状,对176份马铃薯品种(系)以非加权组平均法(unweighted pair group method analysis,UPGMA)进行聚类分析。结果表明,所有品种(系)可被分为7组,大部分品种(系)聚集在A组和C组。16个SSR引物在176份材料中共扩增出91个多态性位点,多态性比率为94.8%。SSR聚类结果表明,176份马铃薯材料被聚为8类。表型性状聚类与SSR聚类结果均表明,从同一地区引进的马铃薯材料亲缘关系相近,遗传差异较小。结合本试验结果与前人研究,进一步确定引物S25、S151、S174和S189可高效区分不同马铃薯种质资源,在今后借助分子育种手段以区分马铃薯种质资源遗传多样性的过程中可优先选择使用。研究表明,部分马铃薯材料的表型性状与SSR标记聚类结果在类群划分具有一致性,表型性状的差异在一定程度上能真实反映基因水平的差异,但表型性状不能从本质上反映马铃薯种质资源的遗传背景差异,因此在评价马铃薯遗传多样性时应当以SSR分子标记为主,表型性状分析为辅,二者结合用于评价马铃薯种质资源遗传多样性。本研究为马铃薯种质创新和遗传改良提供了参考依据。
关键词" 马铃薯;表型性状;SSR;遗传多样性
doi:10.7606/j.issn.1004-1389.2024.08.005
https://doi.org/10.7606/j.issn.1004-1389.2024.08.005
收稿日期:2023-02-13" 修回日期:2023-05-06
基金项目:陕西省重点研发计划项目(2018ZDCXL-NY-03-03,2022NY-174);榆林市科技计划项目(CXY-2022-168);西北农林科技大学试验示范站(基地)科技创新与成果转化项目(TGZX2021-12)。
第一作者:张晓煜,女,硕士研究生,从事马铃薯种质资源创新利用。E-mail:15502452002@163.com
通信作者:刘柏林,男,副教授,主要从事马铃薯种质资源创新利用和新品种选育。E-mail:liubl@nwafu.edu.cn
方玉川,男,正高级农艺师,主要从事马铃薯生产技术推广和应用。E-mail:nksfyc@163.com
马铃薯(Solanum tuberosum L.)为茄科茄属1 a生草本植物[1-2],原产于南美洲安第斯山区,历史可追溯到公元前8 000多年[3]。马铃薯是全球第四大粮食作物[4],在全球有160个国家和地区种植,年种植面积为2 392万hm2,年产量达到" 47 048万t。中国是世界上最大的马铃薯生产国,年种植面积为578万hm2,年产量9" 436" 万t[5]。世界范围内,保存了大约65 000份马铃薯种质资源,中国目前保存有 5 000余份种质资源,以国内外育成品种和品系为主,野生种质资源偏少[6-7]。利用这些种质资源,马铃薯审定(登记)品种数量稳定增加,其中十一五期间审定品种116个,十二五期间审定品种145个,十三五期间审定(登记)新品种227个[8]。这些品种对中国马铃薯品种更新换代、丰富马铃薯品种多样性具有重要意义。种质资源是关系国家粮食安全的战略资源,马铃薯作为外来物种,近年来引种受到了限制。因此,对现有种质资源遗传多样性进行准确、合理评价关系到马铃薯种质创新与利用的成败,是进一步拓宽品种遗传背景的基础。
遗传多样性分析可以区分不同品种之间的遗传差异,是作物育种与遗传改良的前提。表型性状(形态标记)是遗传(基因)和环境综合作用的结果,通过表型性状检测遗传多样性是最直接且最简易的方法。段绍光等[9]研究表明,表型性状的聚类分析可以大致分辨并揭示不同马铃薯材料的生理状态差异,可进一步区分生态型和遗传差异明显的亲本及其后代。农艺性状的观测与分类是早期马铃薯种质资源研究的重要手段,中国的《马铃薯DUS测试指南》主要侧重于形态性状的测定。但是,马铃薯作为同源四倍体,基因组高度杂合,其四体遗传方式增加了性状分离的复杂程度,因此马铃薯表型聚类分析只能相对程度反映不同种质资源间的形态差异,而不能完全反映马铃薯种质资源间的遗传差异。
SSR(Simple sequence repeat,SSR)标记也称微卫星序列标记,以其数量丰富、共显性遗传、多态性丰富等优点现已被广泛应用于马铃薯的品种鉴定、遗传关系分类、核心种质资源搜集评价等领域[10-11]。如段绍光等[9]采用36个SSR标记对从世界各地收集的559份马铃薯材料进行遗传多样性分析,共检测出134个多态性位点,说明品种间有丰富的遗传多样性。吴立萍等[12]从50对SSR引物筛选出14对条带清晰、多态性好的引物,对54份俄罗斯马铃薯品种进行PCR扩增,多态性条带占总扩增条带的92.7%,并通过聚类分析从分子水平上展示了各品种间的亲缘关系。Duan等[13]利用20个SSR标记对217个马铃薯品种进行了遗传多样性分析,表明这些品种的遗传背景狭窄。Karaagac等[14]利用6个SSR标记区分了54个马铃薯无性系品种。温贺等[15]通过筛选出的10对SSR引物,对6个马铃薯品种进行了遗传多样性分析,建立了SSR指纹图,为新品种选育提供依据。Marie-José等[16]利用SSR标记对84份加拿大马铃薯材料进行了遗传多样性分析。Bali等[17]利用23个SSR标记对264个俄罗斯及其他材料进行分析,获得了142个多态性位点,发现这些材料存在显著的遗传多样性。因此SSR标记可为马铃薯种质资源的鉴定与遗传多样性的分析提供分子生物学依据。
本研究对国内外引进和育成的176份马铃薯种质资源材料,利用表型性状和SSR分子标记进行遗传多样性分析,以期揭示176份马铃薯种质资源的遗传背景差异,旨在为马铃薯种质创新和新品种选育提供材料基础和理论依据。
1" 材料与方法
1.1" 试验材料
供试马铃薯材料211份,为西北农林科技大学收集保存的国内外马铃薯种质资源和育成品种(系),选取其中24个表型性状较全的176份材料用于遗传多样性分析(表1),其中‘C15’~‘C133’‘D15’~‘D211’‘XP1-1’‘XP1-2’‘XP1-4’‘XP3-1’为国际马铃薯中心引进种质资源,其余为国内外育成品种(系),‘EB003’‘EB063’‘EB118’和‘EB067’‘HD-24527’~‘HD-24574’为二倍体遗传材料。供试材料于西北农林科技大学榆林马铃薯试验示范站种植,海拔1 050 m,多年平均降水量371 mm,年平均温度8.6" ℃,平均全年日照时数2 900 h,土壤类型为砂壤土,有机质含量4.31""" g/kg。采用随机区组试验设计,设置2个重复,每个小区单垄单行,种植16株,株距为0.25 m,垄间距为0.9 m,2021-2022年,每年5月播种,10月收获,田间管理与当地管理措施相一致。
1.2" 性状调查
选取具有代表性且便于直观统计的农艺性状24个,包括块茎性状(薯皮颜色、薯皮类型、薯形、芽眼深浅、肉色、芽眼数量和芽眼颜色),植株性状(株形、植株繁茂性和开花繁茂性),叶片性状(叶色、叶缘、叶表面光泽度、叶片茸毛多少、顶小叶宽度、顶小叶形状),花冠性状(花冠形状、花冠颜色、重瓣花、柱头形状、柱头颜色、柱头长短、花药形状、花药颜色)。参考《马铃薯DUS测试指南》进行分级(表2)。
1.3" 马铃薯基因组DNA的提取与扩增
采集马铃薯块茎芽,利用改良CTAB法提取基因组DNA。将DNA样本稀释至50 ng/μL,于-20 ℃保存。PCR扩增体系为10 μL,包括模板DNA 1 μL、上下游引物各0.5 μL、2×Taq" Master Mix 5 μL、ddH2O 3 μL。扩增程序为94 ℃ 预变性2 min,94 ℃变性30 s,SSR特定退火温度(53~64 ℃)30 s,72 ℃延伸60 s,30个循环," 72 ℃终延伸7 min。用8%非变性聚丙烯酰胺凝胶电泳检测扩增产物,硝酸银染色观察结果。
1.4" SSR引物来源
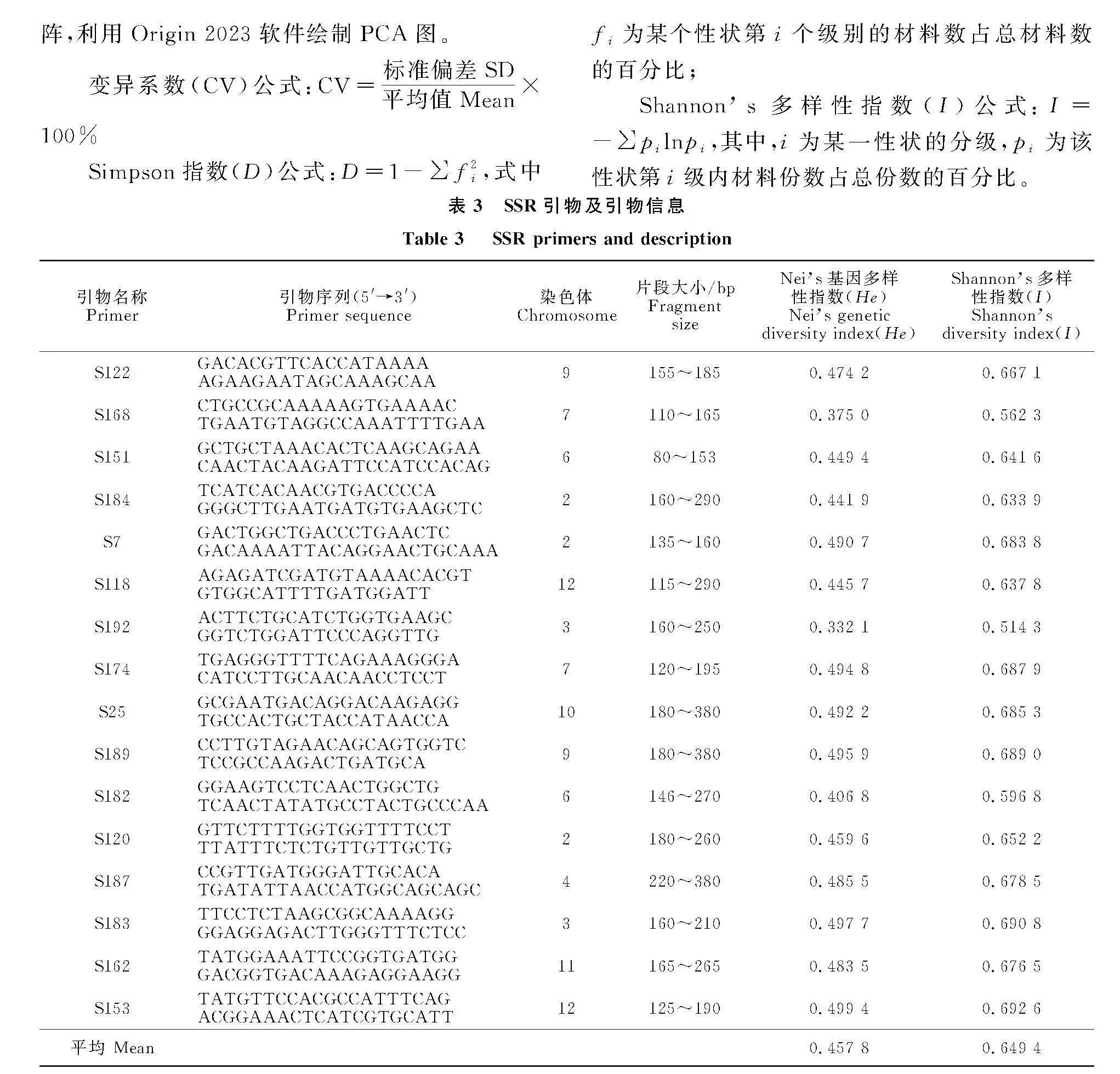
本试验利用来自于公开发表文献中的20对引物,从中筛选出16对谱带清晰、多态性较高的引物[13]。引物由北京擎科生物科技有限公司合成(表3)。
1.5" 数据处理和分析
采用SPSS 26.0软件统计表型性状数据的平均值、方差和极差,利用Microsoft Excel 2016计算变异系数(CV)和Simpson指数(D)。采用0和1赋值法记录SSR扩增谱带位置,在相同迁移位置上有扩增条带的记为1,无带记为0,构建0、1二元数据矩阵。
基于R语言decostand函数、vegdist函数进行数据标准化并计算出欧氏距离矩阵,利用hclust函数UPGMA法进行聚类分析并绘制聚类图。基于R语言dist函数计算出供试材料的遗传距离矩阵,利用ape包对品种进行遗传多样性分析,构建临接系统进化树(Neighbor-joining Tree,NJ)并绘制聚类图。根据SSR分子标记数据,利用遗传多样性分析软件Popgene 32计算Nei’s遗传多样性指数(He)和Shannon’s多样性指数(I)。基于欧式距离矩阵和遗传距离矩阵,利用Origin 2023软件绘制PCA图。
变异系数(CV)公式:CV=标准偏差SD平均值Mean×100%
Simpson指数(D)公式:D=1-∑f2i,式中fi为某个性状第i个级别的材料数占总材料数的百分比;
Shannon’s多样性指数(I)公式:I=" -∑pilnpi,其中,i为某一性状的分级,pi为该性状第i级内材料份数占总份数的百分比。
2" 结果与分析
2.1" 表型性状的遗传多样性分析
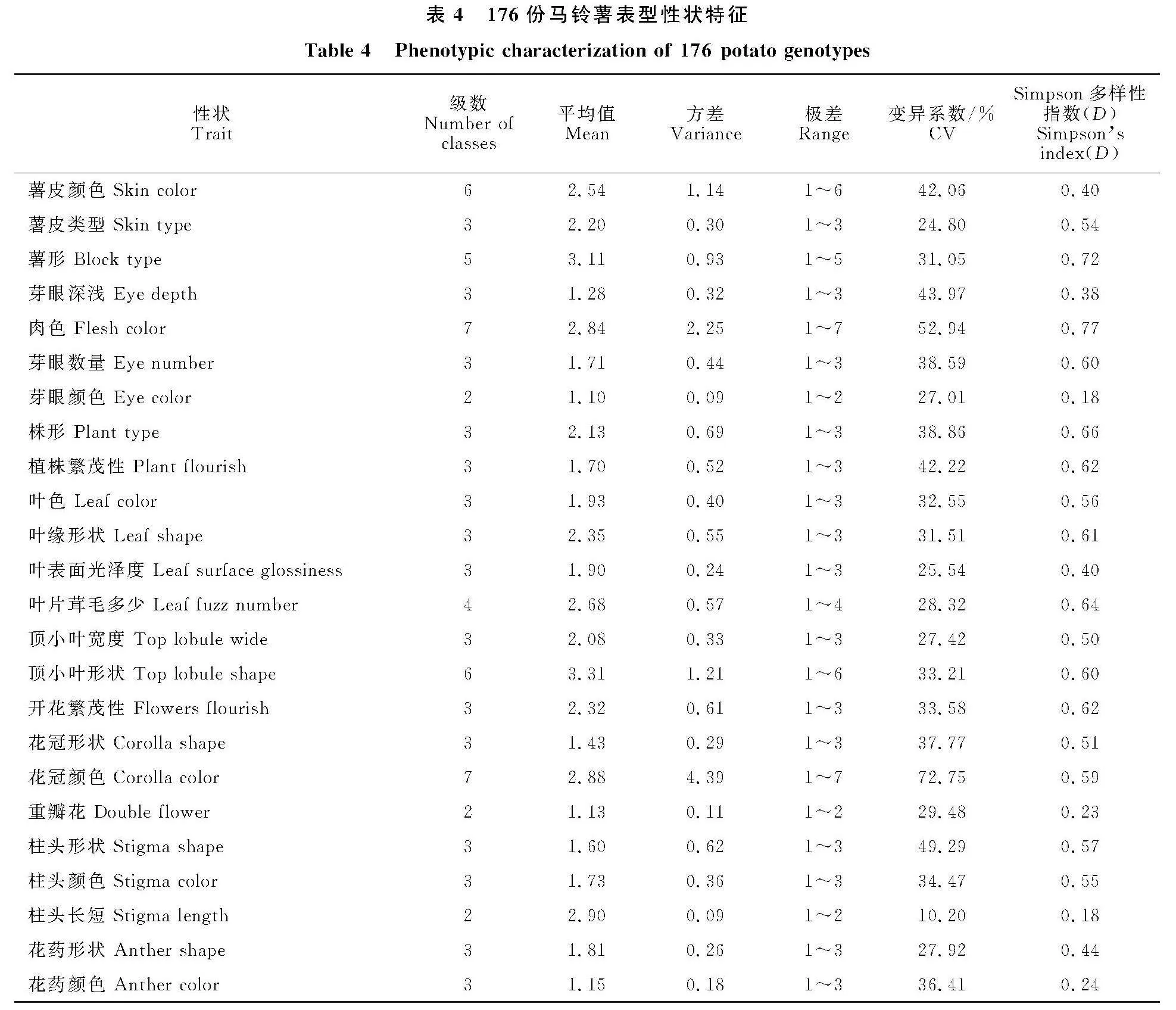
对176份马铃薯品种(系)24个表型性状进行描述性统计(表4),各性状存在不同程度的变异,变异系数范围为10.20%~72.75%,平均为35.50%,其中花冠颜色的变异系数最大,柱头长短的变异系数最小。研究表明,变异系数≥10.00%则表示样本间的差异较大[18]。本研究中176份马铃薯种质资源表型性状的变异系数均≥10.00%,说明这些种质资源有着较大的变异范围,表型性状间差异大,种质资源类型丰富,有利于开展马铃薯特异种质资源的比较、筛选和利用。采用Simpson指数(D)对24个表型性状进行多样性分析,范围为0.18~0.77,平均值为0.50,其中肉色多样性指数最高,芽眼颜色和柱头长短多样性指数最低,遗传多样性指数≥0.50的指标依次为薯皮类型、薯形、肉色、芽眼数量、株形、植株繁茂性、叶色、叶缘形状、叶片茸毛多少、顶小叶宽度、顶小叶形状、开花繁茂性、花冠形状、花冠颜色、柱头形状、柱头颜色,说明这些材料的表型性状较为多样。综合各性状的变异系数、极差和多样性指数,呈现明显的遗传差异,表现出丰富的遗传多" 样性。
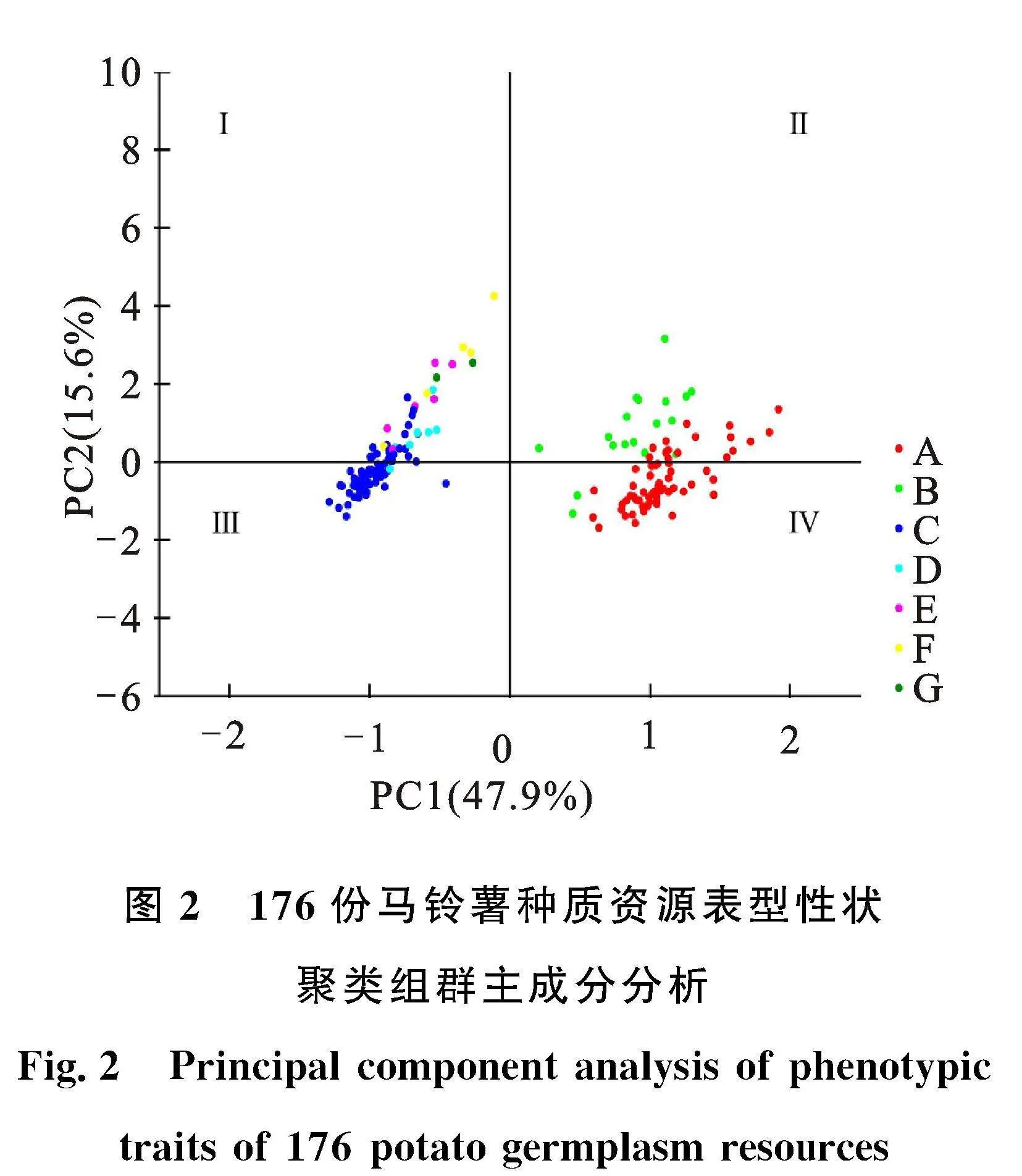
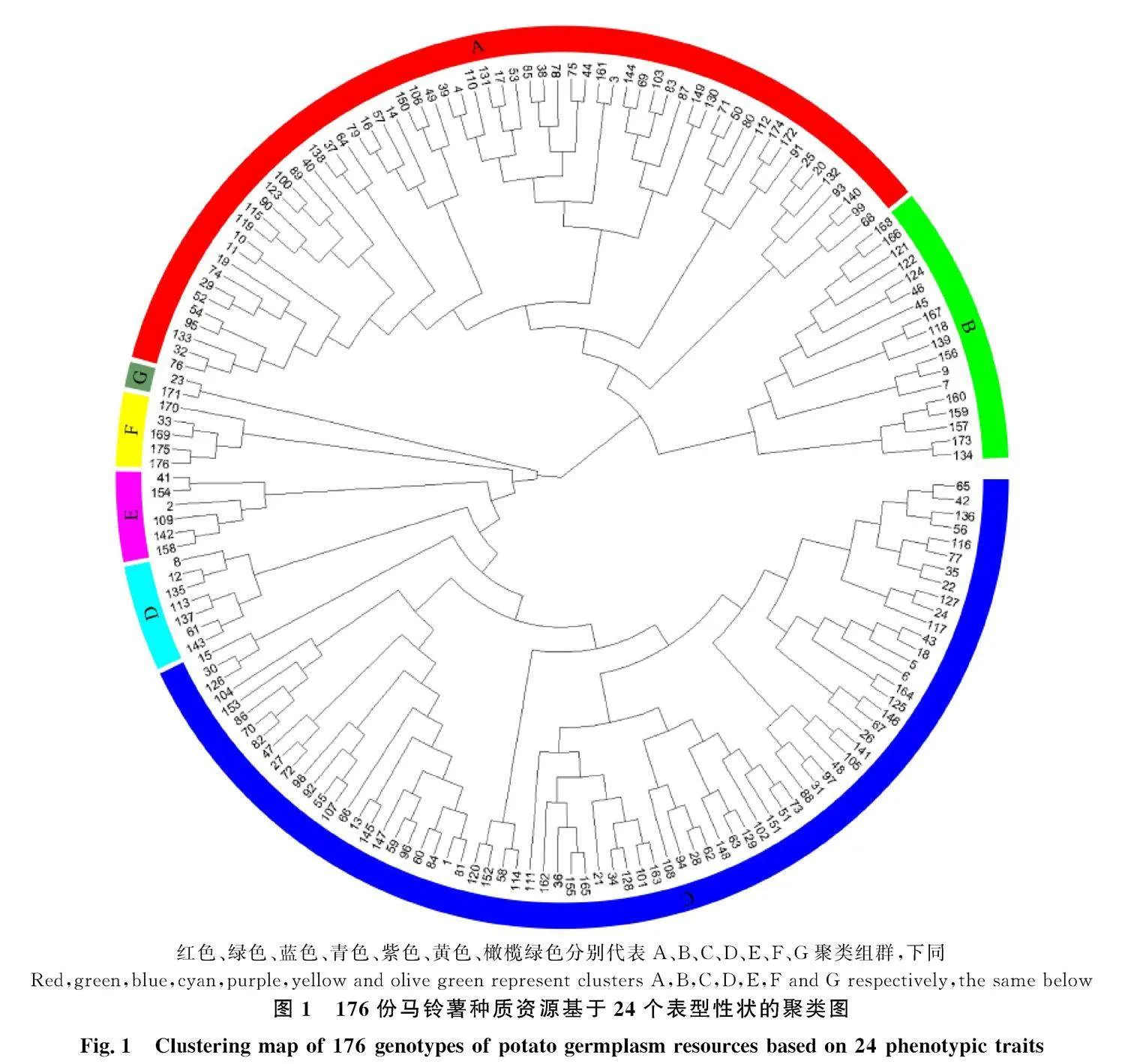
由UPGMA聚类结果可知(图1),所有品种(系)可被分为7组,大部分品种(系)聚集在A组和C组。A组包括以‘中薯26号’为代表的62个品种(系),占比35.23%,主要表现为叶色为绿色,叶表面光泽度为中等,花冠为紫色星形;B组包括以‘X6’和‘HD-24532’为代表的18个品种(系),占比10.23%,主要表现为芽眼为无色,花药颜色为黄色,花冠为紫色星形,薯皮颜色为红色;C组包括以‘C100’‘华薯6号’及‘陇薯20号’为代表的76个品种(系),占比为43.18%,主要表现为顶小叶宽度为中等,重瓣花为无,花冠为白色星形,薯皮颜色为黄色;D组有7个品种(系),占比为3.98%,主要表现为株型为直立,植株繁茂性为中,柱头颜色为绿色;E组有6个品种(系),占比为3.41%,主要表现为叶色为浅绿,肉色为浅黄,柱头颜色为浅绿;F组有5个品种(系),占比2.84%,主要表现为植株繁茂性为强,花冠为白色近五边形,薯皮颜色为紫色;G组有2个品种(系)为‘C20’和‘XP3-1’,占比为1.14%,主要表现为叶色为浅绿,株型为开展,肉色为白色。对表型性状聚类组群进行主成分分析(图2),PC1和PC2分别占总遗传变异的47.9%和15.6%。根据7个聚类组群的分布情况将坐标图划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个区域,从整体上来看,各组群分布相对集中,A组分布在Ⅱ、Ⅳ区,但主要集中在Ⅳ区,B组主要分布在Ⅱ区,C组分布在Ⅰ、Ⅲ区,但主要集中在Ⅲ区,D组主要分布在Ⅰ区,E组、F组、G组均分布在Ⅰ区,各组群坐标分布结果与聚类分组结果基本一致。表型性状聚类表明,从同一地区引进的马铃薯种质或同一单位选育的马铃薯品种,如‘华薯2号’与‘华薯13号’‘北方013’与‘北方005’‘陇薯20号’与‘陇薯11号’‘XP1-4’与‘XP1-1’,两两材料的性状非常相似,表明同一育种单位利用的种质资源间遗传背景狭窄。表型性状聚类分析可以揭示不同马铃薯材料间的形态差异,对品种(系)分类有一定的参考价值,在实际育种中,可根据育种目标进行针对性选择和改良。
2.2" SSR分子标记的遗传多样性分析
筛选出的16对引物均匀分布于马铃薯9条染色体上,利用16对引物对176份材料进行扩增,共扩增出96个等位位点,其中91个等位位点为多态性位点,多态性比率为94.8%。16对引物扩增出的等位位点在4~10个之间,多态性位点在4~9个之间,平均每对引物扩增出6个等位位点,5.7个多态性位点。扩增产物片段大小介于80~380 bp,Nei’s遗传多样性指数(He)的变化范围为0.332 1~0.499 4,平均值0.457 8;Shannon’s多样性指数(I)的变化范围为0.514 3~" 0.692 6,平均值为0.649 4(表3),Shannon’s多样性指数(I)大于平均数的约占60%,表明本研究所用引物能较高质量地反映176份马铃薯种质资源的基因型水平多样性。
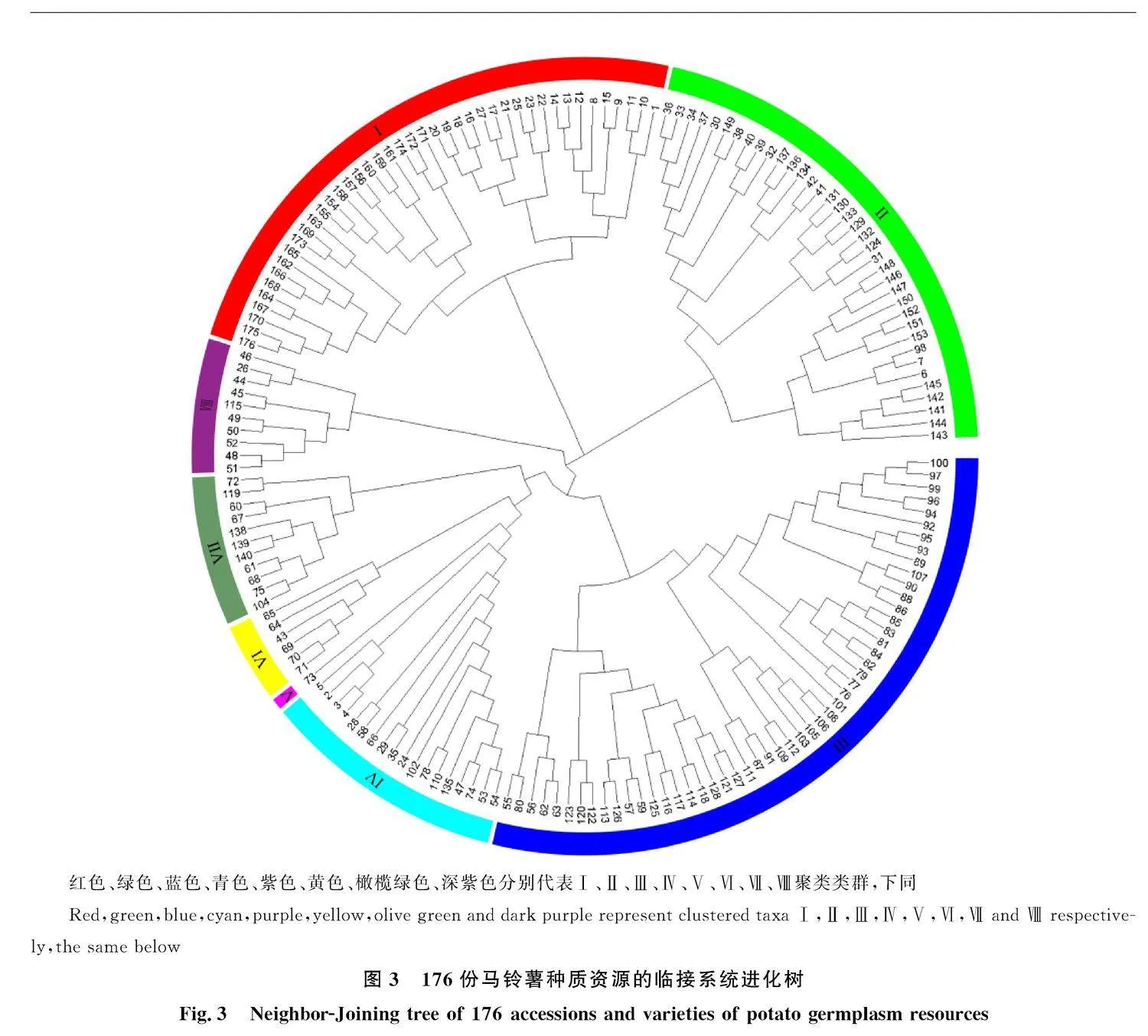
基于16对SSR引物对176份马铃薯种质资源进行聚类分析。图3所示,供试材料可被分为8类。类群Ⅰ包括42个品种(系),占比23.86%,以‘D211’‘D189’‘C86’等从国际马铃薯中心(CIP)引进的品种(系)为主,‘HD-24574’‘HD-24570’和‘EB063’等二倍体材料也包括在内;类群Ⅱ有37个品种(系),占比21.02%,主要来自于北方一作区,代表品种有‘东农322’‘北薯2号’;类群Ⅲ有51个品种(系),是一个大的混合类群,占比28.98%,代表品种为华薯和陇薯系列;类群Ⅳ有18个品种(系),是一个小的混合类群,占比10.23%,从奥地利、国际马铃薯中心部分引进的品种(系)也包括在内;类群Ⅴ只有1个品种,占比0.57%,为‘Spunta’;类群Ⅵ有6个品种(系),占比3.41%;类群Ⅶ有11个品种(系),占比6.25%;类群Ⅷ有10个品种(系),占比" 5.68%,代表品种为中薯系列。SSR标记聚类类群的主成分分析显示,PC1和PC2分别占总遗传变异的29.4%和6.0%,虽然存在少数的离散品种,但整体上各组群分布相对集中(图4),Ⅰ、Ⅱ、Ⅲ在各个区域均有分布,但Ⅰ、Ⅱ主要集中在S1区,Ⅲ主要集中在S3区;Ⅳ分布在S2、S4区;Ⅴ分布在S4区;Ⅵ分布在S2区;Ⅶ分布在S1、S2区;Ⅷ分布在S2、S4区。各类群坐标分布结果与聚类结果基本一致,二者分析结果可相互佐证。
3" 讨" 论
3.1" 马铃薯种质资源的遗传多样性
表型性状水平上的多样性是最易被观察到的,特别是种质资源数量众多时,初步的表型性状观察就显得十分重要。马铃薯地上部植株性状和地下部块茎性状是十分重要的表型性状指标,如株形、茎色、薯形、肉色和薯皮颜色等性状是进行马铃薯分类和品种鉴定的重要指标,也可作为遗传多样性研究的指标[19]。分析作物表型多样性对于种质资源的鉴定、开发和利用具有重要意义[20]。选用Simpson遗传多样性指数、极差、平均值、变异系数对马铃薯材料表型性状进行分析,结果表明供试材料薯皮类型、薯形、肉色等表型性状多样性丰富。在176份马铃薯材料的表型性状数据评价中,花冠颜色变异系数最高,遗传变异丰富;从Simpson指数分析,肉色遗传多样性最为丰富,说明176份马铃薯材料在花冠颜色和肉色上表型多样性丰富,对后续马铃薯育种亲本的选配和新品种的选育、种质资源的开发与利用提供参考。在一般情况下表皮光滑、薯形圆形或椭圆形、中等大小、整齐均一,肉色金黄的商品薯比较受欢迎[21]。因此,在马铃薯育种过程中可以重点改良这些表型性状,从而获得具有优异性状的新品种。值得注意的是,本研究中‘中薯27号’和‘Spunta’均具有以上优良的表型性状,可作为潜在的核心亲本材料进行利用。此外,芽眼数量是决定马铃薯油炸薯片品质和雪花全粉品质的指标之一[22],因此芽眼数量少、薯形圆形材料可作为选育薯片加工品种的潜在核心亲本。
马铃薯高产或优良品种往往具有茎绿色、叶片深绿、芽眼浅、黄皮、黄肉、茸毛少、叶缘波状、花冠白色、表皮光滑、椭圆形等特征[23]。表型性状聚类结果表明,所有马铃薯材料可分为7个类群,其中类群A中的材料绝大多数叶色为绿色,叶表面光泽度为中等,花冠为紫色星形;类群C中的大部分材料顶小叶宽度为中等,重瓣花为无,花冠为白色星形,薯皮颜色为黄色,说明不同类群间遗传背景存在差异,全部材料遗传多样性丰富,育种者可以尝试选择不同类群的种质材料作为亲本,以拓宽马铃薯品种遗传多样性。由于亲本亲缘关系接近或一致,来自同一育种单位的马铃薯品种通常被聚在一起,如‘闽薯4号’与‘闽薯6号’‘甘农薯7号’与‘甘农薯13号’‘天薯13号’与‘天薯16号’。从系谱亲缘关系来说,‘陇薯13号’和‘陇薯14号’,‘中薯22号’‘中薯26号’‘中薯27号’应当被聚为一类。但表型性状分析将‘陇薯13号’和‘中薯26号’聚在类群A中,‘陇薯14号’‘中薯22号’和‘中薯27号’则被聚在类群C中,说明表型性状聚类分析区分马铃薯遗传背景存在一定误差。此外,在表型性状统计过程中,易受到客观因素的干扰,如天气变化以及主观因素导致的系统误差。对部分表型性状相似的材料也会被聚为一类,如‘同薯17号’与‘克新25号’‘丽薯6号’与‘陇薯11号’‘D96’与‘北薯2号’。通过变异系数分析、主成分分析和聚类分析,表型性状所得出的研究结果能帮助育种家筛选出所需的种质资源。因此,形态指标在区分品种时有一定的局限性,故表型分析可作为分子标记育种的参考,但不能作为标准。
本研究所用的16对引物均分布于马铃薯基因组的9条染色体上[13],能准确地反映马铃薯染色体的遗传信息,可作为有效分子标记对马铃薯种质资源遗传多样性进行系统分析。综合Nei’s遗传多样性指数(He)和Shannon’s多样性指数(I)及扩增条带的清晰度,得出引物S25、S151、S174和S189可高效区分不同马铃薯种质资源之间的遗传背景差异,其中,引物S189可区分55份供试马铃薯种质资源;引物S151可区分23份材料;引物S25可区分21份材料;引物S174可区分8份材料。段艳凤[24]利用30个SSR标记对189份供试材料进行扩增,共扩增出173个等位位点,多态性比率达98.84%,其中引物S174和S189的PIC值高于平均值,表明这两对引物可有效区分不同马铃薯材料之间的遗传背景差异;崔阔澍等[25]用34对引物对F1代分离群体210个单株无性系及其双亲的DNA进行扩增,得到235个清晰的SSR位点,其中S151、S189、S174引物多态性位点比率达100%;王丹[26]从108对SSR引物中选出4对多态性丰富、条带清晰稳定的适宜引物用于杂种优良单株的真实性鉴定,其中包括引物S25;宋洁等[27]用14对SSR引物对67份马铃薯材料进行扩增,其中S174引物PIC值大于0.90,说明S174具有高度多态性。以上研究表明这4对引物可有效区分具有不同遗传背景的马铃薯材料,在今后借助分子育种手段以区分马铃薯种质资源遗传多样性的过程中可优先选择使用,为马铃薯种质资源的创新与改良提供参考价值。此外,从同一地区引进的马铃薯材料遗传背景差异较小,如来自国际马铃薯中心(CIP)的品种多数分布在类群Ⅰ中,北方系列全部分布于类群Ⅱ中,说明它们之间的亲缘关系较近。SSR标记可以有效区分不同地区的品种,并将同一地区的品种多数归为一类,说明近年来各地区育种单位在选育品种过程中对表现优良亲本利用频率较高,致使后代亲缘关系相近,遗传多样性不够丰富。通过SSR标记聚类结果可知,来自不同地区或单位的马铃薯材料,在聚类图中也可能被聚为一类,如来自甘肃省农业科学院的陇薯系列和来自华中农业大学的华薯系列多数分布在类群Ⅲ中。类群Ⅰ中的材料与来自国际马铃薯中心的材料亲缘关系较近,可能在育种过程中引入了国际马铃薯中心的种质材料。在本研究中,临接系统进化树能够直观地体现出马铃薯种质资源间亲缘关系的"" 远近。
3.2" 马铃薯材料的遗传多样性综合评价
本研究中SSR标记比表型性状的遗传多样性更丰富,其原因之一可能是表型性状在育种过程中受到强烈的人工选择,而SSR标记无法通过肉眼观察,在育种过程中受到人工选择的影响较小。本研究中,部分种质材料的表型性状聚类分析和SSR聚类分析也存在一致性。如‘陇薯11号’‘陇薯12号’‘陇薯14号’‘陇薯20号’和‘陇薯22号’通过表型性状聚类与SSR聚类分析分别被聚在类群C和类群Ⅲ中。但表型性状聚类分析通常将不同来源的种质材料混杂在一起。刘福翠等[28]研究认为,马铃薯是无性繁殖的作物,其性状,如植株性状和块茎性状容易被外界环境所影响而发生变化,体现出基因型的变异和表现型的变化,从而表现出表型性状标记与SSR分子标记的差异性。段绍光等[9]研究表明,表型性状聚类分析不能从本质上反映马铃薯的遗传差异,只能反映出不同材料之间表型性状的差异。Sosinski等[29]研究表明,因为环境因素的影响,利用块茎类型、叶型、花色和芽的外观等表型性状特征来进行品种鉴定会受到限制。由于SSR标记具有高度的多态性、使用简单、共显性等优点,因而可以有效地分析马铃薯品种之间的遗传距离[30-31]。Mcgregor等[32]研究表明,用形态性状来鉴定马铃薯品种并不总是可靠的,SSR标记鉴定品种的方法足够简单,非常可靠,能更加准确地分析马铃薯遗传多样性。因此在评价马铃薯遗传多样性时应当以SSR分子标记为主,表型性状分析为辅,二者结合用于评价马铃薯种质资源遗传多样性。
4" 结" 论
本研究采用西北农林科技大学收集保存的国内外马铃薯种质资源和育成品种(系)为供试材料,利用24个表型性状和16对SSR引物从两方面进行遗传多样性分析。结合本试验结果与前人研究,进一步确定引物S25、S151、S174和S189可高效区分不同马铃薯种质资源,在今后借助分子育种手段以区分马铃薯种质资源遗传多样性的过程中可优先选择使用。本研究为马铃薯品种鉴定、评价、亲本选配及种质创新提供了理论依据。马铃薯品种的表型性状与SSR标记聚类结果在类群划分上具有一定的一致性,表明表型性状的差异在一定程度上能真实反映基因水平的差异,但表型性状不能从本质上反映马铃薯的遗传差异,因此在评价马铃薯遗传多样性时应当以SSR分子标记为主,表型性状分析为辅,二者结合用于评价马铃薯种质资源遗传多样性。
参考文献" Reference:
[1]" 孙周平.马铃薯高产优质栽培[M].沈阳:辽宁科学技术出版社,2010.
SUN ZH P.High-yield and High-quality Cultivation of" Potato[M].Shenyang:Liaoning Science and Technology Press,2010.
[2]" 孙慧生.马铃薯育种学[M].北京:中国农业出版社,2003.
SUN H SH.Potato Breeding[M].Beijing: China Agricultural Publishing House,2003.
[3]" 谢从华.马铃薯产业的现状与发展[J].华中农业大学学报(社会科学版),2012,97(1):1-4.
XIE C H.Current situation and development of bell potato industry[J].Journal of Huazhong Agricultural University (Social Science Edition),2012,97(1):1-4.
[4]" 赵" 鸿,任丽雯,赵福年,等.马铃薯对土壤水分胁迫响应的研究进展[J].干旱气象,2018,36(4):537-543.
ZHAO H,REN L W,ZHAO F N,et al.Research progress in potato response to soil water stress[J].Journal of Arid Meteorology,2018,36(4):537-543.
[5]" Food and Agriculture Organization of the United Nations.Area harvested/production/yi-eld quantities of potatoes[DB/OL].FAOSTAT 2021(2022-12-23)[2023-03-03].http://www.fao.org/ faostat/en/#data/QCL/visualize.
[6]" PANTA A,PANIS B,YNOUYE C,et al.Development of a PVS2 droplet vitrification method for potato cryopreservation[J].Cryo Letters,2014,35(3):255-266.
[7]" 徐建飞,金黎平.马铃薯遗传育种研究:现状与展望[J]." 中国农业科学,2017,50(6):990-1015.
XU J F,JIN L P.Potato genetic breeding research: current situation and prospect[J].China Agricultural Science,2017,50(6): 990-1015.
[8]" 徐建飞,胡" 军,段绍光,等.2020年马铃薯登记品种分析[C]//中国作物学会马铃薯专业委员会.马铃薯产业与绿色发展(2021).哈尔滨:黑龙江科学技术出版社,2021:2.
XU J F,HU J,DUAN SH G,et al.Analysis of registered potato varieties in 2020[C]//Potato Professional Committee of China Crop Association.Potato industry and green development (2021).Harbin:Heilongjiang Science and Technology Press,2021:2.
[9]" 段绍光,金黎平,李广存,等.马铃薯品种遗传多样性分析[J].作物学报,2017,43(5):718-729.
DUAN SH G,JIN L P,LI G C,et al.Genetic diversity analysis of potato varieties[J].Acta Agronomica Sinica,2017,43(5):718-729.
[10]" CHEN X,TEMNYKH S,XU Y,et al.Development of a microsatellite framework map providing genome-wide coverage in rice (Oryza sativa L.)[J].Theoretical and Applied Genetics,1997,95(4):553-567.
[11]" GHISLAIN M,SPOONER D M,RODRIGUEZ F,et al.Selection of highly informative and user-friendly microsatellites (SSRs) for genotyping of cultivated potato[J].Theoretical and Applied Genetics,2004,108(5):881-890.
[12]" 吴立萍,吕典秋,姜丽丽,等.俄罗斯马铃薯种质资源遗传多样性的SSR分析[J].分子植物育种,2017,15(10):4047-4053.
WU L P,L" D Q,JIANG L L,et al.SSR analysis of genetic diversity of potato germplasm resources in russia[J].Molecular Plant Breeding,2017,15(10):4047-4053.
[13]" DUAN Y F,LIU J,XU J F,et al.DNA fingerprinting and genetic diversity analysis withsimple sequence repeat markers of 217 potato cultivars (Solanum tuberosum" L.) in China[J].American Journal of Potato Research,2019,96(1):21-32.
[14]" KARAAGAC E,YILMA S,CUESTA-MARCOS A,et al.Molecular analysis of potatoes from the pacific northwest tri-state variety development program and selection of markers f-or practical DNA fingerprinting applications[J].American Journal of Potato Research,2014,91(2):195-203.
[15]" 温" 贺,于肖夏,鞠天华,等.4个彩色马铃薯优良株系及其亲本的SSR分析[J].种子,2014,33(5):16-19.
WEN H,YU X X,JU T H,et al.SSR analysis of four color potato lines and their parents[J].Seed,2014,33(5):16-19.
[16]" MARIE-JOS CTE,LISA LEDUC,MELANIE MECTEAU,et al.Evaluation of the diversity of garden potato varieties grown in canada using simple sequence repeat (SSR) and morphology.[J].Canadian Journal of Plant Science,2017,98(3):1-5.
[17]" BALI S,PATEL G,NOVY R,et al.Evaluation of genetic diversity among russet potato clones and varieties from breeding programs across the United States[J].PLoS One,2018,13(8):e0201415.
[18]" 孙" 铭,符开欣,范" 彦,等.15份多花黑麦草优良引进种质的表型变异分析[J].植物遗传资源学报,2016,17(4):655-662.
SUN M,FU K X,FAN Y,et al.Analysis of phenotypic variations in 15 introduced el-ite germplasm of Lolium multiflorum lam[J].Journal of Plant Genetic Resources,2016,17(4):655-662.
[19]" 王" 磊.198份CIP马铃薯种质资源的表型性状和晚疫病抗性的遗传多样性研究[D].兰州:甘肃农业大学,2021.
WANG L.Study on phenotypic traits and genetic diversity of late blight resistance of 198 CIP potato germplasm resources[D].Lanzhou:Gansu Agricultural University,2021.
[20]" 赵春江.植物表型组学大数据及其研究进展[J].农业大数据学报,2019,1(2):5-18.
ZHAO CH J.Big data of plant phenotypes and its research progress[J].Journal of Agricultural Big Data,2019,1(2):5-18.
[21]" 刘" 磊,马奔驰,陈杰盼,等.野生马铃薯材料生长性状调查及抗旱性评价[J].种子,2022,41(8):85-92.
LIU L,MA B CH,CHEN J P,et al.Investigation of growth characteristics and evaluation of drought resistance of wild potato materials[J].Seed,2022,41(8):85-92.
[22]" 杨炳南,张小燕,赵凤敏,等.不同马铃薯品种的不同加工产品适宜性评价[J].农业工程学报,2015,31(20):301-308.
YANG B N,ZHANG X Y,ZHAO F M,et al.Evaluation of suitability of different processed products of different potato varieties[J].Journal of Agricultural Engineering,2015,31 (20): 301-308.
[23]" 贺" 晔.马铃薯主要优良品种及特性[EB/OL].科普中国,2018(2018-10-25)[2023-02-09].https://www.kepuchina.cn/xc/201810/t20181025_757541.shtml.
HE Y.Main excellent varieties and characteristics of potato[EB/OL].Popular Science China,2018(2018-10-25)[2013-02-09] https://www.kepuchina.cn/xc/201810/t20181025_757541.shtml.
[24]" 段艳凤.马铃薯种质资源遗传多样性评价及抗晚疫病相关基因分析[D].北京:中国农业科学院,2019.
DUAN Y F.Genetic diversity evaluation of potato germplasm resources and analysis of genes related to resistance to late blight [D].Beijing:Chinese Academy of Agricultural Sciences,2019.
[25]" 崔阔澍,陈" 龙,于肖夏,等.四倍体彩色马铃薯分子遗传连锁图谱构建研究[J].东北师大学报(自然科学版),2015,47(4):116-122.
CUI K SH,CHEN L,YU X X,et al.Study on the construction of molecular genetic linkage map of tetraploid color potato [J].Journal of Northeast Normal University (Natural Science Edition),2015,47(4):116-122.
[26]" 王" 丹.专用型马铃薯优良新品系选育研究[D].呼和浩特:内蒙古农业大学,2016.
WANG D.Research on breeding of special potato excellent new strains[D].Hohhot:Inner Mongolia Agricultural"" University,2016.
[27]" 宋" 洁,郭华春,李婉琳,等.SSR分子标记分析CIP引进马铃薯品系与国内资源的遗传差异[J].南方农业学报,2017,48(4):567-573.
SONG J,GUO H CH,LI W L,et al.Genetic difference between CIP introduced potato lines and domestic resources by SSR molecular marker analysis[J].Journal of Southern Agriculture,2017,48(4):567-573.
[28]" 刘福翠,谭学林,郭华春.云南省马铃薯品种资源的RAPD分析[J].西南农业学报,2004,17(2):5.
LIU F C,TAN X L,GUO H CH.RAPD analysis of potato varieties resources in Yunnan province[J].Southwest China Journal of Agricultural Sciences,2004,17(2):5.
[29]" SOSINSKI B,DOUCHES D S.Using polymerase chain reaction-based DNA amplification to fingerprint North"" american potato cultivars[J].HortScience,1996,31(1):130-133.
[30]" MILBOURNE D,MEYER R,BRADSHAW J E,et al.Comparison of PCR-based marker system for the analysis of genetic relationships in cultivated potato[J].Molecular Breeding,1997,3(2):127-136.
[31]" BARANDALLA L,GALARRETA J,RIOS D,et al.Molecular analysis of local potato cultivars from Tenerife Island using microsatellite markers[J].Euphytica,2006,152(2):283-291.
[32]" MCGREGOR C E,GREYTING M,WARNIEH L.The use of simple sequence repeats (SSRs) to identify commercially important potato (Solanum tuberosum L.) cultivars in South Africa[J].South Africa Journal of" Plant Soil,2000,17(4):177-180.
Genetic Diversity Analysis of Potato Germplasm Resources Based on Phenotypic Traits and SSR Markers
ZHANG Xiaoyu1,WANG Shipeng1,CAO Kunshan1,LI Xujing1,YE han1,LI" Xiaoyu1,WANG Kui2, FANG Yuchuan2 and" LIU Bailin1
(1.College of Agronomy,Northwest Aamp;F University,Yangling" Shaanxi" 712100,China;
2.Yulin Academy of Agricultural Sciences,Yulin" Shaanxi" 719053,China)
Abstract" Potato is the fourth-most largest food crop,and the genetic diversity of potato germplasm resources is the foundation for innovation in potato germplasm.To determine the genetic diversity of 176 genotypes(accessions and varieties) of potato germplasm,genetic diversity analysis was conducted using 24 phenotypic traits and 16 pairs of SSR markers.The coefficients of variation for the phenotypic variation of 24 traits in the 176 genotypes ranged from 10.20% to 72.75%,with an average of"" 35.50%.The diversity indices ranged from 0.18 to 0.77,with an average of 0.50.Using unweighted pair group method analysis(UPGMA) based on the 24 phenotypic traits,176 accessions and varieties were classified into seven groups,with the majority of the genotypes clustering in Groups A and C.A total of 91 polymorphic loci were amplified by the 16 pairs of SSR primers in the 176 genotypes,with a polymorphism rate of 94.8%.Both the phenotypic and SSR clustering results indicated that the potato genotypes collected from the same region were more closely related genetically than collections from different regions.Primer pairs S25,S151,S174 and S189 are effective in distinguishing most of the accessions and varieties,suggesting that these SSR primers can also be used preferentially when characterizing the genetic diversity of other germplasm resources.Even though phenotypic traits can reflect genetic differences to a certain degree,genetic diversity analysis of potato germplasm should use DNA markers in addition to phenotypic characterization.The genetic diversity and the relationship"" among the 176 cultivars determined by this study can be highly valuble for the anagement,enhancement and breeding of potato germplasm.
Key words" Potato; Phenotypic traits; SSR marker; Genetic diversity
Received ""2023-02-13""" Returned" 2023-05-06
Foundation item" Key Ramp;D Program of Shaanxi Province in China(No.2018ZDCXL-NY-03-03,"" No.2022NY-174); Research Project of Science and Technology for Yulin City in China(No.CXY-2022-168); Research Project of Science and Technology Innovation and" Transformation for Northwest Aamp;F University Experimental Station (No.TGZX2021-12).
First author" ZHANG Xiaoyu,female,master student.Research area:potato breeding and genetics." E-mail:15502452002@163.com
Corresponding"" author" LIU Bailin,male,associate professor.Research area:potato breeding and genetics.E-mail:liubl@nwafu.edu.cn
FANG Yuchuan,male,senior agronomist.Research area:production technologies of" potato." E-mail:nksfyc@163.com
(责任编辑:成" 敏" Responsible editor:CHENG Min)

