洪山菜薹抗根肿病新品系的创制




摘要:以抗根肿病红菜薹(Brassica rapa ssp. chinensis var. purpurea)种质资源GD1为抗源供体,以优异洪山菜薹早熟品系DGZ1902为背景材料进行回交转育,针对抗源携带的抗病基因CRzi8开发PARMS型分子标记,进一步结合分子标记辅助选择、单株优选以及根肿病接种鉴定,创制抗根肿病洪山菜薹新品系。结果表明,开发的标记可准确鉴定回交世代群体的抗性单株。田间病圃抗性鉴定及农艺性状观察表明,创制的洪山菜薹抗根肿病品系CR-DGZ1902高抗根肿菌4号生理小种,同时具有洪山菜薹的农艺性状特征及DGZ1902的早熟特性。
关键词:洪山菜薹; 分子标记; 根肿病; 抗病基因; 新品系
中图分类号:S634.6" " " " "文献标识码:A
文章编号:0439-8114(2024)12-0121-04
DOI:10.14088/j.cnki.issn0439-8114.2024.12.022 开放科学(资源服务)标识码(OSID):
Development of new Hongshancaitai line with clubroot resistance
REN Zhi-yong, DONG Bin-feng, HE Qing-song, NIE Qi-jun
(Institute of Economic Crops, Hubei Academy of Agricultural Sciences, Wuhan" 430064, China)
Abstract: Using clubroot resistance (CR) Brassica rapa ssp. chinensis var. purpurea germplasm GD1 as the resistant donor, and using DGZ1902, an early mature strain of Hongshancaitai, as the background material, backcross breeding was conducted. The penta-primer amplification refractory mutation system (PARMS) marker for CR gene CRzi8 carried by CR donor was developed and furtherly applied in the marker assistance selection (MAS), single plant selection and identification of root disease inoculation, finally the new CR Hongshancaitai line was created. The results showed that the PAMRS marker for CRzi8 could accurately detect the CR individuals from the backcross breeding program. Field resistance test and agronomic traits evaluation indicated that the developed CR Hongshancaitai line CR-DGZ1902 was resistant to Plasmodiophora brassicae pathotype 4, and had both agronomic characteristics of Hongshancaitai and early maturity characteristics of DGZ1902.
Key words: Hongshancaitai; molecular marker; clubroot disease; resistance gene; new line
收稿日期:2024-09-02
基金项目:湖北省自然科学基金青年项目(2023AFB246);国家大宗蔬菜产业技术体系项目(CARS-23-G28);湖北省支持种业高质量发展资金项目(HBZY2023B004)
作者简介:任志勇(1990-),男,河南潢川人,助理研究员,博士,主要从事薹用白菜遗传育种,(电话)13986269176(电子信箱)rzy595997565@163.com;通信作者,聂启军(1976-),男,湖北武汉人,副研究员,主要从事红菜薹育种,(电话)13307152212(电子信箱)nqj@hbaas.com。
根肿病是十字花科蔬菜较为严重的土传病害,根肿病的病原根肿菌属原生动物界根肿菌门根肿菌属芸薹根肿菌(Plasmodiophora brassicae Woronin),专性寄生于十字花科植物,其休眠孢子可在土壤中存活达7~20年,温度约24 ℃,湿度60%~80%、pH为5.5~6.5的土壤环境下较利于其萌发和侵染寄主[1,2]。根肿病发病植株根系瘤状肿大,丧失生理功能,目前尚无可行的植保防治手段,抗病育种是解决该病害的关键。当前大宗十字花科蔬菜如大白菜、甘蓝等已有抗病品种育成[3,4],但一些具有地域特色的十字花科蔬菜抗根肿病育种亟待加强[5]。
洪山菜薹是武汉市特色蔬菜,也是中国地理标志保护产品,被誉为“金殿御菜”[6],因原产于武汉市武昌洪山区一带而得名,在分类学上属不结球白菜变种红菜薹(Brassica rapa ssp. chinensis var. purpurea)中原产于湖北省武汉市的一类特殊地方品种类型[7],主要包括大股子、胭脂红等品种,生育期90~150 d,耐寒能力强,可露地越冬,营养生长旺盛。目前洪山菜薹产业正在逐步发展壮大,在湖北省种植面积约0.1万hm2,其中武汉市周边种植面积占比接近50%[8]。同时,湖北省内鄂西高山蔬菜产区、江汉平原等区域近年来的引种试种规模正在不断扩大,市场上也出现了早八股、“1902”等一批改良后的洪山菜薹新品系[9,10]。然而由于长年连作,包括洪山菜薹原产地保护区域在内的多个洪山菜薹种植基地根肿病频繁发生,危害严重时30%以上植株感染根肿病,因此开展抗病育种,做好抗根肿病洪山菜薹的品种储备对支撑洪山菜薹产业尤为重要。
为了解决洪山菜薹产业中的根肿病危害问题,本研究在前期抗根肿病红菜薹育种的基础上,选择高抗根肿病红菜薹的种质资源GD1为抗源,以洪山菜薹早熟新品系DGZ1902为轮回亲本,进行抗根肿病洪山菜薹的创制。同时针对抗根肿病基因CRzi8开发分子标记,用于每个世代的分子标记辅助选择,筛选到含有抗根肿病基因的单株后,进一步通过田间性状观察,选取与背景材料最为接近的株系进入下一轮回交。在连续两代回交及一代自交后,获得了商品薹性状符合洪山菜薹标准的抗根肿病品系CR-DGZ1902。在抗性方面,根肿菌4号生理小种是湖北省内根肿菌的优势生理小种[11],经苗期接种及田间病圃鉴定,该品系可高抗4号生理小种。
1 材料与方法
1.1 材料
含根肿菌4号生理小种的菌瘤,收集于湖北省宜昌市长阳县火烧坪乡根肿病重病田块;具有洪山菜薹品系大股子遗传背景的抗根肿病红菜薹材料GD1[12];早熟洪山菜薹品系DGZ1902。
1.2 方法
1.2.1 抗根肿病基因CRzi8的PARMS型分子标记开发 将CRzi8不同类型的抗病与感病等位基因进行比较,Crr1a是起源于芜菁(Brassica rapa ssp. rapifera)且对4号生理小种同样具有抗性的抗根肿病基因[13],该基因是CRzi8的抗病等位基因,二者序列高度相似,Crr1a的序列从NCBI数据库中获取(登录号:AB605024.1),已有研究已经取得CRzi8的序列[14],洪山菜薹对应的感病等位基因序列从最新组装的洪山菜薹T2T基因组序列中提取[15]。选择代表性的SNP(Single nucleotide polymorphism,单核苷酸多态性)突变位点,将该位点转化为基于PARMS(Penta-primer amplification refractory mutation system,五引物扩增受阻突变体系)技术的分子标记,PARMS为国产化的竞争性等位基因特异性PCR检测技术,原理与KASP分子标记检测技术一致[16]。DNA提取采用CTAB法(Cetyltrimethylammonium bromide,十六烷基三甲基溴化铵法)进行,PARMS分子标记检测体系体积为10 μL,各组分构成:2×PARMS master mix 5 μL,Allele X primer(10 μmol/L)0.15 μL,Allele Y primer(10 μmol/L)0.15 μL,Common primer(10 μmol/L)0.4 μL,待测DNA(100 ng/μL)" " 1 μL,ddH2O 3.3 μL。扩增程序:94 ℃预变性15 min;94 ℃变性20 s,65~57 ℃(-0.8 ℃/Cycle)1 min共10轮循环;94 ℃变性20 s,57 ℃ 1 min共32轮循环。PCR完成后,使用TECAN infinite M1000酶标仪读取荧光信号,然后利用在线软件snpdecoder(http://www.snpway.com/snpdecoder/)解析转换荧光信号,得到清晰直观的分型图,并根据颜色不同输出基因型结果。
1.2.2 根肿病抗性的接种鉴定 取出-20 ℃冻存的含根肿菌根瘤,解冻打碎,与育苗基质按1∶20(质量比)混合,25 ℃环境下放置48 h后播种。幼苗在温室内生长4周后,调查发病情况。田间病圃鉴定则在湖北省农业科学院内的根肿病病圃进行,每年8月下旬按正常管理条件将材料定植于病圃中,苗接种鉴定及田间病圃鉴定的单株发病等级均分为0~3级:0级,根系无肿瘤;1级,侧根上有轻微肿瘤;2级,主根与侧根均有中等大小肿瘤;3级,根部严重肿大畸变。根据病情指数(Disease index,DI)划定抗病等级,DI为0的材料为免疫;0lt;DI≤20为高抗;20lt;DI≤40为中抗;40lt;DI≤80为感病;DIgt;80为高感。
1.2.3 抗根肿病洪山菜薹的回交转育 2020—2022年秋季以DGZ1902为轮回亲本,以抗根肿病红菜薹GD1为抗源,开展两代回交及一代自交。每年8月10—20日播种,出苗后首先利用分子标记CRzi8-sep开展苗期辅助选择,保留杂合抗病单株,25 d苗龄后定植杂合抗病单株及轮回亲本。每个回交世代的农艺性状观察与田间病圃抗性鉴定同时进行,田间抗性鉴定以洪山菜薹品系DGZ1902为对照。2023年秋季,以DGZ1902为对照,分别在湖北省农业科学院杨家堰、新科园试验基地观测优选株系的自交后代的表现,两个试验地均采用随机区组设计,每个小区40株,3次重复。
2 结果与分析
2.1 抗根肿病基因CRzi8的分子标记开发
本试验中使用的抗根肿病红菜薹材料中携带的抗根肿病基因为CRzi8,该基因为已报道抗根肿病基因Crr1a潜在的等位抗病基因,CRzi8与Crr1a在编码区的第2302处碱基存在C到T非同义突变[14]。本研究基于此处突变结合PARMS特异性分子标记检测技术,开发了CRzi8的基因标记CRzi8-sep(图1)。其中抗病等位基因特异引物被标记为HEX型荧光,感病等位基因标记为FAM型荧光(表1),使用已知基因型的抗病、感病及杂合的DNA模板对该标记进行测试,其基因分型的结果显示,3种基因型的荧光信号分区符合预期,其中绿色信号为HEX型荧光,代表抗病基因型,均聚合在Y轴附近,蓝色信号为FAM型荧光代表的感病基因型,均聚合在X轴附近,杂合基因型为红色信号,则大致分布在中心区域(图1)。以上研究结果表明,基于PARMS技术开发的分子标记CRzi8-sep可以用于CRzi8基因的辅助选择。
2.2 抗根肿病洪山菜薹新品系的转育与筛选
以GD1为抗源供体,以DGZ1902为轮回亲本,其中轮回亲本作母本,分别于2020年秋季、2021年秋季在湖北省农业科学院本部的重病田块内连续进行两代的回交转育。因GD1已具备一定洪山菜薹遗传背景,两个回交世代群体均表现出了洪山菜薹的偏晚熟特点,在11月中下旬抗根肿病洪山菜薹回交群体开始抽薹,此时根据主薹及侧薹表现,从早熟性、薹叶、薹色、口感等方面选择接近洪山菜薹农艺性状的单株,授以DGZ1902的花粉,收获回交后代种子。2022年秋季从BC2代群体中获得1个早熟单株株系CR-DGZ1902,其熟性与DGZ1902接近,同时农艺性状又符合洪山菜薹特征,因此重点对该单株进行了自交扩繁。2023年秋季进行苗期分子标记辅助选择以剔除CR-DGZ1902自交后代中的感病及杂合单株,同时进行根肿病苗期接种与田间抗性鉴定,检验纯合抗病基因型单株的抗性。苗期接种与田间抗性鉴定的结果表明,纯合抗病基因型单株仅少量苗在侧根上发现轻微根瘤,表现为高抗(图2)。
2.3 抗根肿病洪山菜薹的田间表现
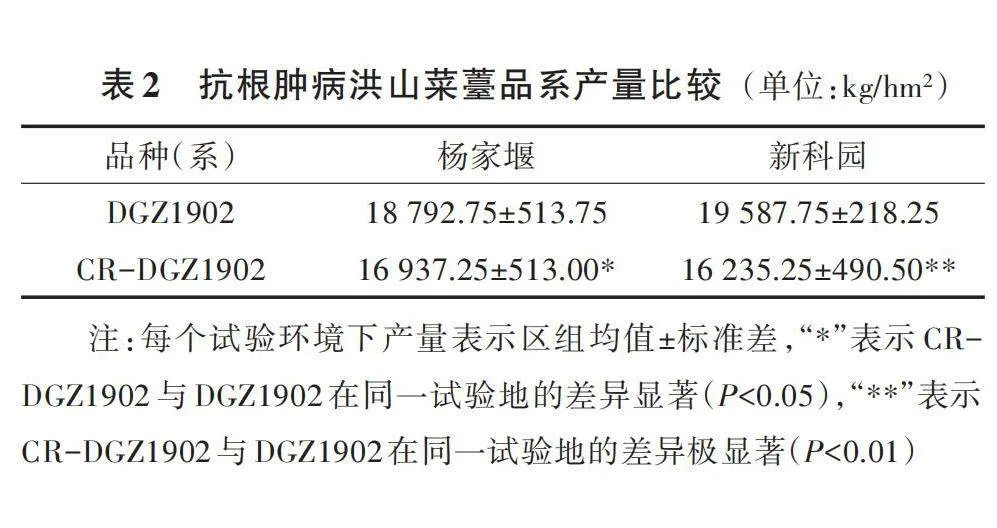
将CR-DGZ1902自交后代中的纯合抗病单株定植于湖北省农业科学院杨家堰、新科园试验基地,对其农艺性状进行进一步的观察。抗病单株群体在定植后85~95 d开始抽薹,其熟性与DGZ1902的85~90 d熟性水平接近,植株生长势旺,耐寒,株高平均75~85 cm,开展度90 cm左右,菜薹表皮亮红色,薹基部粗壮,横径平均2.5 cm,粗的可达4.0 cm以上,薹长38~53 cm,单薹重可达90 g以上,上部薹叶披针形,下部薹叶偏卵圆形,叶缘微锯齿状(图3),抗病单株群体的产量与DGZ1902相比偏低,差异显著或极显著(表2)。总体而言,CR-DGZ1902具备洪山菜薹的基本特征,在熟性方面接近DGZ1902,田间抗性优于DGZ1902(图2),而在商品薹特征方面又与DGZ1902存在一定区别,商品薹性状一致性仍低于DGZ1902。
3 小结与讨论
近年来根肿病在特色十字花科蔬菜上的危害愈演愈烈,加之缺乏抗根肿病品种储备,已给相关产业带来巨大威胁[17,18]。洪山菜薹作为湖北省及武汉市周边重要的十字花科特色蔬菜产业之一,面临着越来越严重的根肿病危害,根肿病从侵染到症状初显需10~16 d,发展到中期以后开始出现营养体生长迟滞、早衰的症状,而洪山菜薹在生长的中后期,茁壮的营养体是持续采收侧薹的保证,因此根肿病对洪山菜薹生产的威胁更为严重[19]。因此,本研究创制的抗根肿病洪山菜薹新品系CR-DGZ1902对解决洪山菜薹产业上的根肿病问题具有重要意义。该品系已在位于武汉市内洪山菜薹原产地的根肿病重病田块进行试种,初步缓解了原产地的根肿病危害问题。
本研究创制的新品系CR-DGZ1902农艺性状符合基本的洪山菜薹特征,同时也从轮回亲本中导入了早熟特性,但在农艺性状如薹叶大小、商品薹顺直度、商品薹一致性等方面仍与优异洪山菜薹品系DGZ1902存在差异。从亲缘关系较远的不同种属、变种导入抗病基因,常会因抗病基因所在染色体区段的交换重组频率较低导致连锁累赘,使得栽培种在获得抗性基因的同时,其他农艺性状也发生变化[20,21]。前期研究表明,CRzi8基因起源于与红菜薹亲缘关系较远的芸薹种变种之一芜菁,后被应用于大白菜育种中[14,22]。CRzi8基因位于A08染色体上,在其前后存在1个约1.6 Mb的渐渗片段[14],因此也不能排除CR-DGZ1902与其轮回亲本的性状差异由连锁累赘导致。综合以上分析,抗根肿病洪山菜薹新品系CR-DGZ1902仍需通过进一步的回交转育以摆脱连锁累赘,并进行多个世代的性状选择,使其成为一致性更高、性状更优异的抗根肿病洪山菜薹品系。
参考文献:
[1] 张 慧,张淑江,李 菲,等.大白菜抗根肿病育种研究进展[J].园艺学报,2020,47(9):1648-1662.
[2] 苏贺楠,秦六月,杨双娟,等.大白菜根肿病抗感品种间的侵染过程及生理生化差异分析[J].中国瓜菜,2024,37(6):45-51.
[3] 王丽丽,王 鑫,吴海东,等.抗根肿病中早熟大白菜新品种辽白27的选育[J].中国蔬菜,2023(5):105-107.
[4] 何 超,祖贵东,赵庆炼,等.威宁县夏秋抗根肿病结球甘蓝品种筛选试验[J].上海蔬菜,2024(1):4-6.
[5] 李崇娟,杨 鼎,吕凤仙,等.抗根肿病长柄芥育种材料的创制与鉴定[J].湖北农业科学,2024,63(4):82-89,95.
[6] 张德纯.武汉洪山菜薹[J].中国蔬菜,2018(5):94.
[7] CHENG F,SUN R F,HOU X L,et al. Subgenome parallel selection is associated with morphotype diversification and convergent crop domestication in Brassica rapa and Brassica oleracea[J].Nature genetics,2016,48(10):1218-1224.
[8] 冯 军,袁尚勇,林处发,等.湖北省洪山菜薹产业现状调查分析与对策[J].长江蔬菜,2022(18):3-6.
[9] 聂启军,朱凤娟,任志勇,等.鄂西高山洪山菜薹栽培技术[J].长江蔬菜,2023(17):5-9.
[10] 聂启军,叶晓佑,冯 军,等.洪山菜薹产业发展优势及制约因素探讨[J].湖北农业科学,2022,61(S1):244-246.
[11] PANG W X,LIANG Y,ZHAN Z X,et al. Development of a sinitic clubroot differential set for the pathotype classification of Plasmodiophora brassicae[J].Frontiers in plant science,2020(11):568771.
[12] 聂启军,邱正明,朱凤娟,等.抗根肿病红菜薹新组合HCR1和HCR2的选育[J].长江蔬菜,2018(2):41-44.
[13] YANG Z Q,JIANG Y F,GONG J F,et al. R gene triplication confers European fodder turnip with improved clubroot resistance[J].Plant biotechnology journal,2022(20):1502-1517.
[14] REN Z Y,LI J Q,ZHANG X Y,et al. Utilizing resequencing big data to facilitate Brassica vegetable breeding: Tracing introgression pedigree and developing highly specific markers for clubroot resistance[J].Horticultural plant journal,2024,10(3):771-783.
[15] ZHOU Y F,YE H Z,LIU E W,et al.The complexity of structural variations in Brassica rapa revealed by assembly of two complete T2T genomes[J].Science bulletin,2024(69):2346-2351.
[16] LU J,HOU J,OUYANG Y D,et al. A direct PCR-based SNP marker-assisted selection system (D-MAS) for different crops[J].Molecular breeding,2020,40:9.
[17] 胡 韬,徐 翔,贾 刚,等.苤蓝根肿病全程绿控技术的田间应用效果[J].中国植保导刊,2020,40(10):53-55.
[18] 吴艺飞,丁茁荑,周晓波,等.菜薹根肿病显微观察及抗病性鉴定[J].中国农学通报,2020,36(17):129-133.
[19] 吴仁锋.洪山菜薹病害的识别与防治[J].长江蔬菜,2022(23):53-54.
[20] LIN T,ZHU G T,ZHANG J H,et al. Genomic analyses provide insights into the history of tomato breeding[J]. Nature genetics,2014,46(11):1220-1226.
[21] ZHANG L,SU W Q,TAO R,et al. RNA sequencing provides insights into the evolution of lettuce and the regulation of flavonoid biosynthesis[J].Nature communications,2017,8(1):2264.
[22] 程 斐,宋 莹,张清霞,等.大白菜衍生系‘CR117-95’抗根肿病基因鉴定与染色体定位分析[J].分子植物育种,2024(1):1-10.

