例析高中化学中晶体的结构与相关计算



摘" 要:晶体的结构与相关计算是近几年高考化学的热点之一,主要涉及晶体的堆积方式、计算离子数、配位数、阿伏伽德罗常数、晶体密度、质点距离、空间利用率等,与空间几何紧密相连,注重考查学生在化学情境下的空间思维能力、空间想象能力以及数据处理与应用能力.
关键词:高中化学;晶体结构;晶体的相关计算
中图分类号:G632""" 文献标识码:A""" 文章编号:1008-0333(2024)22-0142-04
收稿日期:2024-05-05
作者简介:李慧娟(1978.11—),女,甘肃省天水人,本科,中学一级教师,从事高中化学教学研究.
晶体是一种具有规则几何外形的固体,而晶胞是晶体的最小单元,一个晶体是由无数个晶胞“无空隙,同向平行排列”而得到的.晶胞具有如下特点:(1)平行六面体结构;(2)顶角都相同;(3)一定存在3组完全相同的各4根平行棱和3组完全相同的各两个平行面.正是这样的结构特征,为我们计算离子数、配位数、阿伏伽德罗常数、晶体密度、质点距离、空间利用率等提供了便利[1].
1" 用均摊法计算晶胞中的粒子数
如图1,长方体(包括立方体)晶胞中不同位置的微粒数的计算方法:
图1" 晶胞中不同位置的微粒数的计算方法示意图
设晶胞中的粒子数为n(J),顶点原子数为n(V),棱边原子数为n(E),面心原子数n(F),体心原子数n(T),则晶胞中的粒子数一般具有以下公式:n(J)=n(V)+n(E)+n(F)+n(T).
例1" (2023年山东淄博高三·期中节选)如图2,CaC2晶体中存在哑铃形C2-2,使晶胞呈长方体型
结构.试计算晶体C2-2和Ca2+的个数.
图2" CaC2晶胞
解" 根据题意并结合图2,可知晶胞纵向的截面为长方形,横向截面为正
方形,由图中体心Ca2+周围距离最近的C2-2可知,1个Ca2+周围距离最近的C2-2有4个;根据晶胞结构示意图(如图2),可知底面(或顶面)上位于面心的C2-2和位于顶点的C2-2的距离最近.根据均摊法,晶胞中C2-2的个数为8×18+6×12=4,Ca2+的个数=1+12×14=4
点评" 根据晶胞的几何特征,可知体心Ca2+周围距离最近的C2-2的情况:
1个Ca2+周围距离最近的C2-2有4个,根据晶胞结构示意图(如图2),可知底面(或顶面)上位于面心的C2-2和位于顶点的C2-2的距离最近.根据均摊法,再结合空间几何知识,即可获得答案.
2" 利用晶体的堆积方式,计算配位数
晶体是由粒子堆积而成的,一维堆积成线状结构,二维堆积成平面状结构,三维堆积成复杂的空间结构.常见的晶体的堆积方式有:简单立方、面心立方和体心立方.这些晶体结构类型的配位数,易于计算.
例2" (2023届步步高化学一轮复习资料·节选)(1)Li2O具有反萤石结构,其立方晶胞结构如图3所示,A表示锂离子,B表示氧离子,其配位数是.
(2)锌、硒的晶体是一种重要的半导体材料,其晶胞结构如图4所示.图5为该晶胞俯视图,则锌原子的配位数为:.
(3)萤石是制作光料之一,其主要成分氟化钙的晶胞结构,如图6所示.则Ca2+的配位数为.
图3" Li2O晶胞""""" 图4" 锌、硒的晶胞
图5" 锌、硒的晶胞俯视图""" 图6" 氟化钙的晶胞
解" (1)A原子位于体内,其数目为8,B原子位于顶点和面心,其数目为8×18+6×12=4.
A表示Li,B表示O,B周围最近的A的数目为8,则B的配位数为8.
(2)晶胞中位于体内的锌原子个数为4,顶点和面心的硒原子个数为8×18+6×12=4.
晶胞中位于体内的锌原子周围距离最近的硒原子个数为4,则锌原子的配位数为4.
(3)面心上的Ca2+,与之距离最近且等距的F-位于体内,共8个,则每个Ca2+周围距离最近且等距的F-有8个,则Ca2+的配位数为8.
点评" 根据晶体中晶胞的空间几何结构,观测某一原子A(或离子)周围,距离它最近且等距离的某一原子(或离子)的数目,即可得A原子(或离子)的配位数.
3" 计算晶胞的密度、晶胞的棱长、晶胞的体积、微粒间的距离等几何量
(1)晶胞的几何量的计算方法.
(2)金属晶体中体心立方堆积、面心立方堆积中的几组计算公式(设棱长为a)
①面对角线长=2a
②体对角线长=3a
③体心立方堆积4r=3a(r为原子半径)
④面心立方堆积4r=2a(r为原子半径)
⑤刚性原子球体积V(球)=43πr3(r为原子半径)
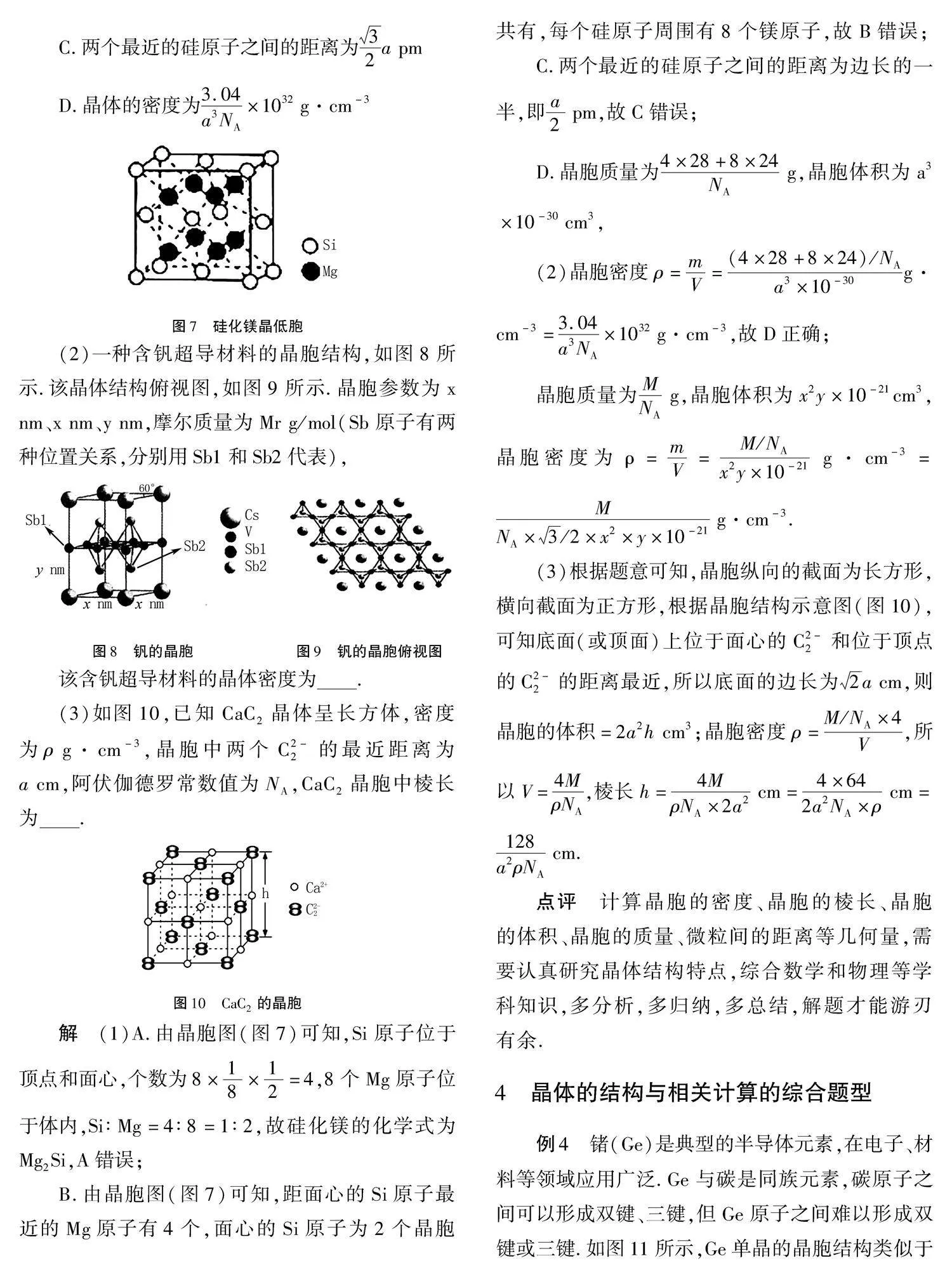
例3" (1)硅化镁是一种窄带隙N型半导体材料,具有重要应用前景.硅化镁晶体属于面心立方晶体,其晶胞结构,如图7所示.每个Mg原子位于Si原子组成的四面体中心,晶胞边长为a pm,阿伏伽德罗常数值为NA,下列有关说法正确的是(" )
A.硅化镁的化学式为MgSi2
B.每个硅原子周围有4个镁原子
C.两个最近的硅原子之间的距离为
32a pm
D.晶体的密度为3.04a3NA
×1032 g·cm-3
图7" 硅化镁晶低胞
(2)一种含钒超导材料的晶胞结构,如图8所示.该晶体结构俯视图,如图9所示.晶胞参数为x nm、x nm、y nm,摩尔质量为Mr g/mol(Sb原子有两种位置关系,分别用Sb1和Sb2代表),
图8" 钒的晶胞""""" 图9" 钒的晶胞俯视图
该含钒超导材料的晶体密度为.
(3)如图10,已知CaC2晶体呈长方体,密度为ρ g·cm-3,晶胞中两个C2-2的最近距离为
a cm,阿伏伽德罗常数值为NA,CaC2晶胞中棱长为.
图10" CaC2的晶胞
解" (1)A.由晶胞图(图7)可知,Si原子位于顶点和面心,个数为8×18×12=4,8个Mg原子位于体内,Si∶Mg=4∶8=1∶2,故硅化镁的化学式为Mg2Si,A错误;
B.由晶胞图(图7)可知,距面心的Si原子最近的Mg原子有4个,面心的Si原子为2个晶胞共有,每个硅原子周围有8个镁原子,故B错误;
C.两个最近的硅原子之间的距离为边长的一半,即a2 pm,故C错误;
D.晶胞质量为4×28+8×24NA g,晶胞体积为a3×10-30 cm3,
(2)晶胞密度ρ=mV=
(4×28+8×24)/NAa3×10-30g·cm-3=
3.04a3NA×1032 g·cm-3,故D正确;
晶胞质量为MNA g,晶胞体积为x2y×10-21cm3,晶胞密度为ρ
=mV=M/NAx2y×10-21 g·cm-3=
MNA×3/2×x2×y×10-21 g·cm-3.
(3)根据题意可知,晶胞纵向的截面为长方形,横向截面为正方形,根据晶胞结构示意图(图10),可知底面(或顶面)上位于面心的C2-2和位于顶点的C2-2的距离最近,所以底面的边长为
2a cm,则晶胞的体积=2a2h cm3;晶胞密度ρ=M/NA×4
V,所以V=4MρNA,棱长h=4MρNA×2a2 cm=
4×642a2NA×ρ cm=128a2ρNA cm.
点评" 计算晶胞的密度、晶胞的棱长、晶胞的体积、晶胞的质量、微粒间的距离等几何量,需要认真研究晶体结构特点,综合数学和物理等学科知识,多分析,多归纳,多总结,解题才能游刃有余.
4" 晶体的结构与相关计算的综合题型
例4" 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.Ge与碳是同族元素,碳原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键.如图11所示,Ge单晶的晶胞结构类似于金刚石.(3=1.732,π=3.14)(注:晶胞中所有的球是等径硬球,且A球和D球相切)下列说法错误的是(" ).
图11" 例4题图
A.原子坐标参数表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),则C(
12,12,0),D(14,14,14),
B(12,0,12)
B.碳原子之间可以形成双键、三键,但Ge原子之间不能形成的原因是Ge原子的半径大,原子间形成的σ单键长,p-p轨道肩并肩的重叠程度小
C.若Ge原子半径为r,Ge单晶晶胞边长为a,Ge原子在晶胞中的空间占有率为34%(一个晶胞中构成晶体粒子在整个晶体空间中所占的体积百分比)
D.两个最近的Ge原子之间的距离为
24
a(Ge单晶晶胞边长为a)
解" A.将晶胞平分为8个小立方体,D原子位于左下前方的小立方体的体心位置,B原子位于前面面
心,C原子位底面面心,根据原子坐标参数A为(0,0,0),可知,B原子坐标参数为(12,0,12),C原子坐标参数为(
12,12,0),D原子坐标参数为(14,14,14),故A正确;
B.虽然Ge与C是同族元素,C原子之间可以形成双键、三键,但考虑Ge的原子半径大,原子间形
成的σ单键长,p-p轨道肩并肩的重叠程度小,难以通过“肩并肩”方式形成π键,所以Ge原子之间难以形成双键或三键,故B正确;
C.晶胞中Ge原子个数为8×
18+6×12+4=8,设Ge原子的半径为r,晶胞边长为a,Ge原子的总体
积为8×43πr3,晶胞的体积为a3,由晶胞结构可知晶胞的对角线长为8r,即8r=3a,a3=
51233r3,则Ge原子在晶胞中的空间占有率为
8×4πr3/3a3×100%=
8×4πr3/3
512r3/33
×100%=34%,故C正确;
D.晶胞边长为a,晶胞的对角线长为3a,由晶胞结构可知两个最近的Ge原子之间的距离为晶胞的
对角线长的14,即
34a,故D错误;
故选:D.
点评" 晶胞的综合性计算,需要结合均摊法进行分析,掌握基础为解题关键,需要学生具备一定的空间想象与数学计算能力,难度较大.
5" 结束语
晶体的相关计算是近几年高考化学中的热点和难点之一.解答此类问题时,必须厘清概念,掌握晶体结构特征和几何特点,构建晶体相关计算类型的基本框架,熟悉晶体配位数、微粒数、晶体棱长与体积、晶体密度、晶体的空间利用率等基础题型的计算[2].同时,还需善于借助数学与物理等其他学科知识综合解答问题.只有这样,我们才能在晶体的结构与相关计算问题中,做到游刃有余.
参考文献:
[1]
黄秋华.高中化学竞赛晶体结构试题的解题技巧[J].高中数理化,2019(10):59.
[2] 王晓波.剖析高中常见晶体结构[J].数理化解题研究,2017(01):93-94.
[责任编辑:季春阳]

