四川麸醋中高产生料淀粉水解酶菌株的分离筛选及应用研究


摘要:淀粉熟化是当前酿造工业生产的必要环节,费时耗能,与当前资源节约、绿色环保、节约粮食的时代主题相悖。水解生料淀粉的微生物在四川麸醋酿造过程中扮演着重要角色。因此,该研究从四川麸醋醋醅中分离筛选出一株产生料淀粉酶的革兰氏阳性杆状菌Bacillus funiculus A2,在BPA培养基中30 ℃培养16 h即可达到稳定期,能在69 ℃范围内生长,其乙醇耐受性为9%,最低生长pH为3.5。通过模拟四川麸醋生产工艺进行醋醅发酵,探究Bacillus funiculus A2接种量对麸醋理化性质的影响。结果表明,接种Bacillus funiculus A2对醋醅水分含量、pH、总酸含量和还原糖含量的影响较小;增大接种量可促进醋醅发酵体系乙醇快速消耗,提高醋醅发酵的淀粉利用率。该研究为四川麸醋酿造的提质降耗和工艺改进提供了理论依据。
关键词:四川麸醋;生料淀粉;Bacillus funiculus;模拟发酵
中图分类号:TS264.22""""" 文献标志码:A"""" 文章编号:1000-9973(2024)11-0007-07
Isolation, Screening and Application of High-Yield Raw Starch Hydrolase Strains from Sichuan Bran Vinegar
XIAO Xiong-jun, TANG Zi-hao, ZENG Lin-min, LIU Ming-xin, LIU Min,
ZHENG Chi-chong, MAO Xiang
(College of Bioengineering, Sichuan University of Science amp; Engineering, Yibin 644000, China)
Abstract: Starch ripening is a necessary link in the current brewing industry production, which is time-consuming and energy-consuming and contradicts the current theme of resource conservation, green environmental protection and grain conservation. Microorganisms that hydrolyze raw starch play an important role in the brewing process of Sichuan bran vinegar. Therefore, in this study, a Gram-positive rod-shaped bacterium Bacillus funiculus A2 which produces raw amylase is isolated and screened from the fermented grains of Sichuan bran vinegar. This strain reaches a stable stage after being cultured at 30 ℃ for 16 h in BPA medium and could grow in the range of 69 ℃, and its ethanol tolerance is 9% and the minimum growth pH is 3.5. The effects of Bacillus funiculus A2 inoculation amount on the physicochemical properties of bran vinegar are studied by simulating the production process of Sichuan bran vinegar.The results show that inoculation of Bacillus funiculus A2 has little effect on moisture content, pH, total acid content and reducing sugar content in fermented grains, and the increase of inoculation amount could promote the rapid consumption of ethanol in the fermentation system of vinegar grains and improve the utilization rate of starch in fermentation of vinegar grains. This study has provided a theoretical basis for improving the quality, reducing the consumption and improving the process of Sichuan bran vinegar brewing.
Key words: Sichuan bran vinegar; raw starch; Bacillus funiculus; simulated fermentation
收稿日期:2024-04-21
基金项目:四川轻化工大学“652”科研创新团队计划资助(SUSE652B003);四川轻化工大学大学生创新创业训练计划项目(S202110622029)
作者简介:肖雄峻(1991—),男,初级实验师,硕士,研究方向:发酵工程。
*通信作者:毛祥(1989—),男,助理研究员,博士,研究方向:食品发酵生物技术。
淀粉是微生物生长、繁殖和代谢的重要能源物质,在发酵食品工业中必不可少。目前工业发酵微生物大多只能利用熟化后的淀粉,即经高温糊化或膨化后的淀粉,能直接酶解生料淀粉进行微生物发酵的菌群相对较少[1]。若能将直接酶解生料淀粉的微生物应用于酿造生产,将极大地降低能源消耗及企业投资和运行成本,在传统食品酿造工业中具有广阔的应用前景。
国内外学者对生料淀粉的利用做了大量研究,已报道了许多能产生料淀粉酶的微生物类群,如霉菌[2]、乳酸菌[3]、芽孢杆菌[4]、假单胞菌[5]、放线菌[6]和酵母菌[7]等。其中大多数产生料淀粉酶的微生物因淀粉糖化、液化条件要求苛刻,且食醋酿造环境酸度高,限制了其在麸醋酿造过程中的淀粉利用。近年来,对水解生料淀粉酶工程菌株构建的研究较多[8],如Cripwell等[9]利用基因重组技术构建Saccharomyces cerevisiae,使其同时具备水解生料淀粉和酒精发酵功能,到目前为止已有数株改造成功的案例,却无应用于工业生产的报道。此外,还有部分学者研究了淀粉酶水解对生料淀粉的作用机制,并改造提升了酶解效率[10-12],这些研究有利于增加淀粉在其他领域应用的发展。四川麸醋因以麸皮为原料而得名,麸皮中含有约11%~33%的生淀粉[13],在麸醋酿造过程中,淀粉残余量高,造成严重的资源浪费[14]。因此,从环境相似的条件(如醋醅)下筛选高产水解生料淀粉酶活力的菌株,并原位应用于四川麸醋的发酵生产,对麸醋酿造产业的提质降耗、节省成本具有重要的理论和应用价值。
1 材料与方法
1.1 材料与试剂
麸醋醋醅:醋醅发酵阶段发酵15 d的四川麸醋醋醅样,取自四川宜宾某麸醋生产厂,醋曲亦为该麸醋厂提供;实验所用化学试剂(均为分析纯):成都市科隆化学品有限公司;微生物培养所需试剂(均为生物纯);麸皮、面粉等:均购自宜宾本地农贸市场;高活性酿酒酵母:安琪酵母股份有限公司;黑曲霉孢子:济宁玉园生物科技有限公司。
富集培养基:牛肉膏5.0 g/L,蛋白胨10.0 g/L,氯化钠5.0 g/L,pH自然,在121 ℃下高压蒸汽灭菌20 min。待培养基冷却后,在无菌条件下加入10.0 g/L于160 ℃干热灭菌2 h的小麦淀粉。
筛选培养基:初筛培养基在富集培养基的基础上添加20 g/mL的琼脂粉,复筛培养基同富集培养基。
牛肉膏蛋白胨培养基(BP):牛肉膏5.0 g/L,蛋白胨10.0 g/L,氯化钠5.0 g/L,pH自然,在121 ℃下高压蒸汽灭菌20 min。固体培养基添加20 g/mL的琼脂粉(BPA)。
1.2 主要仪器与设备
ME204E/02电子天平、FE28 pH计 梅特勒-托利多仪器(上海)有限公司;BXM-75立式压力蒸汽灭菌器、BG2-140电热鼓风干燥箱、BSP-400生化培养箱 上海博迅实业有限公司医疗设备厂;ZHJH-C1118C超净工作台、ZWY-211C恒温培养振荡器 上海智城分析仪器制造有限公司;优普UPT-I-20T超纯水机 四川优普超纯科技有限公司;A390紫外可见分光光度计 翱艺仪器(上海)有限公司;XHF-DY高速分散器 宁波新芝生物科技股份有限公司;Multiskan Spectrum酶标仪 赛默飞世尔(上海)仪器有限公司。
1.3 方法
1.3.1 目的菌株的富集筛选
准确称取25.00 g麸醋醋醅加入225 mL无菌富集培养基中,混匀后置于37 ℃恒温培养24 h。对富集培养液进行梯度稀释,分别取10-5,10-6,10-7倍的菌液涂布平板,置于37 ℃培养24~48 h。在长出的各单菌落边缘滴加稀碘液(0.1 mol/L),观察菌落周围是否出现变色圈,并用游标卡尺测定变色圈直径(D)与菌落直径(d)[15],挑选出D/d比值较大的6株菌株进行复筛。菌落边缘出现变色圈说明该菌株能产生料淀粉酶,而变色圈直径与菌落直径的比值大小说明产酶能力的大小,所以通过D/d的比值确定初筛菌株。
1.3.2 菌株的复筛
用接种环分别取1环初筛获得的6株菌株接种到复筛培养基上,37 ℃、160 r/min摇床培养2 d。取发酵液20 mL,5 000 r/min离心10 min,收集上清液,即为粗酶液,采用DNS法于50 ℃条件下测定各菌株水解生料淀粉酶的活力,选择水解生料淀粉酶活力最强的一株菌株为后续试验的出发菌株。
1.3.3 菌株的鉴定
对各菌株的菌落形态、菌落颜色、菌落大小及菌株形态进行观察,完成菌株的初步鉴定。同时采用生工生物工程(上海)股份有限公司细菌基因组DNA快速抽提试剂盒,参照使用说明对目的菌株基因组DNA进行提取。利用扩增引物27F(5′-AGAGTTTGATAG-AGTTTGATC-3′)和1492R(5′-GGTTACCTTGTTACG-ACTT-3′)对菌株的16S rDNA进行扩增,扩增体系50 μL,2×GS Taq PCR混合物25 μL,上游引物27F(10 μmol/L)和下游引物1492R(10 μmol/L)各2 μL,菌株DNA模板1 μL,无菌重蒸水20 μL,PCR扩增程序:95 ℃预变性4 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃,10 min。采用1%的琼脂糖凝胶电泳检测PCR扩增产物,将PCR产物送往成都擎科伟业生物技术有限公司进行测序,对测序结果使用DNAMAN软件进行拼接,在NCBI数据库中比对分析菌株的同源性,最后通过MEGA 11软件构建系统发育树,采用Neighbor-Joining法进行系统发育分析,自展值设定为1 000次重复计算。
1.3.4 菌株特性分析
为明确目的菌株的应用特性,分别对菌株生长特性、温度、pH和乙醇耐受性等进行评估。取1环菌株接种于250 mL BP液体培养基中,于37 ℃、180 r/min培养数天,期间每2 h取样一次,测定菌液的OD600值,绘制生长曲线。此外,于9 mL BP液体培养基中接种对数生长期菌株菌悬液(OD600为1)1 mL,置于依次设置不同初始温度(10,15,20,25,30,35,40,45,50,55 ℃),180 r/min避光培养24 h,取200 μL用酶标仪测定各培养液的OD600值,评估菌株的生长温度范围;同理,于37 ℃条件下对目的菌株的pH耐受性(用乙酸调节pH为3.0,3.5,4.0,4.5,5.0,5.5,6.0)、乙醇耐受性(0%、1%、5%、7%、9%、11%)进行评估。以等体积的无菌BP液体培养基代替菌悬液作为空白对照,每组试验3个生物学重复。
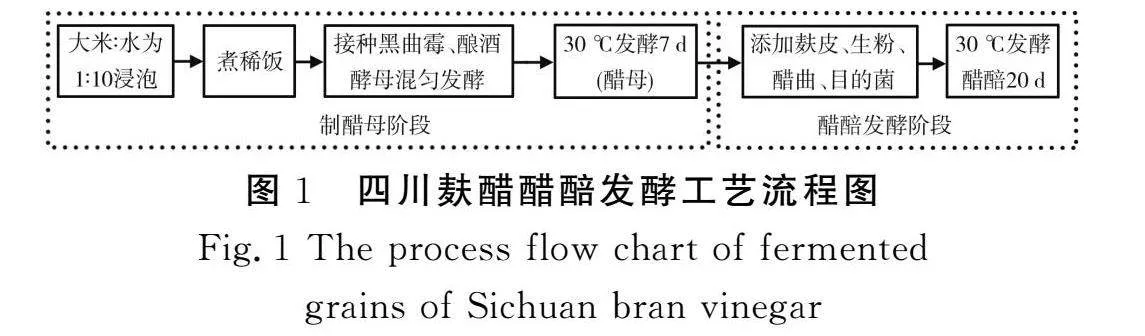
1.3.5 目的菌株发酵麸醋醋醅的制备工艺
取50 mL富集培养基加入150 mL锥形瓶中,调节培养基的pH,以1.0,2.0,3.0,4.0,5.0,6.0为梯度进行试验,在无菌条件下,用灭菌后的生理盐水洗下斜面上的菌株,摇匀,吸取1 mL加入富集培养基中,于37 ℃、160 r/min摇床培养24 h,取出后,在600 nm处测定吸光度,根据吸光度判断菌株的生长情况,得出菌株的耐酸性。
1.3.6 目的菌株发酵麸醋醋醅的制备工艺
参照工厂生产麸醋的工艺[16],接种目的菌株发酵生产醋醅,评估目的菌株对麸醋酿造的影响。首先将大米(110 g)与水按照1∶10的比例混合,浸泡4 h后于105 ℃蒸煮糊化20 min,冷却至室温。其次接种0.02 g黑曲霉孢子、0.1 g酿酒酵母,搅拌混匀后置于30 ℃发酵7 d,期间每12 h搅拌混匀一次,然后以总体积计,按1∶5 000的比例接种醋曲,混匀后均分为4组,分别接种OD600为1的水解生料淀粉芽孢杆菌菌悬液0,5,10,15 mL/100 mL,同时加入9倍大米质量的麸皮、4.5%(以大米质量计)的无菌小麦粉,翻拌均匀,制成醋醅,置于30 ℃发酵20 d。期间每2 d翻醅一次,每4 d取样一次,用于后续分析。
1.3.7 DNS法测定水解生料淀粉酶活力
在孙玲玉等[17]报道的DNS法测定淀粉含量的基础上进行了微调,用于测定各菌株水解生料淀粉酶活力。具体步骤:在25 mL比色管中加入2 mL 50 ℃预热混匀的生淀粉悬液、2 mL pH为5的磷酸盐缓冲液和1 mL粗酶液,置于50 ℃下恒温水浴中反应1 h,水浴期间每5 min摇晃一次,避免淀粉沉淀,反应结束后取出,加入1 mL 2 mol/L的氢氧化钠终止反应,冷却后加入3 mL DNS溶液,沸水浴5 min,取出冷却后加入去离子水定容至25 mL,于540 nm波长处测定吸光度值,计算水解生料淀粉酶的酶活力。同时以提前灭酶处理后的各菌株粗酶液为空白对照。酶活力的定义:1 mL粗酶液在50 ℃、pH 5.0条件下每分钟水解可溶性淀粉生成1 μg葡萄糖为一个酶活力单位(U/mL)。酶活力(E)计算公式如下:
E(U/mL)=N×V×F×1 000C×T。
式中:E为生料淀粉酶活力(U/mL);N为水解淀粉后的葡萄糖生成量(mg/mL);F为粗酶液的稀释倍数;1 000为mg换算成μg的系数;V为反应体系的体积(mL);C为粗酶液的体积(mL);T为反应时间(min)。
1.3.8 目的菌株发酵醋醅理化分析
为评估水解生料淀粉酶菌株对麸醋酿造的影响,对麸醋酿造过程中的关键指标进行了测定。采用直接干燥法测定醋醅的含水量;采用酸碱中和滴定法测定醋醅的总酸含量;采用酸度计法测定游离酸含量的变化;采用重铬酸钾比色法测定醋醅的乙醇含量[18];采用DNS法测定醋醅的还原糖和淀粉含量[17]。醋醅淀粉含量的测定:在10.00 g醋醅中加入100 mL蒸馏水,煮沸2 h使淀粉充分糊化,取出冷却至60 ℃,加入0.1 g α-淀粉溶液(40 U/g原料),60 ℃水浴30 min至完全液化(碘液不显蓝色)。加热煮沸,冷却后定容至250 mL,过滤,取滤液50 mL,加入10 mL 6 mol/mL盐酸,水解1 h。用NaOH中和过量的盐酸并定容至100 mL,过滤,取滤液用DNS法测定还原糖含量。
2 结果与讨论
2.1 高产生料淀粉酶菌株的筛选分离
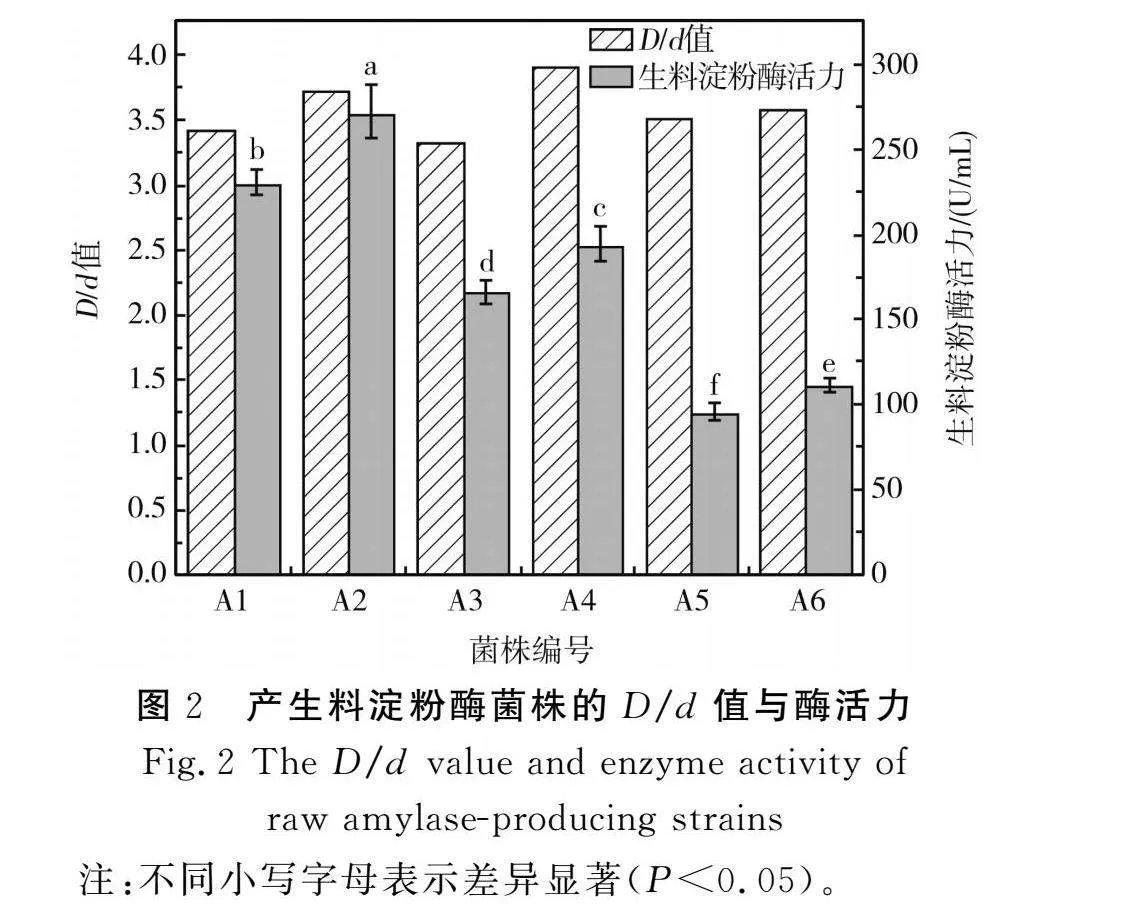
通过富集培养、梯度稀释和平板涂布对水解生料淀粉酶菌株进行富集、培养和筛选,利用平皿生化反应-淀粉酶水解圈试验[15]对其进行功能鉴别。从四川麸醋醋醅中筛选出6株产生料淀粉酶能力较高的菌株,由图2可知,变色圈直径(D)与菌落直径(d)的比值(D/d值)均大于3.0,其中菌株A4的D/d值最大,为3.9,其次为A2。D/d值只能初步定性说明菌株产生料淀粉酶的能力,不能定量反映各菌株产生料淀粉酶的能力,因此对初筛的6株菌株进行摇瓶发酵试验,采用DNS法测定菌株水解生料淀粉酶活力,筛选出产酶能力最佳的菌株。
淀粉酶是微生物细胞分泌的胞外酶,因此测定发酵液中淀粉酶活力即可判断菌株的产酶能力。6株初筛获得的菌株在发酵培养基中37 ℃培养2 d后,各发酵液均有生料淀粉酶活力。其中,A2菌株的产酶能力最大,酶活力为(272.9±15.8) U/mL,其次是1号菌株,酶活力为(230.8±7.28) U/mL,二者酶活力差异均达到显著水平(P<0.05),因此将A2菌株作为后续试验研究的目的菌株。
2.2 高产生料淀粉酶菌株的鉴定
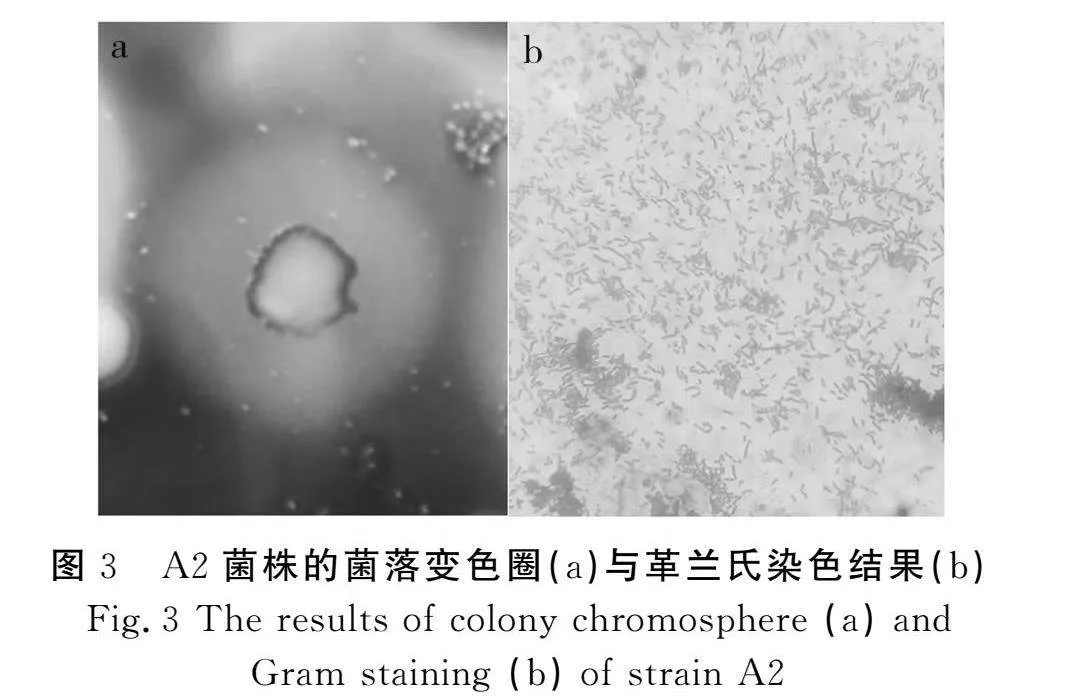
对A2菌株进行形态观察和革兰氏染色(见图3)发现,该菌株为好氧型革兰氏阳性(G+,蓝紫色)杆状细菌,在BPA平板上的菌落呈白色凸起的圆形形态,不透明,边缘光滑,表面光滑且湿润,容易挑取且有不悦的气味。
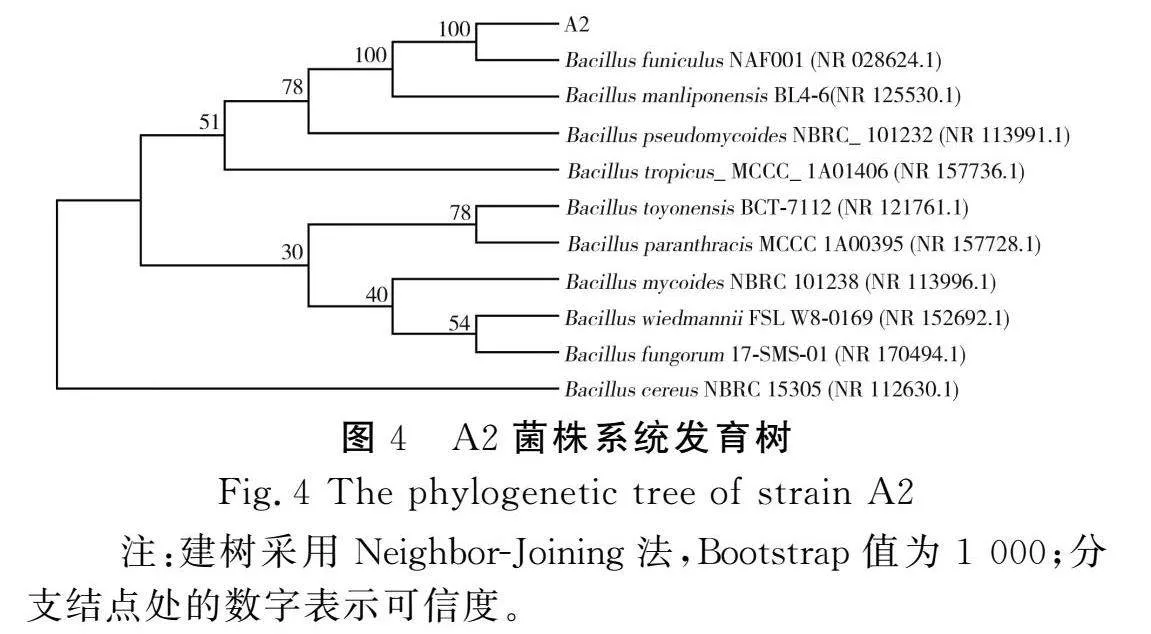
将测序结果(16S rDNA序列)与NCBI数据库中的BLAST工具进行同源性对比分析,选择相似度>98%的10株菌进行多重比较,构建系统发育树,见图4。
由图4可知,A2菌株与Bacillus funiculus NAF001菌株有99%的同源性,结合菌株初步鉴定结果确定A2菌株为Bacillus funiculus,命名为Bacillus funiculus A2。
2.3 Bacillus funiculus A2菌株的发酵特性分析
2.3.1 Bacillus funiculus A2的生长特性
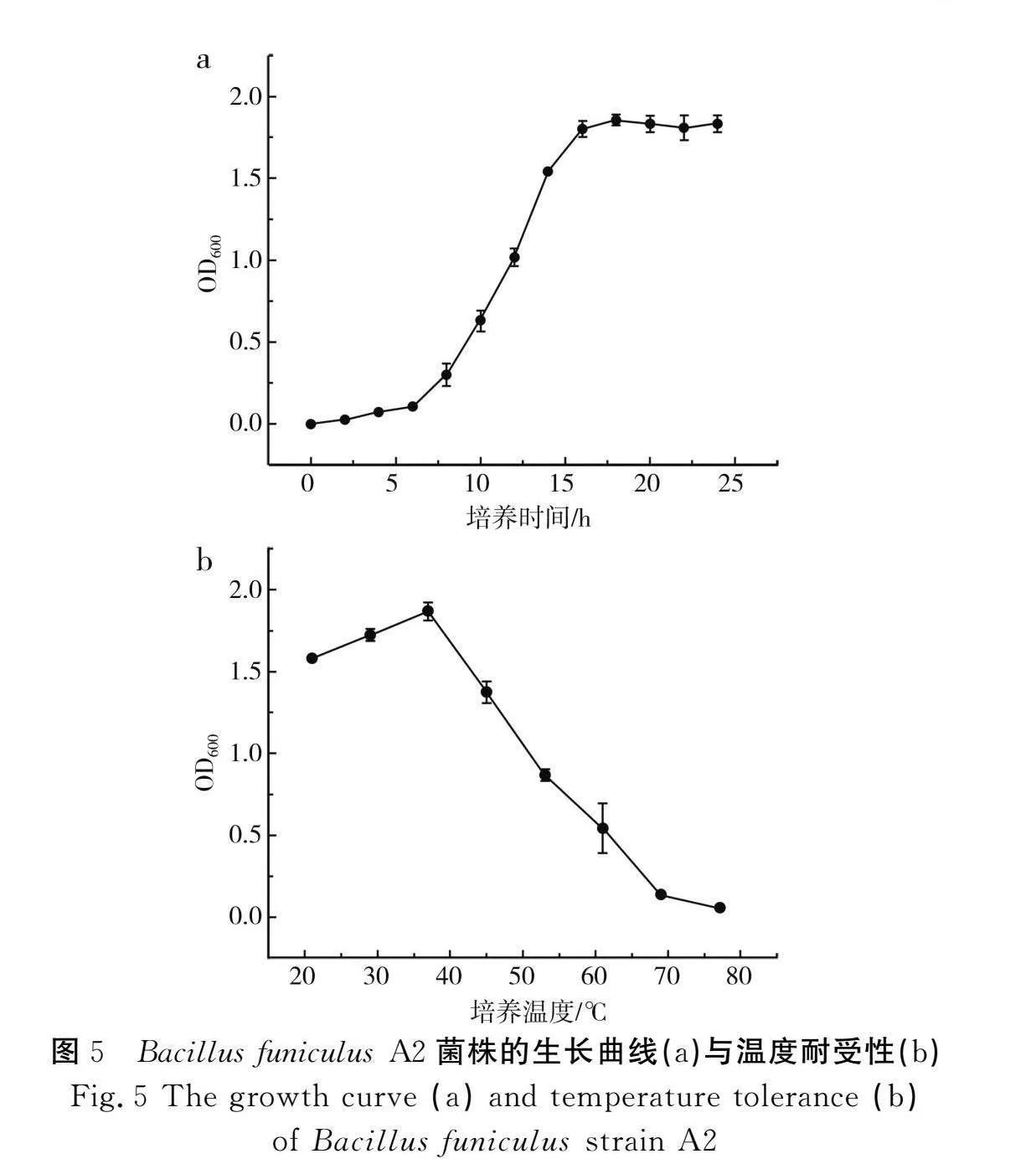
对菌株的生长特性进行分析有利于在试验过程中控制菌株的菌龄,保证接种菌株的活性。由图5中a可知,绳索状芽孢杆菌A2(Bacillus funiculus A2)的生长在接种后6 h处于延滞期,此时菌株生长缓慢,原因可能是菌株对新环境的调整适应过程;在6~16 h时菌株生长进入对数期,OD600值开始明显增长,且增长速度较快;之后菌株生长浊度波动较平稳,说明菌株开始进入平稳期。由于对数生长期的细菌形态相对稳定、生物活性高且繁殖能力强,因此后续均采用对数生长期的菌体进行接种试验。
2.3.2 Bacillus funiculus A2的温度耐受性
四川麸醋醋醅发酵一般控制在45 ℃以下,探究菌株的温度耐受性对菌株的应用具有指导意义。由图5中b可知,Bacillus funiculus A2在21~45 ℃生长能力较强,菌株的OD600值均大于1.0,37 ℃为该菌株的最适生长温度,最高耐受温度可达到69 ℃,这与大多数报道的解淀粉芽孢杆菌情况相似[19]。
2.3.3 Bacillus funiculus A2的乙醇、pH耐受性分析
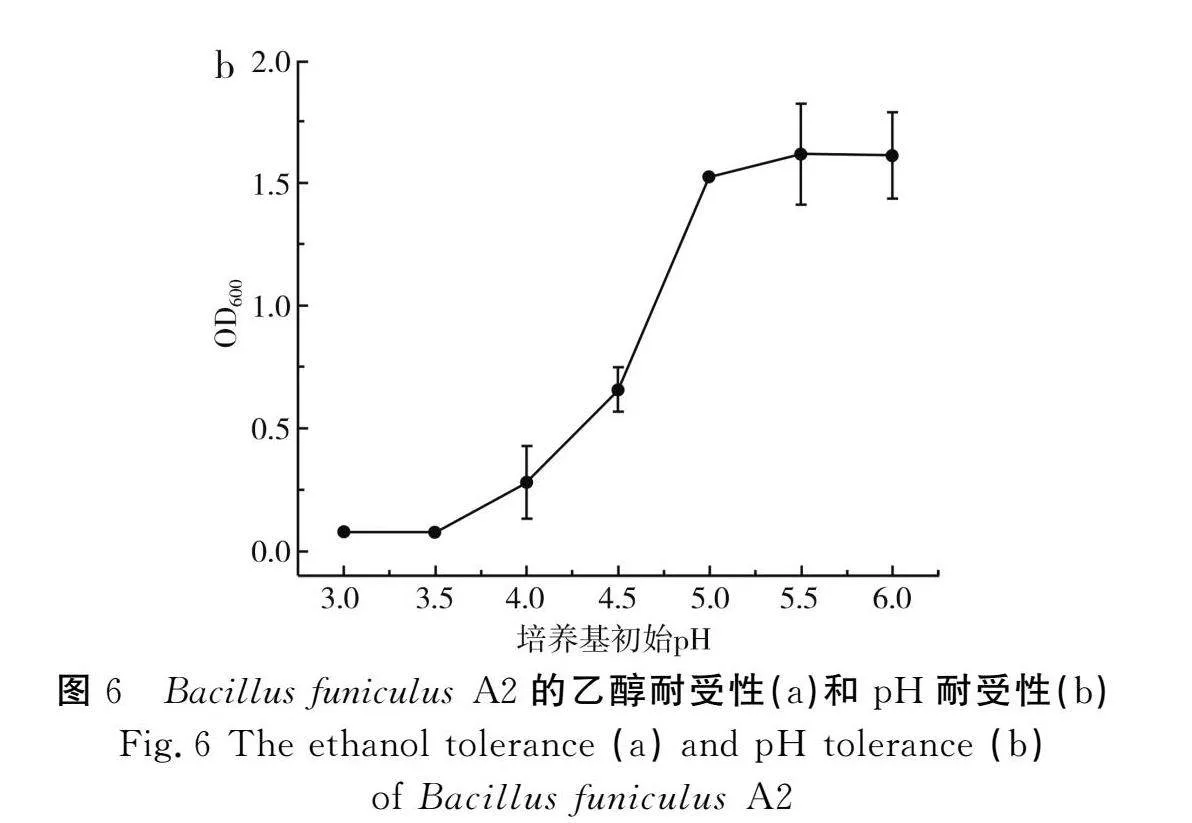
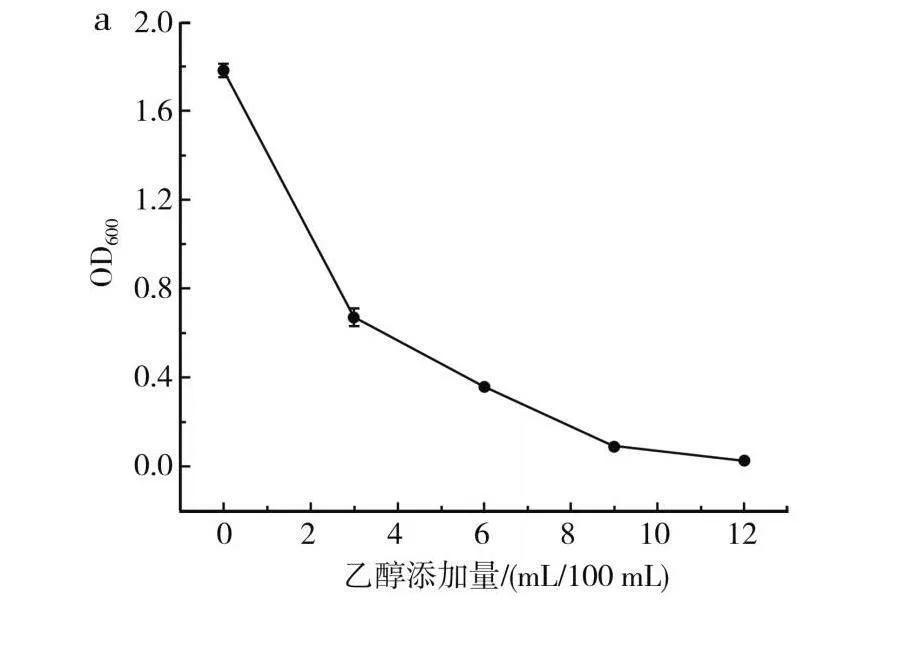
在食醋酿造过程中,醋酸菌以乙醇为底物,氧化形成醋酸,从而形成了食醋的主体呈酸味物质。因此,研究Bacillus funiculus A2菌株的乙醇耐受性、pH(乙酸调节)耐受性,可预判菌株在麸醋酿造过程中的生长情况。由图6中a可知,该菌株能够耐受9 mL/100 mL的乙醇,而为保障食醋酿造过程的正常进行,一般要求乙醇浓度控制在8%以下,传统麸醋因“三边”同时发酵,醋醅中酒精浓度更低(<2%)[20],说明Bacillus funiculus A2菌株具有适应麸醋酿造环境的潜力。由图6中b可知,菌株能够在pH>3.5的条件下生长,具有较强的酸耐受性,能够很好地适应麸醋的发酵生产环境,过高的酸性也会抑制其生长。
2.4 目的菌株对麸醋发酵醋醅理化特性的影响
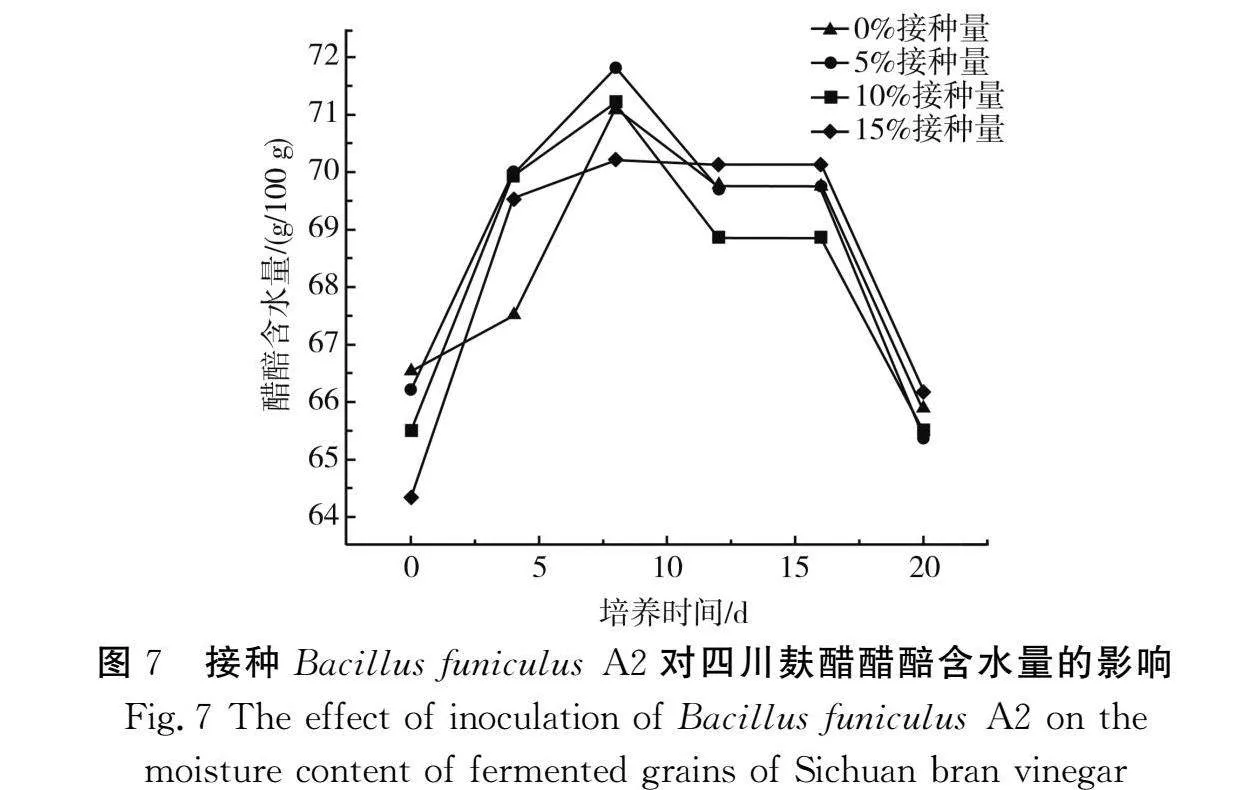
2.4.1 接种Bacillus funiculus A2对四川麸醋醋醅含水量的影响
由图7可知,从整个模拟麸醋酿造过程来看,接种不同浓度的Bacillus funiculus A2对麸醋醋醅水分含量的影响不大,含水量在64.3%~71.8%之间上下波动[21],各阶段的水分含量总体差异不大。在0~8 d各组含水量呈上升趋势,可能是由于发酵初期原料丰富且微生物处于生长旺盛阶段,代谢生成部分水,导致含水量上升。8~20 d含水量逐渐呈下降趋势,醋醅发酵中后期,一方面因为微生物进入次级代谢产物累积阶段,代谢活动减缓;另一方面是醋醅在环境中因蒸发作用造成水分逐渐流失[22]。
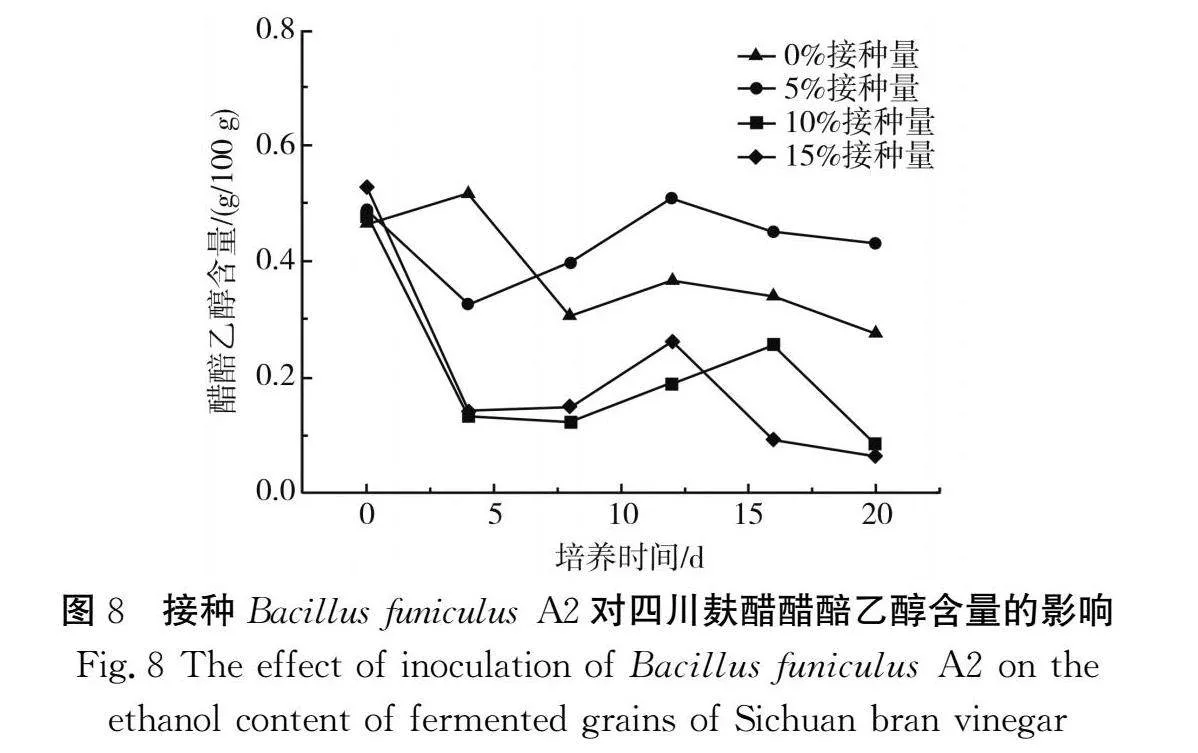
2.4.2 接种Bacillus funiculus A2对四川麸醋醋醅乙醇含量的影响
由图8可知,Bacillus funiculus A2接种量对麸醋醋醅中酒精发酵有显著的影响,具体表现为发酵第4天时5%、10%和15%接种量组乙醇含量下降,这可能是由于产生的酒精在醋酸菌的作用下开始产生醋酸(见图9),且接种量越大,环境中乙醇转化成醋酸越多,所以乙醇含量逐渐下降。对照组(0%接种量组)乙醇含量变化不大,可能是由于环境营养物质充足,酵母利用还原糖产生了酒精[20]。4 d后所有组的乙醇含量均相对稳定,但对照组和5%接种量组乙醇含量明显高于10%和15%接种量组,结合不同接种量的Bacillus funiculus A2对醋醅中乙酸含量的影响(见图9)可知10%和15%接种量组的总酸含量明显高于对照组和5%接种量组,由此可推测随着Bacillus funiculus A2接种量的增加,可能是乙醇氧化成乙酸过程中酸化代谢得到增强,醋醅多边发酵平衡被打破,致使醋醅乙醇含量减少[21]。
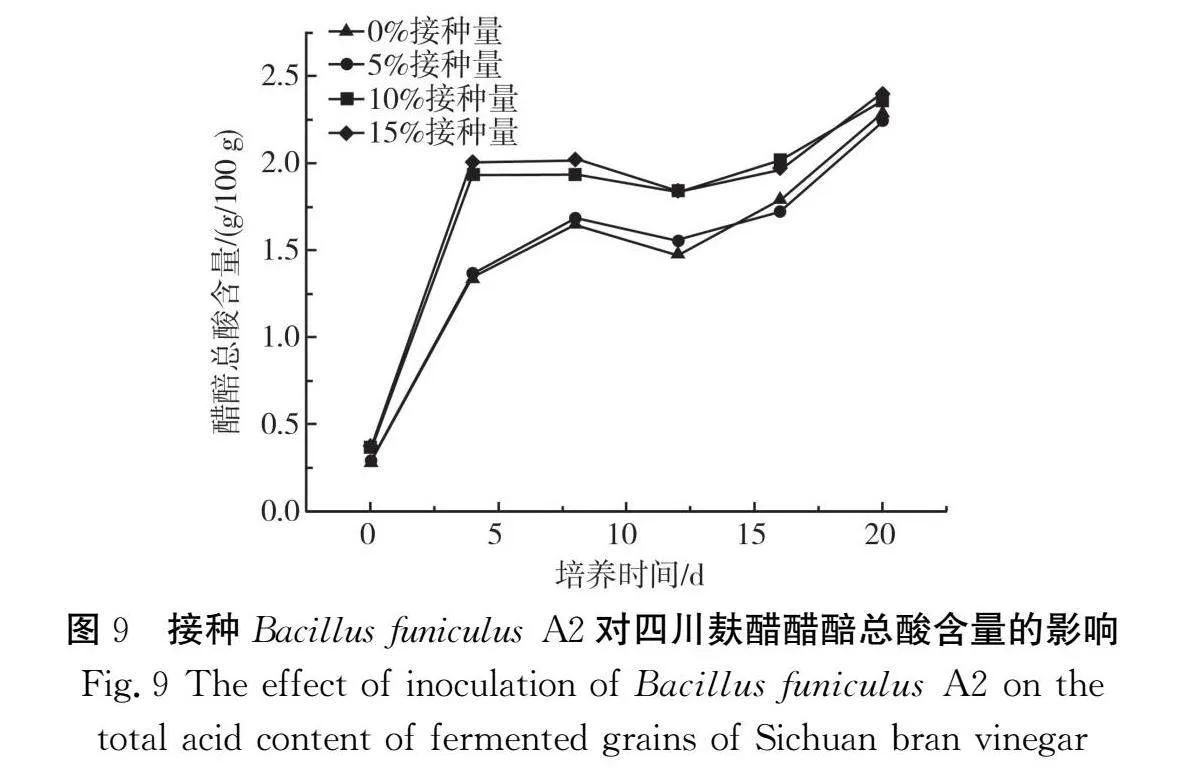
2.4.3 接种Bacillus funiculus A2对四川麸醋醋醅总酸含量和pH的影响
由图9可知,接种Bacillus funiculus A2后,发酵醋醅中总酸含量均呈现上升的趋势,且接种量越大,总酸形成越快。在发酵前4 d各组总酸含量增加较快,且10%和15%接种量组的总酸含量明显大于对照组和5%接种量组,可能是由于发酵前期产酸微生物的生长和代谢活动旺盛,这些微生物适应环境并大量繁殖,不仅将乙醇氧化成乙酸,而且将其他化合物氧化,导致总酸含量迅速增加[23]。同时接种量越大,水解生料淀粉芽孢杆菌降解的淀粉越多,从而可以积累更多的还原糖,而生成的还原糖不断地转化成各种酸性物质。第4天后对照组和5%接种量组总酸含量的增加明显减慢,而10%和15%接种量组总酸含量已达到相对稳定,可能是由于发酵过程中原料的不断利用,环境中积累了大量酸性物质,致使微生物不利于生存在高酸度、低营养的环境中,且接种量越大,环境中的酸性物质积累越多。对照组和5%接种量组在第8天后总酸含量达到相对稳定。发酵第16~20天总酸含量处于上升阶段,可能是由于前期积累的还原糖转化成乙酸。
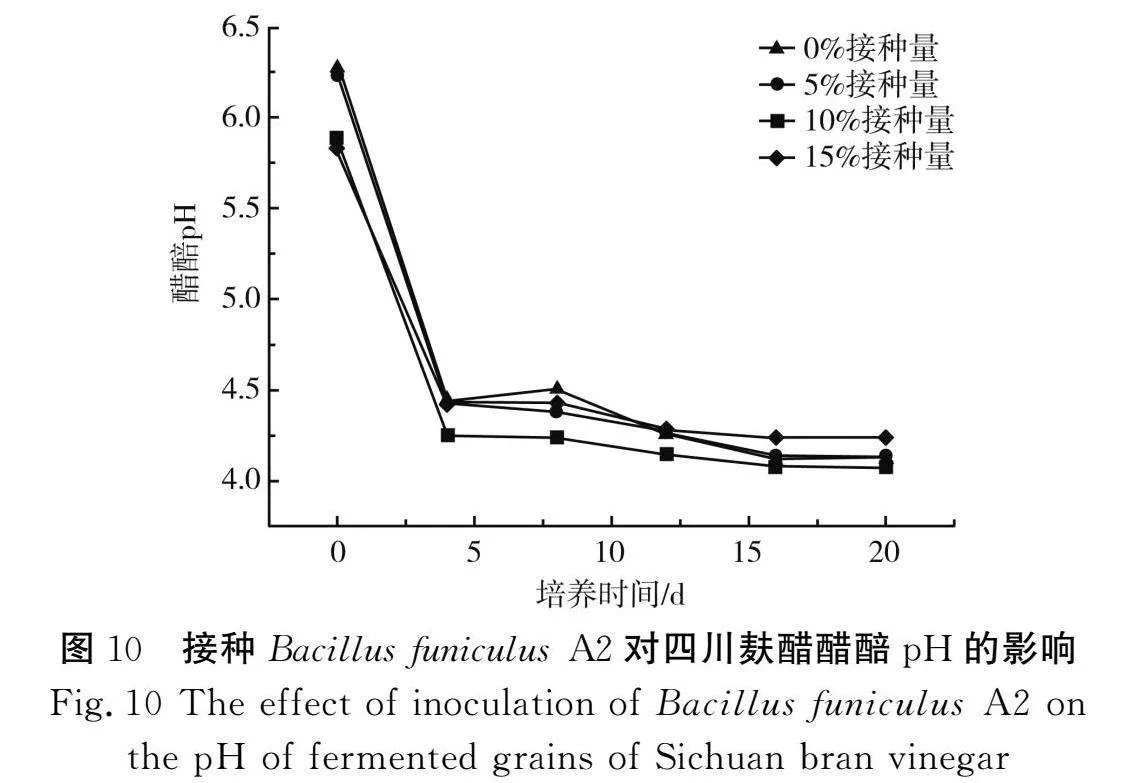
由图10可知,发酵起始时(0 d)醋醅的pH较高,可能是由于此时才加入醋曲,大量的乙醇还未在醋酸菌的作用下转化成乙酸,第4天时醋酸菌利用乙醇产生大量酸性物质,4~20 d pH在4.1~4.5之间波动,说明在发酵过程中四川麸醋形成了一个缓冲体系,使pH始终处于动态平衡中[24]。
2.4.4 接种Bacillus funiculus A2对四川麸醋醋醅还原糖含量的影响
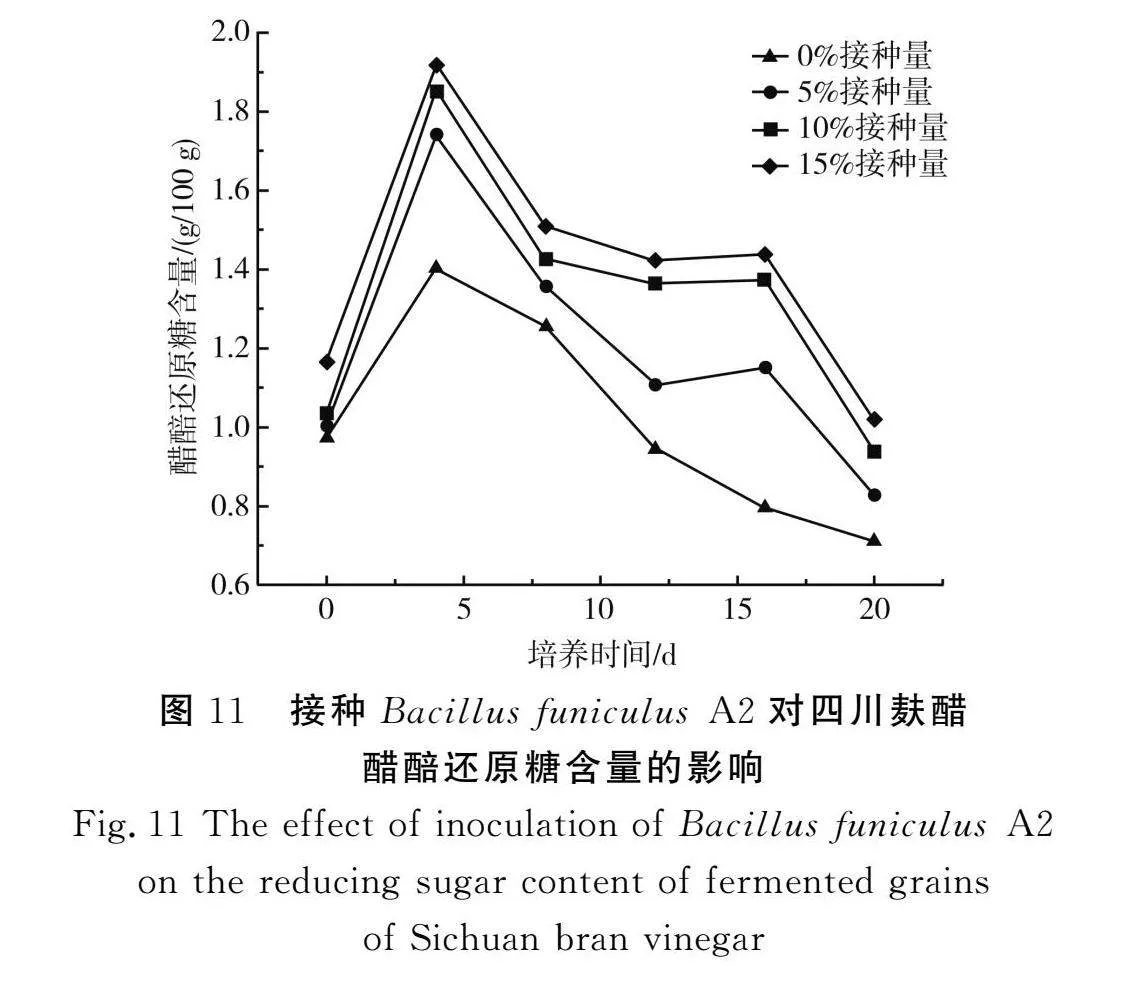
由图11可知,接种Bacillus funiculus A2后,发酵初期(0~4 d),醋醅中还原糖含量增量明显高于对照组,结合醋醅淀粉含量变化结果(见图12)可推测原因是大量的淀粉被降解,及时被微生物利用,导致还原糖含量增加。但随着发酵的持续(4 d后),醋醅中还原糖含量逐渐减少,一方面是醋醅发酵体系中还原糖被转化成乙醇[25],另一方面可能是醋醅发酵末期发酵体系中次级代谢产物累积、酸度增加,微生物代谢、酶活性受到抑制,使得淀粉转化成还原糖的能力减弱。直至发酵结束,醋醅发酵体系中还原糖含量大小仍为15%接种量组>10%接种量组>5%接种量组>对照组,由此可以得出水解生料淀粉芽孢杆菌接种量的增加会促进淀粉的利用,从而生成更多的还原糖。此外,10%接种量组和15%接种量组还原糖含量接近,表明继续增加Bacillus funiculus A2的接种量对麸醋发酵体系淀粉水解的贡献度不大,另外,增加该菌株的接种量还会增加菌株本身不悦气味的风险。
2.4.5 接种Bacillus funiculus A2对四川麸醋醋醅淀粉含量的影响
由图12可知,在麸醋醋醅发酵过程中接种Bacillus funiculus A2后,体系各阶段的残余淀粉含量均低于对照组,且菌株接种量越大,残余淀粉含量越少。醋醅发酵20 d后,各组淀粉含量相较于0 d时均下降了31.68%以上,15%接种量组相较于对照组淀粉利用率提高了近23.78%。但各组的总酸和pH变化较接近,原因可能是Bacillus funiculus A2接种量增加,淀粉水解后的营养成分被其他微生物所利用,没有用于酸类物质的增量发酵,或生成了高级有机酸,亦或转化成其他风味物质,有待证明。此外,15%接种量组和10%接种量组醋醅残余淀粉量接近,还原糖含量亦接近,进一步说明了继续增加Bacillus funiculus A2的接种量对提高麸醋发酵体系淀粉利用率的意义不大。
2.5 接种Bacillus funiculus A2对四川麸醋醋醅理化特性影响的聚类分析
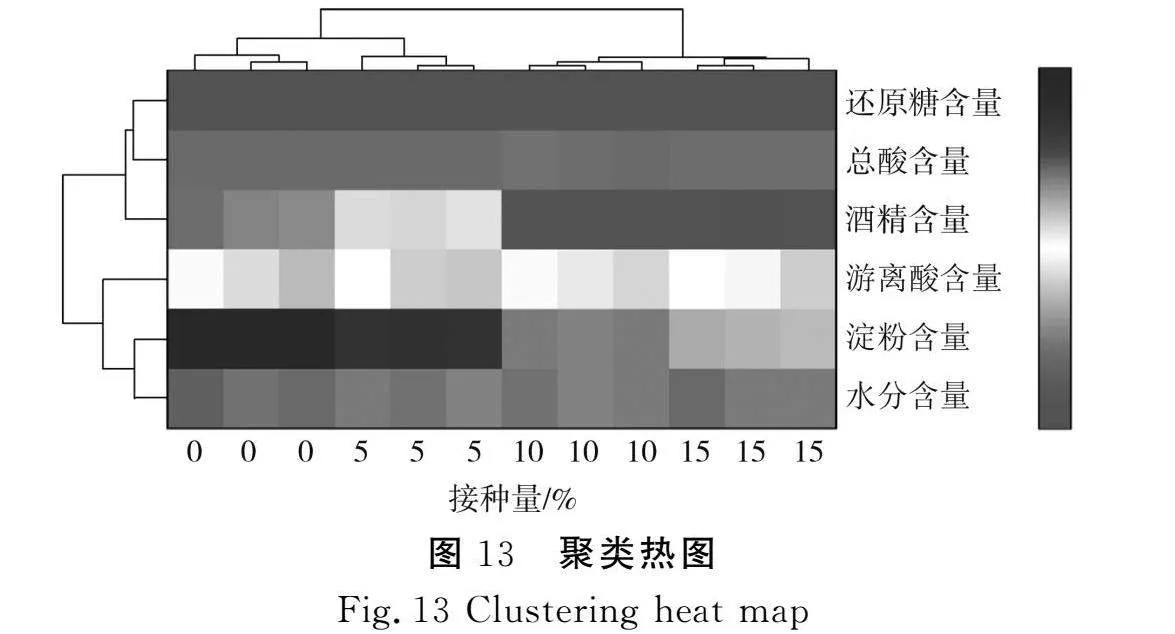
为进一步明确Bacillus funiculus A2菌株对麸醋发酵过程中理化特性的影响,借助Origin软件对发酵结束的醋醅理化结果进行聚类分析,结果见图13。
发酵结束的醋醅样品被分为两大类,对照组与5%接种量组聚在同一分支上,表明二者的理化特性相近,接种5%的Bacillus funiculus A2菌株对麸醋酿造体系理化特性的影响较小,却能提高其淀粉利用率;另外,10%接种量组和15%接种量组聚在同一分支上,说明当Bacillus funiculus A2接种量超过10%后,增加接种量对麸醋酿造体系的理化特性影响不显著。综上所述,接种10%的Bacillus funiculus A2菌株对麸醋发酵提高淀粉利用率有显著作用。
3 结论
Bacillus funiculus A2是一株从高酸性环境——四川麸醋醋醅中分离得到的杆状革兰氏阳性菌(G+),能分泌较高酶活力的生料淀粉酶水解生料淀粉。其生长速度快(16 h达到稳定期),在乙醇含量9%、温度69 ℃、pH 3.5的环境中仍能保持较高的生物活性。接种Bacillus funiculus A2菌株模拟四川麸醋发酵,结果表明该菌株对四川麸醋发酵过程中醋醅水分含量、pH、总酸含量和还原糖含量的影响可以忽略,但增加其接种量能加速麸醋发酵体系中乙醇的氧化,同时提高淀粉的利用率。
参考文献:
[1]王晨霞,杜风光,李根德.淀粉原料生料发酵法生产酒精概述[J].粮食与油脂,2008(6):11-13.
[2]朱强,王瑞鑫,吴铖迪,等.黑曲霉SP7-2固态发酵产生淀粉糖化酶工艺优化[J].食品与发酵工业,2019,45(8):98-102.
[3]郭浩男,张莉力,冯琳琳,等.结合淀粉活性乳酸菌利用生淀粉产酶条件及代谢产物[J].食品科学,2020,41(24):46-53.
[4]高永生,朱丽云,朱贵州,等.枯草芽孢杆菌产酶规律及酶学性质研究[J].安徽农业科学,2011,39(19):11964-11965,11968.
[5]MAALEJ H,HMIDET N,GHORBEL-BELLAAJ O,et al. Purification and biochemical characterization of a detergent stable α-amylase from Pseudomonas stutzeri AS22[J].Biotechnology and Bioprocess Engineering,2013,18(5):878-887.
[6]LOMTHONG T, SAMAIMAI S, YOKSAN R, et al. High loading degradation of poly(lactide)/thermoplastic starch blend film using mixed-enzymes produced by fed-batch culture of Laceyella sacchari LP175[J].Waste and Biomass Valorization,2022,13(4):1981-1991.
[7]SJOSTROM S L, BAI Y, HUANG M, et al. High-throughput screening for industrial enzyme production hosts by droplet microfluidics[J].Lab on a Chip,2014,14(4):806-813.
[8]SIDAR A, VOSHOL G P, VIJGENBOOM E, et al. Novel design of an α-amylase with an N-terminal CBM20 in Aspergillus niger improves binding and processing of a broad range of starches[J].Moleceles,2023,28(13):5033.
[9]CRIPWELL R A, ROSE S H, VILJOEN-BLOOM M, et al.Improved raw starch amylase production by Saccharomyces cerevisiae using codon optimisation strategies[J].FEMS Yeast Research,2019,19(2):127.
[10]宋伟艳,佟毅,李义,等.N-糖基化改造提高Aspergillus fumigatus生淀粉糖化酶的催化效率[J].食品与发酵工业,2023,49(19):1-6.
[11]邴孝凤,何玉,张学成,等.生淀粉水解α-淀粉酶AmyZ1热稳定性提升的分子改造[J].生物学杂志,2023,40(3):35-40.
[12]ZENG J, GUO J J, TU Y K, et al.Functional study of C-terminal domain of the thermoacidophilic raw starch-hydrolyzing α-amylase Gt-amy[J].Food Science and Biotechnology,2020,29(3):409-418.
[13]李幼筠.四川麸醋剖析[J].中国酿造,1990(2):8-12.
[14]周楠,黄钧,周荣清,等.生物强化和中间代谢物扰动对四川麸醋微生物群落结构及代谢组分的影响[J].食品与发酵工业,2022,48(24):211-219.
[15]段绪果,周素雅,沈镇炎,等.一株产生淀粉酶杆菌Bacillus sp. GEL-0的筛选、鉴定及发酵条件优化[J].微生物学通报,2018,45(6):1180-1189.
[16]周荣清.四川麸醋生产工艺的特点及发展趋势[J].四川食品与发酵,2000(3):24-28.
[17]孙玲玉,路兴花,成纪予,等.甘薯中淀粉测定方法的比较与优化[J].中国粮油学报,2023,38(7):199-204.
[18]于华,唐姣,赵佳丽,等.四川麸醋发酵过程中醋醅理化指标及有机酸变化分析[J].中国酿造,2020,39(7):51-55.
[19]杨力权,杨国保,桑鹏,等.一株高温酸性淀粉酶产生菌的筛选、鉴定及其酶学性质研究[J].中国食品添加剂,2019,30(2):98-103.
[20]张奶英,刘书亮,杨勇,等.四川麸醋发酵过程中理化指标与微生物菌相的动态分析[J].食品工业科技,2014,35(11):174-178.
[21]衡小成,毛祥,黄丹,等.川南麸醋入池发酵过程中理化指标变化规律研究[J].中国调味品,2020,45(2):72-75,84.
[22]郑宇,程程,刘静,等.中国传统固态发酵食醋主要特征风味物质组成分析[J].中国食品学报,2020,20(8):237-247.
[23]刘廷锐.四川麸醋关键风味物质及其与酿造微生物的相关性研究[D].成都:西华大学,2021.
[24]谢晓林.中国传统食醋主要风味物质组成及其差异性分析[D].天津:天津科技大学,2021.
[25]张天震.山西老陈醋微生物酿造机理及四大名醋指纹图谱差异性研究[D].太原:山西农业大学,2020.

