一氧化氮释放壳聚糖复合水凝胶的制备及其抗菌性能评估








摘 要: 为了获得能够抵御细菌感染的伤口敷料,将原儿茶醛(PA)和氯化铁配位形成PA/铁离子螯合物(PA/Fe),并通过希夫碱反应与羧甲基壳聚糖(CMCS)交联形成水凝胶,在水凝胶中负载一氧化氮(NO)供体分子N,N′-二仲丁基-N,N′-二亚硝基-1,4-苯二胺(BNN6),得到BNN6@CMCS-PA/Fe复合水凝胶;对BNN6@CMCS-PA/Fe的结构和性能进行表征,评估其生物安全性及体外抗菌性能。结果表明:该水凝胶具有优良的力学性能和高溶胀率(1169%),能够黏附于多种材料表面,并具有自愈合能力和生物相容性;在405 nm光照下,水凝胶中的BNN6分解释放NO的速率达到了7.2 μmol/(L·h),并且水凝胶在808 nm光照下表现出光热效应,10 min平均升温36.5 ℃;该水凝胶对金黄色葡萄球菌和大肠杆菌的生长表现出了显著的抑制效果,其中通过NO对细菌的抑菌率均超过93%,通过光热效应的抑菌率均超过99%。该研究为气体释放敷料应用于促进细菌感染伤口的愈合提供了理论依据。
关键词: 原儿茶醛;壳聚糖;水凝胶;一氧化氮;光热效应;抗菌
中图分类号: TB381
文献标志码: A
文章编号: 1673-3851 (2024)11-0753-11
引文格式:谢冉,李彬. 一氧化氮释放壳聚糖复合水凝胶的制备及其抗菌性能评估[J]. 浙江理工大学学报(自然科学),2024,51(6):753-763.
Reference Format:" XIE" Ran,LI" Bin. Preparation of a nitric oxide-releasing chitosan-based composite hydrogel and assessment of its antimicrobial properties[J]. Journal of Zhejiang Sci-Tech University,2024,51(6):753-763.
Preparation of a nitric oxide-releasing chitosan-based composite hydrogel and assessment of its antimicrobial properties
XIE Ran, LI Bin
(School of Materials Science amp; Engineering, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract:" To obtain a wound dressing resistant to bacterial infection, protocatechualdehyde (PA) and iron chloride were coordinated to form iron PA/ferric ion chelate (PA/Fe). Then PA/Fe was crosslinked with carboxymethyl chitosan (CMCS) by Schiff base to form a hydrogel, which was subsequently loaded with a nitric oxide (NO) donor N,N′-di-sec-butyl-N,N′-dinitroso-1,4-phenylenediamine (BNN6) to obtain a BNN6@CMCS-PA/Fe composite hydrogel. The structure and properties of the BNN6@CMCS-PA/Fe composite hydrogel were characterized, and its biosafety and in vitro antibacterial performance were analyzed. The results showed that the hydrogel had excellent mechanical properties, a high swelling ratio (1169%), adhesion to various materials, self-healing ability and excellent biocompatibility. Under 405 nm light irradiation, the rate of NO release from BNN6 in the hydrogel reached 7.2 μmol/(L·h), and the hydrogel exhibited photothermal effect under 808 nm light irradiation, with an average temperature increase of 36.5 ℃ in 10 minutes. At the same time, the hydrogel showed significant inhibitory effects on the growth of Staphylococcus aureus and Escherichia coli, with antibacterial rates exceeding 93% for bacteria inhibited by NO and over 99% for bacteria inhibited by photothermal effects. To sum up, this study provides theoretical basis for the application of gas-releasing dressing in promoting the healing of bacterial infected wounds.
Key words: protocatechualdehyde; chitosan; hydrogel; nitric oxide; photothermal effect; antibacterial
0 引 言
皮肤是人体最外层的屏障,在抵抗微生物入侵、参与免疫反应、调节体温和代谢过程中发挥着重要作用。一旦皮肤受损,外来病原体就会趁机入侵,可能导致难以愈合的慢性伤口产生。伤口敷料能够降低创面与外界细菌的接触率、有效清除创面的细菌,是促进伤口愈合的有效手段[1-3]。然而,目前临床上使用的纱布、绷带等伤口敷料吸水性较差、需要频繁更换,而且难以完全覆盖伤口表面、抗菌性能弱,容易造成伤口感染[4]。此外,抗生素滥用导致耐药细菌的产生,使得传统抗生素治疗逐渐失效[5]。因此,新型伤口敷料需要同时兼顾吸水性、形状适应性和抗菌性能。
水凝胶是一种新型伤口敷料,具有出色的吸水性和保湿性,可以为伤口愈合提供适宜的环境。动态交联网络水凝胶是通过可逆的化学键交联而成的一类水凝胶,它可以在一定的外界刺激下改变物理状态,具有可注射性和自愈性等特性,能够应对复杂的伤口形状和环境,因此近年来受到了更为广泛的关注[6]。氨基和醛、酮之间发生的可逆希夫碱反应常用于构建具有形状适应性和自愈合能力的动态交联网络水凝胶。壳聚糖是一种由自然界广泛存在的几丁质经过脱乙酰作用得到的天然多糖,其化学结构中含有大量氨基,常用于与醛基反应构建具有良好的生物相容性和高吸水性的可注射水凝胶[7-8]。然而,这类水凝胶的力学强度通常较低,不足以满足伤口愈合的要求。为了增强水凝胶的结构稳定性和力学性能,可以引入第二种交联反应构建双动态交联网络水凝胶。原儿茶醛(Protocatechualdehyde, PA)是一种天然存在的酚醛,具有良好的生物安全性、抗菌和抗氧化性能。一方面,PA的醛基能够与壳聚糖发生希夫碱反应;另一方面,PA的酚羟基还能够与金属离子进行配位,通过双动态交联网络赋予水凝胶更强的稳定性并丰富其功能[9-10]。
水凝胶的抗菌作用可以通过在水凝胶骨架中引入抗菌基团或将抗菌成分负载到水凝胶中实现。PA与Fe3+络合形成的PA/铁离子螯合物(PA/Fe)具有光热效应,能够在近红外光(Near infrared, NIR)光照射下产生热量,从而杀灭抗菌[11-12]。然而,单一抗菌成分往往难以控制混合感染,因此,结合使用不同的抗菌手段可以进一步扩大抗菌谱,增强治疗效果。一氧化氮(Nitric oxide, NO)作为一种人体内源性气体分子,具有广谱抗菌性,且不易引起细菌的耐药性[13-14]。N,N′-二仲丁基-N,N′-二亚硝基-1,4-苯二胺(N,N′-di-sec-butyl-N,N′-dinitroso-1,4-phenylenediamine, BNN6)是一种NO供体,能够在光照或热刺激下释放NO,进一步增强PA/Fe的抗菌效果。同时,NO还具有抗炎,促进细胞增殖和促进血管生成的作用,能够促进伤口愈合[15-17]。
本文利用PA、 Fe3+与羧甲基壳聚糖(Carboxymethyl chitosan, CMCS)之间的席夫碱反应和配位反应构建双动态交联网络水凝胶水凝胶CMCS-PA/Fe(CPF),并将BNN6负载至水凝胶中,得到复合水凝胶BNN6@CMCS-PA/Fe(CPFB)。对CPFB的结构和性能进行表征,并对其吸水性、生物相容性、抗菌性能进行测试。通过综合比较细胞相容性和抑菌率的结果,优化CPFB水凝胶的组成及BNN6负载量,以期能够通过光热和NO释放实现抗菌效果,为其在促进伤口愈合方面的应用提供理论支撑。
1 实验部分
1.1 实验材料
CMCS购自上海麦克林生化科技有限公司,PA、六水合氯化铁(FeCl3·6H2O)、N,N′-二仲丁基-1,4苯二胺(N,N′-Di-sec-butyl-1,4-phenylenediamine, BPA)、氢氧化钠(Sodium hydroxide, NaOH)、亚硝酸钠(Sodium nitrite, NaNO2)、盐酸(hydrogen chloride, HCl)、二甲基亚砜(Dimethyl sulfoxide, DMSO)、Pluronic F127和无水乙醇购自阿拉丁试剂公司,一氧化氮检测试剂盒(Griess试剂盒)购自上海碧云天生物科技股份有限公司,噻唑蓝溴化四唑(Thiazolyl Blue Tetrazolium Bromide, MTT)、DMEM(Dulbecco′s Modified Eagle Medium)培养基、磷酸盐缓冲溶液(Phosphate buffer saline, PBS)和脱纤维兔血购自上海源叶生物科技有限公司。
1.2 实验方法
1.2.1 PA/Fe的合成
根据Li等[18]报道的方法合成PA/Fe螯合物。将PA(1.45 g)溶解在80℃的去离子水中,并与FeCl3溶液(0.1 mol/L)以3∶1的摩尔比混合,用NaOH溶液(10.0 mol/L)将溶液的pH值调至10.0,室温搅拌3 h后得到PA/Fe螯合物。
1.2.2 CPF的制备
将CMCS配置成质量分数为12%的水溶液。将1 mL CMCS溶液分别与20、40 μL和60 μL PA/Fe溶液混匀并静置,得到CPF20、CPF40和CPF60水凝胶。
1.2.3 BNN6的合成
向2.34 mL BPA 中加入18.00 mL无水乙醇,在氮气保护下加入20.00 mL NaNO2水溶液(6.0 mol/L)并搅拌30 min。缓慢滴加20 mL HCl水溶液(6.0 mol/L),随后继续搅拌4 h后,离心收集沉淀,用体积分数50%的乙醇/水混合物和水分别洗涤3次,冷冻干燥得到固体粉末。
1.2.4 CPFB的制备
参照Sun等[19]报道的方法,利用F127包裹BNN6形成胶束,以提高BNN6在水中的分散性。将10 mg BNN6和40 mg Pluronic F127超声溶解于1 mL无水乙醇中,旋蒸得到F127-BNN6复合物薄膜。加入2 mL去离子水并超声分散,通过0.45 μm滤膜过滤得到F127-BNN6胶束,将200 μL胶束分散液(其中含有BNN6的质量浓度为1 mg/mL)与800 μL CPF40前驱体溶液混合形成水凝胶。
1.3 测试与表征
1.3.1 BNN6和水凝胶基本性能测试
用紫外分光光度计(TU-1901,北京普析通用仪器有限责任公司)测定BNN6的紫外可见吸收光谱;用核磁共振波谱仪(AVANCE AV400MHz,瑞士布鲁克公司)测定BNN6的核磁氢谱;用拉曼光谱仪(XploRA Nano,日本HORIBA科学仪器事业部)测定BNN6的拉曼光谱;用红外光谱仪(IRTracer 100,日本岛津仪器有限公司)测试水凝胶的红外光谱;用扫描电镜(Sigma300,德国蔡司光学有限公司)观察和记录水凝胶的微观形貌。
1.3.2 水凝胶的压缩和拉伸性能测试
将制备好的CPF水凝胶(直径10 mm,高8 mm)在万能材料试验机(Instron 5943,美国英斯特朗公司)上以5 min/mm的速率压缩,应变范围为0~80%,记录应力-应变曲线。
用拉伸模具将2 mL水凝胶制备成形,然后用万能材料试验机以10 min/mm的速率拉伸,记录应力-应变曲线。
1.3.3 水凝胶的溶胀测试
将冷冻干燥的水凝胶(冷冻干燥前为1 mL)浸泡在10 mL PBS溶液中,然后放在37 ℃的恒温培养箱中12 h。结束后用滤纸吸去水凝胶表面的水。称量样品的质量,并将其与初始质量进行比较。溶胀率S按式(1)计算:
S/%=T-AA×100(1)
其中:A为水凝胶的初始质量,g;T为水凝胶溶胀平衡后的质量,g。
1.3.4 水凝胶的黏附性能定性测试
将制备好的水凝胶轻轻按压黏附在手掌表面,接触面与地面垂直,观察水凝胶是否滑动或脱落。5 min后揭开水凝胶,观察是否有水凝胶残留在手掌表面。
将水凝胶轻轻按压黏附在食指关节外部,接触面与地面垂直。随后在0°和90°之前反复弯曲手指,观察水凝胶是否开裂、脱落。
用手指将水凝胶分别按压黏附在塑料瓶盖、橡胶塞与玻璃样品瓶表面,抬起手使物体悬空,保持30 s后观察物体是否掉落。
1.3.5 水凝胶的自愈合能力性能
将CPF40水凝胶切成两半,并轻轻贴合,2 h后观察并用手轻轻拉伸水凝胶,确认是否为一个整体。
通过流变仪(MCR52,奥地利安东帕公司)定量评估水凝胶的自愈合性能。在应变1%~1000%的范围内测量水凝胶所能承受的最大临界应变,通过固定角频率(10 rad/s)进行交替扫描试验,其中振幅应变在1%的小应变和高于最大临界应变的大应变之间切换,每次切换的时间间隔为120 s。
1.3.6 水凝胶的血液相容性测试
将兔血以1500 r/min离心5 min得到红细胞,用PBS洗涤3次后配置成质量分数为5%的PBS分散液。将200 μL水凝胶浸出液加入800 μL红细胞分散液中。其中CPFB组光照10 min,在37 ℃下振荡孵育1 h;去离子水组和PBS溶液组分别作为阳性对照和阴性对照。孵育后,将混合物以1500 r/min离心10 min,上清液用酶标仪(LM-MK3,美国赛默飞世尔科技公司)测定540 nm处的吸光度,溶血率H的计算参考式(2):
H/%=S-PW-P×100(2)
其中:S为实验组的吸光度值;W为阳性对照组的吸光度值;P为阴性对照组的吸光度值。
1.3.7 BNN6的稳定性测试
通过紫外分光光度计测试F127-BNN6胶束的紫外可见吸收光谱,随后将溶液在室温避光静置7 d,再测定一次紫外可见吸收光谱进行对比。用405 nm LED灯照射(100 mW/cm2)静置7 d后的F127-BNN6胶束,用Griess试剂测定NO释放量,并与新配置的F127-BNN6胶束的NO释放量进行对比。Griess试剂法的简要步骤如下:将50 μL Griess 试剂I、50 μL Griess 试剂II和50 μL待测溶液混合与96孔板中,通过酶标仪测量540 nm处的吸光度,用相同方法测试NO标准溶液的标准曲线,根据标准曲线和样品的吸光度计算得到样品中的NO浓度。
1.3.8 水凝胶的NO释放
采用Griess试剂法测定NO的释放量。将制备好的1 mL水凝胶(CPF和CPFB)分别浸泡在3 mL PBS溶液中,并与Griess试剂混合均匀。其中CPFB光照组用405 nm LED灯(100 mW/cm2)照射,每光照10 min后用酶标仪测量溶液在540 nm处的吸光度值。另外,CPFB(黑暗)组全程避光,CPFB(37℃)组放置于37℃恒温箱中避光,每10 min测量一次540 nm处的吸光度值,最后通过标准曲线计算出NO释放速率。
1.3.9 水凝胶浸出液NO的释放
将冷冻干燥后的水凝胶在60℃下灭菌1 h,转移至20 mL DMEM培养基中浸泡24 h。取1 mL浸出液置于6孔板中,并与Griess试剂混合均匀,每光照10 min后用酶标仪测量540 nm处的吸光度值,通过NO标准曲线计算出NO释放速率。
1.3.10 水凝胶的细胞毒性测试
采用浸出液的方式对水凝胶的细胞毒性进行测试。将冷冻干燥后的水凝胶在60℃下灭菌1 h,转移至20 mL DMEM培养基中浸泡24 h。将小鼠成纤维细胞(L929细胞)接种于96孔板中,培养24 h后将DMEM培养基更换为水凝胶浸出液,其中1组用405 nm LED灯(100 mW/cm2)光照10 min。分别培养1 d和3 d后,用MTT法测试细胞相容性。MTT法的简要步骤如下:在96孔板内将材料与细胞共培养24 h。弃去旧培养基,每个孔腔加入100 μL PBS静置1 min后弃去,重新加入100 μL完全培养基,随后在避光条件下每孔加入20 μL浓度为5 mg/mL的MTT水溶液,继续转移至二氧化碳培养箱中培养4 h。取出96孔细胞培养板,弃去所有溶液,每孔加入150 μL DMSO后避光置于摇床上以150 r/min摇晃15 min,随后使用酶标仪检测96孔细胞培养板在波长为490 nm和570 nm处的吸光度。每孔的细胞毒性V计算参考式(3):
V/%=S-BC-B×100(3)
其中:B为培养基加入MTT溶液后的吸光度值;C为空白组细胞加入MTT溶液后的吸光度值;S为实验组加入MTT溶液后的吸光度值。
1.3.11 水凝胶的光热性能测试
在波长为808 nm、功率密度分别为0.4、0.6、0.8 W/cm2和1.0 W/cm2的近红外激光照射下,用热成像仪记录10 min内去离子水、CMCS、CPF和CPFB温度随时间变化曲线。为了评估水凝胶的光热稳定性,使用0.8 W/cm2近红外激光对水凝胶CPF表面照射10 min并记录温度变化,停止光照后继续记录温度10 min,重复此过程3次。
1.3.12 水凝胶的抗菌实验
采用平板菌落计数法来评价水凝胶的抑菌效果。将20 μL 含菌菌落数为105个/mL的菌液加入到3 mL LB培养基溶液中,并与1 mL灭菌后的CPFB水凝胶共孵育(CMCS组和CPF组加入等当量的材料),在37℃恒温培养箱中以200 r/min震荡孵育6 h。其中CPFB光照组用405 nm LED灯(100 mW/cm2)照射30 min,CPFB光热组用808 nm激光(0.8 W/cm2)照射10 min。孵育后,将菌液用PBS溶液稀释105倍,用移液枪吸取100 μL稀释液均匀涂布在琼脂板上,37℃孵育12 h,记录琼脂板上的菌落数量。
2 结果与讨论
2.1 材料的结构与性能表征
图1为BNN6的基本性质表征BNN6的核磁氢谱图、PA和PA/Fe的紫外可见吸收光谱和拉曼光谱图。从图1(a)中BNN6的核磁氢谱图可知,氢的化学位移及峰面积的比值与Fan等[13]报道的一致,证明了BNN6的成功合成。图1(b)为PA和PA/Fe的紫外可见吸收光谱,图1(b)表明:相比于PA,PA/Fe在450 nm附近出现了一个新的吸收峰,说明PA和Fe3+之间形成了配位键。PA和PA/Fe的拉曼光谱如图1(c)所示,从图中可以观察到,相比于PA,PA/Fe在470~670 cm-1和1200~1500 cm-1出现了配位键的特征峰[20],进一步证明了PA/Fe螯合物的形成。
图2为制备的双动态键交联水凝胶CPF的形成过程和红外光谱图。从图2(a)可见,CMCS与PA/Fe前驱体溶液混合后即可形成水凝胶。通过比较图2(b)中CMCS、PA/Fe和CPF水凝胶的官能团变化可以观察到,PA的谱图中1639 cm-1处的吸收峰归属于PA的醛基;CPF谱图中1577 cm-1处的吸收峰也证明了CMCS的氨基与PA/Fe的醛基之间形成了希夫碱结构;CPFB谱图中1377 cm-1处的吸收峰则证实了BNN6存在于水凝胶中[21]。
2.2 水凝胶的力学性能、黏附性能和自愈合性能
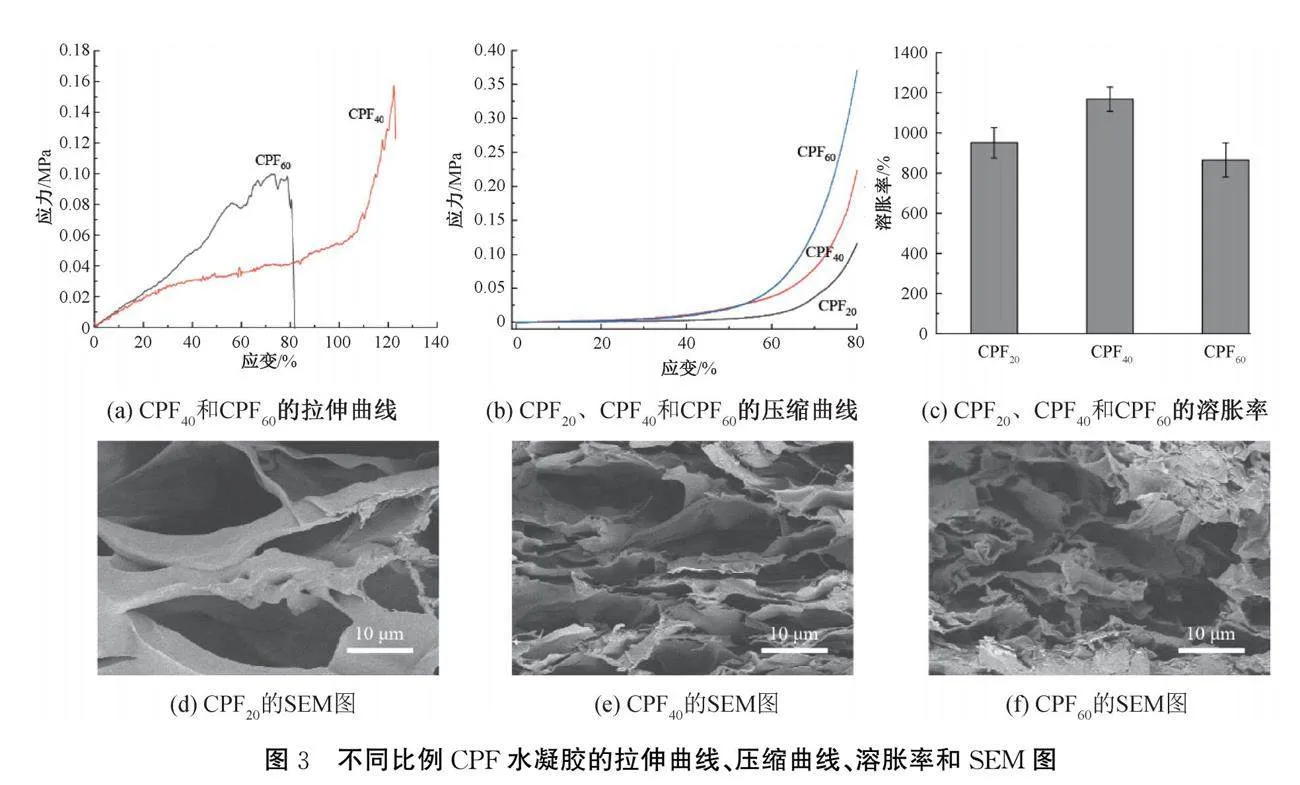
双动态键交联网络能够提高水凝胶的力学性能[22]。图3为PA/Fe在水凝胶的含量对CPF水凝胶力学强度、溶胀性能和微观结构的影响。由图3(a)可知:CPF60相比于CPF40由于PA/Fe含量更高,交联网络更强,水凝胶在相同应变时的拉伸应力增大。CPF40在拉伸应变为122%时,拉伸应力达到最大值0.15 MPa,而CPF60在拉伸应变为79%时,拉伸应力达到最大值0.09 MPa,表明CPF60水凝胶相比于CPF40具有更大的抗压强度,但由于交联密度过大、柔性降低,导致其在拉伸时更容易断裂。水凝胶的压缩测试结果如图3(b)所示,可以发现在0~80%的应变范围内随着PA/Fe含量的增加,水凝胶的压缩应力逐渐增大,其压缩应力从0.11 MPa增加到0.36 MPa。
图3(c)为水凝胶在PBS(pH值7.4)中的溶胀率测试结果。从图中可知,在PBS中浸泡12 h后,CPF20、CPF40、CPF60水凝胶的溶胀率分别达到952%、1169%、866%。由于交联密度较低,CPF20水凝胶的网状结构容易被破坏,溶胀率较低。随着PA/Fe含量的增加,水凝胶的交联网络更加致密,溶胀率也随之增大,因此CPF40的溶胀率更高。但是CPF60水凝胶的溶胀率相较于CPF40更低,可能是由于其交联密度过高,阻碍了溶液的吸收。图3(d)-(f)为不同水凝胶的SEM图,从图中可以观察到水凝胶具有多孔结构,并且随着PA/Fe含量的增加,水凝胶的孔径减小,这与力学性能和溶胀性能测试的结果相符。考虑到CPF40具有最高的溶胀率,且力学强度始终,因此选用CPF40(以下描述为CPF)进行后续实验。
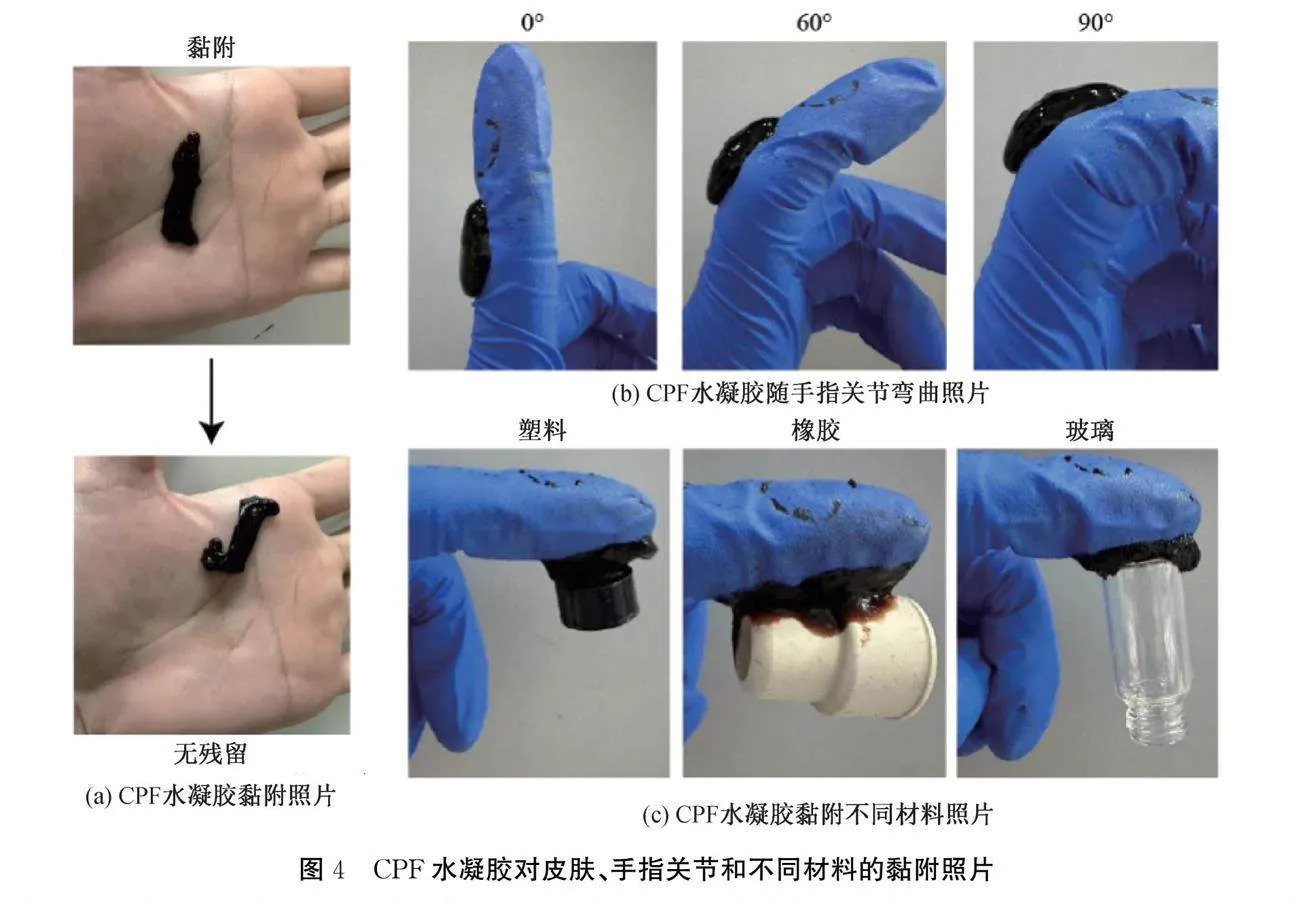
水凝胶需要具有一定的黏附能力以附着在伤口上,因此对其黏附性能进行了定性测试,测试结果如图4所示。从图4(a)可知,CPF水凝胶能够黏附在手上,并且剥离后没有明显的残留。从图4(b)可以观察到水凝胶能够适应不同弯曲程度的手指活动。另外,从图4(c)可以观察到,水凝胶还能够黏附在不同材料(塑料、橡胶和玻璃)表面。CPF水凝胶的黏附性能可能来源于PA中的酚羟基与黏附物之间形成的氢键、静电相互作用和π-π相互作用[23]。以上实验表明CPF水凝胶具有较好的组织黏附性,有利于固定在伤口表面。
动态键交联网络赋予了水凝胶自愈合性能[24-25],CPF水凝胶的表观自愈合实验和流变测试结果如图5所示。从图5(a)可知,CPF水凝胶切成两半后能够自行愈合,2 h后水凝胶表面无裂纹,可以拉伸而不断裂。随后对CPF水凝胶的自愈合性能进行了定量测试,从图5(b)可以观察到,当应变增加到504%时,G′和G″出现交集,这是水凝胶网络崩溃的临界点,表明水凝胶网状结构被破坏,当应变高于504%时,G′急剧下降,因此应用1%和600%应力交替进行的连续交替应变扫描观察水凝胶的自愈合现象。从图5(c)可知,当施加高应变(600%)时,G′的值从879 Pa下降到412 Pa,低于G″(462 Pa),表明凝胶网络受到破坏;当施加低应变(1%)时,G′(519 Pa)大于G″(255 Pa),表明凝胶网络结构恢复了,在经过3次扫描后,G′和G″的大小能够交替变化。以上结果表明CPF水凝胶具有自愈合能力。
2.3 水凝胶的NO释放行为和稳定性
图6为CPFB水凝胶的NO释放速率和稳定性测试。从图6(a)可知,在405 nm光照下,NO释放速率为7.2 μmol/(L·h),而在模拟体温环境(37 ℃)或近红外光照射(808 nm,0.8 W/cm2)下,均没有观察到明显的NO释放现象,说明BNN6在室温和体温下是稳定的。此外,从图6(b)可以计算得出水凝胶浸出液的NO释放速率为4.7 μmol/(L·h),证明BNN6能够缓慢从水凝胶中释放出来,有利于在伤口愈合过程中提高NO的局部浓度。图6(c)为BNN6溶液在室温下保存的稳定性测试,可以观察到,室温避光放置7 d后,F127包裹BNN6胶束分散液仍为无色;在405 nm光照之后,颜色由无色变为红色,表明BNN6仍然能够释放NO。随后测定了NO的释放速率为7.2 μmol/(L·h),与7 d前的溶液相同,表明F127-BNN6具有一定的稳定性,能够在室温、避光环境中保存7 d以上。这些结果表明水凝胶具备稳定释放NO的能力,有利于精确控制NO的浓度用于促进伤口愈合。
2.4 水凝胶的光热效应
PA/Fe具有光热效应,能够吸收近红外光转换成热量,水凝胶的光热性能评估结果见图7。从图7(a)可以观察到,在808 nm激光照射下,CPF水凝胶的温度持续升高,且升温速率与光功率密度正相关。随后,从图7(b)中可以观察到去离子水和CMCS的温度在激光照射下没有明显变化,而CPF和CPFB水凝胶的温度在光照10 min后分别达到了55.6 ℃和57 ℃,表明水凝胶的光热性能来源于PA/Fe。之后进一步研究了水凝胶的光热稳定性,从图7(c)可以观察到,CPF水凝胶在连续3次升降温循环实验中升高的温度没有发生明显变化,均在36.5 ℃左右,表明水凝胶具备良好的光热稳定性。
2.5 水凝胶的生物相容性
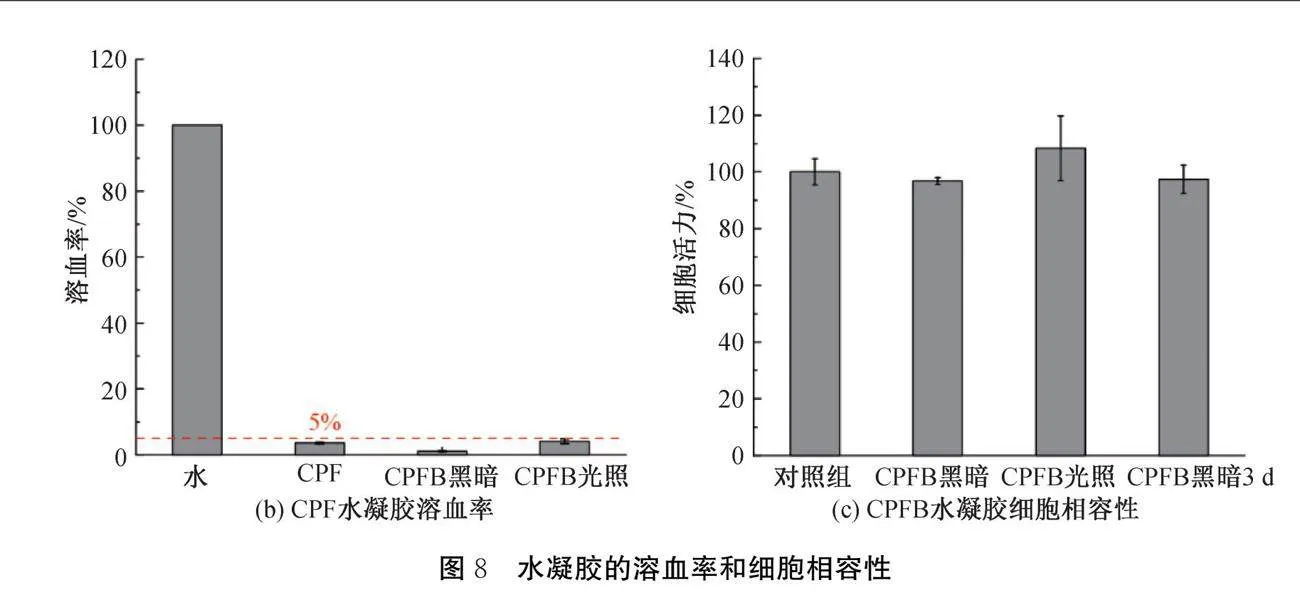
伤口敷料需要与皮肤相互接触,因此CPFB水凝胶的生物相容性至关重要[26]。通过溶血和细胞相容性试验评估了水凝胶的安全性,结果如图8所示。从图8(a)-(b)可以观察到,CPF、CPFB水凝胶在黑暗和405 nm光照下溶血率均低于5%的允许阈值[27],分别为3%、1%和4%,说明水凝胶具有良好的血液相容性。随后又评估了水凝胶浸出液的细胞相容性,从图8(c)可以观察到,L929细胞在与不同方式处理的水凝胶浸出液共孵育后,细胞活性均超过95%,可见CPFB水凝胶具备良好的生物安全性。
2.6 水凝胶的NO与光热抗菌性能
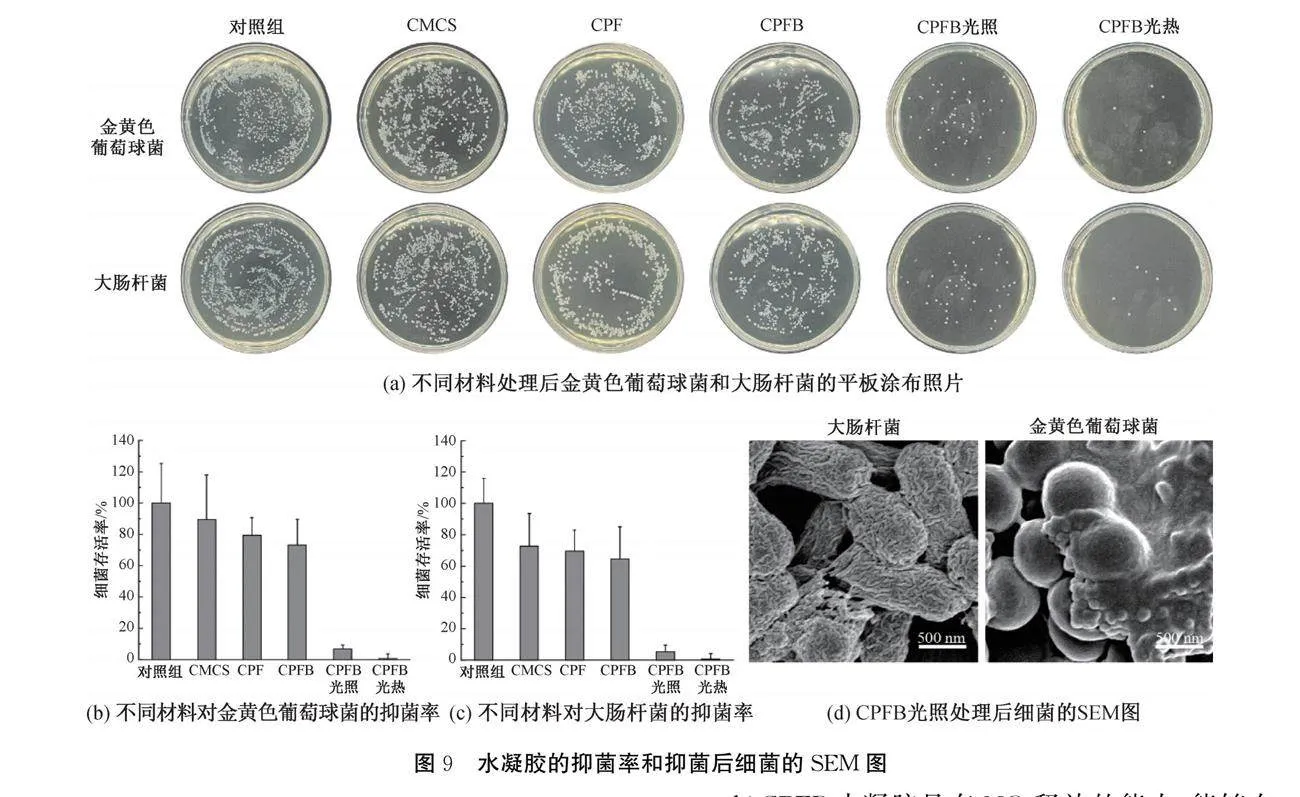
与传统抗生素相比,NO具有广谱抗菌能力,能够通过硝化作用和DNA裂解破坏细菌结构,避免了细菌产生耐药性[28]。因此,选用金黄色葡萄球菌和革兰氏阴性大肠杆菌测试了材料的抗菌性能,结果如图9所示。从图9(a)—(c)中可见,CMCS、CPF和CPFB不光照时金黄色葡萄球菌的存活率分别为89%、79%和73%,大肠杆菌的存活率分别为72%、69%和64%,可见CMCS和PA/Fe都具有一定的抗菌能力。相对而言,CPFB光照和光热处理后金黄色葡萄球菌的存活率分别为7%和1%,大肠杆菌的存活率分别为5%和1%,说明NO和光热均具有显著的的抗菌效果。另外,通过SEM观察CPFB光照处理后细菌的表面形貌,从图9(d)可以观察到,大肠杆菌和金黄色葡萄球菌的表面均出现了褶皱或破裂,说明NO破坏了细菌的膜结构。由此可见,CPFB水凝胶在抗菌和促进伤口愈合方面具有应用潜力。
3 结 论
本文通过将PA/Fe与CMCS复合,成功制备了CMCS-PA/Fe水凝胶,并在其中装载BNN6得到CPFB水凝胶用于NO释放;考察了CPFB的NO释放能力、力学性能、黏附性、自愈合性能、生物安全性及体外抗菌性能,主要结论如下:
a)CPFB水凝胶具有良好的力学性能,在拉伸应变为122%时,拉伸应力达到最大值0.15 MPa;在压缩比80%时应力达到0.22MPa。同时定性观察到水凝胶具有一定的黏附性和自愈合能力,能够抵抗一定的外力,有利于在伤口愈合过程中保持稳定。
b)CPFB水凝胶具有NO释放的能力,能够在405 nm光照下稳定释放NO,NO释放速率为7.2 μmol/(L·h);同时水凝胶在808 nm(0.8 W/cm2)光照下具有较强的光热效应,光照10 min平均升高温度36.5 ℃。
c)CPFB水凝胶具有良好的细胞相容性,溶血率低于5%,且与L929细胞共培养24 h后细胞存活率大于95%。水凝胶主要成分CMCS和PA/Fe均具有一定的抗菌能力,并且能够通过释放NO和光热效应使得金黄色葡萄球菌的存活率分别降至7%和1%,大肠杆菌的存活率分别降至5%和1%。
本文制备的CPFB水凝胶表现出优良的NO释放能力、生物安全性及体外抗菌能力,在促进伤口愈合方面具有潜在应用价值。
参考文献:
[1]祖潇然, 韩愚弟, 周维, 等. 抗菌水凝胶治疗感染创面的研究进展[J]. 中国修复重建外科杂志, 2024, 38(2): 249-255.
[2]Cheng S, Pan M, Hu D R, et al. Adhesive chitosan-based hydrogel assisted with photothermal antibacterial property to prompt mice infected skin wound healing[J]. Chinese Chemical Letters, 2023, 34(12): 108276.
[3]Yang Z M, Fan S S, Ma W, et al. Flexible adhesive GelMA/SF-based patch embedded with polydopamine N-halamine nanoparticles for repair of infected wounds[J]. Chemical Engineering Journal, 2023, 460: 141732.
[4]Ji J Y, Ren D Y, Weng Y Z. Efficiency of multifunctional antibacterial hydrogels for chronic wound healing in diabetes: A comprehensive review[J]. International Journal of Nanomedicine, 2022, 17: 3163-3176.
[5]Liu G H, Wang L, He Y, et al. Polydopamine nanosheets doped injectable hydrogel with nitric oxide release and photothermal effects for bacterial ablation and wound healing[J]. Advanced Healthcare Materials, 2021, 10(23): 2101476.
[6]Huang W J, Cheng S, Wang X L, et al. Noncompressible hemostasis and bone regeneration induced by an absorbable bioadhesive self-healing hydrogel[J]. Advanced Functional Materials, 2021, 31(22): 2009189.
[7]唐国柯, 朱亮, 刘彦斌, 等. 壳聚糖基可注射水凝胶在骨组织修复再生方面的研究进展[J]. 生物骨科材料与临床研究, 2024, 21(2): 71-76.
[8]Bai Q, Gao Q, Hu F F, et al. Chitosan and hyaluronic-based hydrogels could promote the infected wound healing[J]. International Journal of Biological Macromolecules, 2023, 232: 123271.
[9]Tan W W, Long T, Wan Y Z, et al. Dual-drug loaded polysaccharide-based self-healing hydrogels with multifunctionality for promoting diabetic wound healing[J]. Carbohydrate Polymers, 2023, 312: 120824.
[10]Shi T T, Lu H Z, Zhu J Y, et al. Naturally derived dual dynamic crosslinked multifunctional hydrogel for diabetic wound healing[J]. Composites Part B: Engineering, 2023, 257: 110687.
[11]林晓, 赵俊泽, 周舒文, 等. 光热增强抗菌水凝胶的制备及其性能研究[J]. 广州化工, 2023, 51(13): 33-36.
[12]Lv Y C, Cai F Y, He Y X, et al. Multi-crosslinked hydrogels with strong wet adhesion, self-healing, antibacterial property, reactive oxygen species scavenging activity, and on-demand removability for seawater-immersed wound healing[J]. Acta Biomaterialia, 2023, 159: 95-110.
[13]Fan J, He N Y, He Q J, et al. A novel self-assembled sandwich nanomedicine for NIR-responsive release of NO[J]. Nanoscale, 2015, 7(47): 20055-20062.
[14]尚亚廷, 李世超, 周莹杰, 等. NO释放性抗菌、抗氧化水凝胶的制备及性能[J]. 功能高分子学报, 2023, 36(5): 453-460.
[15]Picheth G F, da Silva L C E, Giglio L P, et al. S-nitrosothiol-terminated Pluronic F127: Influence of microstructure on nitric oxide release[J]. Journal of Colloid and Interface Science, 2020, 576: 457-467.
[16]Yang Y, Zhou Y T, Li Y L, et al. Injectable and self-healing hydrogel containing nitric oxide donor for enhanced antibacterial activity[J]. Reactive and Functional Polymers, 2021, 166: 105003.
[17]Liang Z Y, Liu W K, Wang Z Q, et al. Near-infrared laser-controlled nitric oxide-releasing gold nanostar/hollow polydopamine Janus nanoparticles for synergistic elimination of methicillin-resistant Staphylococcus aureus and wound healing[J]. Acta Biomaterialia, 2022, 143: 428-444.
[18]Li M Y, Wang H, Hu J F, et al. Smart hydrogels with antibacterial properties built from all natural building blocks[J]. Chemistry of Materials, 2019, 31(18): 7678-7685.
[19]Sun C Y, Li W J, Ma P, et al. Development of TPGS/F127/F68 mixed polymeric micelles: enhanced oral bioavailability and hepatoprotection of syringic acid against carbon tetrachloride-induced hepatotoxicity[J]. Food and Chemical Toxicology, 2020, 137: 111126.
[20]Xu N, Gao Y P, Li Z, et al. Immunoregulatory hydrogel decorated with Tannic acid/Ferric ion accelerates diabetic wound healing via regulating Macrophage polarization[J]. Chemical Engineering Journal, 2023, 466: 143173.
[21]Bayram C. Carboxymethyl chitosan-glycerol multi-aldehyde based self-healing hydrogel system[J]. International Journal of Biological Macromolecules, 2023, 239: 124334.
[22]Li Z L, Lin Z Q. Recent advances in polysaccharide-based hydrogels for synthesis and applications[J]. Aggregate, 2021, 2(2): e21.
[23]Lv J L, Qi Y, Tian Y M, et al. Functionalized boron nanosheets with near-infrared-triggered photothermal and nitric oxide release activities for efficient antibacterial treatment and wound healing promotion[J]. Biomaterials Science, 2022, 10(14): 3747-3756.
[24]Liang Y Q, Xu H R, Li Z L, et al. Bioinspired injectable self-healing hydrogel sealant with fault-tolerant and repeated thermo-responsive adhesion for sutureless post-wound-closure and wound healing[J]. Nano-Micro Letters, 2022, 14(1): 185.
[25]Min Y J, Han R J, Li G L, et al. The pH-sensitive optical fiber integrated CMCS-PA@Fe hydrogels for photothermal therapy and real-time monitoring of infected wounds[J]. Advanced Functional Materials, 2023, 33(16): 2212803.
[26]Liang Y P, He J H, Guo B L. Functional hydrogels as wound dressing to enhance wound healing[J]. ACS Nano, 2021, 15(8): 12687-12722.
[27]Deliormanl A M, Rahman B, Atmaca H. In vitro cytotoxicity of magnetic-fluorescent bioactive glasses on SaOS-2, MC3T3-E1, BJ fibroblast cells, their hemolytic activity, and sorafenib release behavior[J]. Biomaterials Advances, 2024, 158: 213782.
[28]Hall J R, Rouillard K R, Suchyta D J, et al. Mode of nitric oxide delivery affects antibacterial action[J]. ACS Biomaterials Science amp; Engineering, 2019, 6(1): 433-441.
(责任编辑:张会巍)

