枸杞活性物质的提取工艺优化及活性测定





摘要:采用水提法提取枸杞中的活性成分,并选取料液比、酶解温度、酶解pH 3个单因素,在单因素实验结果的基础上利用响应面法对多糖和蛋白质的提取工艺进行优化,得到的最佳提取工艺为料液比1∶25.29、酶解温度59.29 ℃、酶解pH 5.94,多糖和蛋白质的理论含量为79.36%,在最佳提取工艺下提取3次,平均含量为79.05%,可见响应面法得到的提取工艺的稳定性与可靠性高。对提取物进行抗氧化活性测定,结果表明,枸杞提取物对超氧阴离子自由基有一定的清除作用,但清除作用不明显;对羟基自由基有较好的清除作用,在低浓度时与VC相当;在DPPH自由基清除实验中,在较小质量浓度时其清除能力弱于VC,但在较高质量浓度时其清除能力逐渐接近VC,表明枸杞具有较强的抗氧化能力。
关键词:多糖;工艺优化;抗氧化
中图分类号:TS201.1""""" 文献标志码:A"""" 文章编号:1000-9973(2024)09-0114-06
Optimization of Extraction Process of Active Substances from
Lycium barbarum and Determination of Activity
SHU Yu-zhu, YAO Wen-bo*
(Shaanxi University of Science and Technology, Xi'an 710021, China)
Abstract: The active components in Lycium barbarum are extracted by water extraction method, and solid-liquid ratio, enzymatic hydrolysis temperature and enzymatic hydrolysis pH are selected as the three single factors, the extraction process of polysaccharides and proteins is optimized by response surface method on the basis of single factor experimental results, and the best extraction process is obtained as follows: solid-liquid ratio is 1∶25.29, enzymatic hydrolysis temperature is 59.29 ℃, and enzymatic hydrolysis pH is 5.94. The theoretical content of polysaccharides and proteins is 79.36%, and the average content is 79.05% after three times of extraction under the optimal extraction process. It can be seen that the extraction process obtained by response surface method has high stability and reliability. The antioxidant activity of the extracts is determined, and the results show that the extracts of Lycium barbarum have a certain scavenging effect on superoxide anion radical, but the scavenging effect is not obvious; they have a good scavenging effect on hydroxyl radical, which is equivalent to VC at low concentration; in the DPPH radical scavenging experiment, their scavenging capacity is weaker than VC at low mass concentration, but gradually close to VC at high mass concentration, indicating that Lycium barbarum has strong antioxidant ability.
Key words: polysaccharides; process optimization; antioxidation
收稿日期:2024-03-16
基金项目:陕西省科技厅科技计划-农业领域项目(2022NY-035);陕西省西安市科技计划项目(20NYYF0022,22NYYF048);陕西省西安市未央区科技计划项目(202040);陕西科技大学博士科研启动基金项目(2022BJ-29);陕西省教育厅2023年度一般专项科学研究计划项目(23JK0352)
作者简介:舒雨竹(2000—),女,硕士研究生,研究方向:食用菌多糖。
*通信作者:姚文博(1989—),男,讲师,博士,研究方向:食品安全毒理学。
枸杞的营养价值非常高,属于药食同源性食品[1-5]。枸杞中蕴含许多含量丰富的活性物质,如多糖、活性肽等[6]。据研究报道,枸杞多糖不仅有增强机体免疫力[7]、防衰老[8]、增强造血功能、防止遗传损伤、抗癌[9]、抑制肿瘤生长和细胞突变等作用,而且对高血脂患者的血脂也具有非常明显的影响,能显著降低血清胆固醇和三酰甘油的含量,具有抗氧化功能[10-12]。而枸杞中的蛋白质含量也很多,其中含有20种人体所需氨基酸,且含有人体必需的8种氨基酸(异亮氨酸、色氨酸等)[13-15]。蛋白的来源主要分为动物来源和植物来源。动物性蛋白更利于人类摄取,但是成本过高。植物性蛋白是世界上最大的可再生蛋白资源之一,其来源广,具有抗氧化、抗菌、降血糖、降血脂、降血压和增强免疫力等功能。近年来,由于肽可以维护细胞结构,调节人体生理功能,利用植物性蛋白制备生物肽用于保健品、医疗等领域逐渐增加。有研究发现,生物活性肽具有抗氧化、抗癌、抗突变等活性。将枸杞进行深加工,利用枸杞蛋白制备生物活性肽可提高其经济效益。因此,提取枸杞活性物质、提高其提取率对开发枸杞资源具有重要意义。枸杞富含营养成分,其中枸杞多糖是其主要的活性成分,如何实现枸杞多糖的高效提取是本课题拟解决的关键科学问题,不同的酶能够作用于枸杞的不同部位,比如纤维素酶可以促进细胞壁的破裂,从而加速细胞内容物的释放,因此,考察酶的作用对枸杞活性物质提取率的影响具有一定的研究意义。
枸杞属于枸杞科,主要生长在碱性土壤和砂质土壤中,属于茄科灌木。枸杞果实作为中药已经有2 000多年的历史。近年来,枸杞果实因具有明显的健康保护功能,在许多国家作为一种健康食品被普遍食用。据报道,枸杞果实对肝炎、糖尿病、高脂血症、血栓形成和免疫缺陷具有多种生物活性和药理活性。枸杞果实的活性成分复杂,含有18种氨基酸、21种微量矿物质、黄酮拟杆菌、蛋白质、多糖和类胡萝卜素。多糖是枸杞果实中最重要的活性成分之一[16-19],具有降血脂[20]、抗氧化[21-22]、调节免疫力、抗衰老和抗疲劳等多种生物活性。多糖的生物活性主要受其理化性质和化学结构的影响,并受其提取和纯化方法的影响[23-24]。
1 材料与方法
1.1 材料与仪器
枸杞:安徽松鹿堂生物科技有限公司;无水乙醇(分析纯)、正丁醇(色谱纯)、氯仿(分析纯):天津市天力化学试剂有限公司;糖肽标准品(色谱纯):上海源叶生物科技有限公司。
TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;10N-50A立式真空冷冻干燥机 上海争巧科学仪器有限公司。
1.2 实验方法
1.2.1 提取方式
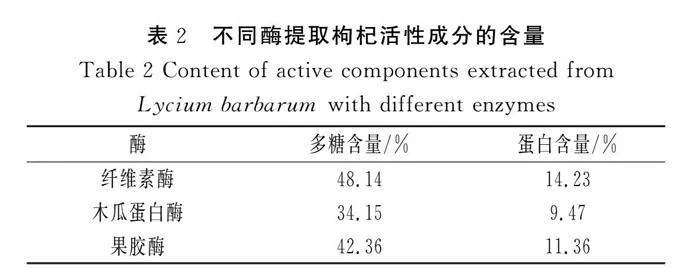
分别考察纤维素酶、果胶酶和木瓜蛋白酶对枸杞中多糖和蛋白质含量的影响。精密称取干燥枸杞粉末1 g,分别置于3个小烧杯中,加入25 mL蒸馏水,分别在数显恒温水浴锅中50 ℃提取120 min,将提取液放入微沸水中灭酶3~5 min,置于抽滤瓶中抽滤后置于旋蒸仪中直至旋蒸完全,加入10 mL蒸馏水复溶后倒入烧杯中,加入体积比为1∶5的95%乙醇溶液进行醇沉,置于4 ℃冰箱中,24 h后取出,离心,将沉淀物复溶后置于冻干机中冻干72 h后取出,称量其冻干后提取物的质量,密封保存,备用,采用苯酚硫酸法和考马斯亮蓝法检测在不同酶情况下提取物中多糖和蛋白质的含量。确定提取率最高的两种酶,再将两种酶调整为总量不变、比例不同的情况按照上述方法操作后测定含量,确定最适酶比例后进行后续实验。
1.2.2 单因素实验
1.2.2.1 料液比对枸杞活性物质提取含量的影响
精密称取过筛后的干燥枸杞粉末1 g,分别置于5个小烧杯中,分别加入10,15,20,25,30 mL蒸馏水配成料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30的溶液,加入0.45%纤维素酶∶果胶酶为3∶1的酶后将提取液的pH调至6,用保鲜膜封住烧杯口,在50 ℃温度下水浴提取120 min,将提取液放入微沸水中灭酶3~5 min,置于抽滤瓶中抽滤后置于旋蒸仪中旋蒸完全,加入10 mL蒸馏水复溶后倒入烧杯中,加入体积比1∶5的95%乙醇溶液进行醇沉,置于4 ℃冰箱中,24 h后取出,放入台式离心机中在8 000 r/min转速下离心15 min,将沉淀物复溶后置于冻干机中冻干72 h后取出,称量其冻干后提取物的质量,密封保存,备用,采用苯酚硫酸法和考马斯亮蓝法检测在不同料液比下提取物中多糖和蛋白质的含量。
1.2.2.2 酶解温度对枸杞活性物质提取含量的影响
精密称取过筛后的干燥枸杞粉末1 g,分别置于5个小烧杯中,加入20 mL蒸馏水配制成料液比为1∶20的溶液,加入0.45%纤维素酶∶果胶酶为3∶1的酶后将提取液的pH调至6,用保鲜膜封住烧杯口,分别在30,40,50,60,70 ℃温度下水浴提取120 min,提取液按照1.2.2.1的方式处理。
1.2.2.3 酶解pH对枸杞活性物质提取含量的影响
精密称取过筛后的干燥枸杞粉末1 g,分别置于5个小烧杯中,加入20 mL蒸馏水配制成料液比为1∶20的溶液,加入0.45%纤维素酶∶果胶酶为3∶1的酶后分别将pH调至4,5,6,7,8,用保鲜膜封住烧杯口,在50 ℃温度下水浴提取120 min,提取液按照1.2.2.1的方式处理。
1.2.3 响应面实验
1.2.3.1 响应面实验因素和水平
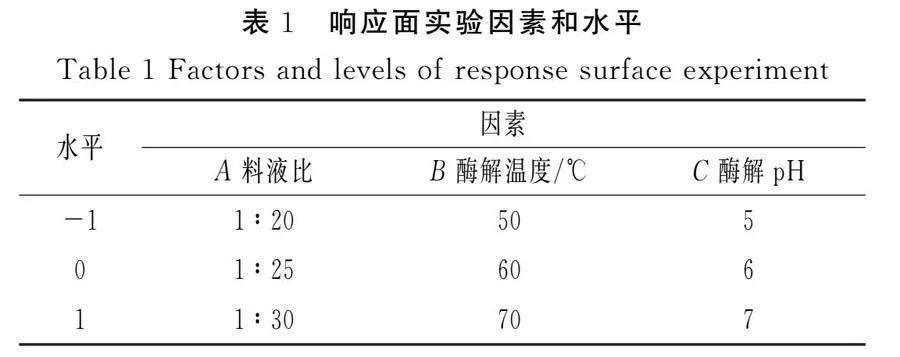
本实验根据单因素实验结果,利用Design-Expert V8.0.6软件中心组合设计法设计三因素三水平响应面实验,以枸杞活性成分含量为响应值,响应面实验因素和水平见表1。
1.2.3.2 验证实验
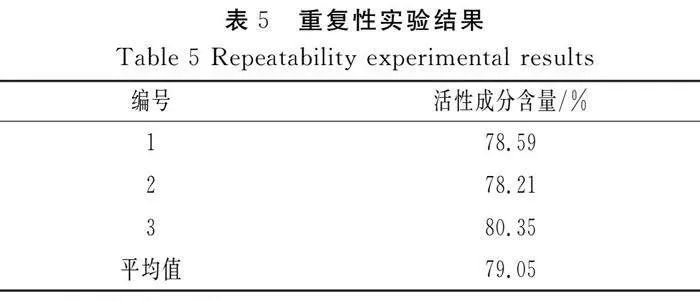
在响应面模型预测得到的最佳提取工艺的基础上进行3次重复性验证实验,判断模型的稳定性和重现性。
1.2.4 枸杞中多糖和蛋白质含量的计算
采用苯酚硫酸法和考马斯亮蓝法测定多糖和蛋白质的含量。
1.2.5 抗氧化活性的测定
1.2.5.1 DPPH自由基清除能力的测定
a.实验试剂
100 mL 0.05 mg/mL DPPH溶液:称取5 mg DPPH,用100 mL无水乙醇溶解,用锡纸包裹,于4 ℃避光备用。
分别配制枸杞提取物样品溶液、VC溶液,浓度分别为0.05,0.1,0.2,0.4,0.8 mg/mL。
b.实验步骤
取上述各浓度梯度的溶液各2 mL,加入DPPH溶液2 mL,涡旋混匀,记作A样品。以无水乙醇代替DPPH溶液,涡旋混匀,记作A对照。以无水乙醇代替样品溶液,涡旋混匀,记作A空白,以VC为阳性对照。将上述溶液在25 ℃下避光反应30 min后,于517 nm处测定吸光值。按下列公式计算清除率,每组实验平行3次,取平均值。
c.计算公式
清除率(%)=[1—(A空白—A样品)]/A对照×100%。
1.2.5.2 O2-自由基清除能力的测定
a.实验试剂
Tris溶液的配制:准确称取 Tris 0.605 6 g,加水定容至50 mL待用;用移液管准确移取浓HCl 0.415 mL,加水定容至50 mL待用;将上述两种溶液按照Tris∶浓HCl为50∶23的比例混合均匀后,加水定容至100 mL,即配制成pH 8.2的Tris-HCl溶液。
焦性没食子酸溶液的配制:准确称取焦性没食子酸 0.063 4 g,加适量水溶解后定容至100 mL待用。
分别配制枸杞提取物样品溶液、VC溶液,浓度分别为0.05,0.1,0.2,0.4,0.8 mg/mL。
b.实验步骤
取0.05,0.1,0.2,0.4,0.8 mg/mL样品溶液、1 mL VC溶液于具塞试管中,随后加入 Tris-HCl(pH 8.2)缓冲液3 mL,于30 ℃水浴20 min,放置至室温后加入3 mL 5 mmol/L焦性没食子酸溶液,混匀后放置3 min,加入1 mL浓盐酸终止反应,在320 nm处测定吸光值A1,以水作为空白对照,抗坏血酸作为阳性对照,每个样品进行 3次平行实验,取其平均值。A样品为待测液在320 nm处的吸光值;A试样为以H2O代替邻苯三酚在320 nm处的吸光值;A空白为以H2O代替待测液在320 nm处的吸光值。
c.计算公式
清除率(%)=[A空白—(A样品—A试样)]/A空白×100%。
1.2.5.3 OH-自由基清除能力的测定
a.实验试剂
100 mL 9 mmol/L H2O2的配制:吸取90 μL 30% H2O2溶液加水定容至100 mL;
100 mL 9 mmol/L FeSO4的配制:称取0.25 g FeSO4·7H2O,加水定容至100 mL;
100 mL 9 mmol/L水杨酸-无水乙醇溶液:称取0.124 2 g水杨酸,用无水乙醇定容至100 mL。
分别配制枸杞提取物样品溶液、VC溶液,浓度分别为0.05,0.1,0.2,0.4,0.8 mg/mL。
b.实验步骤
取上述各浓度梯度的溶液各1 mL,加入9 mmol/L H2O2、9 mmol/L FeSO4、9 mmol/L水杨酸-无水乙醇溶液和蒸馏水各1 mL,涡旋混匀,在37 ℃水浴35 min。于510 nm处测定吸光值,记作A样品。以蒸馏水代替提取液,记作A空白,H2O2溶液用蒸馏水替代,记作A试样,按下列公式计算清除率。以VC溶液作为阳性对照。每组实验平行3次,取平均值。
c.计算公式
清除率(%)=[A空白—(A样品—A试样)]/A空白×100%。
1.3 实验方法
所有实验均重复3次,采用GraphPad Prism 8.0.2和Design-Expert V8.0.6进行数据处理和绘图分析。
2 结果与讨论
2.1 提取工艺优化
2.1.1 最适酶的确定
由表2可知,在纤维素酶和果胶酶的提取条件下,枸杞活性成分的含量较高,因此确定后续实验选取的酶为纤维素酶和果胶酶。
2.1.2 最适酶比例的确定
由表3可知,在纤维素酶∶果胶酶为3∶1的条件下,枸杞活性成分的含量较高,因此确定后续实验选取的酶比例为3∶1。
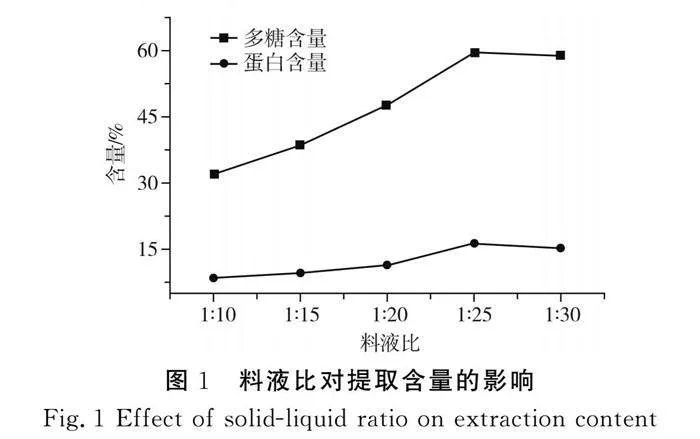
2.1.3 料液比对提取含量的影响
由图1可知,料液比为1∶25时,枸杞活性成分的含量达到最高,因此选择1∶25作为实验的最优条件,为响应面优化工艺提供了参考。
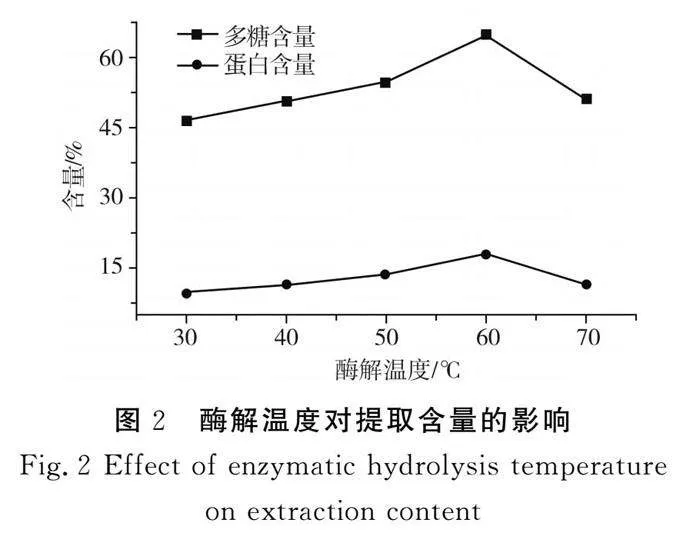
2.1.4 酶解温度对提取含量的影响
由图2可知,酶解温度为60 ℃时,枸杞活性成分的含量达到最高,因此选择酶解温度60 ℃作为实验的最优条件,为响应面优化工艺提供了参考。
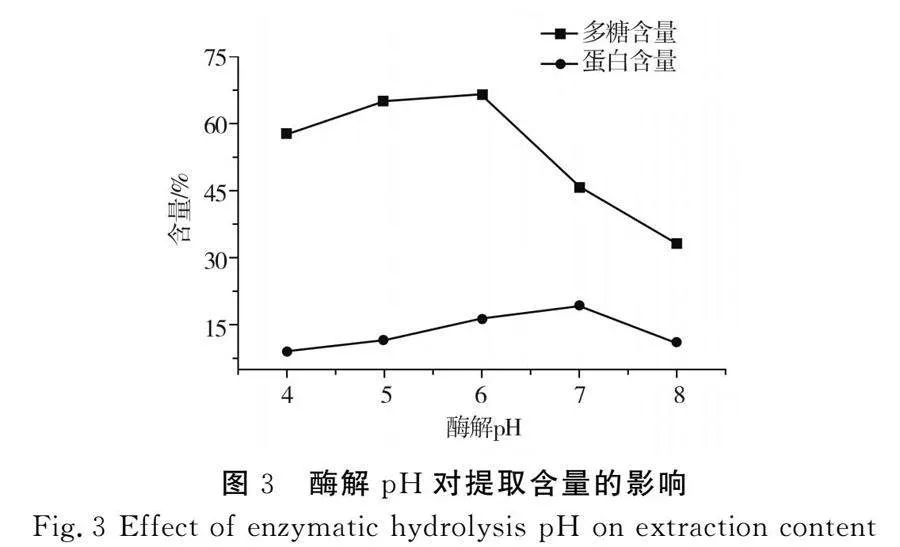
2.1.5 酶解pH对提取含量的影响
由图3可知,酶解pH为6时,枸杞活性成分的含量达到最高,因此选择酶解pH 6作为实验的最优条件,为响应面优化工艺提供了参考。
2.1.6 响应面优化提取工艺
按照表1设计响应面实验,共得到17个实验点,其中分析的实验点有12个,中心点有5个。采用响应面法分析实验结果,以枸杞活性成分含量为响应值,最终得到的回归方程为含量=77.93+0.92A-2.09B-1.28C-9.05AB+1.39AC-4.61BC-12.01A2-16.13B2-7.17C2。
由表4可知,响应面模型的P=0.007 7<0.01,说明响应面模型差异极显著,失拟项的P=0.089 5>0.05,说明响应面实验结果与模型拟合良好,可以使用该模型推测枸杞活性成分含量最大时的最优提取条件。各因素对枸杞活性成分含量的影响由大到小为酶解温度>酶解pH>料液比。两两因素交互作用的等高线和响应面见图4。
在图4中X,Y轴为影响因素,Z轴为枸杞中活性成分的含量,由图4可以明显看出料液比与酶取温度的交互作用、料液比与酶解pH的交互作用以及酶解温度与酶解pH的交互作用。且每两个因素的交互作用都明显存在最高点。根据响应面法建立模型,最终得到最佳的提取条件为料液比1∶25.29、酶解温度59.29 ℃、酶解pH 5.94,此条件下枸杞中活性成分含量为79.36%。
2.1.7 验证实验
在理论条件下提取的枸杞活性成分含量为79.36%。在此基础上进行3次重复性实验,结果见表5。可见预测值与实际提取值的吻合度较好,模型具有良好的稳定性和重现性。
2.2 抗氧化活性测定
2.2.1 DPPH自由基清除能力测定
按照1.2.5中的试剂配制方法配制溶液,并按照实验步骤加入试剂,检测提取物的活性。枸杞提取物、VC对DPPH自由基的清除效果见图5。
由图5可知,在实验质量浓度范围内VC对DPPH自由基的清除率基本上没有变化,均大于80%,随着质量浓度的上升,枸杞提取物对DPPH自由基的清除率增大,逐渐靠近VC。
2.2.2 O2-自由基清除能力测定
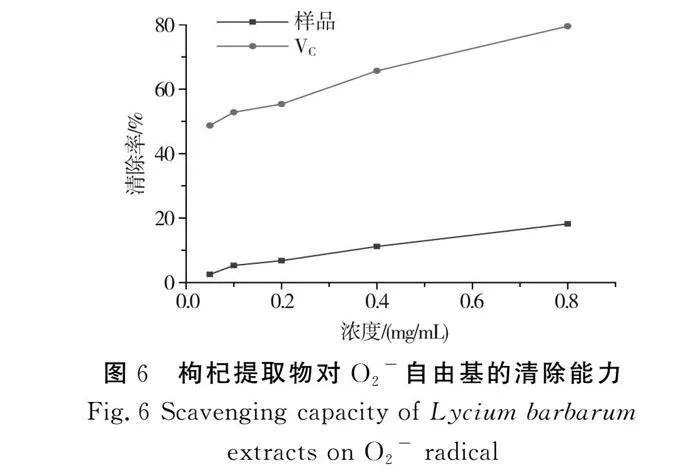
该体系中的邻苯三酚在碱性条件下自氧化形成中间产物超氧阴离子自由基,此自由基能促进邻苯三酚自氧化,因此通过测定某物质对邻苯三酚自氧化的抑制作用,即可表征其对超氧阴离子自由基的清除作用,实验结果见图6。
由图6可知,在所选质量浓度范围内,随着质量浓度的升高,VC的清除率略有上升,而枸杞提取物的清除率变化不明显,均低于30%,说明枸杞提取物对超氧阴离子自由基的清除作用不明显。
2.2.3 OH-自由基清除能力测定
枸杞提取物、VC对羟基自由基的清除效果见图7。
由图7可知,在所选质量浓度范围内,随着质量浓度的增大,VC、枸杞提取物清除羟基自由基的能力显著增大,清除率达到50%时所需枸杞提取物、VC的质量浓度大约都在0.25 mg/mL,说明在此浓度范围内枸杞提取物清除羟基自由基的能力与VC相当。
3 结论
本研究考察了提取酶的种类和酶比例对枸杞多糖和蛋白质含量的影响,发现最适酶为纤维素酶和果胶酶,最适的酶比例为3∶1。考察了料液比、酶解温度、酶解pH 3个单因素对枸杞多糖和蛋白质含量的影响,然后采用Design-Expert V8.0.6软件中心组合设计法设计响应面实验并建立了模型,得到了预测的最优工艺,在预测的最优工艺基础上,进行3次验证实验,发现理论含量与实际含量的吻合度达到99.61%,最终确定了最佳提取工艺为料液比1∶25.29、酶解温度59.29 ℃、酶解pH 5.94。在此条件下提取的枸杞多糖和蛋白质的理论含量为79.36%,实际含量为79.05%。
利用3种不同的活性检测方法对枸杞进行抗氧化活性检测。通过测定枸杞对不同自由基的清除率来判断枸杞的抗氧化能力。分别设置了5个不同的浓度,实验结果表明,枸杞提取物对超氧阴离子自由基有一定的清除作用,但清除作用不明显;对羟基自由基有较好的清除作用,在低浓度时与VC相当;在DPPH自由基清除实验中,在较小质量浓度时其清除能力弱于VC,但在较高质量浓度时其清除能力逐渐接近VC,可见枸杞有较强的抗氧化能力。
参考文献:
[1]VIDOVI B B, MILINI D D, MARETI M D, et al.Health benefits and applications of Goji berries in functional food products development: a review[J].Antioxidants,2022,11(2):248.
[2]GONCALVES G, ZHAO L, PATEL B, et al.Effect of Goji berry consumption on physiological, biochemical and traditional Chinese medicine (TCM) outcomes[J].Proceedings of the Nutrition Society,2018,77:205.
[3]KULCZYNSKI B, GRAMZA-MICHALOWSKA A. Goji berry (Lycium barbarum): composition and health effects-a review[J].Polish Journal of Food and Nutrition Sciences,2016,66(2):67-75.
[4]TEIXEIRA F, SILVA A M, DELERUE-MATOS C, et al. Lycium barbarum berries (Solanaceae) as source of bioactive compounds for healthy purposes: a review[J].International Journal of Molecular Sciences,2023,24(5):4777.
[5]MASCI A, SIMONE C, MARIA-ANTONIETTA C, et al. Lycium barbarum polysaccharides: extraction, purification, structural characterisation and evidence about hypoglycaemic and hypolipidaemic effects.A review[J].Food Chemistry,2018,254:377-389.
[6]JI H X, MA J X, GUO L J, et al. Amino acid sequence identification of Goji berry cyclic peptides and anticervical carcinoma activity detection[J].Journal of Peptide Science,2021,27(8):3326.
[7]MA Z F, ZHANG H X, TEH S S, et al. Goji berries as a potential natural antioxidant medicine: an insight into their molecular mechanisms of action[J].Oxidative Medicine and Cellular Longevity,2019,2019(1):1-9.
[8]LIU J F, MENG J, DU J H, et al.Preparative separation of flavonoids from Goji berries by mixed-mode macroporous adsorption resins and effect on Aβ-expressing and anti-aging genes[J].Molecules,2020,25(15):3511.
[9]WAWRUSZAKA, CZERWONKA A, OKA K, et al. Anticancer effect of ethanol Lycium barbarum (Goji berry) extract on human breast cancer T47D cell line[J].Natural Product Research,2016,30(17):1993-1996.
[10]LIU B,XU Q Q,SUN Y J.Black Goji berry (Lycium ruthenicum) tea has higher phytochemical contents and in vitro antioxidant properties than red Goji berry (Lycium barbarum) tea[J].Food Quality and Safety,2020,4(4):193-201.
[11]ISLAM T, XU X M, BADWAL T S, et al.Comparative studies on phenolic profiles, antioxidant capacities and carotenoid contents of red Goji berry (Lycium barbarum) and black Goji berry (Lycium ruthenicum)[J].Chemistry Central Journal,2017,11(1):59.
[12]REEVE V E, ALLANSON M, ARUN S J, et al.Mice drinking Goji berry juice (Lycium barbarum) are protected from UV radiation-induced skin damage via antioxidant pathways[J].Photochemical amp; Photobiological Sciences,2010,9(4):601-607.
[13]TEIXEIRA S, LUIS I M, OLIVEIRA M, et al. Goji berries superfood—contributions for the characterisation of proteome and IgE-binding proteins[J].Food and Agricultural Immunology,2019,30(1):262-280.
[14]UASUF C G.Identification of immunoreactive protein bands in Goji berries superfood by proteomic analysis[J].Allergy,2020,75:521.
[15]D'AMATO A, ESTEVE C, FASOLI E, et al. Proteomic analysis of Lycium barbarum (Goji) fruit via combinatorial peptide ligand libraries[J].Electrophoresis,2013,34(12): 1729-1736.
[16]MENABREAZ T, DORSAZ M, BOCQUEL D, et al. Goji berry and whey protein concentrate enriched rice extrudates—physical properties and accessibility of bioactives[J].Polish Journal of Food and Nutrition Sciences,2021,71(1):29-37.
[17]YU C X, XU X X, AHMADI S, et al. Structure and in vitro fermentation characteristics of polysaccharides sequentially extracted from Goji berry (Lycium barbarum) leaves[J].Journal of Agricultural and Food Chemistry,2022,70(24):7535-7546.
[18]SKENDERIDIS P, MITSAGGA C, LAMPAKIS D, et al. The effect of encapsulated powder of Goji berry (Lycium barbarum) on growth and survival of probiotic bacteria[J].Microorganisms,2020,8(1):57.
[19]PENG J J, WANG L, WANG M G, et al.Yeast synthetic biology for the production of Lycium barbarum polysaccharides[J]. Molecules,2021,26(6):1641.
[20]ZHOU B J, XIA H, YANG L G, et al.The effect of Lycium barbarum polysaccharide on the glucose and lipid metabolism: a systematic review and meta-analysis[J].Journal of the American Nutrition Association,2022,41(6):618-626.
[21]GEORGIEV K D, SLAVOV I J, ILIEV I A.Antioxidant activity and antiproliferative effects of Lycium barbarum's (Goji berry) fractions on breast cancer cell lines[J].Folia Medica,2019,61(1):104-112.
[22]ZHANG Q Y, CHEN W W, ZHAO J H, et al.Functional constituents and antioxidant activities of eight Chinese native Goji genotypes[J].Food Chemistry,2016,200:230-236.
[23]ZHOU S Y, RAHMAN A, LI J H, et al. Extraction methods affect the structure of Goji (Lycium barbarum) polysaccharides[J].Molecules,2020,25(4):936.
[24]AHMADI S, YU C X, ZAEIM D, et al. Increasing RG-I content and lipase inhibitory activity of pectic polysaccharides extracted from Goji berry and raspberry by high-pressure processing[J].Food Hydrocolloids,2022,126(14):107477.

