不同提取方法提取马铃薯蛋白的研究




摘要:该实验以新鲜马铃薯为原料,采用醇溶法、盐溶法、碱溶法3种方法提取马铃薯蛋白,测定其纯度和提取率,结果表明,醇溶法提取的马铃薯蛋白纯度为94.5%,提取率为4.5%,提取效果最好。通过SDS-PAGE电泳分析,醇溶法提取的马铃薯蛋白亚基条带多,分子量范围广,并且在分子量为25~40 kDa范围内含量很高,说明醇溶法能有效提取马铃薯蛋白质的各个组分;进一步研究其理化性质,发现醇溶法提取的蛋白质持油性、持水性、乳化性、乳化稳定性更好;水解度分析显示醇溶法提取的马铃薯蛋白水解度更高。因此,在这3种方法中,醇溶法是比较经济、所得蛋白质性质较好的提取方法。
关键词:马铃薯蛋白质;提取方法;功能特性;水解度
中图分类号:TS215 """""文献标志码:A """"文章编号:1000-9973(2024)09-0054-05
Study on Extraction of Protein from Potato by Different Extraction Methods
ZHANG Yu-xuan1,2, LI Hua-xin1,2, CHEN Ying1,2, MA Jin-pu1,2,
GUO Xing-chen1,2, FAN Pei-ru3, GAO Dan-dan1,2*
(1.China-Malaysia National Joint Laboratory, Biomedical Research Center, Northwest Minzu University,
Lanzhou 730030, China; 2.College of Life Science and Engineering, Northwest Minzu University,
Lanzhou 730124, China; 3.College of Chemistry, Sichuan University, Chengdu 610207, China)
Abstract: In this experiment, with fresh potatoes as the raw materials, potato protein is extracted by three methods such as alcohol dissolution method, salt dissolution method, alkali dissolution method, and its purity and extraction rate are determined. The results show that the purity of potato protein extracted by alcohol dissolution method is 94.5%, the extraction rate is 4.5%, and the extraction effect is the best. SDS-PAGE electrophoresis analysis shows that the potato protein extracted by alcohol dissolution method has many subunit bands, a wide range of molecular weights, and a high content in the molecular weight range of 25~40 kDa, indicating that alcohol dissolution method could effectively extract various components of potato protein. Further research on its physicochemical properties shows that the protein extracted by alcohol dissolution method has better oil holding capacity, water holding capacity, emulsibility and emulsification stability. Hydrolysis analysis shows that potato protein extracted by alcohol dissolution method has a higher degree of hydrolysis. Therefore, among the three methods, alcohol dissolution method is a more economical extraction method to obtain protein with better properties.
Key words: potato protein; extraction method; functional characteristics; degree of hydrolysis
收稿日期:2024-03-20
基金项目:国家自然科学基金地区基金项目(31960461);兰州市城关区科技计划项目(2022JSCX0011);中央高校基本科研业务费项目(31920230153);甘肃省青年博士基金项目(2023QB-001)
作者简介:张钰璇(1999—),女,硕士,研究方向:预防兽医学。
*通信作者:高丹丹(1983—),女,教授,博士,研究方向:食品生物技术。
马铃薯是一年生草本植物,与胡椒、茄子、番茄等属同一科。在上百种茄科植物中,马铃薯是少数几个块茎植物之一[1-2]。马铃薯目前为第四大粮食作物,仅次于小麦、水稻和玉米,中国的马铃薯种植面积和鲜薯产量均居世界首位,且均占世界的1/4[3]。马铃薯蛋白含有丰富的必需氨基酸,赖氨酸含量可达6.7%~10.10%[4],将马铃薯作为主食可以补足以小麦和大米作为主食的缺陷。目前已有的马铃薯蛋白提取方法包括酸热沉淀法、超滤法、酶法等,使用范围较广的方法是酸热沉淀法,但在实际应用中存在处理工艺较复杂、易使马铃薯蛋白失活的问题[5];超滤法适合大规模生产马铃薯蛋白,但在工业生产中超滤膜的清洗成本偏高,仍需要开发出价格低廉的滤膜从而降低成本[6];酶法作用条件温和,能保持蛋白质的活性,但目前酶的来源较单一,在工业化的大规模生产中技术不是很成熟,有待进一步提高[7]。
本实验主要采用醇溶法、盐溶法和碱溶法提取马铃薯蛋白质,通过SDS-PAGE电泳分析蛋白质组分,并对不同方法提取的蛋白质进行功能性和水解度测定,以期选择更有效的马铃薯蛋白提取方法,为今后马铃薯蛋白的综合开发利用和功能性产品开发提供新思路。
1 材料与方法
1.1 材料与试剂
马铃薯:购于兰州市榆中县福润德超市。
1.2 试剂
甘氨酸:美国Sigma公司;考马斯亮蓝G250、蛋白Marker、牛血清白蛋白:北京索莱宝科技有限公司;木瓜蛋白酶:上海阿拉丁生化科技股份有限公司;其余试剂均为分析纯。
1.3 仪器与设备
Fresco17超速离心机 Thermo Fisher Scientific公司;Scientz-10YG/A冷冻干燥机 宁波新芝冻干设备股份有限公司;KDN-08消化炉 上海新嘉电子有限公司;Kjeltec 8200凯氏定氮仪 丹麦FOSS公司。
1.4 实验方法
1.4.1 马铃薯蛋白提取
1.4.1.1 醇溶法
参考张旭等[8]的方法,取1 kg体积为1 cm3的马铃薯块,加入250 mL 75%乙醇和0.3 g NaHSO3[9]。彻底破碎后于25 ℃水浴浸提2 h,过滤,滤液以7 000 r/min离心15 min,取上清液即为蛋白质醇溶液,调节pH值为4.5,于30 ℃水浴1 h后以6 000 r/min离心15 min,将沉淀冷冻干燥备用。
1.4.1.2 盐溶法
参考祝海娟等[10]和齐斌等[11]的方法。取1 kg马铃薯块,加入0.8 g NaCl和0.3 g NaHSO3混入250 mL蒸馏水,破碎、过滤、离心后取上清液,调节pH值为4.5,30 ℃水浴1 h后以6 000 r/min离心15 min,将沉淀冷冻干燥备用。
1.4.1.3 碱溶法
参考马祥林[12]和姚佳[13]的方法。取1 kg马铃薯块,加入0.3 g NaHSO3和250 mL蒸馏水,破碎、过滤、离心后取上清液,调节pH值为8.5,于30 ℃水浴浸提1 h,调节pH值为4.5,于30 ℃水浴1 h后以6 000 r/min离心15 min,取沉淀并将其洗涤至中性,冷冻干燥备用。
1.4.2 蛋白质含量测定
采用凯氏定氮法测定蛋白质含量[14]。
蛋白质纯度(%)=m2m1。
蛋白质提取率(%)=m1m3。
式中:m1为实际提取的蛋白质质量(g);m2为凯氏定氮法测得的蛋白质含量(g);m3为使用的马铃薯总质量(g)。
1.4.3 马铃薯蛋白的SDS-PAGE分析
参照Fairbanks等[15]的凝胶电泳法,将醇溶法、盐溶法、碱溶法提取的马铃薯蛋白进行SDS-PAGE分析。
1.4.4 蛋白质功能性质的测定
1.4.4.1 起泡性和泡沫稳定性的测定
参照范广琦等[16]所述方法搅打马铃薯蛋白并测定马铃薯蛋白的起泡性和泡沫稳定性。
起泡性(%)=V1V0×100%。
泡沫稳定性(%)=V2V1×100%。
式中:V0为蛋白质溶液体积(mL);V1为搅打后的泡沫体积(mL);V2为放置30 min后的泡沫体积(mL)。
1.4.4.2 持水性和持油性的测定
参照Chandi等[17]的实验方法测定。
持水性(g/g)=m2-m1m。
持油性(g/g)=m4-m3m。
式中:m为蛋白样品质量(g);m1为吸水前蛋白质和离心管质量(g);m2为吸水后蛋白质和离心管质量(g);m3为吸油前蛋白质和离心管质量(g);m4为吸油后蛋白质和离心管质量(g)。
将上述的水换成色拉油,调节反应体系的温度为20,30,40,50,60,70,80,90,100 ℃,按同样的步骤进行实验,即可测定吸油性。
1.4.4.3 乳化性及乳化稳定性的测定
参照程赞等[18]的实验方法测定。
乳化性(EAI)=H2H1×100%。
乳化稳定性(ESI)=H4H3×100%。
式中:H1为试管中样品溶液的高度(cm);H2为试管中乳化层的高度(cm);H3为离心前乳化层的高度(cm);H4为离心后乳化层的高度(cm)。
1.4.5 水解度的测定
将3种方法所得的马铃薯蛋白质溶解,调节pH值为6.8,配制成2%的蛋白质溶液,使用木瓜蛋白酶在65 ℃条件下分别水解1,2,3,4,5 h后,在100 ℃水浴15 min灭酶,采用茚三酮比色法测定水解度[19],水解度计算公式如下:
DH(%)=hhtot×100%。
式中:DH为水解度(%);h为水解后每克蛋白被裂解的肽键毫摩尔数(mmol/g);htot为每克原料蛋白质的肽键毫摩尔数(mmol/g)。
1.4.6 数据处理
利用IBM SPSS Statistics 21软件对数据进行处理,利用Origin 2021软件进行绘图分析。
2 结果与分析
2.1 不同方法提取马铃薯蛋白质的纯度和提取率
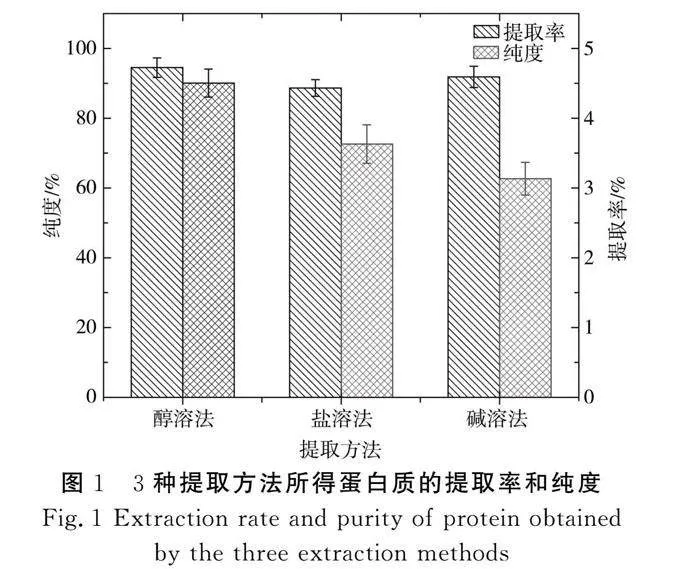
由图1可知,醇溶法提取的马铃薯蛋白质提取率和纯度都高于盐溶法;而碱溶法作为蛋白质的常用提取方法,在提取马铃薯蛋白质时的提取率较高,但是纯度较低。相较于这两种方法,醇溶法得到的蛋白质提取率和纯度最高,变性程度小[20],有利于生产。
2.2 不同方法提取马铃薯蛋白质SDS-PAGE电泳分析
利用SDS-PAGE电泳法分析3种提取方法得到的马铃薯蛋白质的组成,见图2。
由图2可知,3种提取方法所得到的亚基条带分布均匀,但是3种方法所得的亚基差异显著。在分子量为25~40 kDa范围内醇溶法提取的蛋白含量相较于其他两种方法高,并且所得亚基条带比其他两种多。碱溶法提取蛋白分子量分布在25~40 kDa和85~150 kDa,盐溶法提取蛋白分子量分布在25~40 kDa和85~150 kDa,两种提取方法都在分子量为25~40 kDa和85~150 kDa之间较集中。醇溶法提取的蛋白质分布较广且在10~40 kDa和100~150 kDa之间比较集中。综上可知,醇溶法能够更高效地提取马铃薯蛋白的组成成分。
2.3 不同提取方法对蛋白质理化特性的影响
2.3.1 起泡性和泡沫稳定性
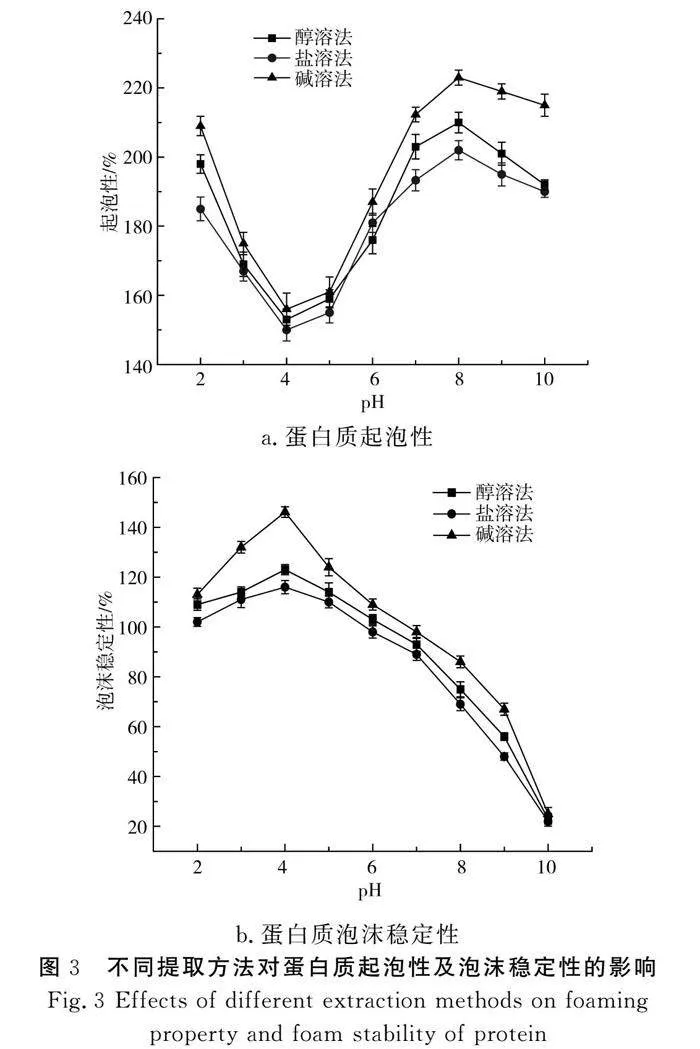
由图3中a可知,在pH接近马铃薯蛋白质等电点时,蛋白质起泡性低,但采用碱溶法所得的马铃薯蛋白起泡性始终高于醇溶法和盐溶法;随着pH的增加,蛋白质的起泡性均有所提升,在pH为8时最大,盐溶法和醇溶法的蛋白质起泡性均低于碱溶法;pH处于8~10范围内,蛋白质的起泡性都有一定程度的降低,但是使用碱溶法得到的蛋白质性质更稳定,这是因为离蛋白质等电点较远时,蛋白质分子之间静电斥力增强,疏水作用减弱,溶解度增强,使得蛋白质分子能够快速在气-液界面展开、重排,有利于气泡的形成[21],蛋白质泡沫是由液膜包裹气体而形成的。pH值、蛋白质质量分数、溶解度、离子强度等因素都影响起泡性和泡沫稳定性[21]。起泡性是指蛋白质产品搅打生成泡沫的能力;泡沫稳定性则反映泡沫存在的持久性。一般来说,蛋白质的起泡性影响面包、蛋糕等食品加工过程,起泡性和泡沫稳定性好的蛋白产品可作为良好的起泡剂用于改善烘焙食品的质构,保证食品口感的舒适[22]。
由图3中b可知,马铃薯蛋白在pH达到等电点时,泡沫稳定性最大,并且3种方法中碱溶法得到的蛋白质泡沫稳定性最高,随着pH的升高,3种方法所得的蛋白质泡沫稳定性均下降。蛋白质的泡沫稳定性因为蛋白质所处环境及蛋白质的空间结构的变化而变化,同时蛋白质的稳定性受液膜的强度大小和气体透过这层液膜的扩散速度快慢的影响,还与泡沫的表面电荷性质有关[23]。而盐溶法和醇溶法提取的蛋白质泡沫稳定性较小,可能是因为蛋白质泡沫因为大小不同而产生压力差或者多个气泡聚集合并,从而使得蛋白质泡沫失稳消散[24]。因此,考虑马铃薯的蛋白质稳定性,可以采用碱溶法进行提取。
2.3.2 持油性和持水性
由图4中a可知,在反应体系温度为25 ℃时,3种方法提取的蛋白质持油性均最高,其中醇溶法提取的蛋白质持油性最高,可达1.31 g/g;随着温度的上升,促进蛋白质变性,使得蛋白质的持油性呈下降趋势,在体系温度达95 ℃时,蛋白质的持油性最低。蛋白质的持油性是指蛋白质能够吸附油脂的能力,是非极性脂肪族链与蛋白质非极性区之间的疏水性相互作用的结果[25-26]。
由图4中b可知,在pH为2~4范围内,3种方法所得的蛋白质持水性随着pH的升高而降低,在pH达到等电点4左右时,蛋白质的持水性最低,醇溶法提取的蛋白持水性较高,为2.74 g/g,在pH为4~10之间时,随着pH的升高,蛋白质的持水性也随之升高,其中醇溶法提取的蛋白质持水性上升趋势更明显。持水能力是指蛋白质摄取水分并将水分保留在蛋白质组织中的能力[27]。蛋白质的持水力在食品加工过程中有重要作用,蛋白质的吸水能力直接影响烘焙食品、凝胶类食品的质构,也与乳制品、肉质类制品的鲜嫩程度相关,因此蛋白质的持水能力对食品的品质、感官等品质有着重要的作用。蛋白质的吸水性受携带亲水基团的数量、溶解性及其他组分等因素的影响。
2.3.3 乳化性和乳化稳定性
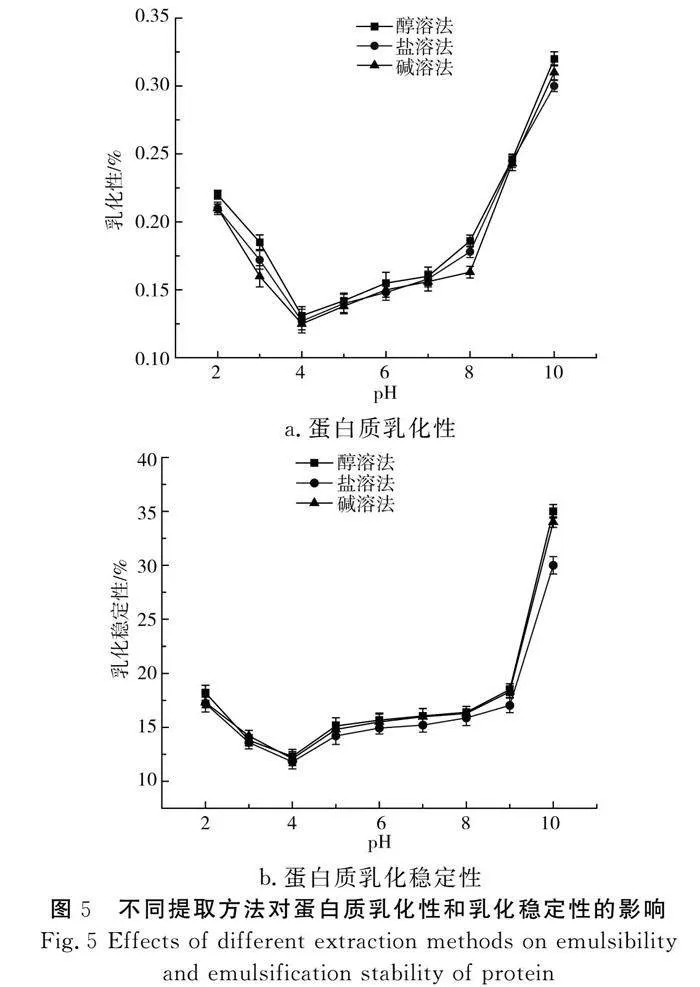
由图5中a可知,在pH为2~4时,蛋白质的乳化性逐步降低,在pH达到4时处于最低水平,且使用3种方法所提取的蛋白质的乳化性较接近;随着pH的升高,蛋白质的乳化性逐渐升高,并在pH 8~10范围内陡增,在pH为10时达到最高值。蛋白质的乳化性是指蛋白质溶液从油包水变成水包油乳化过程中100 mg蛋白质能够乳化油的毫克数。同时乳化性是蛋白质的一种重要功能性质,它具有乳化容量和乳化稳定性两种特性。蛋白质的乳化性可应用于香肠、汤料、奶酪和蛋糕等食品中[28]。
由图5中b可知,这3种方法提取的蛋白质的乳化稳定性与乳化性相接近,均在pH为2~4时降低,在pH为4时达最低点,且在pH 4~10范围内上升,在pH为10时乳化稳定性最大,醇溶法提取的蛋白质乳化稳定性可达35%。蛋白质的乳化稳定性是指蛋白质乳化液保持明显稳定状态并且不会产生两个相分层或者不稳定现象[29-30]。因此,在考虑蛋白质乳化性和乳化稳定性时,可以采用醇溶法进行提取。
2.4 不同提取方法对蛋白质水解度的影响
由图6可知,随着水解时间的增加,3种提取方法得到的马铃薯蛋白质水解度均随之增加,使用醇溶法提取的蛋白质水解度在使用酶处理的前2 h呈陡增趋势,而使用盐溶法和碱溶法所得的蛋白质在前4 h均呈明显上升趋势,随后上升缓慢。相比较而言,使用醇溶法提取的马铃薯蛋白水解度更高,有利于马铃薯蛋白的进一步加工处理。
3 结论
本实验以新鲜马铃薯作为研究材料,通过醇溶法、盐溶法、碱溶法3种方法提取马铃薯蛋白,测定其提取率和纯度后,对其功能性质和水解度进行研究,得出以下结论:醇溶法提取的马铃薯蛋白提取率和纯度最高,碱溶法纯度最低,盐溶法提取率最低;通过SDS-PAGE电泳分析,醇溶法提取的马铃薯蛋白亚基条带多,分子量范围广,并且在分子量为25~40 kDa范围内含量很高;使用碱溶法得到的蛋白质起泡性和泡沫稳定性更好并且更稳定,醇溶法提取的蛋白质持油性和持水性都比其他两种高,并且乳化性和乳化稳定性相较另外两种更好;醇溶法提取的马铃薯蛋白水解度更高且误差更小。综上所述,在这3种方法中,醇溶法是比较经济、所得蛋白质性质较好的提取方法。
参考文献:
[1]马莺,顾瑞霞.马铃薯深加工技术[M].北京:中国轻工业出版社,2003:1-5.
[2]戴朝曦.全能食物:马铃薯[J].森林与人类,2008(10):8-29.
[3]黄凤玲,张琳,李先德,等.中国马铃薯产业发展现状及对策[J].农业展望,2017,13(1):25-31.
[4]WAGLAY A, KARBOUNE S, ALLI I. Potato protein isolates: recovery and characterization of their properties[J].Food Chemistry,2014,142:373-382.
[5]黄闯,张泽生,王玉本,等.马铃薯蛋白酸水解工艺及氨基酸组分检测[J].食品科技,2010,35(8):317-321.
[6]顾文芬,曾凡逵,程锦春.超滤法从马铃薯淀粉加工分离汁水中回收蛋白质的研究[J].现代食品科技,2018,34(3):131-136.
[7]WAGLAY A, KARBOUNE S. A novel enzymatic approach based on the use of multi-enzymatic systems for the recovery of enriched protein extracts from potato pulp[J].Foods Chemistry,2017,220:313-323.
[8]张旭,于国萍.玉米蛋白粉中醇溶蛋白提取方法的研究[J].粮食加工,2007(2):41-45.
[9]QIN W. Investigation of protein-fatty acid interactions in zein films[D].Champaign: University of Illinois Urbana-Champaign,2004.
[10]祝海娟,赵晨霞,刘沐阳,等.盐法提取大麦虫蛋白质的研究[J].江苏农业科学,2013,41(8):274-276.
[11]齐斌,郑丽雪,朴金苗.马铃薯分离蛋白的提取工艺[J].食品科学,2010,31(22):297-300.
[12]马祥林.马铃薯蛋白液中蛋白质的提取与废水处理工业的研究[D].兰州:兰州大学,2010.
[13]姚佳.马铃薯蛋白高效提取分离技术及其功能特性的研究[D].长春:吉林农业大学,2013.
[14]张建杜,褚武英,陈韬.蛋白质分离与纯化技术[M].北京:军事医学科学出版社,2009:9-56.
[15]FAIRBANKS D J, BURGENER K W, ROBISON L R, et al. Electrophoretic characterization of quinoa seed proteins[J].Plant Breeding,2010,104(3):190-195.
[16]范广琦,王俊彤,李丹,等.Protamex酶水解对玉米谷蛋白泡沫性质及结构特性的影响[J].食品科学,2023,44(24):41-49.
[17]CHANDI G K, SOGI D. Functional properties of rice bran protein concentrates[J].Journal of Food Engineering,2007,79(2):592-597.
[18]程赞,赵晓燕,张晓伟,等.核桃分离蛋白酶解产物结构与功能的变化[J].中国油脂,2022,47(6):85-91.
[19]李皖光,汪桃花,王新文,等.4种大米蛋白水解度测定方法比较[J].粮食科技与经济,2017,42(5):35-37.
[20]相恒绪,陈琦,敬思群.玉米醇溶蛋白提取工艺选择与优化[J].郑州轻工业学院学报(自然科学版),2011,26(1):34-38.
[21]贾恬.黄秋葵籽蛋白提取、纯化及特性研究[D].西安:陕西科技大学,2018.
[22]刘素稳.马铃薯蛋白质营养价值评价及功能性质的研究[D].天津:天津科技大学,2008.
[23]HAFEEZ K S, SADIQ B M, KAMRAN S M, et al. Functional properties of protein isolates extracted from stabilized rice bran by microwave, dry heat, and parboiling[J].Journal of Agricultural and Food Chemistry,2011,59(6):2416-2420.
[24]徐杭蓉,于鹏,刘振民.牛奶起泡性的影响因素[J].食品工业,2022,43(6):231-233.
[25]张婷,陈美如,于一丁,等.生物酶解影响蛋白起泡特性的因素及机理研究进展[J].食品科学,2022,43(7):307-313.
[26]史瑞婕,郭丰铭,董亚楠,等.杏鲍菇蛋白质功能特性研究[J].食品科技,2018,43(2):131-136.
[27]温青玉,张康逸,杨帆,等.小麦分离蛋白质理化性质及功能特性研究[J].河南农业科学,2018,47(5):149-154.
[28]周梅,张敏.米糠蛋白的提取及其功能性质的研究[C]//黑龙江省农业工程学会2011学术年会论文集,2011:75-80.
[29]吴加根.谷物与大豆食品工艺学[M].北京:中国轻工业出版社,1995:446-447.
[30]傅亮,田利春.均质条件与大米饮料乳化稳定性关系研究[J].食品与机械,2006,22(3):20-21.

