负载环丙沙星及利福平的聚合物胶束制备及其抗菌性能分析



摘要: 为提高抗生素在病灶感染处的渗透与富集能力,减少单一抗生素在临床上的使用剂量,进一步降低细菌耐药性的风险,采用化学偶联法合成聚乳酸羟基乙酸-透明质酸的两亲性嵌段共聚物用于封装抗生素。该共聚物在水中可自组装为内部疏水、外部亲水的胶束(Micelles, MS),以透析法将疏水药物环丙沙星(Ciprofloxacin, CIP)和利福平(Rifampicin, RFP)封装在MS中,构建了CIP@MS的单一载药胶束及CIP/RFP@MS的双载药胶束;对合成物质的结构、形貌、临界胶束浓度以及载药率进行测试与表征,将MS、CIP@MS、CIP/RFP@MS与金黄色葡萄球菌(Staphylococcus aureus, S.aureus)和大肠埃希菌(Escherichia coli, E.coli)共培养以探索载药胶束的体外抗菌作用,与人脐静脉内皮细胞共培养以评估载药胶束的体外细胞毒性。结果表明:聚乳酸羟基乙酸-透明质酸聚合物在水中可自组装约为142 nm大小的球形胶束,载药后粒径增大约为194 nm;CIP在CIP@MS中的载药率为1.42%,CIP和RFP在CIP/RFP@MS中的载药率分别为1.09%和1.41%;CIP@MS对S.aureus和E.coli的抗菌率分别为27.7%和99.9%,CIP/RFP@MS对S.aureus和E.coli的抗菌率分别达到85.4%和100.0%。该研究为双载药胶束的制备方法及抗菌方面的应用提供了一定的实验基础和理论依据。
关键词: 聚乳酸羟基乙酸;透明质酸;胶束;环丙沙星;利福平;抗菌
中图分类号: TB324文献标志码: A文章编号: 1673-3851 (2024)09-0579-09
引文格式:何清玲,陈柳婷,孙泽月,等. 负载环丙沙星及利福平的聚合物胶束制备及其抗菌性能分析[J]. 浙江理工大学学报(自然科学),2024,51(5):579-587.
Reference Format: HE Qingling, CHEN Liuting, SUN Zeyue, et al. Preparation and antibacterial activity analysis of ciprofloxacin and rifampicin-loaded polymer micelles[J]. Journal of Zhejiang Sci-Tech University,2024,51(5):579-587.Preparation and antibacterial activity analysis of ciprofloxacin
and rifampicin-loaded polymer micelles
HE Qingling CHEN Liuting SUN Zeyue LIU Fei LU Jiaju KONG Xiangdong
(1.School of Materials Science amp; Engineering, Zhejiang Sci-Tech University, Hangzhou 310018, China;
2.Zhejiang Hospital of lntegrated Traditional Chinese and Western Medicine, Hangzhou 310003, China)Abstract:" To improve the penetration and accumulation ability of antibiotics in treating infected lesions, reduce the clinical while minimizing dosage of single antibiotics, and further lowerreducing the risk of bacterial resistance, chemically conjugatedan amphiphilic block copolymer ofcomprising poly(lactic acid-co-glycolic acid) and hyaluronic acid was synthesized via chemical conjugation for the encapsulation of antibiotics. This copolymer can self-assemble into internal hydrophobic and external hydrophilic micellesforms self-assembling micelles (MS) in water, featuring a hydrophobic core and a hydrophobic shell. Hydrophobic drugs, such as ciprofloxacin (CIP) and rifampicin (RFP) were encapsulated in MSwithin these micelles by using dialysis method, resulting inconstructing ciprofloxacin-loaded micelles (CIP@MS) and ciprofloxacin/rifampicin-loaded micelles (CIP/RFP@MS). The synthesized materials were tested and characterized for structure, morphology, critical micelle concentration, and drug loading efficiency of the . In vitro studies involved co-culturing MS, CIP@MS, and CIP/RFP@MS were co-cultured with Staphylococcus aureus (S.aureus) and Escherichia coli (E.coli) to explore theaccess antibacterial effects, in as well as evaluating cytotoxicity vitro, and co-cultured with human umbilical vein endothelial cells to evaluate the cytotoxicity in vitro. The results showed that the copolymer of poly(lactic-co-glycolic acid)-hyaluronic acid could self-assemble into uniform spherical micelles in water with a size of aboutapproximately 142 nm, and its particle size increasedincreasing to 194 nm post-drugapproximately after drug loading. The drug loading efficiency of CIP in CIP@MS was 1.42%, and the drug loading efficiency of CIP and RFPwhile for in CIP/RFP@MS, it was 1.09% for CIP and 1.41% for RFP, respectively. The antibacterial rates of CIP@MS against S.aureus and E.coli were 27.7% and 99.9%, respectively, while the antibacterial rates offor CIP/RFP@MS, rates against S.aureus and E.coli reached 85.4% and 100.0%, respectively. This study providesestablishes an experimental basis and theoretical basis for the preparation method of and the application of dual drug-loaded micelles in antibacterial aspects in some degree.
Key words: poly(d,l-lactide-coglycolide); hyaluronic acid; micelles; ciprofloxacin; rifampicin; antibacterial
0引言
环丙沙星(Ciprofloxacin, CIP)是一种喹诺酮类广谱抗生素,通过干扰阻止DNA合成和复制来抑制细菌生长,广泛用于治疗各种感染和细菌源性疾病[1]。但CIP的溶解度和渗透性较差,静脉注射单一高剂量的CIP可能会引起严重的不良反应并诱导细菌产生耐药性[2-5]。联合使用具有协同效应的2种或2种以上抗生素可以覆盖更为广泛的抗菌谱,显著提高抗生素的抑菌作用,从而降低使用高剂量抗生素产生的不良反应和耐药性风险[6-9]。利福平(Rifampicin, RFP)是一种聚酮类药物,通过抑制细菌RNA的合成达到抗菌作用,在抗结核菌一线用药中占有重要地位[8]。喹诺酮类药物联合RFP可显著提高抗菌效果,降低细菌耐药风险[10-12]。然而,因血液供应不足以及抗生素在感染部位的积累不足等原因,CIP联合RFP的抗菌疗效仍然有限[12-13]。
近年来,聚合物胶束因其具有被动菌靶向、副作用小、药溶性增强和药代动力学改善等突出优势,在抗菌材料领域得到了广泛的研究与开发[14]。载药胶束的纳米尺寸性质有利于其在炎症部位的内皮外泄及在病灶感染处有效积累,并且纳米载体具有较高的表面积,能够解决药物因溶解度低而遇到的递送障碍问题[15-16]。另外,胶束可以保护药物免受酶的降解,增加半衰期和稳定性,最大限度地减少药物副作用,将抗生素药物封装到载体中可以增强抗生素的生物利用度和有效性[17-18]。Chen等[19]制备了负载槲皮素和RFP的聚(ε-己内酯)-单甲氧基聚乙二醇胶束(QRMs),评价了其对耐甲氧西林金黄色葡萄球菌的抗菌活性,发现QRMs可以有效地穿透和去除耐甲氧西林金黄色葡萄球菌的生物膜,加速细菌中活性氧的积累以达到持续的抗菌效果。
聚乳酸羟基乙酸(Poly (d,l-lactide-coglycolide), PLGA)是一种人工合成的可生物降解共聚物,已被批准用于药物递送;此外,透明质酸(Hyaluronic acid, HA)是一种亲水性的天然多糖,具有无毒、无免疫原性和可生物降解等优点[20]。在各种药物递送系统中,基于PLGA的药物载体已被深入研究,例如:Gheffar等[21]使用纳米沉淀法合成负载CIP的PLGA聚合物基纳米粒子用于金黄色葡萄球菌的抗菌活性研究;Wu等[22]使用乳化溶剂蒸发法将亲水性HA与含有多黏菌素B(PMB)的PLGA结合形成HA@PLGA-PMB纳米粒子用于雾化治疗肺部感染;Hlaing等[23]将姜黄素封装于HA偶联的PLGA纳米颗粒中用于治疗溃疡性结肠炎。尽管将HA和PLGA结合的纳米粒子作为抗菌剂的药物递送系统已进行了大量研究,但将它们结合形成胶束并负载双抗生素抗菌的研究报道较少。
本文利用具有良好生物相容性的材料PLGA和HA,通过还原胺化法将HA连接于PLGA上合成PLGA-b-HA的两亲性嵌段共聚物,PLGA-b-HA在水中可自组装为内部疏水、外部亲水的胶束(Micelles, MS),并以透析法将疏水药物CIP及RFP封装在MS中,构建了CIP@MS的单一载药胶束及CIP/RFP@MS的双载药胶束,评价了胶束的形态、粒径分布、载药率、包封率、抗菌性能及其对细胞的毒性,并探讨了单一载药及双载药胶束的抗菌性能,为双载药胶束的制备方法及抗菌方面的应用提供了一定的理论基础。
1实验部分
1.1实验材料及仪器实验材料:PLGA购自上海源叶生物科技有限公司;HA(分子量7 kDa)、氰基硼氢化钠和N-N二异丙基乙胺均购自上海易恩化学技术有限公司;丁二胺购自上海麦克林生化科技股份有限公司;N-羟基琥珀酰亚胺(NHS)、1-(3二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCL)、RFP和CIP均购自阿拉丁试剂有限公司;透析袋(截留分子量8 kDa)购自上海亿欣生物科技有限公司;其他试剂均为分析纯。
菌株:金黄色葡萄球菌(Staphylococcus aureus, S.aureus)来源于CICC库10384菌株,大肠埃希菌(Escherichia coli, E.coli)来源于CICC库10389菌株。
实验仪器:傅里叶变换红外光谱仪(Nicolte 5700, 美国);核磁共振波谱仪(Avance AV 400MHz, 瑞士);动态光散射仪(Zetasizer Nano ZS, 英国);透射电子显微镜(JEM-2100, 日本);扫描电子显微镜(ZEISS Gemini 500, 德国);紫外-可见光分光光度计(P7 Double Beam Spectrophotometer, 上海美谱达仪器有限公司);荧光分光光度计(Fluoromax, 美国)。
1.2实验方法
1.2.1PLGA-b-HA嵌段共聚物的制备PLGA-b-HA制备方法参考文献[24],具体方法如下:
a)HA-NH2合成。取2.0 g HA溶解于60 mL乙酸盐缓冲液(pH值为5.6),在磁力搅拌下将2 mL的丁二胺添加到HA溶液中,在50 ℃下搅拌24 h形成亚胺,并加入1.2 g氰基硼氢化钠搅拌72 h;反应结束后,将反应溶液装入透析袋中,在去离子水中透析3 d,每6 h更换一次透析液,透析结束后将袋内溶液冻干待用。
b)PLGA-NHS合成。取1.0 g的PLGA溶解于10 mL的二氯甲烷中,分别加入48 mg的NHS和80 mg的EDC·HCL,在室温下密封并磁力搅拌24 h,反应结束后用冰冷的乙醚析出沉淀产物,再用冰冷的乙醚/甲醇(50/50, v/v)混合液洗涤3次以去除过量的NHS和EDC·HCL,最后将纯化后的产物真空干燥待用。
c)PLGA-b-HA合成。取0.5 g的PLGA-NHS和0.5 g的HA-NH2,分散到20 mL的DMSO中,再加入20 μL的N,N-二异丙基乙胺,在50 ℃下磁力搅拌48 h。反应结束后将该溶液装入透析袋中,在去离子水中透析3 d以纯化产物,平均每6 h更换一次透析液,透析结束后将袋内溶液冻干待用。
1.2.2MS制备将10 mg PLGA-b-HA溶解于1 mL的DMSO中搅拌15 min,缓慢滴加3 mL的去离子水,再搅拌15 min后,将溶液装入透析袋在去离子水中透析6 h除去多余的有机溶剂,最终加去离子水定容至5 mL,获得质量浓度为2 mg/mL的MS。
1.2.3CIP@MS制备将CIP溶于HAc中配成质量浓度为1 mg/mL的CIP溶液,在烧杯中加入10 mg的PLGA-b-HA和1.0 mL的DMSO,磁力搅拌下缓慢滴加0.5 mL的CIP溶液和1.0 mL的去离子水于烧杯中继续搅拌15 min,转入透析袋中透析6 h制备的胶束过0.45 μm的滤膜除去未包载的CIP,然后加去离子水定容至5.0 mL得到质量浓度为2 mg/mL的CIP@MS。冻干后备用
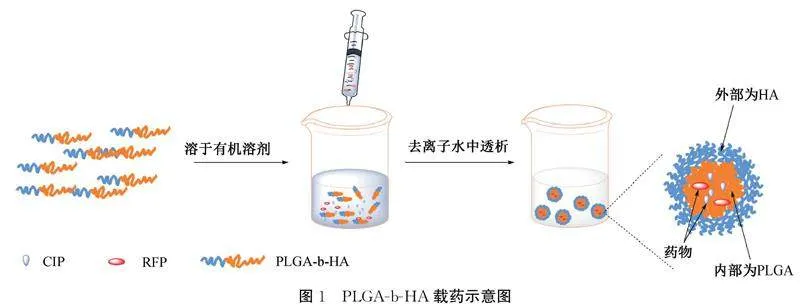
1.2.4CIP/RFP@MS制备将CIP和RFP分别溶于HAc和DMSO中配成质量浓度均为1 mg/mL的CIP和RFP溶液,各取0.5 mL得到1.0 mL的混合溶液。在烧杯中加入10 mg的PLGA-b-HA和1.0 mL的DMSO,磁力搅拌下缓慢滴加1.0 mL的混合溶液和1.0 mL的去离子水于烧杯中继续搅拌15 min,后续操作与CIP@MS载药胶束的制备方法相一致,PLGA-b-HA载药示意图如图1所示。
1.3测试与表征
1.3.1核磁共振氢谱测试将HA溶于DMSO-d6,PLGA-b-HA分别溶于DMSO-d6和D2O中,使用核磁共振波谱仪进行核磁共振氢谱(1H Nuclear magnetic resonance spectra,1H NMR)测试。
1.3.2傅里叶变换红外光谱测试使用傅里叶变换衰减全反射红外光谱(Attenuated total internal reflectance fourier transform infrared spectroscopy, ATR-FTIR)仪对HA-NH2、PLGA-NHS、PLGA-b-HA材料进行测试,设置波长范围为4000~500 cm-1。
1.3.3临界胶束浓度测试采用芘荧光探针法测定PLGA-b-HA嵌段共聚物的临界胶束浓度(Critical micelle concentration, CMC),荧光分光光度计的激发光谱测定条件为:固定发射波长390 nm,检测激发波长300~360 nm。将聚合物质量浓度分别调制为:5×10-5、1×10-4、5×10-4、1×10-3、2×10-3、5×10-3、8×10-3、1×10-2、2×10-2、5×10-2 mg/mL和10×10-2 mg/mL进行测试。以芘在336 nm和334 nm处的荧光强度比值(I336/I334)对LogC作图,突变点的计算采用Origin进行分段线性模拟,2条直线的交点处即为PLGA-b-HA的CMC。
1.3.4粒径及电位测试使用动态光散射仪(Dynamic light scattering, DLS)测定胶束载药前后的粒径及电位变化。
1.3.5透射电子显微镜表征使用透射电子显微镜(Transmission electron microscope, TEM)观察经过磷钨酸负染色液处理后的胶束微观形貌。
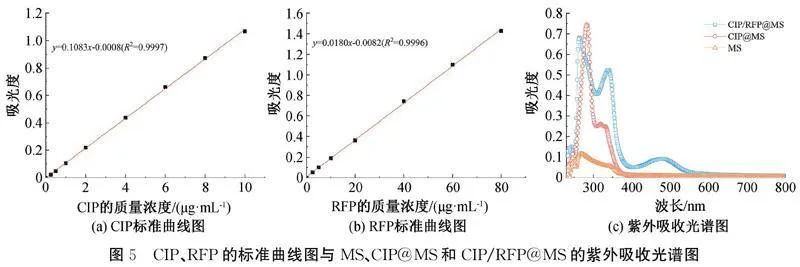
1.3.6紫外-可见光分光光度计测试分别配制质量浓度为10 μg/mL的CIP溶液和100 μg/mL的RFP溶液,梯度稀释后分别测量CIP在波长为280 nm处的吸光度和RFP在344 nm处的吸光度,绘制CIP和RFP的标准曲线,得出标准曲线方程。将冻干后的PLGA-b-HA嵌段共聚物、负载CIP的PLGA-b-HA嵌段共聚物以及负载CIP/RFP的PLGA-b-HA嵌段共聚物溶于DMSO中进行紫外吸收光谱曲线测量,参照CIP和RFP的标准曲线,依据式(1)和式(2)计算包封率和载药率:
X/%=m1/m2×100 (1)
其中:X为胶束中药物的包封率,%;m1为载入胶束b的药物质量,g;m2为投入的药物总质量,g。
Y/%=m1/m×100 (2)
其中:Y为胶束中药物的载药率,%;m1为载入胶束的药物质量,g;m为载入胶束的药物质量与胶束载体质量之和,g。
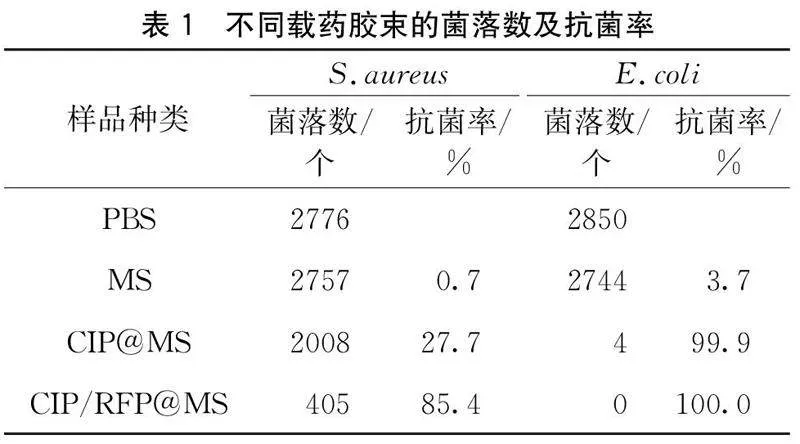
1.3.7抗菌性能测试抗菌测试方法参考文献[10]和文献[25],将S.aureus和E.coli分别接种于Luria-Bertani(LB)培养液中,置于37 ℃震荡培养箱振荡培养过夜,用紫外-可见光分光光度计调整菌液吸光度(OD600)为0.1,并用LB稀释至1×106个/mL的浓度备用。取100 μL质量浓度均为20 μg/mL的MS、CIP@MS和CIP/RFP@MS分别与100 μL的S.aureus和E.coli于96孔板中共培养4 h后进行SEM表征;继续共培养24 h后,分别稀释105和104倍进行平板涂布测试,将细菌与磷酸盐缓冲液(Phosphate buffer saline, PBS)共培养设置为空白对照组,最终使用图像处理软件(ImageJ, NIH, USA)进行平板菌落计数,并计算抗菌率。
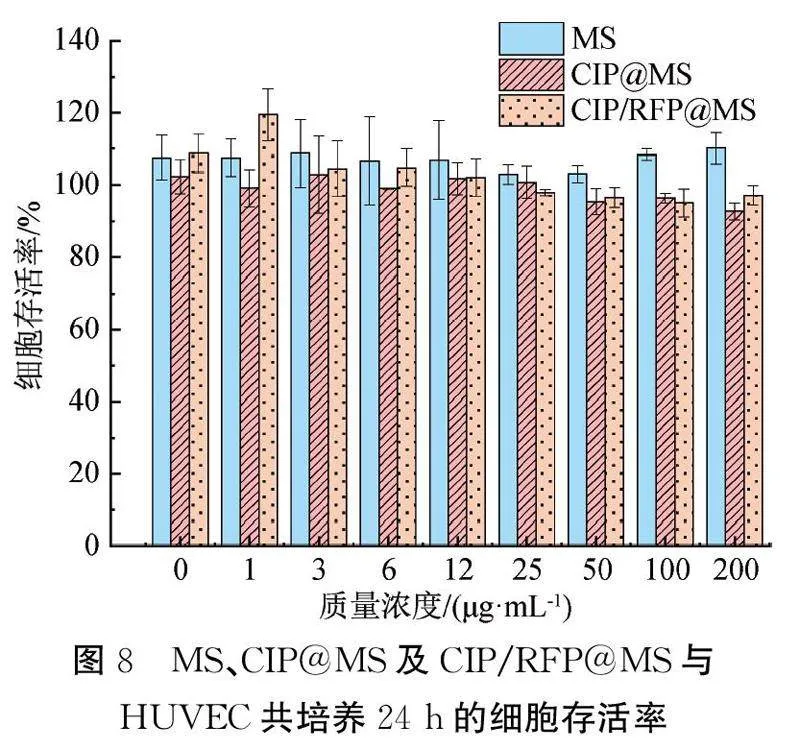
1.3.8细胞毒性测试以人脐静脉内皮细胞(Human umbilical vein endothelial cell, HUVEC)为细胞模型,将生长状态良好的细胞以104个/孔的密度接种于96孔板中,在细胞培养箱中培养24 h使细胞贴壁;将不同质量浓度的MS、CIP@MS和CIP/RFP@MS与HUVEC共培养24 h,使用MTT法评估材料对细胞的毒性。
2结果与讨论
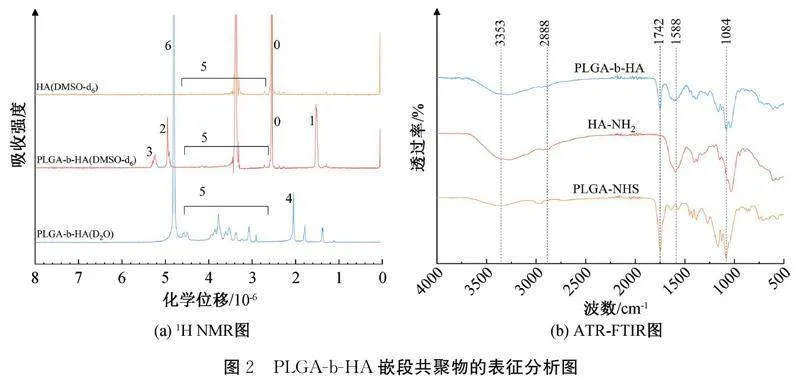
2.1PLGA-b-HA嵌段共聚物的表征与分析图2(a)为HA溶于DMSO-d6、PLGA-b-HA分别溶于DMSO-d6和D2O中的1H NMR图。图2(a)显示:图谱中0为DMSO-d6溶剂峰,1~3为PLGA中的特征峰,4和5为HA的特征峰,6为D2O溶剂峰;当PLGA-b-HA溶解在DMSO-d6中时,同时出现PLGA和HA的特征峰,而当其溶解到D2O中时PLGA的特征峰消失,出现HA的特征峰,这是由于PLGA-b-HA在重水中形成了核-壳结构的纳米粒,PLGA的疏水核心被HA外壳所屏蔽[24],1H NMR结果初步证明PLGA-b-HA嵌段共聚物的合成。为进一步验证PLGA-b-HA的结构,对PLGA-NHS、HA-NH2和PLGA-b-HA进行ATR-FTIR测试,结果如图2(b)所示。由图2(b)可知:HA-NH2在3353 cm-1和2888 cm-1处出现宽峰,对应于O—H伸缩振动峰和C—H伸缩振动峰,PLGA-NHS在1742 cm-1处出现明显的尖峰,对应于CO伸缩振动峰。合成的PLGA-b-HA在图中表现为HA-NH2和PLGA-NHS的混合光谱,在1742 cm-1处的羰基伸缩振动峰与3353 cm-1处的羟基伸缩振动峰在图谱中同时出现,且羟基伸缩振动峰相较于PLGA的明显增强,在1084 cm-1处对应于C—O—C的伸缩振动峰相较于HA的明显增强[26-27]。以上结果表明成功合成PLGA-b-HA嵌段共聚物。
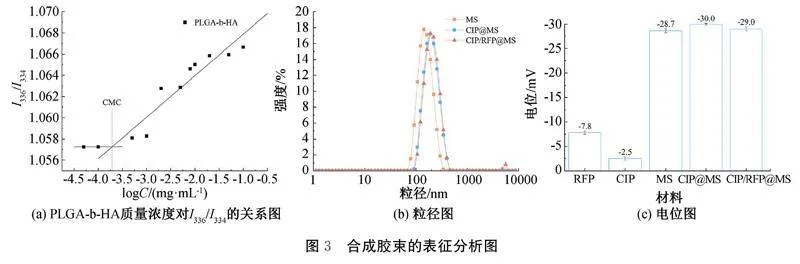
2.2胶束的合成表征及分析图3(a)为PLGA-b-HA质量浓度对I336/I334的关系图,随着PLGA-b-HA质量浓度的增大,芘荧光激发波长从334 nm红移到336 nm,两条直线交点处为CMC的值:0.2 mg/L,低CMC值表明PLGA-b-HA在较低的质量浓度下可形成胶束并保持良好的稳定性,具备成为载药聚合物胶束的潜质。图3(b)为MS、CIP@MS、CIP/RFP@MS的粒径图,MS的平均粒径为142 nm,负载CIP后的胶束平均粒径增大为190 nm,共同负载CIP和RFP后的胶束平均粒径为194 nm,载药后的胶束粒径逐渐增大,但大部分的胶束粒径小于200 nm,有利于胶束在感染病灶处的渗透富集。图3(c)显示CIP、RFP、MS、CIP@MS、CIP/RFP@MS的Zeta电位依次为:-7.8、-2.5、-28.7、-30.0 mV和-29.0 mV,胶束在载药前后的电位变化不明显,其原因可能是药物含量较低,对胶束的电位影响较小。
从图4可以看出:3种胶束均具有球状形貌和明显的双层结构,大小均在200 nm以内;MS的分散性较好,CIP@MS的大小较均一,CIP/RFP@MS的粒径较大,其差异的原因可能是在载药过程中,药物、溶剂和载体之间形成了一定的相互作用;胶束的形成及稳定可以通过丁达尔效应侧面印证,当光束通过含有纳米颗粒的胶体分散体系时,从垂直入射光方向可以观察到体系中出现一条光亮的“通路”,该现象被称为丁达尔效应[28]。图4的右上方插图分别为MS、CIP@MS、CIP/RFP@MS丁达尔效应示意图,在3个体系中均出现明显的光通路,进一步说明MS、CIP@MS、CIP/RFP@MS体系中均形成胶束,且具有良好的稳定性。
2.3药物标准曲线及胶束载药率测定通过紫外-可见光分光光度计测试获得了CIP和RFP的标准曲线以及冻干后负载药物聚合物的紫外吸收光谱图,结果如图5所示。图5(a)和图5(b)显示:CIP和RFP在各自的质量浓度范围内具有较好的线性关系。由图5(c)紫外吸收峰的变化可知:药物成功负载,CIP在CIP@MS中的载药率为1.42%,包封率为28.30%;CIP和RFP在CIP/RFP@MS中的载药率分别为1.09%和1.41%,包封率分别为21.80%和28.10%。
2.4抗菌测试表征及分析图6为S.aureus和E.coli分别与不同载药胶束共培养4 h的SEM图,其中红色箭头标识为被破坏的细菌。与图6(a)PBS组相比,图6(b)MS组中2种细菌的形貌基本没有发生变化,均具有独立、完整的形貌结构,MS未表现出对细菌细胞膜的破坏;图6(c)CIP@MS组中大多数S.aureus形貌仍保持为原来的球形完整结构,小部分S.aureus的膜结构出现了破损现象,部分E.coli细胞膜出现融合现象,其膜结构界限不再清晰分明;图6(d)CIP/RFP@MS组中可以明显的观察到S.aureus和E.coli的形貌和结构均出现了严重破损,大量的S.aureus已不具有完整的球型结构,大量的E.coli出现了更为严重的膜融合现象,细菌结构坍塌;相对于CIP@MS,CIP/RFP@MS对2种细菌膜结构的破坏作用更为显著,表现出显著的杀菌作用。E.coli对CIP较为敏感,CIP通过靶向细菌DNA旋转酶,抑制细菌DNA的合成,达到抗菌效果;S.aureus对RFP较为敏感,RFP通过与细菌的RNA聚合酶结合抑制细菌生长[29-31]。在本文的载药体系中,药物封装于胶束内部,胶束与细菌共培养时,药物从胶束中释放并作用于细菌,抑制细菌DNA或RNA合成,促使细胞膜破裂,最终实现抗菌作用。
为进一步分析载药胶束的抗菌性能,将载药胶束与细菌继续共培养24 h后进行平板涂布测试,结果如图7和表1所示。与图7(a)PBS组相比,图7(b)MS组中S.aureus和E.coli的菌落个数与PBS组的菌落个数相差都较小,几乎没有表现出抗菌效果;在载药胶束中,图7(c)CIP@MS组对S.aureus具有一定的抗菌效果,抗菌率达到27.7%,对E.coli表现出显著的杀菌效果,抗菌率达到99.9%;图7(d)CIP/RFP@MS组的抗菌效率较为明显,对S.aureus的抗菌率达到85.4%,对E.coli的抗菌率达到了100.0%。CIP@MS对E.coli的抗菌率明显高于对S.aureus的抗菌率,而CIP/RFP@MS对2种细菌的抗菌效果优于CIP@MS,载药胶束中CIP与RFP表现出协同作用。由图6和图7的结果可知,当S.aureus和E.coli分别与不同载药胶束共培养4 h和24 h时,MS、CIP@MS、CIP/RFP@MS在对细菌的破坏作用上具有一致性,S.aureus对RFP较为敏感,E.coli对CIP较为敏感,2种药物共同负载于胶束载体中,可拓宽抗生素谱,减少单一药物剂量。
2.5细胞毒性测试表征及分析将不同质量浓度的MS、CIP@MS、CIP/RFP@MS与HUVEC共培养24 h,测定细胞活性,结果如图8所示。由图8可知:随着MS、CIP@MS、CIP/RFP@MS质量浓度的不断增加,MS组的细胞存活率无明显下降,质量浓度增加到200 μg/mL时,CIP@MS组和CIP/RFP@MS组细胞存活率略有下降,但均保持在95%以上,表明3种胶束对HUVEC的细胞毒性较小,具有潜在的临床转化应用。
3结论
本文将PLGA和HA改性后通过缩聚反应合成了PLGA-b-HA两亲性嵌段共聚物,制备了可同时负载CIP和RFP的载药纳米胶束,探讨了MS、CIP@MS和CIP/RFP@MS对S.aureus和E. col的抗菌性能,并评估了胶束对HUVEC的体外细胞毒性,所得结论如下:
a)PLGA-b-HA嵌段共聚物在水溶液中自组装形成胶束的CMC较低,胶束呈圆球状形貌,表面具有一定负电荷,粒径分布于100~200 nm之间,具有良好的分散性和稳定性;
b)双载药胶束对S.aureus的抗菌率达到85%以上,对E.coli的抗菌性能达到100%,载药胶束中CIP与RFP表现出协同抗菌作用;
c)MS、CIP@MS和CIP/RFP@MS对HUVEC的体外细胞毒性较小,具有潜在的临床转化应用。
参考文献:
[1]史玉敏, 严恒, 王俊, 等. 氟喹诺酮类杂合体的抗耐药菌活性[J]. 中国抗生素杂志, 2023, 48(11):1273-1280.
[2]Zhang L L, Bao M, Liu B, et al. Effect of andrographolide and its analogs on bacterial infection: A review[J]. Pharmacology, 2020, 105(3/4): 123-134.
[3]Gao W W, Thamphiwatana S, Angsantikul P, et al. Nanoparticle approaches against bacterial infections[J]. Nanomedicine and Nanobiotechnology, 2014, 6(6): 532-547.
[4]Lu C B, Xiao Y, Liu Y Y, et al. Hyaluronic acid-based levofloxacin nanomicelles for nitric oxide-triggered drug delivery to treat bacterial infections[J]. Carbohydrate Polymers, 2020, 229: 115479.
[5]Douafer H, Andrieu V, Phanstiel O, et al. Antibiotic adjuvants: Make antibiotics great again![J]. Journal of Medicinal Chemistry, 2019, 62(19): 8665-8681.
[6]Coates A R M, Hu Y, Holt J, et al. Antibiotic combination therapy against resistant bacterial infections: Synergy, rejuvenation and resistance reduction[J]. Expert Review of Anti-infective Therapy, 2020, 18(1): 5-15.
[7]Sullivan G J, Delgado N N, Maharjan R, et al. How antibiotics work together: Molecular mechanisms behind combination therapy[J]. Current Opinion in Microbiology, 2020, 57: 31-40.
[8]Hardie K R, Fenn S J. JMM profile: Rifampicin: A broad-spectrum antibiotic[J]. Journal of Medical Microbiology, 2022, 71(8):1566-1571.
[9]Qiao Z W, Yuan Z, Zhang W P, et al. Preparation, in vitro release and antibacterial activity evaluation of rifampicin and moxifloxacin-loaded poly(d,l-lactide-co-glycolide)microspheres[J]. Artificial Cells Nanomedicine and Biotechnology, 2019, 47(1): 790-798.
[10]Kang Y R, Chung D R, Ko J H, et al. Comparing the synergistic and antagonistic interactions of ciprofloxacin and levofloxacin combined with rifampin against drug-resistant staphylococcus aureus: A time-kill assay[J]. Antibiotics, 2023, 12(4): 711-723.
[11]Miranda C L, Yus C, Remirez D G C, et al. Combinatorial wound dressings loaded with synergistic antibiotics in the treatment of chronic infected wounds[J]. Chemical Engineering Journal, 2023, 476: 146679.
[12]Yeh Y C, Huang T H, Yang S C, et al. Nano-based drug delivery or targeting to eadicate bacteria for infection mitigation: A review of recent advances[J]. Frontiers in Chemistry, 2020, 8: 286-308.
[13]Yang X, Domalaon R, Lyu Y F, et al. Tobramycin-linked efflux pump inhibitor conjugates synergize fluoroquinolones, rifampicin and fosfomycin against multidrug-resistant Pseudomonas aeruginosa[J]. Journal of Clinical Medicine, 2018, 7(7): 158-170.
[14]Wang S T, Gao Y F, Jin Q, et al. Emerging antibacterial nanomedicine for enhanced antibiotic therapy[J]. Biomaterials Science, 2020, 8(24): 6825-6839.
[15]Walvekar P, Gannimani R, Govender T. Combination drug therapy via nanocarriers against infectious diseases[J]. European Journal of Pharmaceutical Sciences, 2019, 127: 121-141.
[16]Nwabuife J C, Omolo C A, Govender T. Nano delivery systems to the rescue of ciprofloxacin against resistant bacteria “E." coli; P." aeruginosa; Saureus; and MRSA” and their infections[J]. Journal of Controlled Release, 2022, 349: 338-353.
[17]Wassif R K, Elkayal M, Shamma R N, et al. Recent advances in the local antibiotics delivery systems for management of osteomyelitis[J]. Drug Delivery, 2021, 28(1): 2392-2414.
[18]Baptista P V, McCusker M P, Carvalho A, et al. Nano-strategies to fight multidrug resistant bacteria-“a battle of the titans”[J]. Frontiers in Microbiology, 2018, 9: 1441-1467.
[19]Chen Y X, Zhao Q, Han J H, et al. Dual drug loaded pH-sensitive micelles for efficient bacterial infection treatment[J]. Pharmaceutical Research, 2022, 39(6): 1165-1180.
[20]Klodzinska S N, Wan F, Jumaa H, et al. Utilizing nanoparticles for improving anti-biofilm effects of azithromycin: A head-to-head comparison of modified hyaluronic acid nanogels and coated poly (lactic-co-glycolic acid)nanoparticles[J]. Journal of Colloid and Interface Science, 2019, 555: 595-606.
[21]Gheffar C, Le H, Jouenne T, et al. Antibacterial activity of ciprofloxacin-loaded poly (lactic-o-glycolic acid)-nanoparticles against Staphylococcus aureus[J]. Particle amp; Particle Systems Characterization, 2021, 38(1): 2000253.
[22]Wu J, Zhai T S, Sun J, et al. Mucus-permeable polymyxin B-hyaluronic acid/poly (lactic-co-glycolic acid)nanoparticle platform for the nebulized treatment of lung infections[J]. Journal of Colloid and Interface Science, 2022, 624: 307-319.
[23]Hlaing S P, Cao J, Lee J, et al. Hyaluronic acid-conjugated PLGA nanoparticles alleviate ulcerative colitis via CD44-mediated dual targeting to inflamed colitis tissue and macrophages[J]. Pharmaceutics, 2022, 14(10): 2118-2136.
[24]Huang J B, Zhang H, Yu Y, et al. Biodegradable self-assembled nanoparticles of poly (d,l-lactide-co-glycolide)/hyaluronic acid block copolymers for target delivery of docetaxel to breast cancer[J]. Biomaterials, 2014, 35(1): 550-566.
[25]Maurya D K. Colonycountj: A user-friendly image j add-on program for quantification of different colony parameters in clonogenic assay[J]. Journal of Clinical Toxicology, 2017, 7(5): 1-4.
[26]Lee H, Ahn C H, Park T G. Poly [lactic-co-(glycolic acid)]-grafted hyaluronic acid copolymer micelle nanoparticles for target-specific delivery of doxorubicin[J]. Macromolecular Bioscience, 2009, 9(4): 336-342.
[27]Albano C, Gonzalez G, Palacios J, et al. PLLA-HA vs. PLGA-HA characterization and comparative analysis[J]. Polymer Composites, 2013, 34(9): 1433-1442.
[28]Ghomi A R G, Mohammadi-Khanaposhti M, Vahidi H, et al. Fungus-mediated extracellular biosynthesis and characterization of zirconium nanoparticles using standard penicillium species and their preliminary bactericidal potential: A novel biological approach to nanoparticle synthesis[J]. Iranian Journal of Pharmaceutical Research, 2019, 18(4): 2101-2110.
[29]Robertson G T, Bonventre E J, Doyle T B, et al. In vitro evaluation of CBR-2092, a novel rifamycin-quinolone hybrid antibiotic: Studies of the mode of action in Staphylococcus aureus[J]. Antimicrobial Agents and Chemotherapy, 2008, 52(7): 2313-2323.
[30]Piddock L J V, Jin Y F, Ricci V, et al. Quinolone accumulation by Pseudomonas aeruginosa, Staphylococcus aureus and Escherichia coli[J]. Journal of Antimicrobial Chemotherapy, 1999, 43(1): 61-70.
[31]Weinstein M P, Deeter R G, Swanson K A, et al. Crossover assessment of serum bactericidal activity and pharmacokinetics of ciprofloxacin alone and in combination in healthy elderly volunteers[J]. Antimicrobial Agents and Chemotherapy, 1991, 35(11): 2352-2358.
(责任编辑:廖乾生)

