CT引导下射频消融术治疗肺癌的疗效及对血清肿瘤指标的调节作用
【摘要】目的 探讨肺癌患者应用CT引导下射频消融术治疗的效果及对血清肿瘤指标、生存质量、生存情况等的影响。方法 回顾性分析国药东风茅箭医院2019年12月至2022年12月收治的61例肺癌患者的临床资料,依据治疗方法不同将其分为A组(30例)、B组(31例)。两组患者均采用化疗治疗,3周为1个疗程,治疗4个疗程,B组于化疗前采用CT引导下射频消融术治疗,均随访观察1年。比较两组患者治疗4个疗程后的临床疗效,治疗前及治疗4个疗程后的血清肿瘤指标、生存质量评分,以及治疗期间不良反应发生情况,随访1年生存率。结果 治疗4个疗程后,B组患者疾病控制率较A组更高;与治疗前比,治疗4个疗程后两组患者血清糖类抗原125(CA125)、糖类抗原153(CA153)、血管内皮生长因子(VEGF)、促血管生成素-2(Ang-2)水平及欧洲癌症研究与治疗组织生命质量测定量表(EORTC QLQ-C30)中单项测试项目评分、症状量表评分均降低,且B组均低于A组;与治疗前比,治疗4个疗程后两组患者EORTC QLQ-C30中功能量表、整体生活质量量表评分均升高,且B组均高于A组;B组1年生存率高于A组(均Plt;0.05);两组咳血、气胸、胃肠道反应、骨髓抑制、脱发、胸腔积液等发生率经比较,差异均无统计学意义(均Pgt;0.05)。结论 肺癌患者化疗前联合CT引导下射频消融术治疗的效果显著,有助于下调血清肿瘤标志分子表达,改善患者生存质量,延长生存期,且安全性良好。
【关键词】肺癌 ; CT引导下射频消融术 ; 化疗 ; 肿瘤标志物 ; 生活质量 ; 生存率
【中图分类号】R734 【文献标识码】A 【文章编号】2096-3718.2024.16.0076.04
DOI:10.3969/j.issn.2096-3718.2024.16.025
肺癌在发病初期多无明显临床表现,但随着病情进展,患者可出现咳嗽、胸痛、呼吸困难等症状,且此时就诊病情多已处于中晚期,错失手术最佳治疗时期,使得化疗方案成为患者积极治疗的手段。化疗方案主要是通过应用化疗药物杀灭肿瘤细胞,控制肿瘤生长,进而延长患者生命周期,但其应用效果易受患者耐药性影响,使得个体差异较明显[1]。CT引导下射频消融术主要是通过将能量积聚于肿瘤组织中,升高肿瘤区域温度,进而抑制肿瘤生长,临床常用于肝癌患者的辅助治疗中,且已取得良好效果[2-3]。但目前关于其应用于肺癌的疗效及对患者血清肿瘤指标的调节作用尚需进一步探讨,基于此,本研究通过选取61例肺癌患者进行回顾性研究,旨在分析化疗前应用CT引导下射频消融术的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析国药东风茅箭医院2019年12月至2022年12月收治的61例肺癌患者的临床资料,依据治疗方法不同将其分为A组(30例)、B组(31例)。A组患者年龄40~74岁,平均(65.07±4.85)岁;男、女性患者分别为14、16例;病理分期[4]:Ⅲ、Ⅳ期分别为18、12例;肿瘤直径4~7 cm,平均(5.50±0.73) cm。B组患者年龄40~75岁,平均(64.74±4.96)岁;男、女性患者分别为13、18例;病理分期:Ⅲ、Ⅳ期分别为17、14例;肿瘤直径3~7 cm,平均(5.42±0.68) cm。上述资料组间比较,差异无统计学意义(Pgt;0.05),可比。纳入标准:⑴符合《2010中国肺癌临床指南∶中国肺癌临床指南》 [5]中的诊断标准;⑵临床资料完整;⑶首次确诊,单侧病灶数 ≤3个,病灶最大直径≤8 cm。排除标准:⑴严重脑、肝、肾等功能不全;⑵伴有其他原发恶性肿瘤;⑶合并肺结核、肺炎等其他肺部疾病;⑷既往接受过放化疗。本研究经国药东风茅箭医院医学伦理委员会批准。
1.2 治疗方法 A组患者采用化疗治疗:用药前1周补充维生素、叶酸。于化疗前1 d及当天口服地塞米松片(福州海王福药制药有限公司,国药准字H35021170,0.75 mg/片),剂量4.5 mg/次,2次/d;化疗第1天静脉滴注注射用培美曲塞二钠(湖南科伦制药有限公司,国药准字H20223539,规格:100 mg),剂量500 mg/(m2·次),滴注时间:15 min;化疗第1~4天避光静脉滴注注射用顺铂(锦州九泰药业有限责任公司,国药准字H21020212,规格:20 mg),剂量75 mg/(m2·次),1次/d。3周为1个疗程,治疗4个疗程。
B组在化疗前先开展CT引导下射频消融术:术前4 h禁食、禁水,肌肉注射注射用尖吻蝮蛇血凝酶(北京康辰药业股份有限公司,国药准字H20080633,规格:1 U)1 000 U及皮下注射盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司,国药准字H21022436,规格:1 mL∶10 mg)10 mg,建立静脉通路,予以吸氧、心电监护,并贴电极片。依据病灶位置,选择合适的体位(俯卧位或仰卧位),不透X射线的栅栏格放于病变大体位置,使用64排螺旋CT扫描仪(美国GE公司,型号:Optima 680),120 kV,100 mA,层厚3 mm,进行三维重建显示病变部位与周围组织关系,开展多靶点消融。首先CT小范围扫描,以设计进针路线,注意避开肺大泡、大血管及肋骨,并精准测量进针的深度与角度,体表标记进针点,常规消毒铺巾,局部麻醉,在CT引导下,采取分步进针法,将可调单极RFA电极针穿刺至肿块内,通过CT快速重建矢状位和冠状位,确定针尖准确到达预定位置并对RFA电极覆盖瘤体的情况进行观察。随后,连接射频治疗仪(STARmed Co., Ltd.,型号:VRS01),调节功率,开始肿瘤射频治疗。对于肿瘤直径lt;4 cm者,电极针1次便可将全部瘤体覆盖;而肿瘤直径≥ 4 cm或瘤体不规则者,调整射频针位置,行单次多点叠加适形消融。消融功率、时间根据肿瘤直径及患者耐受情况而定,RFA功率:60~100 W,时间:10 min,温度:85 ℃,术中CT扫描评估射频效果。RFA完成后,消融穿刺针道,防止出血和预防肿瘤针道种植转移。术后穿刺侧在下卧床24 h,常规心电监护、吸氧、抗感染、止血等对症治疗,持续使用抗感染药物3~5 d,必要时24~48 h后拍胸片或CT扫描,观察是否有不良反应发生,并予以相应的对症治疗。化疗方案与A组相同。两组患者均于化疗4个疗程后定期随访1年。
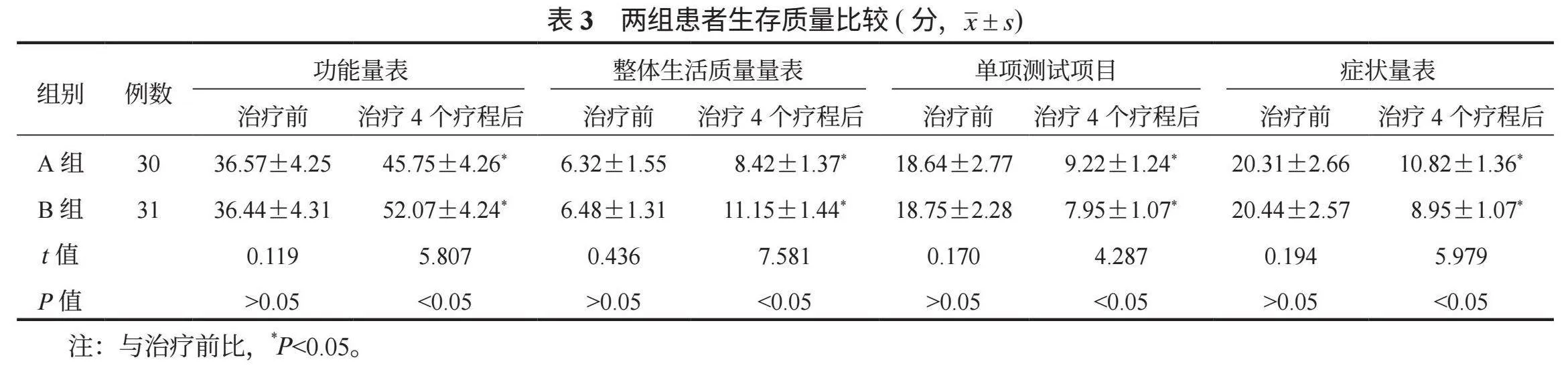
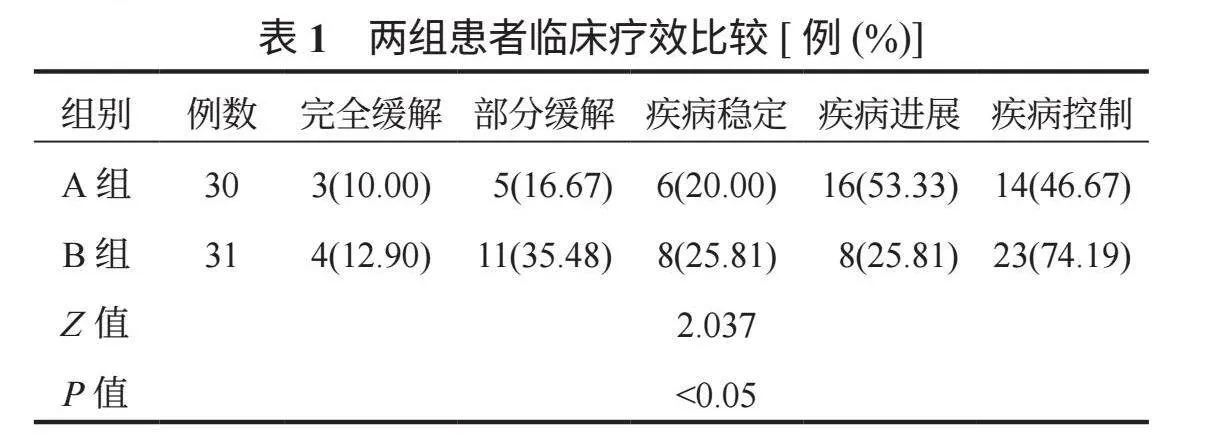
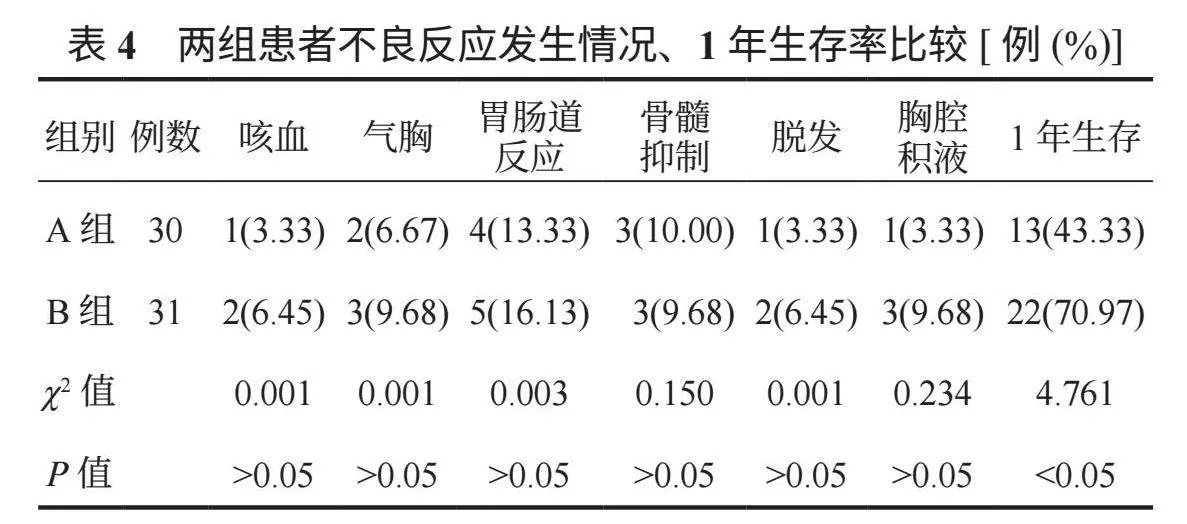
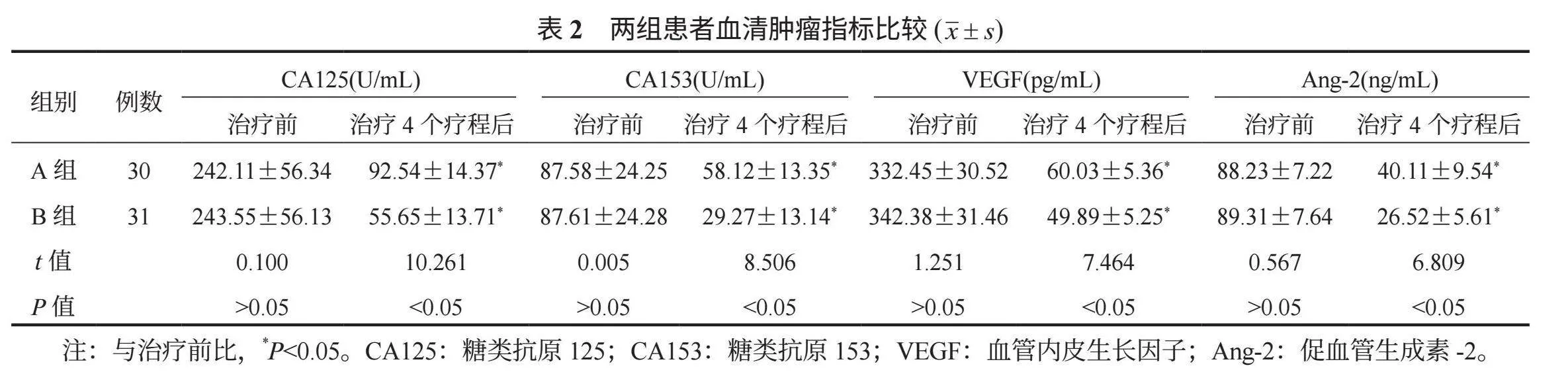
1.3 观察指标 ⑴临床疗效。治疗4个疗程后,依据《2010中国肺癌临床指南∶中国肺癌临床指南》 [5]评估患者临床疗效,可分为完全缓解:增强CT值lt;5 HU,瘤内无血供,病灶完全消融;部分缓解:增强CT值为5~15 HU,瘤内有少量血供,肿瘤体积变小;疾病稳定:增强CT值为15lt;~30 HU,瘤内有较多血供,肿瘤体积无变化;疾病进展:增强CT值gt;30 HU,瘤内血供丰富,肿瘤体积变大。疾病控制率=完全缓解率+部分缓解率+疾病稳定率。⑵血清肿瘤指标。治疗前及治疗4个疗程后取患者空腹静脉血3 mL,离心(10 min,3 500 r/min)分离上层血清,检测血清糖类抗原125(CA125)、糖类抗原153(CA153)含量,检测方法为电化学免疫发光法;检测血清血管内皮生长因子(VEGF)、促血管生成素-2(Ang-2),检测方法为酶联免疫吸附法。⑶生存质量。分别于治疗前及治疗4个疗程后使用欧洲癌症研究与治疗组织生命质量测定量表(EORTC QLQ-C30) [6]评估患者生活质量,该量表包括30个条目:功能量表(总分值15~60分,共15个条目)、整体生活质量量表(总分值2~14分,共2个条目)、单项测试项目(总分值6~24分,共6个条目)、症状量表(总分值7~28分,共7个条目),其中单项测试项目、症状量表得分越高,表明患者对应症状越严重,功能量表、整体生活质量量表得分越高,表明患者功能、整体生活质量越佳。⑷不良反应、1年生存率。统计患者咳血、气胸、胃肠道反应、骨髓抑制、脱发、胸腔积液等不良反应发生情况,以及随访1年内生存情况。
1.4 统计学方法 采用SPSS 26.0统计学软件分析数据,计数资料(咳血、气胸、胃肠道反应、骨髓抑制、脱发、胸腔积液等发生率及1年生存率)以[例(%)]表示,组间比较采用χ2检验,等级资料(疾病控制率)采用秩和检验;计量资料(血清肿瘤指标与生存质量)经S-W法检验证实符合正态分布,用( x ±s)表示,组间比较采用独立样本t检验,治疗前后比较采用配对t检验。 Plt;0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较 治疗4个疗程后,B组疾病控制率较A组更高,差异有统计学意义(Plt;0.05),见表1。
2.2 两组患者血清肿瘤指标比较 相较于治疗前,治疗4个疗程后两组血清肿瘤分子含量均降低,B组均低于A组,差异均有统计学意义(均Plt;0.05),见表2。
2.3 两组患者生存质量比较 相较于治疗前的生存质量,治疗4个疗程后两组EORTC QLQ-C30中单项测试项目、症状量表评分均降低,且B组均低于A组;功能量表、整体生活质量量表评分均升高,B组均高于A组,差异均有统计学意义(均Plt;0.05),见表3。
2.4 两组患者不良反应发生情况、1年生存率比较 两组患者咳血、气胸、胃肠道反应、骨髓抑制、脱发、胸腔积液等发生率比较,差异均无统计学意义(均Pgt;0.05);B组1年生存率高于A组,差异有统计学意义(Plt;0.05),见表4。
3 讨论
肺癌一般起源于支气管黏膜或腺体,其发病主要与吸烟、肺部病史等因素有密切关系,由于该病起病隐匿,早期不易被发现或重视,从而使得就诊时病情多已为中晚期。因此针对此类患者,临床如何选择治疗方案,以最大程度改善预后是研究重点之一。化疗属于肺癌较为保守的一种治疗方式,虽可控制肿瘤生长,但其应用中也会对患者身体的正常细胞造成损伤,影响预后。
CT引导下射频消融术主要是运用电磁波内生热效应原理,通过将其作用于病变组织细胞以损伤肿瘤细胞膜的通透性、流动性,进而杀灭肿瘤细胞,使得病灶纤维化,抑制肿瘤内部血管生成,继而控制肿瘤生长,延长患者生存期,提高患者生存质量[7]。本研究结果中,治疗4个疗程后,B组患者疾病控制率高于A组,1年生存率高于A组,这表明肺癌患者应用CT引导下射频消融术治疗的效果显著,且有助于延长生存期。
CT引导下射频消融术能够有效抑制肺癌患者肿瘤病情进展,提高临床治疗效果,进而有助于改善患者生活质量。此外,CT引导下射频消融术属于一种微创治疗方式,其在CT引导下能够提高射频消融术穿刺、治疗的精准度,以使得该治疗方法对机体造成的损伤较小,进而不易引发不良反应发生,具有一定的安全性[8]。通过对两组生存质量和安全性进行对比分析发现,治疗4个疗程后,B组EORTC QLQ-C30中各项评分均优于A组;两组咳血、气胸、胃肠道反应、骨髓抑制、脱发、胸腔积液等发生率比较,差异均无统计学意义,这表明肺癌患者应用CT引导下射频消融术治疗有助于改善生存质量,且安全性良好。
CA125、CA153作为血清肿瘤标志物,能够反映机体肿瘤的恶性程度,其在肺癌患者中水平越高,则表明肿瘤恶性程度越高,患者病情越严重;VEGF可参与肿瘤血管新生过程,故其在肺癌患者中水平升高,则表明肿瘤增殖、侵袭风险越高,患者病情越严重;Ang-2具有促血管生成、增加血管壁通透性等作用,故其在肺癌患者中含量降低表明机体肿瘤负荷降低,肿瘤恶性程度降低,患者病情好转[9]。本研究结果中,治疗4个疗程后,B组患者血清CA125、Ang-2、CA153、VEGF水平均低于A组,这表明肺癌患者应用CT引导下射频消融术治疗有助于下调体内血清肿瘤标志因子的表达。分析其原因可能为,一方面,CT引导下射频消融术产生的热效应能够提高免疫反应(非特异性),抑制肿瘤生长,降低血清肿瘤指标含量;另一方面,CT引导下射频消融术通过高温作用能够将肿瘤细胞固化、灭活,进而有助于控制肿瘤生长、转移,因而抑制血清肿瘤标志分子的表达[10]。
综上,肺癌患者应用CT引导下射频消融术治疗的效果显著,且有助于下调血清肿瘤标志因子表达量,改善生存质量,延长生存期,且安全性良好,值得临床推广应用。
参考文献
冯沛贝, 冯帆, 闫晓倩, 等. CT引导下射频消融术治疗晚期肺腺癌疗效观察[J]. 新乡医学院学报, 2020, 37(1): 63-67.
陈卓, 何海艳, 袁瑞凡, 等. 射频消融治疗在EGFR-TKI治疗后缓慢进展的非小细胞肺癌患者中的临床应用[J]. 临床肺科杂志, 2021, 26(12): 1881-1885.
刘继伟, 杨瑞. 高分辨率CT引导下射频消融治疗早期非小细胞肺癌研究[J]. 实用放射学杂志, 2023, 39(6): 1001-1004.
李岸凤, 赵咏梅, 刘运秋. NSE和ProGRP表达水平与小细胞肺癌病理分期的相关性研究[J]. 实用癌症杂志, 2018, 33(2): 177-180.
中国抗癌协会肺癌专业委员会. 2010中国肺癌临床指南: 中国肺癌临床指南[J]. 北京: 人民卫生出版社, 2010: 123-124.
万崇华, 陈明清, 张灿珍, 等. 癌症患者生命质量测定量表EORTC QLQ-C30中文版评介[J]. 实用肿瘤杂志, 2005, 20(4): 353-355.
于晓磊. 化疗联合射频消融术治疗局部晚期非小细胞肺癌的临床疗效[J]. 医学临床研究, 2020, 37(1): 136-138.
何灵慧, 黄灿红, 丁勇生. 射频消融术治疗老年早期非小细胞肺癌的疗效[J]. 临床与病理杂志, 2022, 42(11): 2681-2688.
宋健, 李杨, 邓爱兵, 等. 中性粒细胞与淋巴细胞比值、白蛋白及T淋巴细胞亚群CD4+对中晚期肺癌射频消融术预后评估的意义[J]. 中国医学装备, 2021, 18(2): 5.
汪毅, 梁旭, 詹蕊羽. CT动态增强扫描参数与肺癌患者射频消融前后血清肿瘤指标的相关性[J]. 海南医学院学报, 2021, 18(2): 73-77.

