海榄雌叶多糖的提取、结构表征及其抗氧化活性研究
多糖作为活性生物大分子已经受到人们的广泛关注。海榄雌作为民间用药具有多种药理活性,但对其多糖研究一直鲜有报道。对海榄雌叶多糖的提取、结构解析和抗氧化活性等进行研究,为有效开发和利用其药理活性提供实验依据和理论基础。通过水提醇沉得到海榄雌叶中的多糖,高效液相色谱分析其单糖组成,红外光谱分析其官能团,研究其抗氧化活性。液相色谱显示单糖组成为:甘露糖、鼠李糖、D-半乳糖醛酸、葡萄糖、D-半乳糖和阿拉伯糖。红外光谱表明内含吡喃糖环和α-糖苷键。以VC为对照,在浓度200μg/mL时,海榄雌叶多糖对DPPH的清除率为86.53%,表现出良好的抗氧化活性。
广东省湛江市沿海滩涂生产大片红树林群落,海榄雌是红树林生态系统的主要品种。长期受周期性潮水浸淹,其环境的特殊性(高盐度,高压,低氧,避光),使得其与陆地生物相比有着巨大的差异,往往能够产生一些化学结构新颖、生物活性多样且显著的药物先导化合物,为新药研究与开发提供了大量的模式结构和药物前体[1]。国内外研究都集中在其生态特性上,对于海榄雌药理活性成分的研究还较少。海榄雌作为民间用药在哮喘、风湿、溃疡等疾病治疗上都有功效[2-8]。
植物多糖在国内已经有很多报道,作为植物体中生物活性分子,其是由多个单糖分子脱水缩合而成的,以糖苷键相连接串联成大分子,常具有三维结构,具有多种生物活性,能预防疾病,抗衰老和增强免疫力[9]。然而对于海榄雌叶多糖还未见系统报道,本文首次对海榄叶多糖进行提取,并对其结构和活性进行研究。水提醇沉法试剂便宜、工序简单,对设备要求不高[10]。因此,本文采用水提醇沉法提取得到的海榄雌叶粗多糖。多糖的脱蛋白方法主要有Sevag法、三氟三氯乙烷法、三氯乙酸法等。最常用的方法是Sevag法,是将正丁醇、氯仿按照一定的比例相互混匀,再以一定比例混合于多糖溶液中,离心除去混合液中的蛋白沉淀絮状物[11]。三氟三氯乙烷法效率更高,但因为难挥发等缺点限制了它的应用[12]。张萍等[13]建立了一种柱前衍生高效液相色谱法测定石榴皮多糖的单糖组成分析方法,结果揭示本法测定单糖的线性范围宽、重复性好、准确性高,测得石榴皮多糖组分含有甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖等7种单糖。何源等[14]研究3种鹿茸多糖,红外光谱显示均具有典型的多糖结构,2 930 cm-1附近的CH的拉伸和弯曲振动吸收峰是多糖的特征吸收峰,次峰出现在2 854 cm-1处,表明存在亚甲基并含有硫酸根基团,属糖胺聚糖。何婷婷等[15]利用红外光谱表征蒲公英多糖为β-吡喃糖,1 072、779、618、541 cm-1为吡喃糖特征吸收峰之一。蒋文明等[16]通过提取椰子皮多糖,并对其生物活性进行研究,体外抗氧化试验表明,椰子皮多糖对ABTS+自由基、DPPH自由基和O2-均有一定的清除效果,随着椰子皮多糖浓度的增加清除能力逐渐增强。赵赛蕾等[17]总结了山药多糖能清除活性氧,通过减少自由基进而延缓衰老和抗氧化。蔡永萍等[18]揭示薏苡仁多糖具有良好的抗氧化能力,对α-淀粉酶和α-葡萄糖苷酶的抑制能力效果明显,并且随着浓度的增加,抑制率增加。
据此,本论文通过95%乙醇提取得到的海榄雌叶多糖,水提醇沉得到海榄雌叶中的多糖,高效液相色谱法研究其单糖组成,红外光谱揭示其官能团,DPPH清除实验研究其抗氧化活性,为海榄雌药用价值开发利用提供科学的理论依据。
1材料与方法
1.1材料与试剂
以湛江市南三岛沿海采集的新鲜海榄雌叶条为实验对象。裁剪新鲜碧绿的海榄雌叶,初步自然晒干,然后放入50℃恒温烘箱烘干后,分别粉碎至40目大小,在干燥环境中保存备用。所用试剂与药物:95%乙醇、丙酮、无水乙醇、PMP(1-苯基-3-甲基-5-吡唑啉酮)、三氟乙酸(TFA)、氢氧化钠、甲醇、盐酸、氯仿、DPPH药品、磷酸二氢钠、乙腈、D-葡萄糖醛酸、D-(+)-半乳糖醛酸、阿拉伯糖、无水葡萄糖、甘露糖、D-半乳糖、木糖、鼠李糖、维生素Vc(广州赛国生物科技有限公司)。实验所用药物和试剂除D-葡萄糖醛酸、D-(+)-半乳糖醛酸、岩藻糖、阿拉伯糖、无水葡萄糖、甘露糖、D-半乳糖、木糖、鼠李糖(上海研域生物科技有限公司)为标准对照品外,其余均为分析纯。
1.2仪器与设备
RD-C18(250 mm×4.6 mm,5μm)色谱柱(中谱红)、沃特世2695高效液相色谱仪、CF12RX(日本日立)多用途冷冻离心机、754N紫外可见分光光度计(上海仪电分析仪器有限公司)、AUW220D电子分析天平(日本岛津)、真空干燥箱、冰箱等仪器设备。
1.3实验方法
1.3.1多糖成分的提取
将打碎过筛后得到的海榄雌叶粉末称重后,平均分成3份,每份2 kg,分别填充至10 L蒸馏瓶内,加入5 L超纯水浸泡2 h,然后于80℃条件下蒸馏提取2 h,重复该过程1次,将2次提取所得溶液混合后于2 000 rpm、10 min条件下离心,去除海榄雌叶粉末残渣,将上清液真空浓缩至100 mL。对应加入4倍体积的95%浓度乙醇进行沉淀;沉淀完全后于2 000 rpm、10 min条件下离心收集絮状物,并分别用300 mL去离子水复溶,真空浓缩除去残余乙醇,再将残留液于2 000 rpm、10 min条件下离心除去不溶物;上清液真空浓缩,冷冻干燥后,依次用丙酮和无水乙醇洗涤3遍,最后一次洗涤后,置于通风橱内让残余的有机试剂自然挥发,待有机试剂挥发完后,提取到的海榄雌叶多糖(YAM),收集多糖固体,称重备用。
1.3.2高效液相色谱法测定单糖组成
利用PMP(1-苯基-3-甲基-5-吡唑啉酮)柱前衍生化高效液相色谱法测定单糖组成。
1.3.2.1样品的完全酸水解
称取2 mg YAM固体,分别加到具塞试管中,之后加入2 mL 2 mol/L的三氟乙酸(TFA),120℃下油浴4 h,将酸水解后所得样品溶液转于蒸馏瓶内,加入10 mL甲醇溶液旋转蒸发至干,此操作重复2次,去除TFA。用1 mL去离子水溶解,待衍生化。
1.3.2.2 PMP衍生化
分别吸取100μL的YAM水解液放入试管中,再分别取50μL 0.3 mol/L的NaOH溶液和0.5 mol/L PMP甲醇溶液混匀,70℃下水浴30 min,自然冷却10 min。加入50μL 0.3 mol/L HCl中和,再加入1 mL氯仿萃取3次,上层为水层,加100μL超纯水混匀稀释,0.22μm的微孔滤膜过滤后待进样。
1.3.2.3 9种单糖标准品混合液的衍生化
取2 mmol/L单糖标准品D-葡萄糖醛酸、D-(+)-半乳糖醛酸、阿拉伯糖、葡萄糖、甘露糖、D-半乳糖、木糖、鼠李糖和岩藻糖各50μL,分别加入0.5 mol/L 50μL PMP甲醇溶液和0.3 mol/L 50μL NaOH溶液,70℃下水浴30 min,自然冷却10 min。加入50μL 0.3 mol/L HCl中和,再加入1 mL氯仿萃取3次,上层为水层,加100μL超纯水混匀稀释,待进样。
1.3.2.4进样分析
液相色谱条件:色谱柱:中谱红RD-C18(250 nm×4.6 nm,5μm);流动相:0.1 mol/L磷酸盐(pH 6.7)、缓冲液-乙腈(体积比为83∶17);柱温:30℃;检测波长:250 nm;流速:1 mL/min;进样体积:20μL。
1.3.3红外光谱分析
取一定量干燥的多糖样品,与干燥KBr粉末混匀后压片,在400~4 000 cm-1范围内进行红外光谱扫描,记录红外光谱图。
1.3.4海榄雌叶多糖对DPPH的清除率测定
取多糖母液和VC母液,分别制得不同浓度2.5、5、10、20、50、75、100μg/mLYAM的多糖溶液和VC溶液,然后分别对应吸取:测定管:0.5 mL多糖溶液+3.5 mLDPPH液;空白管:0. 5 mL蒸馏水+3.5 mLDPPH液。涡旋混匀,在黑暗处放置30 min,1 cm光径,517 nm,95%乙醇调零,测定各管吸光度值。通过下式计算海榄雌叶多糖对DPPH的清除率,结果如表1。

其中Y表示DPPH清除率,A1为测定管的吸光度,A0为空白管的吸光度。
2.2红外结果分析
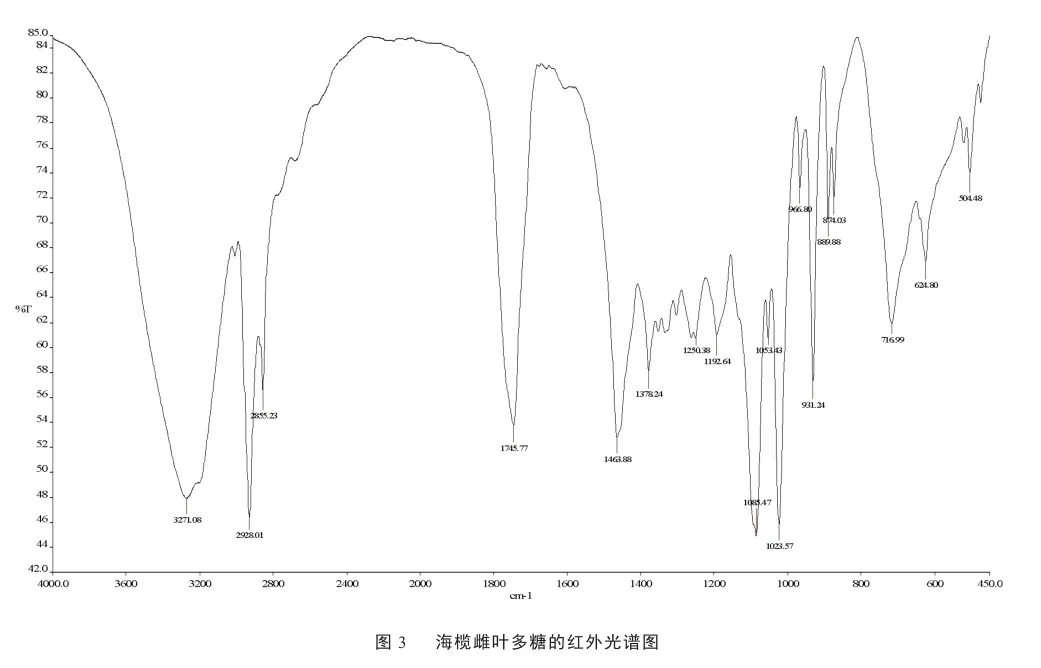
红外结果如见图3所示。在400~4 000 cm-1得到如下的吸收峰:3 271、2 928、1 745、1 463、1 085、1 023、931、716、624、504 cm-1。各峰归属如下:3 271 cm-1处的峰信号强且宽,为O-H伸缩振动引起的。2 928 cm-1出现的吸收峰为CH2或者CH3的C-H的伸缩振动。1 745 cm-1为乙酰胺基(-NHCOCH3)的C=O伸缩振动,说明多糖是一种含氨基的糖缀合物。1 463 cm-1处的吸收峰可能是C-H的变角运动引起的,1 085和
2结果分析
2.1单糖组成分析
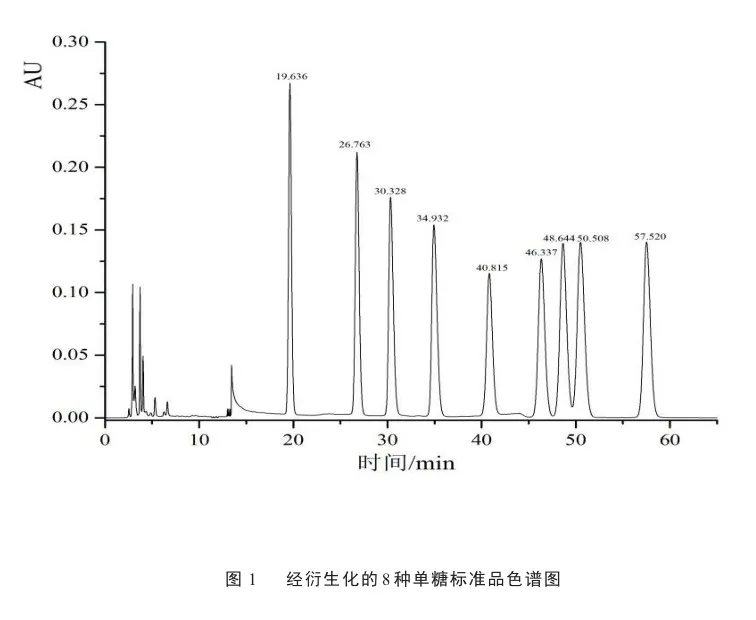
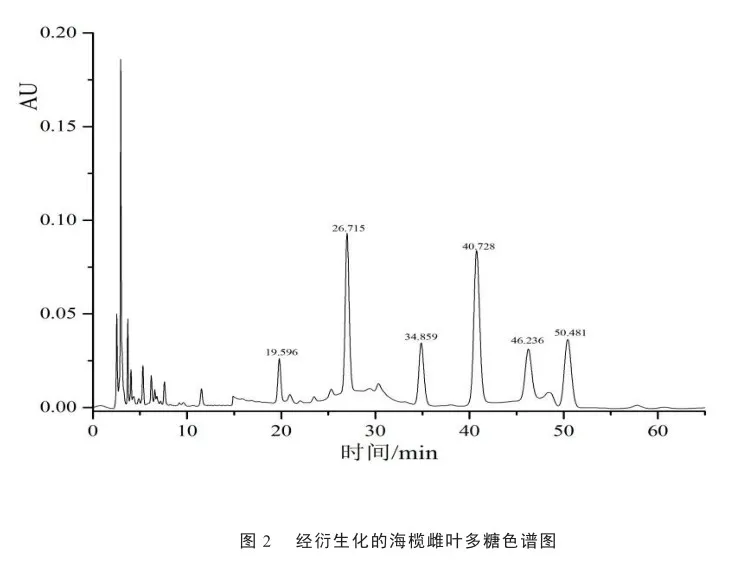
高效液相色谱结果显示如见图1,各单糖分离度好,峰型尖锐,从左往右依次为甘露糖(19.636)、鼠李糖(26.763)、D -葡萄糖醛酸(30.328)、D -半乳糖醛酸(34.932)、葡萄糖(40.815)、D-半乳糖(46.337)、木糖(48.644)、阿拉伯糖(50.508)、岩藻糖(57.520)。海榄雌叶多糖液相色谱结果如见图2,显示该多糖由甘露糖(19.596)、鼠李糖(26.715)、D -半乳糖醛酸(34.859)、葡萄糖(40.728)、D-半乳糖(46.236)和阿拉伯糖(50.481)组成,摩尔比为1∶2∶1∶2∶1∶1。葡萄糖含量最高,甘露糖酸含量最低,单糖组成往往与多糖的生物活性息息相关。

1 023 cm-12处的吸收峰预示多糖内含由于吡喃糖环。931 cm-1说明多糖可能含有β-D吡喃葡萄糖环。716 cm-1是α-吡喃环的弯曲振动特征峰,表示多糖结构中有α-糖苷键。584 cm-1则是O-H外平面振动峰[19-21]。
2.3 DPPH清除实验结果分析
清除实验结果见表1,表明海榄雌叶多糖具有良好的清除DPPH自由基的活性,且随着浓度的增加,对DPPH自由基的清除率呈上升趋势,在浓度50 ug/mL时,清除活性达到85%左右,随着浓度增加,清除活性趋于平缓。浓度增加,清除活性趋于平缓。
3结论与讨论
随着医药技术的不断发展,生物医药开发不再满足于已收录的药用植物名录,海榄雌作为中国分布面积最大的红树林植物种类,研究其天然活性成分,充分挖掘其利用功能,有利于拓宽植物资源的开发利用范围,创造新的生物制药。海榄雌对多种疾病的治疗存在良好药效,多糖作为植物体中的主要活性成分,对海榄雌叶进行多糖提取,分析其多糖结构及研究其体外抗氧化活性,更利于探究海榄雌的药用价值,对提高海榄雌整株的利用率具有重要意义。
本论文采用95%乙醇对海榄雌叶的多糖进行提取,利用PMP(1-苯基-3-甲基-5-吡唑啉酮)柱前衍生化高效液相色谱法(HPLC)测定其单糖组成,结果表明单糖组成为:甘露糖、鼠李糖、D-半乳糖醛酸、葡萄糖、D-半乳糖和阿拉伯糖组成。红外光谱说明多糖是一种含氨基的糖缀合物,内含由于吡喃糖环、β-D吡喃葡萄糖环和α-糖苷键。通过DPPH自由基清除实验,表明海榄雌叶多糖具有一定的抗氧化活性,为海榄雌的提取及进一步加工利用提供了一定的科学理论依据。
参考文献
[1]向晨晨,周珊珊,柴树茂,等.红树林链霉菌ZFSM1-146中抗菌活性物质的发现[J].微生物学通报,2021,48(7):2329-2340.
[2]林鹏.我国药用的红树植物[J].海洋药物,1984,12(4):231-237.
[3] MaeFarlane G R,Butcher M D.Toxicity,growth and accumulation relationships of copper lead and zinc in the grey mangrove Avicenna marina (Forsk.) Vierh[J]. Envi‐ronmental Research,2002(54):65-84.
[4] Hibino T,Meng Y L,Kawamitsu Y. Molecular clon‐ing and functional characterization of two kinds of beta‐ine-aldehydedehydrngenaseinbetaine-accumulating mangrove Avicenna marina (Forsk.) Vierh[J].Plant Mo‐lecular Biology,2001(45):353-363.
[5] Sharp H,Thomas D,Carrie F.Pinoresinol and syrin‐garesinol:two lignans from Avieennia germinans(Avicen‐niaceae) [J].Biochemical Systemsfics and Ecology,2001(29):325-327.
[6] Suzuki M,Yasumoto E,Baba S.Effect of salt stress on the metabolism of ethenolamine and choline in leaves of the belaine-producing mangrove species Avicenna ma‐rina[J].Phytoehemistry,2003,(64):941-948.
[7] Tian S,Saravanan K,Mothana R A,et al. Anti-cancer activity of biosynthesized silver nanoparticles using Avi‐cennia marina against A549 lung cancer cells through ROS/mitochondrial damages[J]. Saudi Journal of Biolog‐ical Sciences,2020,27(11):3018-3024.
[8] Bell K H,Duewell H.Triterpenoids from the bark of Avicennia marina[J]. Australian Journal of Chemistry,1961(14):662-663.
[9]张璐,杨莹莹.高效液相色谱法测定党参多糖的单糖组成及含量[J].中国食品添加剂,2021,32(12):163-169.
[10]陈亮,郝梦超,安超娜,等.淫羊藿多糖提取工艺及其药理活性研究进展[J].江苏调味副食品,2023(1):5-8.
[11]Chen Y,Xie M,Nie S,et al. Purification, composi‐tion analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum [J]. Food Chemistry,2008,107(1):231-241.
[12]张岩,马丽娜,王鹏,等.苦豆子多糖脱蛋白工艺比较[J].中国新药杂志,2012(8):921-925.
[13]张萍,陈燕,尚永辉,等.柱前衍生高效液相色谱法测定石榴皮多糖的单糖组成[J].分析试验室,2019,38(5):523-528.
[14]何源,王露露,张晶. 3种鹿源鹿茸多糖含量、红外谱图、抗氧化活性比较[J].中成药,2022,44(3):1028-1031.
[15]何婷婷,柴军红,钟读波,等.蒲公英活性成分提取工艺的优化、多糖红外表征及其抗氧化性[J].江苏农业科学,2018,46(11):163-166.
[16]蒋文明,周石洋.椰子皮多糖的提取、结构表征及生物活性研究[J].中国食品添加剂,2023,34(5):111-118.
[17]赵赛蕾,丁侃,胡玉龙,等.山药多糖生物活性及构效关系研究进展[J].粮食与油脂,2023,36(5):29-33.
[18]蔡永萍,李阳杰.薏苡仁多糖闪式提取工艺优化及其生物活性[J].食品研究与开发,2023,44(9):164-170.
[19]贺婷.正红菇多糖结构分析及其生物活性研究[D].广州:华南理工大学,2015.
[20]韩铨.茶树花多糖的提取、纯化、结构鉴定及生物活性的研究[D].杭州:浙江大学,2011.
[21]彭光华,朱影,许倩兮.雪灵芝多糖的分离以及红外光谱和气相色谱分析[J].中国药师杂志,2009,12(11):1557-1560.
基金项目:海南省自然科学基金(221QN0923)[1中国热带农业科学院农产品加工研究所陈吴海,罗成,叶剑芝(通信作者);2云南农业大学热带作物学院熊玉民,谢宇欣,杨佳丽]

