促卵泡素对雏鸡原始卵泡形成的影响






摘要:【目的】探究促卵泡素(FSH)对雏鸡原始卵泡形成的影响,为开展雏鸡卵巢的早期发育及提高蛋鸡产蛋性能的研究提供理论依据。【方法】将40只刚出壳雏鸡随机分为试验组(FSH)和对照组(CK),分别肌肉注射20 IU/mL FSH和生理盐水。试验开始后0和5.5 d称取雏鸡体重,5.5 d采集雏鸡卵巢组织进行石蜡切片、HE染色和转录组测序(RNA-Seq)分析。通过生物信息学分析筛选差异表达基因(DEGs),并进行GO功能注释和KEGG信号通路富集分析。将DEGs上传STRING数据库构建蛋白互作(PPI)网络。最后通过实时荧光定量PCR检测基因相对表达量。【结果】与CK组相比,FSH组雏鸡体重无显著变化(Pgt;0.05,下同),卵巢体积明显增大。HE染色结果表明,FSH组卵巢皮质较厚,卵巢组织更致密,原始卵泡数量增多且体积增大,能明显看到原始卵泡结构。2组雏鸡卵巢中共存在617个DEGs,FSH组有107个,CK组有510个。GO功能注释和KEGG信号通路富集分析结果表明,DEGs注释到的GO功能条目可分为生物学过程、细胞组分和分子功能三大类,主要富集到PI3K-AKT、Wnt/β-catenin、MEK/ERK和MEK1/2/ERK1/2信号通路。实时荧光定量PCR结果显示,与CK组相比,FSH组DAZL和PIWIL1基因相对表达量极显著降低(Plt;0.01,下同),SMAD2、ZP1和CYP17A1基因相对表达量显著(Plt;0.05)或极显著升高,FSHR基因相对表达量无显著变化。【结论】FSH可能是通过影响颗粒细胞增殖、类固醇生成和血管生成等多条卵泡发育相关信号通路来促进雏鸡原始卵泡形成,其对CYP17A1、SMAD2和ZP1等基因的调控可能是其促进原始卵泡生成的主要分子机制之一。
关键词:鸡;促卵泡素;卵巢;原始卵泡;RNA-Seq
中图分类号:S831.89文献标志码:A文章编号:2095-1191(2024)09-2772-11
Effects of follicle stimulation hormone on primordial follicle formation in chicks
CUI Yu-fei,YANG Can-can,LING Wei-dong,LIU Si-qi,PENG Rui,LIANG Jiong-ming,YU Lin-tian,LU Yang-qing*
(College of Animal Science and Technology,Guangxi University,Nanning,Guangxi 530004,China)
Abstract:【Objective】To investigate the effect of follicle stimulating hormone(FSH)on the formation of primordial follicles in chicks,which could provide theoretical basis for research on the early development of the ovary in chicks and the improvement of egg-laying performance inlaying hens.【Method】Forty freshly fledged chicks were randomly divided into test group(FSH)and control group(CK),and were injected intramuscularly with equal amounts of 20 IU/mL FSH and saline respectively.The chicks were weighed at 0 and 5.5 d after the start of the experiment,and the ovarian tissues were collected at 5.5 d for paraffin sectioning,HE staining and transcriptome sequencing(RNA-Seq)analysis.Differen-tially expressed genes(DEGs)were screened by bioinformatics analysis,and GO function annotation analysis and KEGG signal pathway enrichment analysis were performed.The DEGs were uploaded to the STRING database to con-struct the protein interaction(PPI)network.Finally,the relative gene expression was detected by real-time fluorescence quantitative PCR.【Result】Compared with the CK group,there was no significant change in the body weight of the chicks in the FSH group(Pgt;0.05,the same below),and the volume of the ovary increased greatly;HE staining results showed that the ovarian cortex was thicker in the FSH group,the ovarian tissues were denser,the number of primordial follicleswas increased and their volume was enlarged and the primordial follicular structure could be clearly seen.There were 617 DEGs in the ovaries of the 2 groups,107 in the FSH group and 510 in the CK group.The analysis of GO function annota-tion and KEGG signal pathway enrichment showed that the GO function entries annotated by DEGs could be classified into 3 major categories:biological processes,cellular components and molecular functions,and were mainly enriched in the signal pathways such as PI3K-AKT,Wnt/β-catenin,MEK/ERK and MEK1/2/ERK1/2.The results of real-time fluores-cence quantitative PCR showed that compared with the CK group,the relative expression of DAZL and PIWIL1 genes in the FSH group was extremely significantly decreased(Plt;0.01,the same below),the relative expression of SMAD2,ZP1 and CYP17A1 genes was significantly(Plt;0.05)or extremely significantly increased,and there was no significant change in the relative expression ofFSHR genes.【Conclusion】FSH may promote the formation of primordial follicles in chicks by affecting several signal pathways related to follicular development,such as granulosa cell proliferation,steroidogene-sis and angiogenesis,and its regulation of genes such as CYP17A1,SMAD2 and ZP1 may be one of the main molecular mechanisms to promote primordial folliculogenesis.
Key words:chick;follicle stimulating hormone;ovary;primordial follicle;RNA-Seq
Foundation items:National Natural Science Foundation of China(31960157);Guangxi University Undergraduate Innovation and Entrepreneurship Training Project(202210593102)
0引言
【研究意义】在专门化蛋鸡实际生产中,产蛋性能是一个重要的生产指标。产蛋性能与卵巢发育活动密切相关,包括原始卵泡池建立、各级卵泡形成和发育及正常排卵等。鸡原始卵泡池大小取决于原始卵泡的形成和激活,并在雏鸡孵化后4~5 d逐渐形成(Li etal.,2016)。促卵泡素(FSH)是一种促性腺激素,主要作用于性腺。Roy和Albee(2000)、Wang和Roy(2007)研究发现,FSH能促进小鼠原始卵泡的形成;Recchia等(2021)研究表明,FSH主要通过作用于卵巢中的颗粒细胞,以提高雌激素等类固醇激素的合成水平,进而促进卵泡的发生。因此,探究FSH对雏鸡原始卵泡形成的影响对解析鸡原始卵泡的早期发育和提升鸡的繁殖性能具有重要意义。【前人研究进展】在雌性动物胚胎中,原始生殖细胞在胚胎早期迁移到性腺后成为卵原细胞,出生前通过有丝分裂发育形成簇状生殖系囊(Germ cell cyst)或卵母细胞巢(Oocyte nest),出生后经历卵母细胞巢崩解过程后单个卵母细胞被颗粒细胞包围形成原始卵泡(O’Connell and Pepling,2021)。原始卵泡形成过程伴随着大量卵母细胞损耗,损耗的卵母细胞会发生程序性降解,为能正常发育的卵母细胞提供营养物质和细胞器等以协助其形成原始卵泡(Lei and Spra-dling,2016)。原始卵泡的形成是一个复杂且精细的调控过程,涉及多细胞类型和多因素调节。Wang等(2020)通过单细胞测序探究小鼠原始卵泡的形成,鉴定了原始生殖细胞、不同类型的卵巢体细胞及其不同阶段的细胞群;Zhao等(2020)对猴子胎儿卵巢发育调控的研究也得到了类似结果。鸡的生殖细胞数量在孵化后第17 d达到高峰(约680000个)(Hughes,1963),而后随着孵化逐渐损耗,至孵化后第4 d卵母细胞巢开始崩解并形成原始卵泡;出壳当天生殖细胞数量约为175000~480000个,至孵化后第7 d锐减到约75000个;原始卵泡在4周龄左右完全建立,此时生殖细胞数量仅剩约50000个(Méndez-Herrera et al.,1998;González-Morán,2011)。原始卵泡的发育与颗粒细胞和膜细胞等细胞的正常发育密不可分。Skinner(2005)研究发现,牛、人和啮齿动物等物种颗粒细胞的初始功能是合成雌二醇(E2)和黄体酮;Zachos等(2002)、Wang和Roy(2007)、Chakraborty和Roy(2017)研究发现,雌激素能促进狒狒、仓鼠等物种原始卵泡的形成。而Chen等(2007)、Tanimoto等(2021)研究表明,雌激素和孕酮对小鼠原始卵泡的组装具有抑制作用,这种抑制作用是通过雌激素激活其受体雌激素受体1(ESR1)并诱导下游抗缪勒管激素(AMH)的表达,进而调控颗粒细胞的增殖分化,导致原始卵泡发育延迟。提示哺乳动物原始卵泡的形成受类固醇激素的调控,但具体的调控机制与物种有关。Guo等(2019)研究表明,鸡促卵泡激素和干细胞因子联用能促进卵泡发生并抑制细胞凋亡;Nie等(2023)研究发现,短吻鳄孵化后卵巢中FSH和E2能促进减数分裂标记基因SYCP3的表达,卵巢体外培养试验还表明FSH和E2能有效抑制细胞凋亡。细胞色素P450 17A1(CYP17A1)是细胞色素(P450)家族成员,具有多种生物学活性。Rangel等(2007)研究发现,CYP17A1是合成雄激素的限速酶,不仅参与早期卵泡的生长发育,合成的雄激素还能通过增加促黄体激素(LH)刺激鸡排卵前卵泡颗粒细胞产生孕酮(P);Akhtar等(2011)研究表明,CYP17A1具有羟化酶活性,能将孕烯醇酮和孕酮转化为17-羟孕烯醇酮和17-羟基孕酮,为17,20-碳链裂解酶裂解第17和第20位碳链提供前体物质。Li等(2008)研究发现,卵巢颗粒细胞敲除SMAD2基因会导致女性生育缺陷;Sharum等(2017)研究表明,SMAD2也能参与调节小鼠卵巢的早期卵泡发育,其在多数卵泡细胞中不表达,但在颗粒细胞中表达。Li等(2007)发现MEK/ERK信号通路能通过拮抗STAT3活性来调节小鼠胚胎干细胞(mESC)的自我更新,对维持细胞干性起重要作用;Sun等(2013)研究发现,幼年斑马鱼能通过MEK1/2-ERK1/2信号通路调控SOX9A基因胞质表达水平,进而促进卵泡的发生;Li等(2014)研究表明,激活Wnt/β-catenin信号通路能促进颗粒细胞凋亡并抑制卵泡类固醇生成,显著抑制卵泡发育;Guo等(2019)研究表明,FSH和碱性成纤维细胞生长因子(bFGF)协同作用能调节磷脂酰肌醇-3-激11酶-蛋白激酶B(PI3K-AKT)和细胞外信号调节激酶(ERK)信号通路,进而调节颗粒细胞活性、增殖和凋亡。【本研究切入点】终生产蛋量是蛋鸡实际生产中的重要指标,与饲养经济效益密切相关,原始卵泡数量是决定雌鸡终生产蛋量的重要因素。目前提升蛋鸡终生产蛋量的措施多立足于疾病防控、饲养管理和日粮营养配方等方面,有关鸡原始卵泡形成的研究相对较少,原始卵泡形成的调控机制也尚未明确。【拟解决的关键问题】通过转录组测序(RNA-Seq)和实时荧光定量PCR等方法探究FSH对雏鸡原始卵泡形成的影响及其作用机制,为开展雏鸡卵巢早期发育及提高蛋鸡产蛋性能的研究提供理论依据。
1材料与方法
1.1试验动物
供试广西麻鸡(0日龄,80羽)饲养于广西大学牧场,雏鸡在温度和湿度适宜的环境中自由采食。雏鸡的饲养管理和采样步骤参照广西大学动物实验伦理审查规范进行。动物试验由广西大学实验动物伦理委员会批准,批准号GXU-2023-0207。
1.2试验方法
1.2.1 FSH剂量筛选预试验设3个FSH注射剂量为3个试验组(FSH),分别对应3个对照组(CK),每组10只雏鸡。3个FSH组于试验开始后0~5.5 d每天17:00肌肉注射25、50和100μL 20 IU/mL FSH,3个CK组分别注射等体积生理盐水。第5.5 d使用颈脱位屠宰60只雏鸡,分离卵巢并观察卵巢形态。结果发现,100μL注射剂量组雏鸡卵巢膨大最明显,长度和宽度均大于其他组,故选择100μL FSH开展后续试验。
1.2.2分组与采样将40只雏鸡随机分为FSH组和CK组,每组20只。FSH组雏鸡在0~5.5 d注射100μL 20 IU/mL FSH,CK组注射等体积生理盐水。分别在第0和第5.5 d称取雏鸡体重;第5.5 d使用颈脱位屠宰雏鸡,迅速采集卵巢并清理多余组织,一部分卵巢放入EP管中,液氮速冻后转移至-80℃冰箱保存备用,另一部分卵巢迅速放置于4%多聚甲醛中固定,随后进行脱水、包埋、切片和苏木精—伊红(HE)染色。
1.2.3卵巢形态观察采集卵巢后,使用刻度尺测量对比雏鸡卵巢,观察其表观差异。卵巢石蜡包埋后切成5μm的切片,每个卵巢选择3~4个连续切片进行HE染色,观察每皮质面积的卵泡发育情况。
1.2.4 RNA-Seq分析采用总RNA提取试剂盒(R0027,上海碧云天生物技术股份有限公司)提取总RNA。使用Illumina平台进行二代RNA-Seq,委托北京诺禾致源科技股份有限公司构建测序文库。对测序获得的原始序列(Raw reads)进行检测和质控,得到高质量的Clean reads。利用HISAT2将Clean reads与参考基因组序列(GRCg6a)进行比对。使用FeatureCounts计算比对到每个基因的Reads数目。根据每个基因的长度和该基因的读取数计算TPM值。使用R语言factoextra软件包进行主成分分析,DESeq2软件包分析差异表达基因(DEGs),以|log2 Fold Change|gt;1且Plt;0.05为标准筛选DEGs,并进行GO功能注释分析和KEGG信号通路富集分析。将DEGs上传STRING数据库构建蛋白互作(PPI)网络,置信评分gt;0.4。利用Cytoscape软件对DEGs进行PPI网络分析。
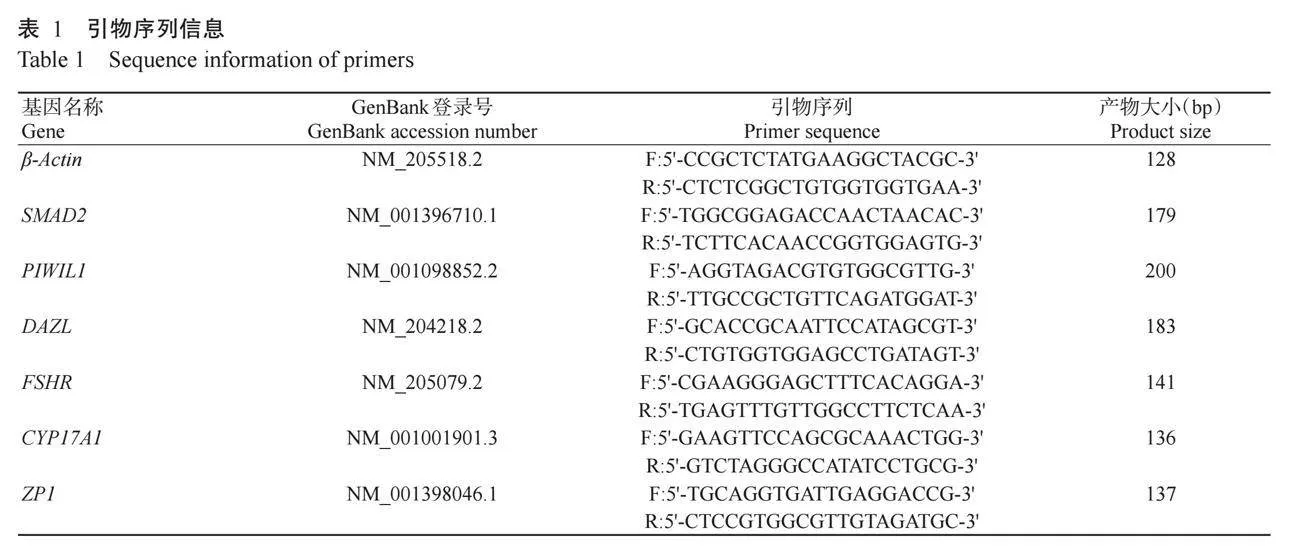
1.2.5 RNA提取和实时荧光定量PCR分析使用RNAeasyTM动物RNA抽提试剂盒(离心柱式)(R0027,上海碧云天生物技术股份有限公司)提取RNA,使用TransScript®All-in-One First-Strand cDNA Synthe-sis SuperMix for qPCR(One-Step gDNA Removal)试剂盒(Q51122,北京全式金生物技术有限公司)将RNA反转录合成cDNA并进行实时荧光定量PCR检测。反应体系20.0μL:SYBR Green PCR Mix 10.0μL,上、下游引物各0.4μL,cDNA模板4.0μL,ddH2O 5.2μL。扩增程序:94℃预变性30 s;94℃5 s,55℃15 s,72℃10 s,进行40个循环。利用2-ΔΔCt法计算目的基因相对表达量。引物序列见表1。
1.3统计分析
使用GraphPad Prism 9.5.1对试验数据进行整理和制图,采用t检验进行差异显著性分析。
2结果与分析
2.1雏鸡卵巢形态观察及体重变化情况
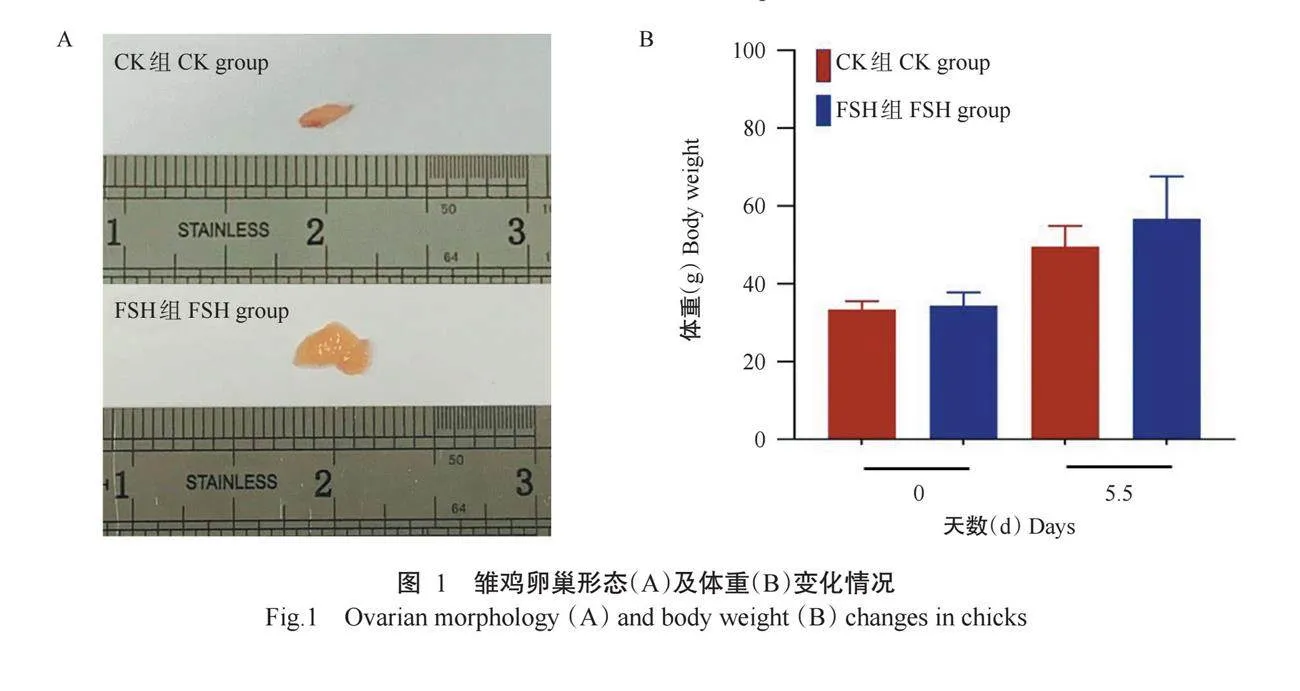
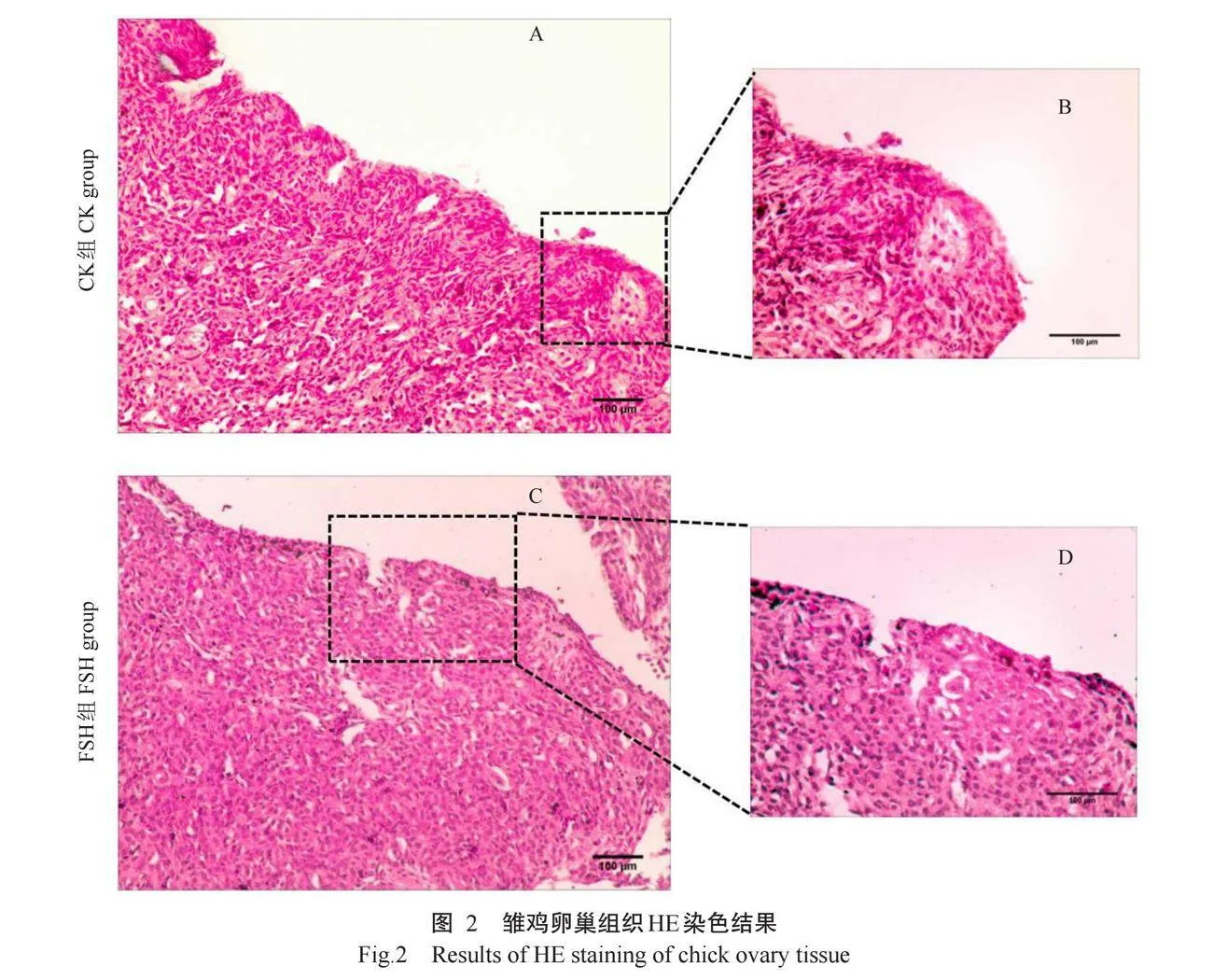
雏鸡卵巢形态如图1-A所示,与CK组相比,FSH组雏鸡卵巢体积明显增大。雏鸡体重变化情况如图1-B所示,FSH组0~5.5 d雏鸡体重变化较CK组更明显,2组内0和5.5 d雏鸡体重均无显著差异(Pgt;0.05,下同)。雏鸡卵巢组织HE染色如图2所示,CK组卵巢皮质中存在较多的原始生殖细胞簇和较少的成型原始卵泡,常见由多个生殖细胞以细胞内桥连接而聚集成的簇状结构;FSH组雏鸡卵巢组织中成型的原始卵泡数量增多且体积增大,可明显观察到原始卵泡结构(由单层扁平化颗粒细胞包围的卵母细胞结构)和原始生殖细胞簇;与CK组相比,FSH组雏鸡卵巢皮质较厚,组织更致密。
2.2主成分分析(PCA)和聚类分析结果
PCA结果(图3-A)显示,与CK组相比,FSH组样本空间分布较集中,分类更明显,组内样本相似性较高,重复性较好,具有较好的聚类特性。CK组和FSH组样本在三维得分图中可以各自区分,点分布相对离散。样本聚类分析结果(图3-B)显示,CK组和FSH组样本被划分为两簇,表现出明显的差异,与PCA结果一致,说明可以开展进一步分析。
2.3 DEGs筛选结果
DEGs筛选结果(图4)显示,FSH组和CK组分别检测到12337和12740个基因,其中FSH组和CK组共有的基因有12230个,FSH组DEGs有107个,CK组DEGs有510个。
2.4 DEGs的GO功能注释分析和KEGG信号通路富集分析结果
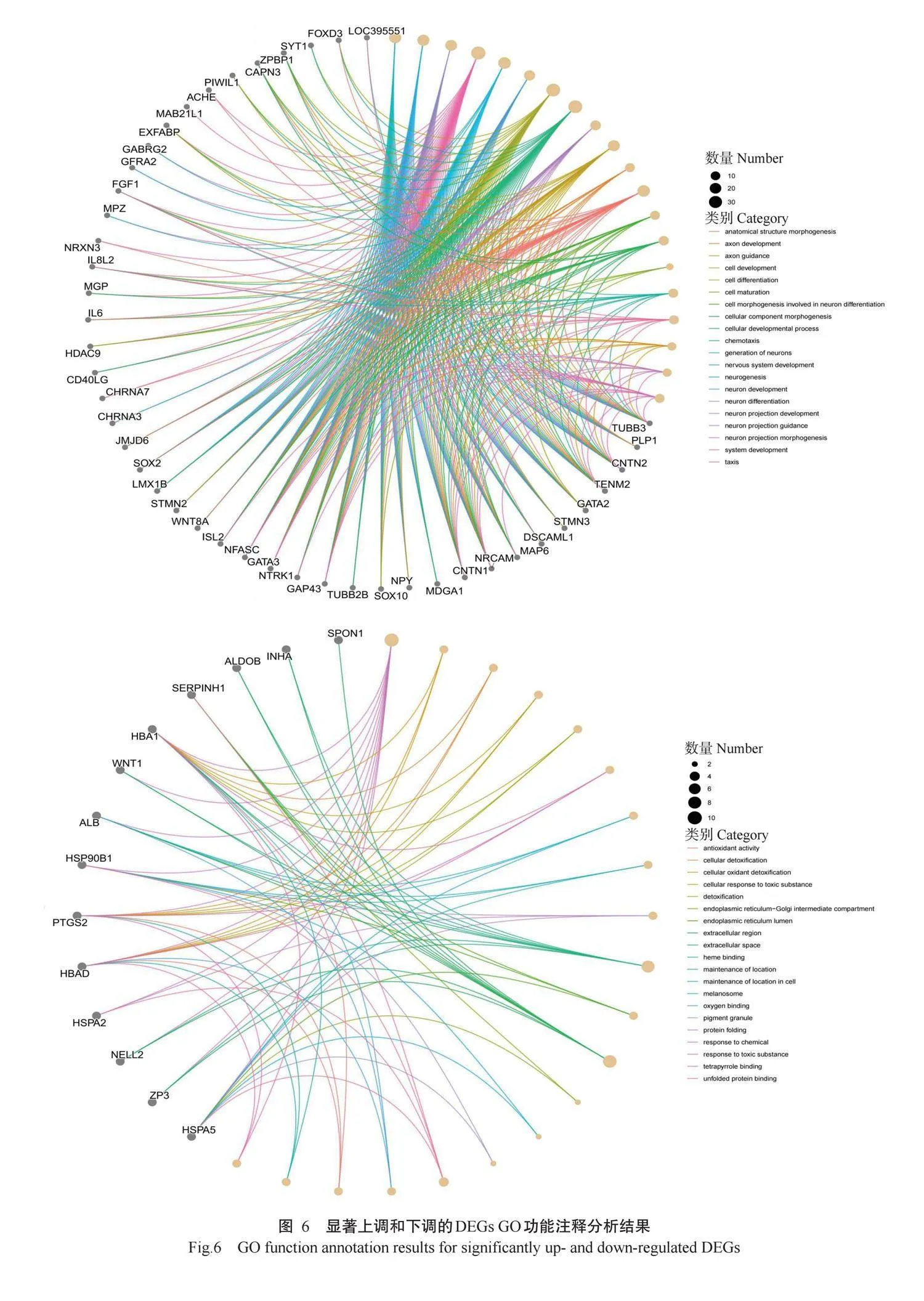
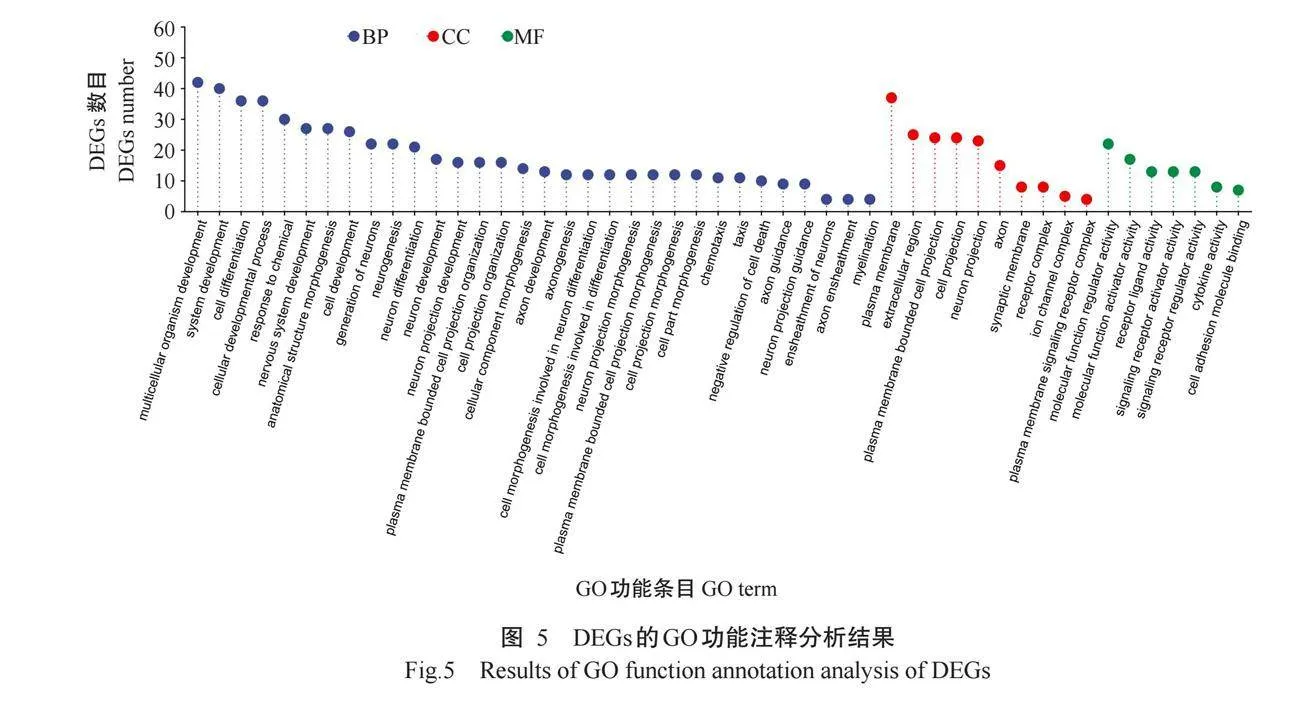
根据DEGs筛选结果进行GO功能注释分析,结果(图5)发现,DEGs注释到的GO功能条目可分为生物学过程(BP)、细胞组分(CC)和分子功能(MF)三大类,其中生物学过程主要涉及系统发育(System development)、细胞分化(Cell differentiation)和细胞发育过程(Cellular developmental process)等GO功能条目;细胞组分主要涉及质膜(Plasma membrane)和细胞外区域(Extracellular region)等GO功能条目;分子功能主要涉及调节分子功能活性(Molecu-lar function regulator activity)、激活分子功能活性(Molecular function activator activity)和受体活性(Receptor ligand activity)等GO功能条目。为了进一步分析DEGs的功能,对表达量显著上调和下调的DEGs进行GO功能注释分析,根据基因富集数目展示前20个GO功能条目,结果(图6)显示,上调的DEGs参与了细胞外区域(Extracellular region)、维持细胞位置(Maintenance of location in cell)和抗氧化活性(Antioxidant activity)等GO功能条目;下调的DEGs参与了神经发生(Neurogenesis)、解剖结构形态变化(Anatomical structure morphogenesis)和轴突发育(Axon development)等GO功能条目。KEGG信号通路富集分析结果(表2)显示,DEGs主要富集于mToR、Wnt和TGF-β信号通路,主要包括PI3K-AKT、Wnt/β-catenin、MEK1/2-ERK1/2和MEK/ERK信号通路。
2.5 DEGs的PPI网络分析结果
利用STRING数据库构建PPI互作网络,进一步探究DEGs间的互作关系,结果(图7)显示,共得到25个蛋白节点和33条互作关系,差异基因有HSPH1、SMAD2、HSP90B1、HSPA5、HSPB8和MYOC等,与其他基因互作最多的基因是HSPA2和ALB。
2.6实时荧光定量PCR验证结果
实时荧光定量PCR检测结果(图8和图9)显示,与CK组相比,FSH组DAZL和PIWIL1基因相对表达量极显著降低(Plt;0.01,下同),表明FSH组雏鸡卵巢发育先于CK组,FSH促进了雏鸡卵泡发育;与CK组相比,FSH组SMAD2、ZP1和CYP17A1基因相对表达量显著(Plt;0.05)或极显著升高,表明这些基因及其所在信号通路可能参与FSH影响雏鸡原始卵泡形成的过程;FSH受体相关基因FSHR相对表达量在FSH组和CK组间无显著差异,提示FSH促进雏鸡卵泡发育可能是通过提高SMAD2、ZP1和CYP17A1基因相对表达量来实现。此外,DAZL、PIWIL1、SMAD2、ZP1和CYP17A1基因的实时荧光定量PCR检测结果与RNA-Seq结果一致,反应测序数据质量可靠的同时也进一步证明了DAZL、PIWIL1、SMAD2、ZP1和CYP17A1基因在FSH组和CK组之间存在差异。
3讨论
动物原始卵泡的发生是一个复杂且调控严密的生理过程,由于缺乏有效的研究模型,该方面的研究存在诸多困难,至今FSH调控动物原始卵泡形成的机制仍有待揭示。Lei等(2010)研究表明,FSH能促进小鼠原始卵泡的发生;Guo等(2019)研究发现,鸡卵巢体外培养时添加FSH能促进原始卵泡的发生;Bi等(2021)研究发现,FSH能促进鸡颗粒细胞增殖。本研究结果显示,FSH组雏鸡卵巢体积和原始卵泡数量明显大于CK组,且体重变化更明显,提示FSH可能促进了雏鸡卵巢的发育。此外,FSH处理后的雏鸡卵巢体积明显增大,并且观察到有更多原始卵泡的形成,提示FSH对雏鸡原始卵泡的形成有积极影响。
PCA是对数据进行降维处理的一种方法,在不损失或低程度损失原有信息的前提下,将原来个数较多且彼此相关的指标转化为个数较少且彼此独立或相关性较小的综合指标,可避免重复信息的干扰并简化选择程序,便于综合评价候选个体,具有准确性和科学性(Guillén-Casla et al.,2011)。聚类分析是一种将数据对象划分成若干簇或类的过程,使同一类中的对象高度相似,而不同类之间的对象具有较大的差异(苏嘉庚等,2014)。本研究PCA结果显示,FSH组与CK组间差异明显,组内相似性较高,且与聚类分析结果基本一致,为DEGs分析打下了基础。PPI网络分析可揭示蛋白之间的互作关系,更好的理解生物过程的调控机制、疾病发生的分子基础和药物作用的潜在靶点(Li etal.,2014)。本研究中,PPI网络分析确定了主要参与FSH影响雏鸡原始卵泡发育的基因,这些基因编码的蛋白可能在FSH影响雏鸡原始卵泡发育的过程中发挥作用。此外,通过PPI网络分析共得到25个蛋白节点和33条互作关系,并鉴定出SMAD2等基因在FSH影响雏鸡原始卵泡发育中起关键作用。
本研究共获得617个DEGs,主要富集到PI3K-AKT、Wnt/β-catenin、MEK1/2-ERK1/2和MEK/ERK信号通路,这些通路主要参与颗粒细胞增殖(Lapointe et al.,2012)、原始卵泡的形成和发育(Li etal.,2014)及血管生成(Gong et al.,2021)等过程。DAZL和PIWIL1是原始生殖细胞中的高表达基因,常被视为原始生殖细胞的标记基因。PIWIL1是Argonaute(AGO)家族成员(Iwasaki et al.,2015),PIWI亚家族蛋白主要在生殖腺中表达,调控生殖干细胞维持和自我更新及生殖细胞发育和分化等生殖相关事件(Ku and Lin,2014)。研究表明,鸡卵巢PIWIL1基因表达水平随日龄的增长呈下降趋势(Chen et al.,2013)。本研究结果显示,FSH处理显著降低了DAZL和PIWIL1基因表达水平,推测是FSH促进了原始卵泡的发育,原始生殖细胞逐渐形成了原始卵泡所致。研究发现,CYP17A1参与雄激素的合成且能影响鸡的排卵进程(Rangel et al.,2007)。本研究结果显示,FSH处理显著升高了CYP17A1基因表达水平,推测FSH是通过调控CYP17A1基因的表达来调节雄激素的合成,进而影响雏鸡原始卵泡的形成。研究发现,SMAD2在多数早期卵泡中不表达,但会在颗粒细胞中表达(Sharum etal.,2017);敲除卵巢颗粒细胞中SMAD2基因会导致女性生育能力缺陷,这种缺陷与多个卵巢发育过程相关,包括卵泡发育和卵母细胞产生(Li etal.,2008),提示SMAD2基因可能与雏鸡卵泡发育相关。
研究表明,PI3K-AKT和Wnt信号通路参与细胞活性、增殖和凋亡的调控,在原始卵泡形成中发挥重要作用(Lapointe et al.,2012;Guo et al.,2019);MEK1/2-ERK1/2信号通路能调控细胞外基质沉积,细胞外基质作为卵巢基质的一部分,在卵泡发生中发挥重要作用(Sun et al.,2013);Wnt/β-catenin信号通路能增加颗粒细胞凋亡水平,抑制卵泡类固醇生成,进而抑制卵泡发育(Li etal.,2014)。本研究筛选出的DEGs主要富集在PI3K-AKT、Wnt、MEK1/2-ERK1/2和MEK-ERK信号通路,提示这些DEGs可能是通过PI3K-AKT、Wnt、MEK1/2-ERK1/2和MEK-ERK信号通路影响生殖细胞的增殖、分化和凋亡,进而调节雏鸡卵泡的形成。
4结论
FSH可能是通过影响颗粒细胞增殖、类固醇生成和血管生成等多条卵泡发育相关信号通路来促进雏鸡原始卵泡的形成,其对CYP17A1、SMAD2和ZP1等基因的调控可能是其促进原始卵泡生成的主要分子机制之一。
参考文献(References):
苏嘉庚.2014.基于Hadoop平台的分布式EM聚类算法[D].保定:河北师范大学.[Su J G.2014.Distributed EM clus-tering algorithm based on hadoop platform[D].Baoding:Hebei Normal University.]doi:10.7666/d.Y2563693.
Akhtar M,Wright J N,Lee-Robichaud P.2011.A review of mechanistic studies on aromatase(CYP19)and 17α-hydroxylase-17,20-lyase(CYP17)[J].The Journal of Ste-roid Biochemistry and Molecular Biology,125(1-2):2-12.doi:10.1016/j.jsbmb.2010.11.003.
Bi Y L,Yang S Y,Wang H Y,Chang G B,Chen G H.2021.Follicle-stimulating hormone is expressed in ovarian fo-llicles of chickens and promotes ovarian granulosa cell pro-liferation[J].Journal of Integrative Agriculture,20(10):2749-2757.doi:10.1016/S2095-3119(21)63606-7.
Chakraborty P,Roy S K.2017.Stimulation of primordial fo-llicle assembly by estradiol-17βrequires the action of bone morphogenetic protein-2(BMP2)[J].Scientific Reports,7(1):15581.doi:10.1038/s41598-017-15833-4.
Chen R,Chang G B,Dai A Q,Ma T,Zhai F,Xia M X,Liu L,Li J C,Hua D K,Chen G H.2013.Cloning and expression characterization of the chicken Piwil1 gene[J].Molecular Biology Reports,40(12):7083-7091.doi:10.1007/s 11033-013-2831-9.
Chen Y,Jefferson W N,Newbold R R,Padilla-Banks E,Pep-ling M E.2007.Estradiol,progesterone,and genisteininhibit oocyte nest breakdown and primordial follicle assembly in the neonatal mouse ovary in vitro and in vivo[J].Endocrinology,148(8):3580-3590.doi:10.1210/en.2007-0088.
Gong G W,Zheng Y Z,Kong X P,Wen Z.2021.Anti-angiogenesis function of Ononin via suppressing the MEK/ERK signaling pathway[J].Journal of Natural Products,84(6):1755-1762.doi:10.1021/acs.jnatprod.1c00008.
González-Morán M G.2011.Histological and stereological changes in growing and regressing chicken ovaries during development[J].Anatomical Record,294(5):893-904.doi:10.1002/ar.21364.
Guillén-Casla V,Rosales-Conrado N,León-González M E,Pérez-Arribas LV,Polo-Díez L M.2011.Principal compo-nent analysis(PCA)and multiple linesr regression(MLR)statistical tools to evaluate the effect of E-beam irradiationon ready-to-eat food[J].Journal of Food Composition andAnalysis,24(3):456-464.doi:10.1016/j.jfca.2010.11.010.Guo C Q,Liu G,Zhao Z,Mi YL,Zhang C Q,Li J.2019.Interac-tion of follicle-stimulating hormone and stem cell factor to promote primordial follicle assembly in the chicken[J].Frontiers in Endocrinology,10:91.doi:10.3389/fendo.2019.00091.
Guo C Q,Zhang G L,Lin X,Zhao D,Zhang C Q,Mi Y L,2019.Reciprocal stimulating effects of bFGF and FSH on chicken primordial follicle activation through AKT and ERK pathway[J].Theriogenology,132:27-35.doi:10.1016/j.theriogenology.2019.04.005.
Hughes G C.1963.The population of germ cells in the develo-ping female chick[J].Journal of Embryology and Experi-mental Morphology,11(3):513-536.doi:10.1242/dev.11.3.513.
Iwasaki Y W,Siomi M C,Siomi H.2015.PIWI-interacting RNA:Its biogenesis and functions[J].Annual Review of Biochemistry,84:405-433.doi:10.1146/annurev-biochem-060614-034258.
Ku H Y,Lin H F.2014.PIWI proteins and their interactors in piRNAbiogenesis,germline development and gene expres-sion[J].National Science Review,1(2):205-218.doi:10.1093/nsr/nwu014.
Lapointe E,Boyer A,Rico C,Paquet M,Franco H L,Gossen J,DeMayo F J,Richards J S,Boerboom D.2012.FZD1 regu-lates cumulus expansion genes and is required for normalfemale fertility in mice[J].Biology of Reproduction,87(5):104.doi:10.1095/biolreprod.112.102608.
Lei L,Jin S Y,Mayo K E,Woodruff T K.2010.The interac-tions between the stimulatory effect of follicle-stimulating hormone and the inhibitory effect of estrogen on mouse primordial folliculogenesis[J].Biology of Reproduction,82(1):13-22.doi:10.1095/biolreprod.109.077404.
Lei L,Spradling A C.2016.Mouse oocytes differentiatethrough organelle enrichment from sister cyst germ cells[J].Science,352(6281):95-99.doi:10.1126/science.aad 2156.
Li J,Wang G W,Wang C Y,Zhao Y,Zhang H,Tan Z J,Song Z H,Ding M X,Deng H K.2007.MEK/ERK signaling con-tributes to the maintenance of human embryonic stem cell self-renewal[J].Differentiation,75(4):299-307.doi:10.1111/j.1432-0436.2006.00143.x.
Li J,Zhao D,Guo C Q,Li J,Mi Y L,Zhang C Q.2016.Involvement of Notch signaling in early chick ovarian fol-licle development[J].Cell Biology International,40(1):65-73.doi:10.1002/cbin.10538.
Li L,Ji S Y,Yang J L,Li X X,Zhang J,Zhang Y,Hu Z Y,Liu Y X.2014.Wnt/β-catenin signaling regulates follicular development by modulating the expression of Foxo3a sig-naling components[J].Molecular and Cellular Endocrino-logy,382(2):915-925.doi:10.1016/j.mce.2013.11.007.
Li M,Chen W J,Wang J X,Wu F X,Pan Y.2014.Identifyingdynamic protein complexes based on gene expression pro-files and PPI networks[J].Biomed Research International,2014:375262.doi:10.1155/2014/375262.
Li Q L,Pangas S A,Jorgez C J,GraffJ M,Weinstein M,Mat-zuk M M.2008.Redundant roles of SMAD2 and SMAD3 in ovarian granulosa cells in vivo[J].Molecular and Cellu-lar Biology,28(23):7001-7011.doi:10.1128/MCB.00732-08.
Méndez-Herrera M C,Tamez L,Cándido A,Reyes-Esparza J A,Pedernera E.1998.Follicle stimulating hormone increa-ses somatic and germ cell number in the ovary du-ring chick embryo development[J].General and Comparative Endocrinology,111(2):207-215.doi:10.1006/gcen.1998.7108.
Nie H T,Xu Y L,Zhang Y Q,Wen Y,Zhan J X,Xia Y,Zhou Y K,Wang R P,Wu X B.2023.The effects of endogenous FSH and its receptor on oogenesis and folliculogenesis in female Alligator sinensis[J].BMC Zoology,8(1):8.doi:10.1186/s40850-023-00170-z.
O’Connell J M,Pepling M E.2021.Primordial follicle formation-some assembly required[J].Current Opinion in Endocrine and Metabolic Research,18:118-127.doi:10.1016/j.coemr.2021.03.005.
Rangel P L,Rodríguez A,Gutierrez C G.2007.Testosterone directly induces progesterone production and interacts with physiological concentrations of LH to increase granulosa cell progesterone production inlaying hens(Gallus domes-ticus)[J].Animal Reproduction Science,102(1-2):56-65.doi:10.1016/j.anireprosci.2006.09.029.
Recchia K,Jorge A S,Pessôa L V F,Botigelli R C,Zugaib V C,de Souza A F,Martins D D S,Ambrósio C E,Bressan F F,Pieri N C G.2021.Actions and roles ofFSH ingermi-native cells[J].International Journal of Molecular Scien-ces,22(18):10110.doi:10.3390/ijms221810110.
Roy S K,Albee L.2000.Requirement for follicle-stimulating hormone action in the formation of primordial follicles du-ring perinatal ovarian development in the hamster[J].Endo-crinology,141(12):4449-4456.doi:10.1210/endo.141.12.7805.
Sharum I B,Granados-Aparici S,Warrander F C,Tournant,F P,Fenwick M A.2017.Serine threonine kinase receptor associated protein regulates early follicle development in the mouse ovary[J].Reproduction,153(2):221-231.doi:10.1530/REP-16-0612.
Skinner M K.2005.Regulation of primordial follicle assembly and development[J].Human Reproduction Update,11(5):461-471.doi:10.1093/humupd/dmi020.
Sun D,Zhang Y,Wang C,Hua X,Zhang X A,Yan J.2013.Sox9-related signaling controls zebrafish juvenile ovary-testis transformation[J].Cell Deathamp;Disease,4(11):e930.doi:10.1038/cddis.2013.456.
Tanimoto R,Sekii K,Morohaku K,Li J Z,Pépin D,Obata Y.2021.Blocking estrogen-induced AMH expression is cru-cial for normal follicle formation[J].Development,148(6):dev197459.doi:10.1242/DEV.197459.
Wang C,Roy S K.2007.Development of primordial follicles inthe hamster:Role of estradiol-17β[J].Endocrinology,148(4):1707-1716.doi:10.1210/en.2006-1193.
Wang J J,Ge W,Zhai Q Y,Liu J C,Sun X W,Liu W X,Li L,Lei C Z,W.Dyce P W,De Felici M,Shen Wei.2020.Single-cell transcriptome landscape of ovarian cells during primordial follicle assembly in mice[J].PLoS Biology,18(12):e3001025.doi:10.1371/journal.pbio.3001025.
Wang J R,K.Roy S K.2004.Growth differentiation factor-9 and stem cell factor promote primordial follicle formation in the hamster:Modulation by follicle-Stimulating hor-mone[J].Biology of Reproduction,70(3):577-585.doi:10.1095/biolreprod.103.023234.
Zachos N C,Billiar R B,Albrecht E D,Pepe G J.2002.Deve-lopmental regulation of baboon fetal ovarian maturation by estrogen[J].Biology of Reproduction,67(4):1148-1156.doi:10.1095/biolreprod67.4.1148.
Zhao Z H,Li CY,Meng T G,Wang Y,Liu W B,LiA,Cai Y J,Hou Y,Schatten H,Wang Z B,Sun Q Y,Sun Q.2020.Single-cell RNA sequencing reveals regulation of fetal ovary development in the monkey(Macaca fascicularis)[J].Cell Discovery,6(1):97.doi:10.1038/s41421-020-00219-0.
(责任编辑 兰宗宝)

