碱胁迫下油莎豆幼苗生理代谢和转录组分析
摘要:油莎豆是一种草本油料作物,也是粮、油、饲、肥应用型经济作物,综合利用价值很高,而且油莎豆具有抗旱和耐盐碱特性,明确其耐盐碱分子调控机制可为其分子育种奠定基础。本研究对油莎豆幼苗进行100 mmol/L混合碱(NaHCO3+Na2Co3,摩尔比2:1)胁迫处理,并分别于处理0、3、6、9、12 d取样,进行丙二醛(MDA)含量、可溶性蛋白(SP)含量、超氧化物歧化酶(SOD)活性、脯氨酸(Pro)含量、过氧化物酶(POD)和过氧化氢酶(CAT)活性等生理指标的测定和转录组测序分析。结果表明,SOD和CAT活性在处理前6d迅速上升,之后平缓下降;POD活性先迅速上升,胁迫6d后迅速下降;MDA含量在碱胁迫下表现为先逐渐上升,6d后上升迅速;Pro和SP含量在碱胁迫时均表现出逐渐增大趋势,前者上升迅速,后者上升相对平缓。转录组分析发现,在碱胁迫6d时,共鉴定出5 842个差异表达基因(DEGs),其中上调3 136个,下调2 706个。CO和KECC聚类分析显示,DECs在植物激素信号转导、淀粉和蔗糖代谢等过程中显著富集。此外,实时荧光定量PCR(qRT-PCR)分析结果与转录组分析结果大致相同,这证实了RIVA-seq数据的有效性。本研究结果为深入了解油莎豆幼苗对碱胁迫的响应机制提供了重要信息。
关键词:油莎豆;碱胁迫;生理特性;转录组分析
中图分类号:S565.9 文献标识号:A 文章编号:1001-4942(2024)12-0001-09
土壤盐碱化严重影响植物生长发育,对全球农业造成了一定的威胁。据统计,全球有上百个国家存在盐碱地,我国盐碱地面积约占全球总盐碱地面积的10%,高达约1亿hm2,其中有920.9万hm2的盐碱化耕地,占我国耕地面积的6.62%。东北地区是我国最大的盐碱地分布区,仅松嫩平原盐碱地面积就高达373.3万hm2。全球气候变暖等自然因素以及大面积开荒等人为因素导致土壤次生盐碱化日益加重,严重影响了我国农业的发展,因此,利用基因工程等技术手段来筛选农作物耐盐碱基因,培育耐盐碱品种,提高盐碱地开发和利用率,对我国经济发展和粮食安全具有重要意义。
油莎豆(Cyperus esculentus L.)是莎草科的草本油料作物,脂肪含量约为30%,且油脂脂肪酸组成与橄榄油相近,不饱和脂肪酸约占80%(油酸65%-70%,亚油酸12%-15%),而且还富含淀粉、糖、维生素和矿物质等,被广泛用于食品加工、酿酒、榨油以及化妆品、药品生产等。油莎豆原产地为沙漠干旱地区,具有耐旱、耐涝、耐贫瘠、耐盐碱、适应性广的特点,非常适宜荒漠化等边际土地种植,可以实现在不与主粮争地的同时为国家食用油及粮食安全做出贡献,是一种可以用于盐碱地改良和边际土地利用的优质作物。
当植物开始遭受碱胁迫时,会迅速产生活性氧(reactive oxygen species,ROS),ROS作为第二信使,参与植物生长过程中的多种反应。但当植物体内ROS浓度过高时,会导致膜脂过氧化并产生大量丙二醛(malondialdehyde,MDA),使膜透性增加。为了抵御胁迫,植物会启动体内的酶促和非酶促清除系统来清除体内多余的ROS,主要包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)等抗氧化酶以及脯氨酸(proline,Pro)、可溶性蛋白(soluble protein,SP)等渗透调节物质,以减少胁迫带来的伤害。
同时,植物在抵抗碱胁迫时发生的一系列生理生化反应又会诱导碱胁迫相关基因的表达,这些基因参与激素信号转导、离子转运、氧化还原、渗透调节等多种生物学过程,其存在与否及表达差异使植物呈现出对碱胁迫不同的耐受程度,因此,分析碱胁迫相关基因的表达差异和模式可为解析植物的耐碱机制奠定基础。转录组测序技术(RNA-seq)常被用来分析差异表达基因(DEGs),已被应用于拟南芥、玉米、大豆等多种植物的碱胁迫相关基因表达检测。
国内对油莎豆的研究起步较晚,对其抵御碱胁迫的研究相对较少,尚缺乏对其碱胁迫机制的全面深入了解。本研究以NaHCO3和Na2CO3混合碱溶液模拟碱胁迫环境,通过测定油莎豆苗期叶片与碱胁迫有关的生理指标解析碱胁迫下其生理代谢的规律,并用RNA-seq挖掘差异基因,了解油莎豆的分子响应机制,以期为油莎豆在盐碱地的种植及耐碱品种的培育提供参考。
1材料与方法
1.1试验材料
油莎豆品种选用吉林省农业科学院经济植物研究所选育的‘吉莎2号’。100 mmol/L碱胁迫溶液用分析纯NaHCO3和Na2CO3按摩尔比2:1混合配制。试验于2022年5月10日至12月30日进行。
1.2试验设计
选取籽粒饱满的油莎豆种子,在35℃恒温培养箱中用清水浸种24 h,然后取出用湿毛巾包裹住放人铁盘中,再继续放入35℃恒温培养箱中催芽:待芽发齐后移栽至装有蛭石与细沙(1:1混合)的育苗钵(9 cmx9 cmx8 cm)中,每钵一株;将育苗钵放在育苗盘中培育,期间每3d浇一次水,7d后待幼苗三片叶时进行混合碱胁迫处理(A),以未进行胁迫处理的幼苗为对照(CK)。每个处理设3次重复,每个重复10株。分别在处理0、3、6、9、12 d取叶样,用于生理指标测定以及转录组测序分析。
1.3生理指标测定
SOD活性测定采用氮蓝四唑(NBT)法,POD活性测定采用愈创木酚法,CAT活性测定采用紫外吸收法,SP含量测定采用考马斯亮蓝(G-250)染色法,Pro含量测定采用磺基水杨酸法,淀粉酶含量测定采用3,5-二硝基水杨酸法,MDA含量测定采用硫代巴比妥酸(TBA)法。
1.4转录组测序分析
1.4.1提取RNA、构建文库以及转录组测序 根据生理指标测定结果,选取处理6d的油莎豆叶片,委托北京百迈客生物科技有限公司进行转录组测序。先构建cDNA文库,然后使用IlluminaNovaSeq6000测序平台进行测序,过滤筛选后得到高质量的Clean Data;利用Triruty软件进行序列组装,筛去表达量低的转录本,统计Unigene的长度。
1.4.2Unigene功能注释 通过比较碱胁迫处理与对照的基因表达量,得到差异表达基因(DEGs)。利用FPKM值表示对应Unigene的表达丰度。差异倍数(Fold Change)表示两样品(组)间表达量的比值。错误发现率(1 discover rate,FDR)是通过对差异显著性P值(P-val-ue)进行校正得到的,表示差异的显著性。本试验中将Fold Change≥2且FDRlt;0.01作为筛选标准。
用DIAMOND软件将Urugene序列与KEGG数据库比对,用KOBAS得到KEGGOnhology结果;用InterProScan基于InterPro整合的数据库分析新基因的GO Orthology结果;预测完Unigene的氨基酸序列后使用HMMER软件与Pfam数据库比对,获得Urugene的注释信息。
1.4.3荧光定量PCR验证候选基因 为了验证转录组测序分析结果的准确性,从富集通路中筛选出11个DEGs进行荧光定量PCR检测。使用RNA提取试剂盒(天根)提取碱胁迫6d的油莎豆苗叶片的总RNA。使用Mi曲tyScript第一链cDNA合成Master Mix反转录试剂盒(生工)将RNA反转录成cDNA。利用IDT's PrimerQuestTool(https://www.idtdna.com)设计特异性引物,以CeUCE2作为内参基因,然后采用2-△△Ct法计算基因相对表达量,并与转录组测序分析得到的FPKM值进行对比。
2结果与分析
2.1碱胁迫对油莎豆生理代谢的影响
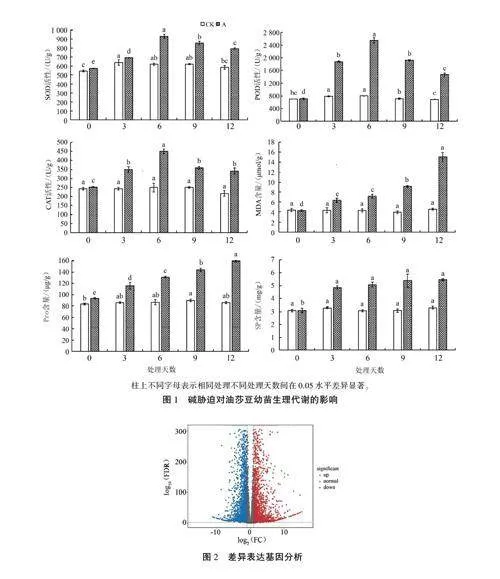
如图1所示,碱胁迫后油莎豆叶片中的SOD、POD、CAT活性及MDA、SP、Pro含量均明显升高。随着碱胁迫时间的延长,MDA、SP、Pro含量均持续上升,而SOD、POD、CAT活性呈现先上升后下降的趋势,且均在处理6d时最高,说明处理第6天是研究碱胁迫响应机制的最佳采样时间。
2.2碱胁迫后的差异表达基因分析
根据生理指标分析结果,选取碱胁迫6d的油莎豆幼苗叶片,利用RNA-seq技术进行转录组测序分析,比较组名称为CK vs A。使用Unigene数据集作为进一步分析的参考,DEGs则通过DESeq2进行评估。结果显示,共鉴定到5 842个DEGs,其中上调3 136个,下调2 706个(图2)。
2.3GO富集分析
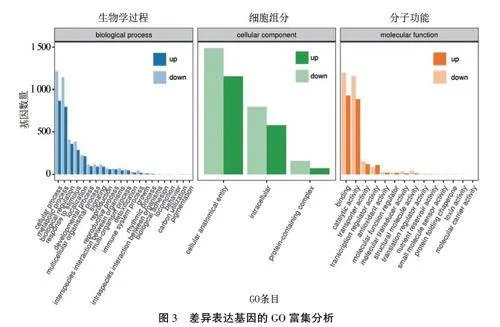
对鉴定到的DEGs进行GO富集分析,结果见图3。在生物学过程方面,细胞过程(cellular process)、代谢过程(metabolic process)、生物调节(biologcal regulation)、应激反应(response to stimulus)等在碱胁迫下被显著富集。在细胞组分方面,细胞解剖实体(cellular anatomical entity)、细胞内(intracellular)、蛋白质复合物(proteincontaining complex)等在碱胁迫下被显著富集。在分子功能方面,结合(binding)、催化活性(catalytic activity)、转运体活性(transponer activity)、转录调节活性(transcription regulator activity)等在碱胁迫下被显著富集。
2.4KEGG通路分析
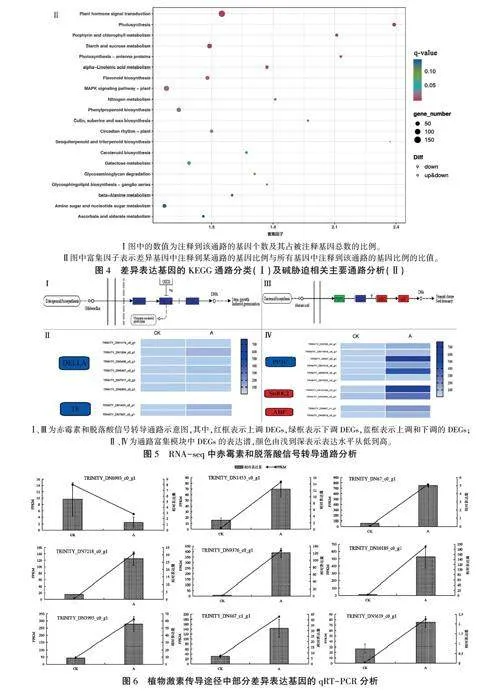
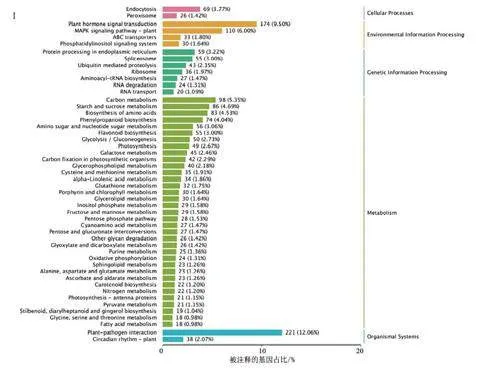
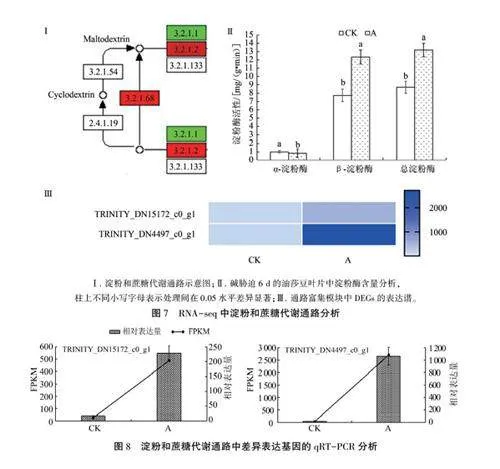
根据KEGG注释结果,发现共有1 832个DEGs注释到KEGG数据库,富集到127个代谢通路中。其中,大多DEGs注释到代谢通路,占被注释基因总数的70.42%;注释到环境信息处理、基因信息处理、生物有机体系统通路的DEGs分别占18.94%、14.41%、14.13%:注释到细胞过程的DEGs最少,仅占5.19%(图41)。在分类通路中,富集DEGs最多的通路为植物一病原互作(plant-pathogen interaction),有221个DEGs,占12.06qo;其次为植物激素信号转导(plam hormonesignal transduction),有174个DEGs,占9.49%;MAPK信号通路-植物(MAPK signaling pathway-plant)、碳代谢(carbon metabolism)、淀粉和蔗糖代谢(starch and sucrose metabolism)、氨基酸的生物合成(biosynthesis of amino acids)通路分别注释有110、98、86、83个DEGs,占比分别为6.00%、5.35%、4.69%、4.53%。
进一步分析与碱胁迫相关的主要通路,结果(图4Ⅱ)表明,q值gt;0.05的通路为植物激素信号转导以及淀粉和蔗糖代谢。推测碱胁迫下油莎豆通过高富集表达与植物激素信号转导、淀粉和蔗糖代谢相关的基因来提高植株的碱胁迫耐性。
2.5qRT-PCR对DEGs高富集通路的验证分析
2.5.1植物激素信号转导通路 上述分析结果显示植物激素信号转导通路(k004075)在GO和KEGG中均有DEGs富集,因此对该通路中DEGs表达明显发生改变的赤霉素(图5 Ⅰ、Ⅱ)和脱落酸(ABA)(图5Ⅲ、Ⅳ)两个通路进行进一步分析,并从中选取9个DEGs进行qRT-PCR验证分析,结果(图6)显示,qRT-PCR结果与RNA-seq结果在表达量上存在差异,但在CK和碱胁迫下的变化趋势相似,证明了本研究转录组测序结果的合理性和可靠性。
2.5.2淀粉和蔗糖代谢通路 KEGG分析显示在淀粉和蔗糖代谢途径(ko00500)(图7Ⅰ)富集的DEGs表达也明显改变(图7Ⅲ);而且碱胁迫6d的油莎豆叶片中,a-淀粉酶活性显著降低,B-淀粉酶和总淀粉酶活性显著升高(Plt;0.05)(图7Ⅱ)。因此推测淀粉和蔗糖代谢途径也参与了油莎豆对碱胁迫的响应。对该通路富集的两个表达明显改变的DEGs进行qRT-PCR分析,结果(图8)显示,qRT-PCR结果与RNA-seq结果在CK和碱胁迫下的表达趋势相似且表达量相近,再次证明了本研究转录组测序结果的合理性和可靠性。
3讨论
苗期是植物对外界环境十分敏感的时期,也是进行胁迫处理的关键时期。碱胁迫对植物组织和器官的发育影响显著,因此明确油莎豆苗期对碱胁迫的响应机制对提高其耐碱性具有重要意义。前人研究发现,碱胁迫后植物地上部生物量的降低程度显著高于地下部生物量,说明地上部对碱胁迫更敏感。因此,本研究选用碱胁迫下的油莎豆苗期叶片进行生理指标测定和转录组测序分析。
碱胁迫通常会对植物造成渗透胁迫、次生伤害以及离子毒害等,为了维持正常生长,植物会启动体内的酶促清除系统(SOD、POD、CAT等抗氧化酶)来缓解ROS带来的伤害,同时通过积累SP、Pro等渗透调节物质降低渗透胁迫伤害。本研究结果显示,混合碱胁迫下,油莎豆叶片中的SOD、POD、CAT活性均呈先上升后下降趋势,且均在处理第6天达到峰值,之后均显著下降;MDA含量在胁迫过程中持续增加,尤其胁迫处理6d后快速升高。这可能是因为碱胁迫初期,油莎豆能够通过提升体内相关抗氧化酶活性快速清除ROS,维持植株正常生长:但随着胁迫时间的延长,活性氧积累-清除平衡被打破,ROS过量积累,对细胞膜系统造成脂质过氧化伤害,从而导致MDA大量积累,抗氧化酶系统受到破坏,酶活性下降。孔德真等研究表明,当用200 mmol/LNa2CO3处理高丹草时,在0-12 h抗氧化酶活性显著上升,超过12 h则逐渐下降。这与本研究结果一致,说明抗氧化酶活性在植物抗逆过程中发挥作用时受到细胞自主活性的限制。另外,本研究结果显示Pro、SP含量也均随着碱胁迫时间的延长呈显著上升趋势,这与麻莹等在盐地碱蓬、刘佳等在山桃中的研究结果一致。综上,处理第6天是研究油莎豆苗期对碱胁迫响应机制的合适采样时间,因此本研究选用碱胁迫处理第6天的油莎豆叶片样品进行后续转录组测序分析。
耐碱相关基因会在植物受到碱胁迫时迅速响应,但因为差异基因的存在,不同植物的耐碱性不同。本研究利用RNA-seq技术检测了100mmol/L混合碱处理第6天的油莎豆苗期叶片的基因表达情况,结果显示,碱胁迫下有5 842个基因差异表达,其中3 136个上调表达,2 706个下调表达。
由于物种不同以及胁迫处理的溶液、浓度、时间的不同,DEGs富集的GO条目和KEGG通路会有所差别,但也会存在很大的相似性。魏嘉等研究发现,在100 mmol/L Na2CO3胁迫6d的野生大豆中,DEGs显著富集在细胞、细胞部分、结合、催化活性等GO条目。本研究结果显示,DEGs显著富集在细胞过程、代谢过程、结合等GO条目中,有与上述野生大豆相似的条目,说明这些条目可能与碱胁迫响应密切相关。
植物中大部分耐碱基因与其胁迫下的生理代谢过程相对应,比如与渗透调节、植物激素信号转导和离子转运相关的基因等。本研究在KEGG分析中发现,大多数DEGs被注释到植物激素信号转导、淀粉和蔗糖代谢、卟啉和叶绿素代谢等通路上。这与李慧姬用碱胁迫辣椒13 h得到的DEGs主要富集在类黄酮生物合成、淀粉和蔗糖代谢、类胡萝卜素的生物合成等通路大致相同,说明碱胁迫对植物生理过程产生的影响非常复杂。
植物对非生物胁迫尤其是碱胁迫的响应机制有很多,激素信号转导是其核心途径,其中,碱胁迫可以诱导ABA、赤霉素快速响应,进而引发植物一系列的生理生化反应,以抵御碱胁迫伤害。在本研究中,GO和KEGG分析均发现DEGs在ABA和赤霉素相关途径有富集,表明两者均参与了油莎豆对碱胁迫的响应。同时,本研究中DEGs在淀粉和蔗糖代谢途径也有较多富集,而且油莎豆幼苗叶片中的淀粉酶活性在碱胁迫下也发生了显著变化,这表明淀粉和蔗糖代谢途径也在油莎豆抵御碱胁迫时发挥了作用。
4结论
油莎豆苗期对混合碱胁迫具有一定的耐性,胁迫6d是对其进行转录组测序分析的最佳取样时间。从碱胁迫6d的油莎豆叶片中,共鉴定到3 136个上调表达和2 706个下调表达基因,这些DEGs主要富集在植物激素信号转导(ko04075)、淀粉和蔗糖代谢(ko00500)等途径。本研究结果可为油莎豆耐碱品种选育和耐碱分子机制解析奠定基础。

