原发性腹股沟精原细胞瘤1 例报告及文献复习
[摘 要] 目的:分析1例腹股沟精原细胞瘤睾丸精原细胞瘤患者的临床资料,为该类患者诊断和治疗提供参考。方法:收集1例原发性腹股沟精原细胞瘤患者的临床症状、影像学特征、病理学表现和诊断及治疗方法,并进行文献复习。结果:患者,男性,43岁,因偶然发现左侧腹股沟肿物入院,专科查体肿块、边界尚清,表面欠光整,可触及结节和局部波动感,活动欠佳,无表皮溃疡,肤温略高,双侧睾丸形态和大小正常且无压痛。辅助检查,甲胎蛋白(AFP) 2. 3 mg·L-1、β-绒毛膜促性腺激素(HCG) lt;0. 1 IU·L-1、乳酸脱氢酶(LDH) 254. 31 IU·L-1,肝功、肾功、血常规和凝血常规均正常,胸部CT、心电图、心脏彩超、肝胆脾胰彩超和后腹膜彩超均未见异常。肿瘤科术前穿刺病理结果提示精原细胞瘤,经临床综合分析后决定行腹股沟肿物切除术和腹股沟淋巴结清扫术,术后病理与术前病理结果一致,均为精原细胞瘤且伴腹股沟淋巴结转移,术后1、3、6 和8 个月随访,患者恢复良好,无任何不适,能从事轻度体力活动,且病情稳定,无进展表现,目前已于肿瘤科行3 次放化疗。结论:原发性腹股沟精原细胞瘤治愈率高,恶性度普遍较低,对放疗和化疗敏感,预后良好。
[关键词] 腹股沟肿物; 原发性精原细胞瘤; 甲胎蛋白; 绒毛膜促性腺激素; 乳酸脱氢酶
[中图分类号] R699. 8 [文献标志码] B
精原细胞瘤常见于睾丸, 为生殖细胞肿瘤中最常见的类型[1]。在异位精原细胞瘤中, 发生于腹股沟的精原细胞瘤较为罕见, 其中大部分伴单侧睾丸发育不全或单侧隐睾。两侧睾丸发育正常的原发性腹股沟精原细胞瘤则更为罕见, 大部分特征和睾丸精原细胞瘤相似, 无特异性表现, 故明确诊断需要依靠病理穿刺活检。目前国内少有报道, 仅于2009 年报道过1 例原发性腹股沟精原细胞瘤的治验[2]。本文作者报道1 例原发性腹股沟精原细胞瘤患者的临床症状、体征、影像学、病理学和免疫学特点, 分析其手术方法、放疗、化疗和预后情况, 并进行文献复习, 以提高临床医生对该疾病的认识。
1 临床资料
1. 1 一般资料 患者,男性,43岁,2023年 9月偶然发现左侧腹股沟肿物,质硬,无疼痛和红肿。遂就诊于吉林大学中日联谊医院肿瘤科行病理穿刺活检,病理结果提示左侧腹股沟精原细胞瘤可能性大。于2023 年10 月17 日入本科治疗。入院后患者神志清楚,精神状态良好,饮食正常且睡眠充足,大小便均无任何异常。查体结果:左侧腹股沟区可触及大小约5 cm×4 cm×4 cm 肿块, 边界尚清,表面欠光整, 可触及结节和局部波动感, 活动欠佳,无表皮溃疡,肤温略高。双侧睾丸形态和大小正常,无压痛。全身淋巴结未触及肿大。
1. 2 实验室检查 肝功、肾功、血常规和凝血常规检查均正常。甲胎蛋白(alpha fetoprotein,AFP)2. 3 mg·L-1, β-绒毛膜促性腺激素(chorionicgonadotropin, HCG) lt;0. 1 IU·L-1, 乳酸脱氢酶(lactate dehydrogenase,LDH) 254. 31 IU·L-1。
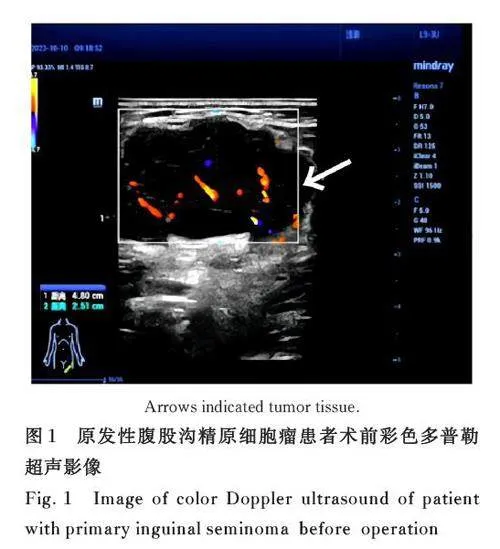
1. 3 影像学检查 胸部CT、心电图、心脏彩超、肝胆脾胰彩超和后腹膜彩超均未见异常。全身浅表淋巴结彩超显示:双侧颈部、锁骨上窝、双腋下和右侧腹股沟区未见肿大淋巴结,左侧腹股沟区可见大小4. 8 cm×2. 5 cm 低回声团,内可见血流信号。超声提示:左侧腹股沟占位(图1)。
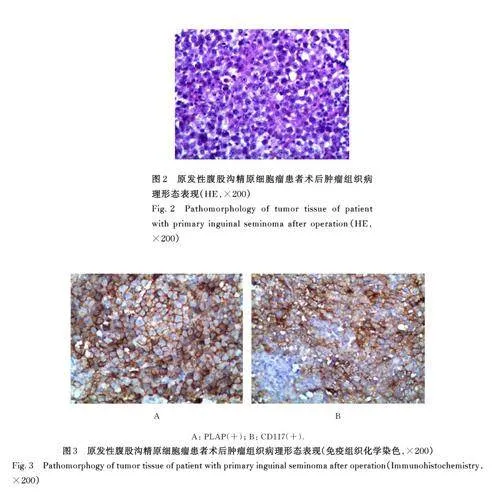
1. 4 病理学检查 经临床综合分析,决定对患者行腹股沟肿物切除术和腹股沟淋巴结清扫术。手术过程:患者于静吸复合全身麻醉下取平卧位,术区及周围皮肤强力碘消毒,铺无菌巾单,在左侧腹股沟上0. 5 cm 作平行于腹股沟切口, 长约5. 0 cm,切开皮下脂肪, 剪开腹外斜肌腱膜, 钝性向下分离,充分暴露左腹股沟管。术中见:左侧腹股沟肿物1 枚,大小约6. 0 cm×4. 5 cm×4. 0 cm,周围边界欠清晰,周围组织粘连重。术中诊断:左侧腹股沟肿物(精原细胞瘤可能性大),决定行左侧腹股沟肿物切除术和腹股沟淋巴结清扫术,沿肿物边界分离肿物于周围组织,避免肿瘤破裂导致肿瘤细胞播散, 完整切除肿物及周围淋巴结, 在切除过程中,要注意保护周围的血管和神经等重要结构。切除完毕后,充分止血,然后按层次缝合切口各层组织, 术毕。术中麻醉效果良好, 患者生命体征平稳,失血少,未输血,无特殊用药。标本家属过目后送病理。术后病理结果:左侧腹股沟精原细胞瘤(与术前穿刺结果一致)。肿瘤大小为6. 0 cm×4. 5 cm×4. 0 cm,切面灰白质地细腻,表面多结节状。周围淋巴组织增生明显,大小1. 0 cm×0. 8 cm×0. 6 cm,切面找到可疑结节5 枚,直径0. 5~0. 6 cm(图2)。免疫组织化学染色结果:A5 片免疫组织化学 染 色,胎 盘 碱 性 磷 酸 酶(placental alkalinephosphatase, PLAP)(+)(图3A); AFP (-),β-HCG (-),Ki67 (热点区70%+),CD30 (-),磷脂酰肌醇蛋白聚糖3 (glypican-3,GPC-3)(-),CD117 (+)(图3B); 淋巴管内皮细胞特征性标志物D2-40 ( + ), 上皮膜抗原(epithelialmembrane antigen,EMA)(-),婆罗双树样基因4(spalt-like transcription factor 4, SALL4)(+),RNA 结合蛋白LIN28 (+),OCT3/4 (+),白细胞共同抗原(leukocyte common antigen, LCA)(-)。左侧腹股沟淋巴结转移(2/7) 转移灶最大径0. 2 cm,B1 片免疫组织化学染色,SALL4 (-);B2 片免疫组织化学染色,SALL4 (+)。
1. 5 临床诊断和治疗 结合患者病史、查体、实验室检查、影像学和术前及术后病理检查,最终诊断为左侧原发性腹股沟精原细胞瘤和左侧腹股沟淋巴结转移癌。术后患者进行放疗和化疗。
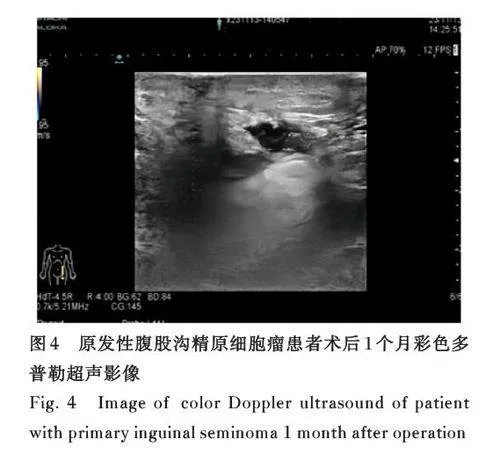
1. 6 随 访 患者术后1 个月前往本科门诊行复查全身淋巴结彩超提示:左侧腹股沟区低回声,考虑术后所致, 且未见淋巴结转移(图4)。采用电话回访方式随访至2024 年5 月,共4 次,目前患者无任何不适,能从事轻度体力活动,且病情稳定,无进展表现。
2 讨 论
精原细胞瘤是起源于生殖腺的恶性肿瘤,最常见的是睾丸精原细胞瘤,占睾丸肿瘤的30%~40%,精原细胞瘤在青春期前很少出现,发病年龄高峰在40~50 岁, 多发生于生殖腺, 异位的原发精原细胞瘤较为罕见, 纵隔约71%, 腹膜后约25%,原发性腹股沟精原细胞瘤尤为罕见,是一种胚胎残余肿瘤,常来自残余的泌尿生殖嵴胚胎,多数为一侧睾丸下降不完全,但也可发生于两侧睾丸正常的腹股沟精原细胞瘤[2-3]。该患者为原发性腹股沟精原细胞瘤, 年龄43 岁, 符合精原细胞瘤发病年龄,且有腹股沟淋巴结转移。目前精原细胞瘤病因尚未完全阐明,常见的病因包括先天性因素和后天性因素。精原细胞瘤先天性因素主要包括隐睾、遗传、多乳症和睾丸女性综合征等,其中隐睾为最主要诱发因素。隐睾发生恶变的概率是正常睾丸的30~50 倍,其中精原细胞瘤发生率达80% [4]。7%~10% 的睾丸肿瘤患者既往存在隐睾病史,其原因可与生殖细胞形态异常、局部温度、血供应障碍、内分泌功能障碍和性腺发育不全有关。患者10 岁后行睾丸固定术, 对预防睾丸肿瘤发生无意义, 患者10 岁前手术可明显降低其睾丸肿瘤发病率,但也有观点认为手术使隐睾下降固定仅解决了温度因素,睾丸自身细胞发育和内分泌代谢的缺陷却无法改善,因此手术并未降低隐睾的恶变率[5]。精原细胞瘤后天性因素主要包括损伤、激素、感染和睾丸萎缩等,临床上最常见的以隐睾为主[6]。精原细胞瘤为生殖细胞肿瘤中最常见的类型,因精原细胞瘤常见于睾丸,常见的症状是单个结节或单侧无痛性肿胀睾丸,因其发展较慢,肿瘤虽大,但症状不明显,通常未引起注意。而原发性腹股沟精原细胞瘤仅为腹股沟区单发无痛性肿块,同样缺乏特异性。该例患者疾病初发时仅为腹股沟区单发的无痛性肿块,与上述表现一致。
肿瘤诊断中体格检查仍是重要诊断手段,如触诊睾丸精原细胞瘤时用拇指、示指和中指对睾丸进行仔细的触诊,因被白膜所限制通常为卵圆形,且精原细胞瘤一般为无痛和橡皮样的膨胀性方式生长。腹股沟原发性精原细胞瘤也可用上述方式查体,查体时注意肿物大小、与周围组织的关系、肿物性质、皮温、有无压痛、有无波动感和活动度等。该患者左侧腹股沟区可触及大小约5 cm×4 cm×4 cm 肿块,边界尚清,表面欠光整,可触及结节和局部波动感,活动欠佳,无表皮溃疡,肤温略高且无压痛。触诊睾丸时两侧睾丸均未触及肿块。其次超声检查仍可作为首选检查之一,测定肿物大小、形态、有无肿块及区别是否为炎症和组织水肿等。睾丸精原细胞瘤可行磁共振成像(magnetic resonance imaging,MRI) 检查,因肿瘤细胞排列致密, 含水量低于正常睾丸组织, MRI上T1WI 等信号,T2WI 显示稍低信号,肿瘤内存在纤维血管间隔可显示为T2WI 更低信号的瘤内分隔且增强后强化, 肿瘤细胞排列致密使水分子扩散受限, 磁共振弥散加权成像(diffusionweighted imaging,DWI) 呈高信号,表观弥散系数(apparent diffusion coefficient, ADC) 值降低[7]。肿瘤较大时内部可出现出血和坏死[8]。以上辅助检查相辅相成,但均无法确诊,病理穿刺活检为金标准,可明确诊断。
腹股沟肿物诊断时还需要与腹股沟疝和股疝等疾病相鉴别。直疝患者在行ValsaIva 动作时下腹部局部的腹壁变微单薄,此时可见球形或半球形包块从直疝三角突出,超声观察时可见腹部下血管血流束。斜疝则常为梨形,常由内环口突出,彩超表现为阴囊、腹股沟区不均匀和大小不一的回声区,若存在肠管或疝内容物,会出现蠕动性的肠腔回声,增加腹腔压力,蠕动强度增明显增加[9]。该患者腹股沟区肿物ValsaIva 动作及改变体位未见肿物变化,阴囊触诊及阴囊彩超均见异常,故排除腹股沟疝可能性。股疝常见于40 岁以上的中年女性患者[10]。该患者行睾丸彩超提示双侧睾丸未见明显异常,故排除继发可能性。术前病理穿刺活检提示精原细胞瘤,故未进行进一步影像学检查。实验室检查AFP、β-HCG 和LDH 可作为必查指标进行辅助诊断。该患者AFP 和β-HCG 水平均未升高,仅LDH 水平升高。
非精原细胞瘤肿瘤标志物水平升高约为90%,AFP 为50%~70%, β -HCG 为40%~60%。精原细胞瘤肿标志物升高仅为30%,且β2 微球蛋白(β2-microglobulin,β2-MG) 在精原细胞瘤患者外周血中表达明显升高[11]。β2-MG 和碱性磷酸酶比值(albumin to alkaline phosphatase ratio, AAPR) 均对精原细胞瘤有较高的诊断效能,二者联合诊断效能更佳, 可为临床提供参考依据[12]。白蛋白和AAPR 在外周血中表达水平明显降低,且其并无绝对固定的统一标准正常值。精原细胞瘤的免疫组织化学染色结果具有一定的特异性, PAS (+)、CD117 (+) 和PLAP (+) 能够辅助确诊精原细胞瘤[13]。该患者免疫组织化学染色结果完全支持精原细胞瘤的诊断。
精原细胞肿瘤的经典治疗方式包括手术治疗,如发生于睾丸则行睾丸根治性切除术、腹膜后淋巴结清扫术、放疗和化疗等。该患者因伴有腹股沟淋巴结转移,行腹股沟精原细胞瘤根治性切除术和腹股沟淋巴结清扫术。精原细胞瘤转移途径多以淋巴道为主,晚期可有血道转移,恶性度普遍较低,不易转移[14-16]。早期行手术切除,效果良好,是少数几种可治愈的恶性肿瘤之一。典型精原细胞瘤多采用以顺铂为中心的联合化疗方案, 如BEP 方案(博来霉素+依托泊苷+顺铂),其中放疗范围包括腹主动脉旁、同侧髂血管淋巴引流区、腹股沟淋巴结区和手术瘢痕区[13]。
研究[17-19] 显示:CD8+ 细胞毒性T 淋巴细胞(cytotoxic T lymphocytes, CTLs) 功能异常在睾丸恶性肿瘤发生发展中发挥重要作用。此外,精原细胞瘤发生过程中抗肿瘤CD4+CTLs 亚群随之升高,在抑制肿瘤发生进展过程中发挥重要作用。
该患者于本院泌尿外科行手术治疗后, 于本院肿瘤科行3 次放疗和化疗, 第1 次化疗复查:AFP 1. 8 mg·L-1、β -HCGlt;0. 1 IU·L-1 和LDH161. 80 IU·L-1;第2 次化疗复查:AFP 1. 8 mg·L-1、β -HCGlt;0. 1 IU·L- 1 和LDH 891. 40 IU·L- 1; 第3 次未复查以上3 种实验室检查。同时,分别在术后1、3、6 和8 个月对患者进行电话随访,患者严格按照医生的指导用药, 化疗期间并未出现任何不良反应。最后1 次随访时间为2024 年5 月,患者身体各方面恢复良好,日常生活不受影响,生活质量比较术前明显改善,且无病情进展表现。可见精原细胞瘤预后较好,手术加以放疗和化疗能较大提高患者的生存率[20-21]。
综上所述, 原发性腹股沟精原细胞瘤病例罕见,两侧睾丸发育正常者则更为罕见,临床表现无特异性,实验室检查及影像学检查可辅助诊断,最终确诊还需病理穿刺活检。原发性腹股沟精原细胞瘤恶性程度低,对放疗和化疗效果敏感,手术加以放疗和化疗能够提高患者生存率,预后良好。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:金光俊参与病例资料收集、文献检索及论文撰写,刘蕾和王永刚参与文献检索及论文审校。
[参考文献]
[1] 黄卓雅, 陈 思, 蓝创歆, 等. 睾丸肿瘤61例临床与病
理特征分析[J]. 海南医学, 2020, 31(17): 2191-2194.
[2] 徐佳灵, 陈良良. 原发性腹股沟精原细胞瘤治验
1例[J]. 实用中医药杂志, 2009, 25(6): 411.
[3] 彭 剑. 非精原细胞瘤远处转移的预后、危险因素研究
及预测模型的构建[D]. 广州: 南方医科大学, 2023.
[4] 刘杨青, 嘉若琳, 丁孝芹, 等. 非梗阻性无精子症患者
睾丸显微取精获精的影响因素及辅助生殖结局
分析[J]. 郑州大学学报(医学版), 2023, 58(5):
676-680.
[5] 曲玉江. 144例新疆睾丸生殖细胞肿瘤患者患病情况及
预后分析[D]. 乌鲁木齐: 新疆医科大学, 2013.
[6] 唐诗迪, 訾 豪, 朱 聪, 等. 1990—2019年中国睾丸
癌疾病负担分析[J]. 解放军医学杂志, 2024, 49(3):
272-279.
[7] LIU R W, LEI Z X, LI A B, et al. Differentiation of
testicular seminoma and nonseminomatous germ cell
tumor on magnetic resonance imaging[J]. Medicine,
2019, 98(45): e17937.
[8] 龙德云, 舒 亮, 叶孝乾, 等. 睾丸精原细胞瘤MRI
表现及其鉴别诊断[J]. 武警医学, 2021, 32(1): 30-33.
[9] 黎金娣, 吴彩云. 彩色超声多普勒在腹股沟疝诊断中的
应用[J]. 影像技术, 2022, 34(2): 68-71.
[10]万里明. 27 例股疝的临床诊疗体会[J]. 安徽医学,
2016, 37(12): 1544-1546.
[11]MATEI D V, VARTOLOMEI M D, RENNE G, et al.
Reliability of frozen section examination in a large cohort
of testicular masses: what did WeLearn?[J]. Clin
Genitourin Cancer, 2017, 15(4): e689-e696.
[12]胡 平, 何燕燕, 孙馨悦, 等. PRMT7抑制前列腺癌细
胞体外迁移和侵袭的研究[J]. 同济大学学报(医学版),
2023, 44(2): 166-172.
[13]BEDI D, BAGGA P K, SINGH A, et al. Primary
extra-gonadal retroperitoneal seminoma, clinically
mimicking sarcoma[J]. J Clin Diagn Res, 2015, 9(12):
ED11-ED12.
[14]NORTON B C, ROBERTSON I, FAN H, et al.
Massive seminoma presenting with inguinal lymph node
metastases only[J]. J Surg Case Rep, 2016, 2016(11):
rjw177.
[15]ALSYOUF M, DANESHMAND S. Clinical stage Ⅱ
seminoma: management options[J]. World J Urol,
2022, 40(2): 343-348.
[16]朱 刚, 张 凯. 睾丸癌腹膜后淋巴结清扫的现状及
展望(附光盘)[J]. 现代泌尿外科杂志, 2020, 25(1):
4-6.
[17]BOLDRINI R, DE PASQUALE M D, MELAIU O,
et al. Tumor-infiltrating T cells and PD-L1 expression in
childhood malignant extracranial germ-cell tumors[J].
Oncoimmunology, 2019, 8(2): e1542245.
[18]KIM J H, CHON S K, IM K S, et al. Infiltrating
Foxp3+ regulatory T cells and histopathological
features in canine classical and spermatocytic
seminomas[J]. Zuchthygiene, 2013, 48(2): 218-222.
[19]韩圣斌, 高宇文, 陈兵华. 细胞毒性相关辅助T淋巴细
胞在精原细胞瘤中的表达及其临床意义[J]. 中国当代
医药, 2023, 30(36): 22-26, 封4.
[20]CHUNG P, DAUGAARD G, TYLDESLEY S, et al.
Evaluation of a prognostic model for risk of relapse in
stage I seminoma surveillance[J]. Cancer Med, 2015,
4(1): 155-160.
[21]TANDSTAD T, STÅHL O, DAHL O, et al.
Treatment of stage I seminoma, with one course of
adjuvant carboplatin or surveillance, risk-adapted
recommendations implementing patient autonomy:
a report from the Swedish and Norwegian Testicular
Cancer Group (SWENOTECA)[J]. Ann Oncol, 2016,
27(7): 1299-1304.

