宫颈病变和宫颈癌组织中嗜酸性粒细胞浸润及其临床意义


[摘 要] 目的:探讨嗜酸性粒细胞 (EOS) 在宫颈组织中的浸润差异及其与宫颈相关疾病之间的关系,阐明EOS对宫颈上皮不典型增生(CIN)和宫颈癌发生发展的影响。方法:收集256例宫颈疾病患者的临床资料,根据其发病情况分为宫颈癌组(n=46,其中宫颈鳞状细胞癌26 例、宫颈腺癌15 例和宫颈腺鳞癌5 例)、慢性宫颈炎组(n=50)、CINⅠ期组(n=50)、CINⅡ期组(n=50)、CINⅢ期组(n=30) 和正常组(癌旁正常宫颈组织,n=30)。阴道镜观察各组患者宫颈组织形态表现,薄层液基细胞学测试(TCT) 法观察各组患者宫颈脱落细胞形态表现,杂交捕获-化学发光法检测各组患者宫颈组织人乳头瘤病毒(HPV) 感染情况,HE 染色观察各组患者宫颈组织病理形态表现,刚果红染色检测各组患者宫颈组织中EOS 浸润数,Pearson 相关性分析EOS 浸润数与宫颈癌恶性程度的相关性。结果:正常组患者宫颈表面光滑,呈粉红色,毛细血管均匀分布;慢性宫颈炎组患者宫颈表面呈红色炎性改变,部分伴有纳氏囊肿形成,可见不同程度的糜烂和溃疡等;CINⅠ期、CINⅡ期和CINⅢ期组患者宫颈可见上皮溃疡、增厚和形态不规则,细镶嵌及点状血管明显;宫颈癌组患者宫颈表面隆起,可见新生肿物及坏死性溃疡,质脆易出血。醋酸染色后,正常组患者宫颈无明显改变;慢性宫颈炎组患者宫颈呈少量白色改变,持续时间较短;CINⅠ期、CINⅡ期和CINⅢ期组患者宫颈薄醋白上皮不规则、呈地图样边界,其中CINⅠ期组患者宫颈部分组织呈醋白反应,CINⅡ期组患者宫颈出现明显醋白反应,CINⅢ期组患者宫颈醋白反应非常明显,面积较大,且持续时间较长;宫颈癌组患者宫颈醋白反应明显,白色上皮厚,持续时间久,轮廓硬直,边界清晰。正常组患者宫颈碘染色后呈棕褐色,着色均匀;慢性宫颈炎组患者宫颈炎性病变区着色差;CINⅠ期组患者宫颈上皮化生区碘着色不明显;CINⅢ期组患者宫颈病变区着色差,转化区周围面积较大;宫颈癌组患者宫颈表面不规则,呈菜花样生长,碘染色后不着色,呈现为橘黄或芥末黄色。TCT 法观察,正常组患者宫颈脱落细胞中无异型性细胞,炎症细胞浸润少;慢性宫颈炎组患者宫颈脱落细胞中可见大量的中性粒细胞和EOS 等炎症细胞,无异型性细胞;CINⅠ期和CINⅡ期组患者宫颈脱落细胞中可见双核异型性细胞,核质比较高,细胞核较深染,周围见空晕;CINⅢ期组患者脱落细胞中可见较多异型性细胞,核质比较高,核膜不规则;宫颈癌组患者宫颈脱落细胞中可见大而显著的核仁,聚集成片,合胞体样改变明显;与正常组比较,CINⅠ期组、CINⅡ期组、CINⅢ期组和宫颈癌组患者宫颈脱落细胞异型性均明显增加。杂交捕获-化学发光法检测,与正常组和慢性宫颈炎组比较,CINⅠ期、CINⅡ期和CINⅢ期组患者HPV感染数和TCT 异型性细胞数均明显增加(Plt;0. 05);与CINⅠ期、CINⅡ期和CINⅢ期组比较,宫颈癌组患者HPV 感染数和TCT 异型性细胞数均明显增加(Plt;0. 05)。HE 染色观察,正常组宫颈组织细胞形态正常,结构清晰,可见中性粒细胞、单核细胞、巨噬细胞、EOS 和淋巴细胞等炎症细胞浸润;慢性宫颈炎组患者炎症细胞浸润增加;CIN 组患者宫颈细胞核核仁稍大,可见异型性细胞,炎症细胞主要分布于异型性细胞周围;宫颈癌组患者宫颈细胞核仁大而深染,细胞异型性明显,癌细胞周围炎症细胞浸润增加。与正常组比较, 慢性宫颈炎组患者宫颈组织中炎症细胞数和EOS 浸润数均明显增加(Plt;0. 05), CIN 组患者炎症细胞数和EOS 浸润数均明显增加(Plt;0. 05); 与慢性宫颈炎组比较,CIN 组患者炎症细胞数和EOS 浸润数均明显减少(Plt;0. 05);与慢性宫颈炎组和CIN 组比较,宫颈癌组患者炎症细胞数和EOS 浸润数均明显增加(Plt;0. 05)。宫颈癌组织中EOS 主要分布于癌巢周围,与CINⅠ期组比较,CINⅡ期组和CINⅢ期组患者宫颈组织中EOS 浸润数均明显增加(Plt;0. 05);与CINⅡ期组比较,CINⅢ期组患者宫颈组织中EOS 浸润数明显增加(Plt;0. 05)。肿瘤恶性程度越高,EOS 浸润越多,EOS 浸润数与宫颈癌浸润深度呈正相关关系(r=0. 533 0,Plt;0. 01)。结论:HPV感染和EOS浸润具有促进宫颈癌癌前病变及宫颈癌发生发展的作用。
[关键词] 嗜酸性粒细胞; 宫颈肿瘤; 宫颈上皮不典型增生; 慢性宫颈炎; 细胞浸润
[中图分类号] R737. 33 [文献标志码] A
据世界卫生组织(World Health Organization,WHO) 统计,癌症目前是世界人口死亡的主要原因之一,随着世界人口的增加和老龄化日益加重,癌症的发病和死亡率逐渐升高,探讨癌症病因及危险因素较为重要[1]。宫颈癌在女性癌症中发病率较高,位居全球女性癌症发病率和死亡率的第2 位,并呈逐年上升趋势。宫颈癌以中老年女性发病居多, 严重威胁女性健康。2020 年, 全世界约有新发宫颈癌病例60. 4 万, 死亡病例约34. 2 万[2-3],2000~2016 年, 中国宫颈癌新发病例119 300 例,因该疾病死亡人数达到37 200 例,其发病率在女性恶性肿瘤中位居第3 位[4-5]。宫颈癌发病机制尚未完全阐明, 但高危型人乳头瘤病毒(humanpapilloma virus, HPV) 感染仍是宫颈癌发生发展的重要原因。HPV 感染可促进炎症细胞的浸润,其中嗜酸性粒细胞(eosinophils,EOS) 与炎症反应性疾病及恶性肿瘤的发生发展有密切关联[6]。研究[7-9] 证实:恶性肿瘤,如胃癌、食管癌、头颈部肿瘤、乳腺癌、卵巢癌和肺癌等, 伴有大量EOS浸润,EOS 在Lewis 肺癌、直结肠癌及转移性黑色素瘤中浸润增加, 且EOS 在头颈部肿瘤和口腔鳞状细胞癌的诊断意义不一致。EOS 在宫颈癌发生发展过程中的作用及其相关机制的研究较少。因此, 本研究探讨EOS 在宫颈组织中的浸润差异及其与宫颈相关疾病之间的关系, 阐明EOS 对宫颈上皮不典型增生(cervical intraepithelial neoplasia,CIN) 和宫颈癌发生发展的影响,为宫颈癌的临床诊断和预后研究提供实验依据。
1 资料与方法
1. 1 研究对象 将2018年1月—2023年3月于吉林省长春市妇产医院收治的宫颈疾病患者256 例,根据其发病情况分为宫颈癌组(n=46,其中宫颈鳞状细胞癌26 例、宫颈腺癌15 例和宫颈腺鳞癌5 例)、慢性宫颈炎组(n=50)、CIN Ⅰ 期组(n=50)、CIN Ⅱ 期组(n=50)、CIN Ⅲ 期组(n=30) 和正常组(癌旁正常宫颈组织,n=30)。本研究经吉林省长春市妇产医院医学伦理委员会批准(伦理审批号:CLSP-LW-2023-02),所有患者自愿签署知情同意书。
1. 2 主要试剂和仪器 刚果红、苏木素和阴离子防脱片剂(北京中杉金桥试剂有限公司),HPV 核酸检测试剂盒(上海普洛麦格生物),Papanicolaou染色液(上海尚宝生物科技有限公司),石蜡、二甲苯、甲醛、无水乙醇、苏木素和伊红(天津化工有限公司),中性树胶封片剂(上海研生生化试剂公司),甲醇刚果红溶液(刚果红0. 5 g,甲醇80 mL,甘油20 mL)、碱性乙醇分化液(氢氧化钾0. 2 g,80% 乙醇100 mL)、自配3% 冰醋酸溶液(蒸馏水97 mL,冰醋酸3 mL) 和1% 碘溶液为北华大学基础医学院病理生理学教研室自配。阴道镜(型号:Vostro 20-3052,中国厦门戴尔医疗集团),化学发光免疫分析仪(型号:KPS-QQ80) 和液基薄层细胞制片机(型号:TIB-AutoPrep 2406)(石家庄康普生科技有限公司),显微镜和配套摄像仪(型号:BX53, 日本Olympus 公司), 电子天平(型号:FA1004B,上海圣科仪器有限公司),移液器(德国Eppendorf 公司), 台式低速离心机(型号:L400, 湖南湘仪集团), 电热鼓风干燥箱(型号:DHG-9053A,上海左乐仪器有限公司)。
1. 3 阴道镜观察各组患者宫颈组织形态表现 所有患者阴道镜检查前24 h 内避免阴道用药、性交和其他阴道检查,检查前排空膀胱,患者外阴部充分清洁,并保持阴道干燥。检查时患者采取截石位,外阴涂少量无菌润滑剂,防止患者不适,轻柔插入窥器,充分暴露宫颈,利用阴道镜进行观察。为了保证视野清晰,用无菌棉拭子轻轻擦去多余宫颈分泌物,观察宫颈引导区、转化区和阴道穹窿部,寻找糜烂、溃疡、肿块及颜色变化等异常情况。将3% 冰醋酸溶液涂抹于宫颈,观察宫颈表面出现醋白上皮的情况,判断有无点状血管、异常血管和醋酸后醋白上皮反应等, 对于可疑区域反复聚焦观察。将1% 碘溶液涂抹于疑似病变区,观察该区域形态表现,正常宫颈组织全部着色,宫颈异常区域有不同程度的不着色碘反应, 对于可疑的病变组织,用活检钳取适量的组织块进行病理检测。
1. 4 薄层液基细胞学测试(thin-cytologic test,TCT)法观察各组患者宫颈脱落细胞形态表现 采用TCT 法观察宫颈脱落细胞形态表现,将采样的宫颈细胞刷于标本瓶,取出细胞染色机中的比率浊度标准液,将标准液放入标本中,混匀,摇晃,使细胞充分解离分散。将其放入液基薄层细胞制片机内,按设备说明书操作,系统自动制备薄层细胞图片,完成细胞固定、水化、染色和分化等过程,人工封片,显微镜下观察宫颈脱落细胞形态表现。
1. 5 杂交捕获-化学发光法检测各组患者宫颈组织HPV感染情况 采用杂交捕获-化学发光法对收集的各组患者宫颈组织进行HPV 核酸检测,所有操作过程严格遵循试剂盒说明书。
1. 6 HE 染色观察各组患者宫颈组织病理形态表现 对所收集的各组患者宫颈组织进行HE 染色,光学显微镜下观察各组患者宫颈组织病理形态表现和炎症细胞浸润情况,计数炎症细胞数。
1. 7 刚果红染色检测各组患者宫颈组织中EOS浸润数 10% 甲醛溶液固定宫颈组织,常规石蜡包埋,切片,取组织切片于二甲苯中脱蜡3 次,每次10 min。经梯度酒精脱水,蒸馏水冲洗5 min,刚果红染色20 min, 碱性酒精分化液分化5 s, 自来水冲洗5 min,苏木素复染15 min,自来水冲洗5 min,再经梯度酒精脱水,擦去玻片周围多余水渍,二甲苯透明,中性树脂封片保存。由2 位病理医师双盲独立阅片,分别进行宫颈脱落细胞形态判定、HE 染色和刚果红染色结果判定。在固定染色时间下,当细胞膜和(或) 胞质出现对比明显的红色颗粒时,判定为有EOS 阳性浸润。在200 倍显微镜下拍摄,采用Image J 软件分析各组患者宫颈组织中EOS 浸润情况,以EOS 浸润数代表EOS 浸润情况。EOS 浸润数=阳性细胞个数/染色面积(mm2)。
1. 8 统计学分析 采用 SPSS 20. 0统计软件进行统计学分析。各组患者宫颈脱落细胞异型性细胞数和HPV 感染数为计数资料,组间比较采用χ2 检验或Fisher 确切概率法;EOS 浸润数为计量资料,符合正态分布, 以x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q 检验。采用Pearson 相关性分析EOS 浸润数与宫颈癌恶性程度的相关性。以Plt;0. 05 为差异有统计学意义。
2 结 果
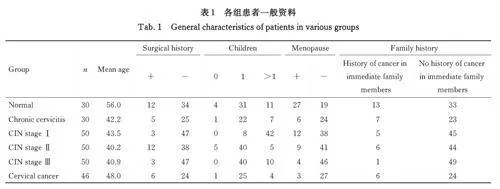
2. 1 各组患者一般资料 正常组患者平均年龄(48. 0±7. 0) 岁, 慢性宫颈炎组患者平均年龄(43. 5±5. 2) 岁, CIN Ⅰ 期组患者平均年龄(40. 2±2. 5) 岁, CIN Ⅱ 期组患者平均年龄(40. 9±3. 2) 岁, CIN Ⅲ 期组患者平均年龄(42. 2±2. 0) 岁,宫颈癌组患者平均年龄(56. 0±5. 0) 岁。所有患者术前均未行放疗和化疗,术后均有明确病理学诊断。见表1 和2。
2. 2 各组患者宫颈组织形态表现 正常组患者宫颈表面光滑,呈粉红色,毛细血管均匀分布;慢性宫颈炎组患者宫颈表面呈红色炎性改变,部分伴有纳氏囊肿形成,可看到不同程度的糜烂和溃疡等;CINⅠ期、CINⅡ期和CINⅢ期组患者宫颈可见上皮溃疡、增厚和形态不规则,细镶嵌及点状血管明显;宫颈癌组患者宫颈表面隆起,可见新生肿物及坏死性溃疡,质脆易出血。
醋酸染色后,正常组患者宫颈无明显改变;慢性宫颈炎组患者宫颈呈少量白色改变,持续时间较短;CINⅠ期、CINⅡ期和CINⅢ期组患者宫颈薄醋白上皮不规则、呈地图样边界,其中CINⅠ期组患者宫颈部分组织呈醋白反应,CINⅡ期组患者宫颈出现明显醋白反应,CINⅢ期组患者宫颈醋白反应非常明显,面积较大,且持续时间较长;宫颈癌组患者宫颈醋白反应明显,白色上皮厚,持续时间久,轮廓硬直,边界清晰。见图1。
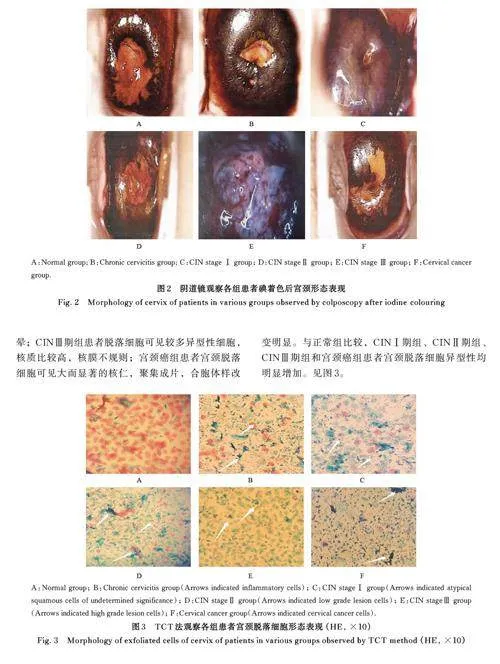
复方碘实验结果显示:正常组患者宫颈碘染色后呈棕褐色,着色均匀;慢性宫颈炎组患者宫颈炎性病变区着色差;CINⅠ期组患者宫颈上皮化生区碘着色不明显; CIN Ⅲ 期组患者宫颈病变区着色差,转化区周围面积较大;宫颈癌组患者宫颈表面不规则,呈菜花样生长,碘染色后不着色,呈现为橘黄或芥末黄色。见图2。
2. 3 各组患者宫颈脱落细胞形态表现 正常组患者宫颈脱落细胞中无异型性细胞, 炎症细胞浸润少;慢性宫颈炎组患者宫颈脱落细胞中可见大量的中性粒细胞和EOS 等炎症细胞, 无异型性细胞;CINⅠ期和CINⅡ期组患者宫颈脱落细胞可见双核异型性细胞,核质比较高,细胞核较深染,周围见空晕;CINⅢ期组患者脱落细胞可见较多异型性细胞,核质比较高,核膜不规则;宫颈癌组患者宫颈脱落细胞可见大而显著的核仁,聚集成片,合胞体样改变明显。与正常组比较,CINⅠ期组、CINⅡ期组、CINⅢ期组和宫颈癌组患者宫颈脱落细胞异型性均明显增加。见图3。
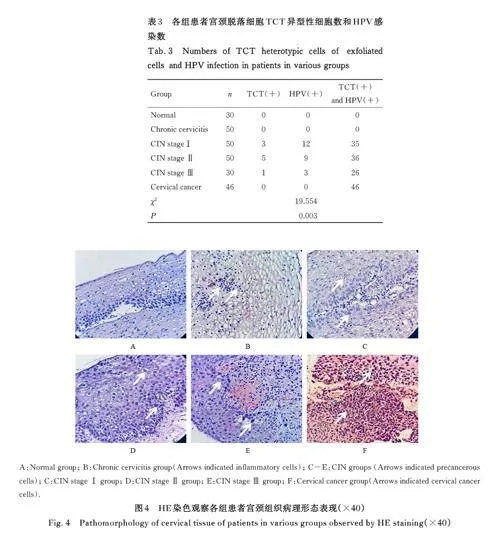
2. 4 各组患者宫颈脱落细胞中异型性细胞数和HPV 感染情况 与正常组和慢性宫颈炎组比较,CINⅠ期、CINⅡ期和CINⅢ期组患者HPV 感染数和TCT 异型性细胞数均明显增加(Plt;0. 05)。与CINⅠ期、CINⅡ期和CINⅢ期组比较,宫颈癌组患者HPV 感染数和TCT 异型性细胞数均明显增加(Plt;0. 05)。见表3。
2. 5 各组患者宫颈组织病理形态表现 正常组宫颈组织细胞形态正常, 结构清晰, 可见中性粒细胞、单核细胞、巨噬细胞、EOS 和淋巴细胞等炎症细胞浸润; 慢性宫颈炎组患者炎症细胞浸润增加;CIN 组患者宫颈细胞核核仁稍大,可见异型性细胞,炎症细胞主要分布于异型性细胞周围;宫颈癌组患者宫颈细胞核仁大而深染, 细胞异型性明显, 癌细胞周围炎症细胞浸润增加。与正常组比较,慢性宫颈炎组患者宫颈组织炎症细胞数明显增加(Plt;0. 05), CIN 组患者炎症细胞数明显增加(Plt;0. 05)。与慢性宫颈炎组比较,CIN 组患者炎症细胞数明显减少(Plt;0. 05)。与慢性宫颈炎组和CIN 组比较,宫颈癌组患者炎症细胞数明显增加(Plt;0. 05)。见图4 和5。
2. 6 各组患者宫颈组织中EOS浸润情况 与正常组[(2. 3±0. 4) 个·mm-2] 比较,慢性宫颈炎组患者宫颈组织中EOS 浸润数[(37. 2±3. 2)个·mm-2]明显增加(Plt;0. 05),CIN 组患者宫颈组织中EOS浸润数[(23. 5±3. 5) 个·mm-2] 明显增加(Plt;0. 05)。与慢性宫颈炎组比较,CIN 组患者宫颈组织中EOS 浸润数明显减少(Plt;0. 05)。宫颈癌组织中EOS 主要分布于癌巢周围, 与慢性宫颈炎组和CIN 组比较, 宫颈癌组患者宫颈组织中EOS 浸润数[ (52. 5±8. 3) 个·mm-2] 明显增加(Plt;0. 05)。与CIN Ⅰ 期组[ (8. 2±2. 5) 个·mm-2]比较, CIN Ⅱ 期组和CIN Ⅲ 期组患者宫颈组织中EOS 浸润数[(22. 3±4. 2) 个·mm-2和(39. 5±5. 2) 个·mm-2] 均明显增加(Plt;0. 05)。与CIN Ⅱ 期组比较, CIN Ⅲ 期组患者宫颈组织中EOS 浸润数明显增加(Plt;0. 05)。见图6 和7。
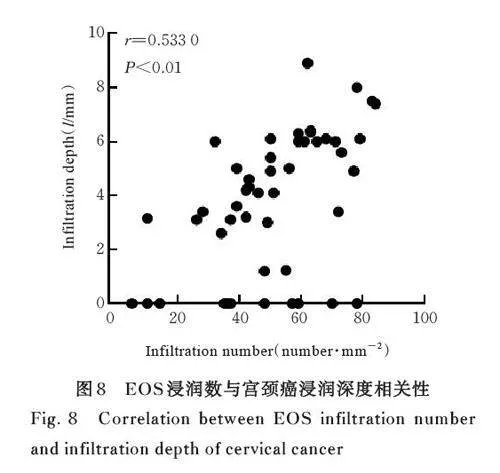
2. 7 EOS 浸润数与宫颈癌浸润深度的相关性 肿瘤恶性程度越高, EOS 浸润越多, EOS 浸润数与宫颈癌浸润深度呈正相关关系(r=0. 533 0,Plt;0. 01)。见图8。
3 讨 论
宫颈癌病变周期长,对女性影响大,因此早期筛查对宫颈癌防治具有重要意义。阴道镜是一种立体放大镜, 可以清楚、自然和立体地进行活体检查,通过观察宫颈上皮的结构及血管形态,可及时发现与癌相关的异型组织和血管。同时,阴道镜对可疑病变的组织切片具有一定指导意义,有助于早期宫颈癌的诊断,提高宫颈病变的检出率。
近年来,对恶性肿瘤发生发展机制的探索逐渐扩展到肿瘤组织和肿瘤免疫微环境的协同作用,其中免疫和炎症反应是当前研究的热点[10]。研究[11]证实:肿瘤发生发展过程中伴有炎症细胞浸润和细胞因子分泌,在微生物作用下的菌群环境改变和炎症刺激均可导致宫颈脱落细胞形态改变及宫颈内微环境变化,同时诱导大量炎症细胞和免疫细胞(如中性粒细胞、单核细胞、巨噬细胞EOS 和淋巴细胞等) 浸润于炎症组织区, EOS 作为重要的炎症细胞参与疾病的发病过程。研究[12]发现:EOS 可浸润于多种肿瘤组织,如鼻咽癌、乳腺癌和卵巢癌等,对肿瘤细胞有直接或间接杀伤作用。SIMSON 等[13]发现: EOS 具有明显的抗纤维肉瘤效应。动物实验和临床研究[14-16] 证实:白细胞介素(interleukin,IL)-4、IL-2 和IL-25 发挥抗肿瘤作用的主要机制与EOS 产生增加有密切关联, EOS 可合成和分泌大量的过氧化物酶、阳离子蛋白及肿瘤坏死因子(tumor necrosis factor, TNF) 等炎症因子, 直接调控抗癌细胞的生长和转移[17-19]。研究[20-21] 发现:EOS 具有促进宫颈鳞状细胞癌、Hodgkin’s 淋巴瘤和黑色素瘤细胞的生长及转移等效应, EOS 可分泌大量的前列腺素E2, 加速Th1 细胞向Th2 细胞转化,减少肿瘤抗原表达,抑制CD8+淋巴细胞的抗肿瘤效应。EOS 能够加速细胞外基质的降解,产生大量基质金属蛋白酶(matrix metalloproteinases,MMPs),促进肿瘤侵袭和转移。EOS 分泌大量的细胞因子, 如血管内皮生长因子A (vascularendothelial growth factor-A, VEGF-A)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF) 和IL-8 等,促进肿瘤组织的血管生成。此外, EOS 与细胞程序性死亡配体1 (programmedcell death-ligand 1,PD-L1) 和程序性细胞死亡蛋白受体1 (programmed cell death protein-1,PD-1) 结合, 与细胞发挥促瘤效应有关[22-25]。因此, EOS在实体恶性肿瘤发生发展中的作用依据组织来源、肿瘤类型和分化程度等不同,发挥双向调节效应。其机制较为复杂, 可能与EOS 表面富含模式识别受体(pattern recognition receptors, PRRs), 能够特异性识别病原微生物或其他致病信号发生炎症反应,释放大量的细胞因子、化学因子及颗粒阳性蛋白有关, 也可能与EOS 表达多种类型细胞因子(如IL-2、IL-3 和TNF- β 等) 受体、化学因子受体、整合素和黏附分子受体,并通过内分泌、旁分泌或自分泌等形式发挥促瘤或抗瘤效应有关。EOS是免疫球蛋白、补体、蛋白酶、脂类介质如白三烯(leukotrienes, LTs)、前列腺素(prostaglandins,PGs) 和唾液酸结合免疫球蛋白样凝集素8 (sialicbindingimmunoglobulin-like lectin-8, Siglec-8) 等细胞因子的特异性识别部位,通过不同的信号途径发挥双向调节效应[26]。EOS 在宫颈癌发生发展过程中的作用及其机制还需要进一步验证。
本研究结果显示: CIN 组织HPV 感染率明显增加,而宫颈癌组织几乎均伴发HPV 感染,提示HPV 是促进CIN 及宫颈癌发生发展的重要因素。HPV 是一个包含环状双链DNA 的无包膜病毒,目前已发现200 多种亚型,分为高危型、中危型和低危型[27]。研究[28-29] 证实:HPV 在机体多为一过性感染,可自行消退或好转,但若宿主基因突变或缺陷, HPV 病毒基因部分片段与突变或缺陷的宿主基因整合,可引起基因调控紊乱,导致恶性肿瘤的发生发展。高危型HPV 癌蛋白E6 和E7 的表达是导致宫颈上皮细胞恶性转化及维持致癌表型的关键因素,当E6 出现高表达时,原癌基因骨髓细胞瘤病病毒癌基因同源物(myelocytomatosis viraloncogene homolog,MYC) 表达水平随之升高,进而影响人端粒酶催化亚单位(human telomerasereverse transcdptase, hTERT) 表达, 使受感染的细胞不断复制。感染了HPV 的宫颈宿主细胞还可以通过信号传导通路调整HPV 的感染状态,E6 蛋白作用的重要靶点是P53 和含有底物的PDZ 结构域,E7 蛋白则通过结合视网膜母细胞瘤抑制蛋白(retinoblastoma tumor suppressor protein, pRB),间接使转录因子E2F 与pRB 分离,细胞周期失控,导致宫颈癌的发生[30]。除E6 和E7 外,E2 和E5 在宫颈癌发生过程中的作用不可忽视,HPV E2 可以启动病毒DNA 复制,调节基因转录过程,可以通过与细胞蛋白相互作用的间接机制影响宿主细胞增殖、凋亡和衰老等关键过程。E5 可以改变表皮生长因子(epidermal growth factor,EGF) 的内吞途径, 阻碍EGF 受体(EGF receptor, EGFR) 降解, 导致其介导的生长信号明显增加, 从而扩大HPV 感染;E5 还可以通过细胞膜内碱化,使主要组织相容性复合体(major histocompatibilitycomplex,MHC)Ⅰ相关分子被限制在高尔基体内,进而下调细胞表面的MHCⅠ 类分子,通过损害T 淋巴细胞的抗原识别和呈递过程逃避宿主的免疫监视,形成HPV 持续性感染[31]。此外,E5 通过与E6 和E7 相互作用协同促进宫颈癌的发展。HPV 感染宫颈后固有免疫功能下降和T 淋巴细胞介导的免疫逃逸在CIN 及宫颈癌患者发病中发挥重要作用[32]。尽管HPV 感染后患者短时间内无明显的临床表现,但通过采集患者宫颈脱落细胞及HPV 核酸检测,有助于判断患者的病情, HPV 感染是宫颈癌发生发展重要的因素。
CIN 目前被认为是宫颈癌的癌前病变[33]。本研究结果显示:与正常宫颈组织及慢性宫颈炎组织比较,CIN 和宫颈癌组织中EOS 浸润数明显增加,且随着CIN 的进展和宫颈癌浸润深度的增加,EOS 浸润数明显增加,提示EOS 和HPV 的双重协同作用促进宫颈癌恶性转化。HPV 可通过弱化免疫反应和(或) 强化免疫调节表型适应新的免疫环境, EOS 作为效应因子和协调因子在先天性免疫及适应性免疫过程中发挥作用, 如EOS 以Th2 免疫依赖方式抵抗微生物感染或组织损伤, 也可与T 淋巴细胞亚群或树突细胞相互作用发挥致瘤效应。HPV 和EOS 均可通过Th2 型免疫反应或影响TGF-β1、MMPs 和VEGF 合成及分泌,相关细胞因子均具有免疫抑制、促进肿瘤发生和进展的效应[34-35]。此外, HPV 感染后, 宿主的免疫调节因子由IL-2 向EOS 趋化的细胞因子蛋白转变,导致大量EOS 分泌到外周血管, 富集于肿瘤组织周围并活化,进一步使疾病恶化[36]。
综上所述,HPV 感染和EOS 浸润具有促进癌前病变及宫颈癌发生发展的作用,但其对宫颈癌作用的具体机制尚需通过体内外实验进一步探索。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:鲁艳艳参与论文选题、实验数据整理和论文撰写,许翔博和吴亚梅参与数据收集,刘雨齐和王涵参与数据统计学分析,杨丽娟、王振江和肖梓屾参与实验操作,刘艳波参与论文审校和指导。
[参考文献]
[1] BRAY F, LAVERSANNE M, WEIDERPASS E, et al.
The ever-increasing importance of cancer as a leading
cause of premature death worldwide[J]. Cancer, 2021,
127(16): 3029-3030.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global
cancer statistics 2020: GLOBOCAN estimates of
incidence and mortality worldwide for 36 cancers in
185 countries[J]. CA Cancer J Clin, 2021, 71(3):
209-249.
[3] 蔡会龙, 原伟光. 全球及我国宫颈癌流行现状及防治
策略[J]. 临床肿瘤学杂志, 2023, 28(1): 90-93.
[4] ZHENG R S, ZHANG S W, ZENG H M, et al.
Cancer incidence and mortality in China, 2016[J]. J Natl
Cancer Cent, 2022, 2(1): 1-9.
[5] KPOGHOMOU M A, GENEAU M, MENARD J,
et al. Assessment of an onco-sexology support and
follow-up program in cervical or vaginal cancer patients
undergoing brachytherapy[J]. Support Care Cancer,
2021, 29(8): 4311-4318.
[6] 何朝奎. 肿瘤免疫治疗中嗜酸性粒细胞作用的研究
进展[J]. 中国肿瘤生物治疗杂志, 2023, 30(2): 178-182.
[7] GRISARU-TAL S, ROTHENBERG M E, MUNITZ A.
Eosinophil-lymphocyte interactions in the tumor
microenvironment and cancer immunotherapy[J].
Nat Immunol, 2022, 23(9): 1309-1316.
[8] REICHMAN H, KARO-ATAR D, MUNITZ A.
Emerging roles for eosinophils in the tumor
microenvironment[J]. Trends Cancer, 2016, 2(11):
664-675.
[9] DAVIS B P, ROTHENBERG M E. Eosinophils and
cancer[J]. Cancer Immunol Res, 2014, 2(1): 1-8.
[10]王思羽, 王宽松. 嗜酸性粒细胞在肿瘤免疫微环境中的
作用研究进展[J]. 中国普通外科杂志, 2022, 31(5):
675-687.
[11]肖梓屾, 刁书腾, 张莉爽, 等. IL-17A对前列腺癌细胞
迁移的促进作用及其机制[J]. 吉林大学学报(医学
版), 2020, 46(6): 1194-1201.
[12]GHAFFARI S, REZAEI N. Eosinophils in the tumor
microenvironment: implications for cancer
immunotherapy[J]. J Transl Med, 2023, 21(1): 551.
[13]SIMSON L, ELLYARD J I, DENT L A, et al.
Regulation of carcinogenesis by IL-5 and CCL11: a
potential role for eosinophils in tumor immune
surveillance[J]. J Immunol, 2007, 178(7): 4222-4229.
[14]SOSMAN J A, BARTEMES K, OFFORD K P, et al.
Evidence for eosinophil activation in cancer patients
receiving recombinant interleukin-4: effects of
interleukin-4 alone and following interleukin-2
administration[J]. Clin Cancer Res, 1995, 1(8):
805-812.
[15]HULAND E, HULAND H. Tumor-associated
eosinophilia in interleukin-2-treated patients: evidence of
toxic eosinophil degranulation on bladder cancer cells[J].
J Cancer Res Clin Oncol, 1992, 118(6): 463-467.
[16]BENATAR T , CAO M Y , LEE Y , et al. IL-17E ,
a proinflammatory cytokine, has antitumor efficacy
against several tumor types in vivo[J]. Cancer Immunol
Immunother, 2010, 59(6): 805-817.
[17]GRISARU-TAL S , ITAN M , KLION A D , et al.
A new dawn for eosinophils in the tumour
microenvironment[J]. Nat Rev Cancer, 2020, 20(10):
594-607.
[18]VESTERINEN E, PUKKALA E, TIMONEN T, et al.
Cancer incidence among 78 000 asthmatic patients[J].
Int J Epidemiol, 1993, 22(6): 976-982.
[19]ZHU J, WANG H, GAO M J, et al. Prognostic values
of lymphocyte and eosinophil counts in resectable
cervical squamous cell carcinoma[J]. Future Oncol,
2019, 15(30): 3467-3481.
[20]ZHU J, WANG H, GAO M J, et al. Prognostic values
of lymphocyte and eosinophil counts in resectable
cervical squamous cell carcinoma[J]. Future Oncol,
2019, 15(30): 3467-3481.
[21]PESCE S, THOREN F B, CANTONI C, et al. The
innate immune cross talk between NK cells and
eosinophils is regulated by the interaction of natural
cytotoxicity receptors with eosinophil surface ligands[J].
Front Immunol, 2017, 8: 510.
[22]BANDEIRA-MELO C, BOZZA P T, WELLER P F.
The cellular biology of eosinophil eicosanoid formation
and function[J]. J Allergy Clin Immunol, 2002,
109(3): 393-400.
[23]NISSIM BEN EFRAIM A H, LEVI-SCHAFFER F.
Roles of eosinophils in the modulation of
angiogenesis[J]. Chem Immunol Allergy, 2014, 99:
138-154.
[24]YOUSEFI S , HEMMANN S , WEBER M , et al.
IL-8 is expressed by human peripheral blood eosinophils.
Evidence for increased secretion in asthma[J].
J Immunol, 1995, 154(10): 5481-5490.
[25]KLEFFEL S, POSCH C, BARTHEL S R, et al.
Melanoma cell-intrinsic PD-1 receptor functions promote
tumor growth[J]. Cell, 2015, 162(6): 1242-1256.
[26]MATTEI F, ANDREONE S, MARONE G, et al.
Eosinophils in the tumor microenvironment[J]. Adv Exp
Med Biol, 2020, 1273: 1-28.
[27]LEGRAND F, DRISS V, DELBEKE M, et al.
Human eosinophils exert TNF- α and granzyme
A-mediated tumoricidal activity toward colon carcinoma
cells[J]. J Immunol, 2010, 185(12): 7443-7451.
[28]QIU Y F, NGUYEN K D, ODEGAARD J I, et al.
Eosinophils and type 2 cytokine signaling in macrophages
orchestrate development of functional beige fat[J]. Cell,
2014, 157(6): 1292-1308.
[29]李 双, 李明珠, 丛 青, 等. 人乳头瘤病毒疫苗临床
应用中国专家共识[J]. 中国妇产科临床杂志, 2021,
22(2): 225-234.
[30]薛剑侠, 王玉兰, 李晓旭, 等. 人乳头瘤病毒在宫颈癌
发病机制中的研究进展[J]. 中国药物与临床, 2017,
17(4): 542-543.
[31]崔湘杰, 史 荔, 陶玉芬. HPV E2、E5致癌机制及相关
疫苗研究进展[J]. 中华疾病控制杂志, 2024, 28(1):
96-100.
[32]王佳森, 张 妍, 付晓雪, 等. 宫颈癌免疫学发病机制
研究进展[J]. 国际妇产科学杂志, 2022, 49(2):
207-211.
[33]贾荣霞, 周 旭, 石贽堃, 等. 宫颈上皮内瘤变Ⅰ级患
者病变进展危险因素分析[J]. 吉林大学学报(医学
版), 2022, 48(6): 1528-1534.
[34]RIMINI M, FRANCO P, BERTOLINI F, et al. The
prognostic role of baseline eosinophils in HPV-related
cancers: a multi-institutional analysis of anal SCC and
OPC patients treated with radical CT-RT[J].
J Gastrointest Cancer, 2023, 54(2): 662-671.
[35]REGAUER S, REICH O. The histologic and molecular
spectrum of highly differentiated HPV-independent
cervical intraepithelial neoplasia[J]. Am J Surg Pathol,
2023, 47(8): 942-949.
[36]MARKS M A, VISCIDI R P, CHANG K, et al.
Differences in the concentration and correlation of
cervical immune markers among HPV positive and
negative perimenopausal women[J]. Cytokine, 2011,
56(3): 798-803.

