PDE1B 表达与胃癌预后和肿瘤微环境的生物信息学分析
[摘 要] 目的:通过生物信息学方法筛选胃癌中具有差异预后意义的调节性细胞死亡和衰老基因,分析磷酸二酯酶1(PDE1)B对胃癌患者生存预后的影响。方法:自TCGA公共数据库下载胃癌基因表达数据和临床数据,本地数据库中随机抽取50 例胃癌患者,收集其临床信息和石蜡样本,包括胃癌组织和癌旁正常组织。采用R 软件“limma”程序包筛选差异表达基因(DEGs),单因素COX 分析和Kaplan-Meier 生存分析筛选有预测生存价值的DEGs,获取影响胃癌患者生存预后的交集基因,筛选与临床病理特征最具关联的基因PDE1B。TCGA 数据库和Kaplan-Meier 生存分析检测胃癌患者癌旁正常组织和胃癌组织中PDE1B mRNA 表达水平及其与胃癌患者生存期的关系,采用基因本体论(GO) 功能和京都基因与基因组百科全书(KEGG) 信号通路富集分析PDE1B 生物学功能,CIBERSORT 算法、肿瘤免疫数据库(TISIDB) 和GSCA 在线网站分析PDE1B 与肿瘤微环境、免疫特征分子和药物敏感性的相关性。实时荧光定量PCR (RT-qPCR) 法检测胃癌患者胃癌组织和癌旁正常组织中PDE1B mRNA 表达水平。结果:共筛选 716 个 DEGs,其中 505 个 DEGs 表达上调 (Plt;0. 05),211 个DEGs 表达下调(Plt;0. 05),获得10 个影响生存预后的交集基因,PDE1B mRNA 表达水平与胃癌患者临床病理特征关系最为密切,其与年龄、肿瘤分级、肿瘤分期和肿瘤T、N 及M 期有关联(Plt;0. 05); 与G1-G2、Stage Ⅰ 、T1-T2、N0 和M0 期胃癌患者比较, G3-G4、StageⅡ -Ⅳ 、T3-T4、N1-N3 和M1 分期胃癌患者胃癌组织中PDE1B mRNA 表达水平均明显升高(Plt;0. 05)。与癌旁正常组织比较,胃癌患者胃癌组织中PDE1B mRNA 表达水平明显降低(Plt;0. 05);与PDE1B低表达胃癌患者比较,PDE1B 高表达胃癌患者总体生存率明显降低(Plt;0. 01)。PDE1B 表达、年龄和肿瘤分期是胃癌患者预后的危险因素(Plt;0. 05)。在调整了性别、年龄、肿瘤分级和肿瘤分期后,PDE1B 表达是影响胃癌患者预后的独立危险因素(Plt;0. 05)。PDE1B 主要富集于免疫球蛋白产生、钙离子转运、第二信使介导的信号转导等生物过程(BP),T 淋巴细胞受体复合体、细胞膜信号受体复合体和含胶原蛋白的细胞外基质等细胞成分(CC),抗原结合、糖胺聚糖结合和细胞外基质结构成分等分子功能(MF);PDE1B 主要参与了神经活性配体-受体相互作用、钙信号通路、环磷酸鸟苷(cGMP) -蛋白激酶G (PKG) 信号通路及细胞因子-细胞因子受体的相互作用等途径。PDE1B 与调节性T 淋巴细胞(r=0. 488)、髓源性抑制细胞(r=0. 474) 和巨噬细胞(r=0. 617) 呈正相关关系(Plt;0. 01);与PDE1B 低表达胃癌患者比较,PDE1B 高表达胃癌患者促进肿瘤的调节性T 淋巴细胞、单核细胞和M2 型巨噬细胞浸润均明显增加(Plt;0. 05)。PDE1B mRNA 表达水平与免疫抑制剂转化生长因子β (TGF-β) 1 (r=0. 535)、集落刺激因子1 受体(CSF1R)(r=0. 519)、免疫激活剂外核苷三磷酸二磷酸水解酶1 (ENTPD1)(r=0. 593) 和CXC 趋化因子配体12 (CXCL12)(r=0. 646) 呈正相关关系(Plt;0. 01)。PDE1B高表达的胃癌组织对氟尿嘧啶(-0. 3癌患者胃癌组织中PDE1B mRNA 表达水平明显升高(Plt;0. 01)。 结论:PDE1B是胃癌患者预后的独立危险因素,可作为胃癌预后不良的有效指标。
[关键词] 胃肿瘤; 生存预后; 磷酸二酯酶1B; 肿瘤微环境; 药物敏感性
[中图分类号] R735. 2 [文献标志码] A
胃癌是全球第五大常见癌症及第四大癌症死亡病因,严重威胁人类健康[1]。近些年来,中国胃癌患者5 年生存率由27. 4% 提高至35. 1%, 但仍显著低于韩国(75. 4%) 和日本(81. 0%), 因此,如何继续提高胃癌生存率是当前研究的重点[2-3]。
调节性细胞死亡(regulated cell death, RCD)和衰老与肿瘤发生发展有密切关联。RCD 是指受特定基因调控的细胞为了维持内环境稳态选择自主有序的死亡方式,主要包括细胞凋亡、自噬、铁死亡和坏死性凋亡等途径。近年来“自噬受损”被纳入衰老的新标志[4-5]。衰老的细胞可以通过旁分泌衰老相关分泌表型(senescence-associatedsecretory phenotype,SASP) 促进肿瘤细胞的侵袭和转移[6]。本研究基于生物信息学分析,筛选胃癌中差异表达且具有预后意义的RCD 和衰老相关基因,分析其与临床性状的关系及磷酸二酯酶1(phosphodiesterase 1,PDE1) B 与肿瘤微环境和免疫治疗的关系,为胃癌患者的个体化治疗提供新的方案。
1 资料与方法
1. 1 公共数据库资料 于肿瘤基因组图谱 (Thecancer Genome Atlas, TCGA) 数据库(https://portal. gdc. cancer. gov/) 中按顺序筛选“stomach”“TCGA-STAD”“transcriptome profiling”“GeneExpression Quantification”和“clinical”,并依次下载胃癌转录组数据及对应的临床数据,包含375 例胃癌样本和32 例正常样本。
1. 2 本地数据库资料和实验样本 本地数据库资料来源于本课题组自2007 年起建立的“ 石河子大学第一附属医院胃癌患者随访数据库”,采取打电话和上门访问等方式进行患者随访, 截至2023 年10 月,随访时间共计16 年。纳入标准:①接受胃切除手术;②经组织病理学诊断确诊为胃癌;③术前未接受过放化疗及其他辅助治疗。本研究从本地数据库中采用简单随机抽样方法抽取50 例胃癌患者,收集其临床信息和石蜡样本,包含胃癌组织和癌旁正常组织(距癌组织切缘5 cm 或以上)。本研究由石河子大学医学院第一附属医院医学伦理委员会批准(伦理审批号:2018-067-02)。
1. 3 RCD 和衰老相关基因的获取及差异分析由Ferrdb 数据库(http://www. zhounan. org/ferrdb)、HADb 数据库(http://www. autophagy.lu/clustering/) 和既往文献[7-8] 中共收集了4 392 个基因,包括295 个铁死亡、19 个NETosis 相关死亡、1 972 个坏死性凋亡、57 个细胞焦亡、222 个自噬和18 个挤压死亡相关基因及1 809 个衰老相关基因。使用R 软件“limma” 程序包标准化数据,并筛选胃癌组织和癌旁正常组织样本中的差异表达基因(differentially expressed genes,DEGs)。筛选标准为|log2FC| gt;1 且假阳性率(1 discoveryrate,FDR) lt;0. 05。
1. 4 双重预后分析 使用R软件“limma”程序包将患者的生存状态和生存时间与DEGs 表达量进行合并。R 软件“survival” 和“survminer” 程序包对合并数据集分别进行Kaplan-Meier 生存分析和单因素COX 分析,以Plt;0. 01 为差异有统计学意义。R 软件“VennDiagram”程序包对已获取的基因取交集,获取影响胃癌患者生存预后的交集基因。
1. 5 目的基因筛选 基于TCGA数据库提供的胃癌患者临床资料,使用R 软件“limma”程序包分析交集基因表达水平在不同临床病理特征分组间的差异。根据显著性基因的数量,筛选与临床病理特征最具关联性的基因, 为PDE1B。TCGA 数据库和Kaplan-Meier 生存分析检测胃癌患者胃癌组织和癌旁正常组织中PDE1B mRNA 表达水平及其与胃癌患者生存期的关系。
1. 6 PDE1B 相 关 通 路 富 集 分 析 使 用 R 软 件“org. Hs. eg. db” 和“clusterProfiler” 程序包对PDE1B 进行基因本体论(Gene Ontology, GO)功能和京都基因与基因组百科全书(KyotoEncyclopedia of Genes and Genomes,KEGG) 信号通路富集分析,分析PDE1B 可能涉及的分子机制和生物学功能,以Plt;0. 05 为差异有统计学意义。
1. 7 肿瘤微环境、免疫特征和药物敏感性分析采用CIBERSORT 算法计算胃癌组织中PDE1B高和低表达胃癌患者肿瘤浸润淋巴细胞(tumorinfiltrating lymphocytes,TILs) 的相对丰度,迭代次数为1 000 次,以Plt;0. 05 为差异有统计学意义。使用肿瘤免疫数据库(Integrated Repository Portalfor Tumor-immune System Interactions,TISIDB)(http://cis. hku. hk/TISIDB/)分析胃癌样本中PDE1B 与TILs、免疫抑制剂和免疫激活剂的相关性。筛选条件: ① 登录在线网站, 选择“GeneSymbol” 和 “PDE1B” 输 入 查 询; ②在“Lymphocyte” 和“Immunomdulator” 模块, 选择“STAD” 并寻找相关分子; ③ 相关系数(r) gt;0为正相关,rlt;0 为负相关,以Plt;0. 05 为差异有统计学意义。利用基因集癌症分析平台(Gene SetCancer Analysis, GSCA) 在线网站(https://guolab. wchscu. cn/GSCA/)分析PDE1B 对药物的敏感性。筛选条件:选择“Drug”和“CTRP drugsensitivity and expression correlation”。
1. 8 实 时 荧 光 定 量 PCR(real-time fluorescencequantitative PCR,RT-qPCR) 法 检 测 PDE1BmRNA表达水平 使用 TRIzol试剂提取癌旁正常组织和胃癌石蜡样本中总RNA, NanoDrop 2000分光光度计(美国Thermo Scientific 公司) 检测RNA 浓度和质量。使用逆转录试剂盒(北京康为世纪公司) 将其逆转录为cDNA。使用RT-qPCR试剂盒(北京康为世纪公司) 进行RT-qPCR 反应,按照试剂盒说明书操作。以甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 为内参,每组设置3 个复孔,采用2-ΔΔCt法计算目的基因表达水平。引物由生工生物工程(上海) 股份有限公司合成设计。引物序列:GAPDHF 5'-GTCTCCTCTGACTTCAACAGCG-3',R 5'-ACCACCCTGTTGCTGTAGCCAA-3'; PDE1B F5'-CTGCGCTACATGGTGAAGCA-3', R 5'-CAAGATTTGCCGTGTCTCATCTA-3'。
1. 9 统 计 学 分 析 采 用 SPSS 26. 0、 GraphPadPrism 8. 0 和R 4. 3. 2 统计软件进行统计学分析并绘制图像。胃癌患者胃癌组织和癌旁正常组织中PDE1B mRNA 表达水平比较采用Wilcoxon 秩和检验,胃癌组织不同病理特征组间PDE1B 表达水平比较采用Wilcoxon 和Kruskal-Wallis H 检验,PDE1B与免疫细胞和免疫因子的相关性采用Spearman 相关性分析。以Plt;0. 05 为差异有统计学意义。
2 结 果
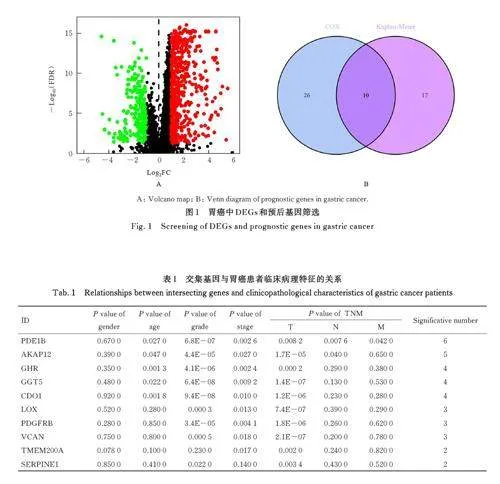
2. 1 胃 癌 差 异 预 后 基 因 筛 选 共 筛 选 716 个DEGs, 其中505 个DEGs 表达上调(Plt;0. 05),211 个DEGs 表达下调(Plt;0. 05)。对DEGs 分别进行单因素COX 分析和Kaplan-Meier 生存分析,获得36 和27 个影响生存预后的基因(Plt;0. 01),二者取交集后共获得半胱氨酸双加氧酶1(cysteine dioxygenase type CDO1)、脂 氧 合 酶(lipoxygenase, LOX)、A 激酶PRKA 锚定蛋白12(A kinase anchor protein 12, AKAP12)、γ-谷氨酰基转氨酶5 (gamma-glutamyltransferase 5,GGT5)、生长激素受体(growth hormone receptor,GHR)、PDE1B、多功能蛋白聚糖(recombinant versican,VCAN)、血小板衍生生长因子受体β (plateletderived growth factor receptor beta,PDGFRB)、丝氨酸蛋白酶抑制剂家族E 成员1 (serine proteaseinhibitor family E member 1,SERPINE1) 和跨膜蛋 白 200A (transmembrane protein 200A,TMEM200A) 共10 个交集基因。见图1。
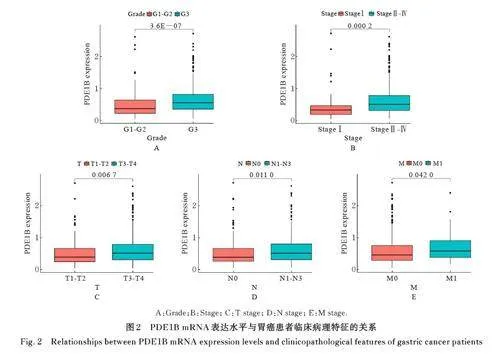
2. 2 PDE1B mRNA 表达水平与胃癌患者临床病理特征的关系 10个交集基因中PDE1B mRNA表达水平与临床病理特征关系最为密切,其与患者年龄、肿瘤分级、肿瘤分期和肿瘤T、N 及M 期有关联(Plt;0. 05)。与G1-G2、Stage Ⅰ、T1-T2、N0和M0 期胃癌患者比较,G3-G4、StageⅡ-Ⅳ、T3-T4、N1-N3 和M1 期胃癌患者胃癌组织中PDE1B mRNA表达水平均明显升高(Plt;0. 05)。见表1 和图2。
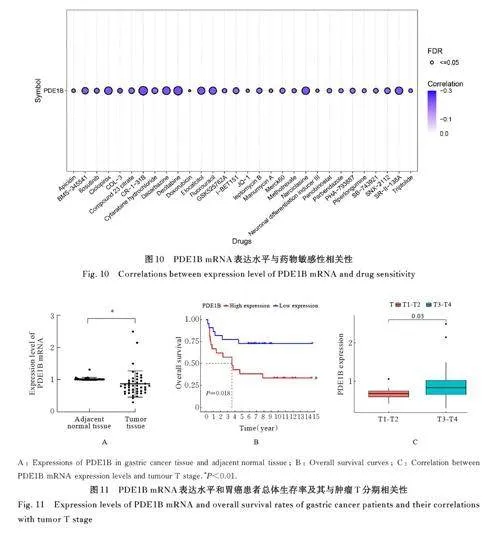
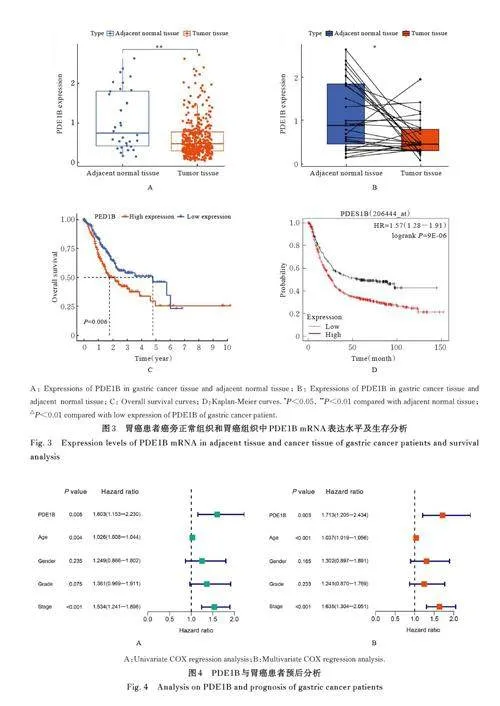
2. 3 在胃癌组织中PDE1B高表达患者生存率 差异分析和配对差异分析结果显示:与癌旁正常组织比较,胃癌患者胃癌组织中PDE1B mRNA 表达水平明显降低(Plt;0. 05)。生存分析结果显示: 与PDE1B 低表达胃癌患者比较,PDE1B 高表达胃癌患者总体生存率明显降低(Plt;0. 01)。见图3。
2. 4 胃癌患者生存预后的危险因素 单因素COX分析结果显示: PDE1B 表达、年龄和肿瘤分期是胃癌患者预后的危险因素(Plt;0. 05)。在调整了性别、年龄、肿瘤分级和肿瘤分期后, PDE1B 表达是影响胃癌患者预后的独立危险因素(Plt;0. 05)。见图4。
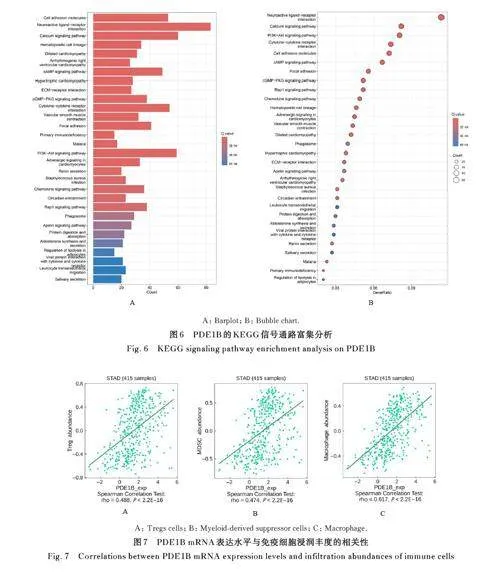
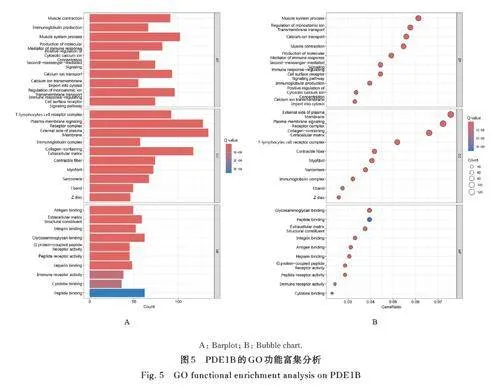
2. 5 PDE1B的生物学功能 GO功能富集分析结果显示: PDE1B 主要富集于免疫球蛋白产生、钙离子转运、第二信使介导的信号转导等生物过程(biological process,BP),T 淋巴细胞受体复合体、细胞膜信号受体复合体,和含胶原蛋白的细胞外基质等细胞成分(cellular component, CC), 抗原结合、糖胺聚糖结合和细胞外基质结构成分等分子功能(molecular function, MF)。KEGG 信号通路富集分析结果显示: PDE1B 主要参与了神经活性配体- 受体相互作用、钙信号通路、环磷酸鸟苷(cyclic guanosine monophosphate,cGMP) -蛋白激酶G (protein kinase G,PKG) 信号通路及细胞因子-细胞因子受体的相互作用等途径。见图5 和6。
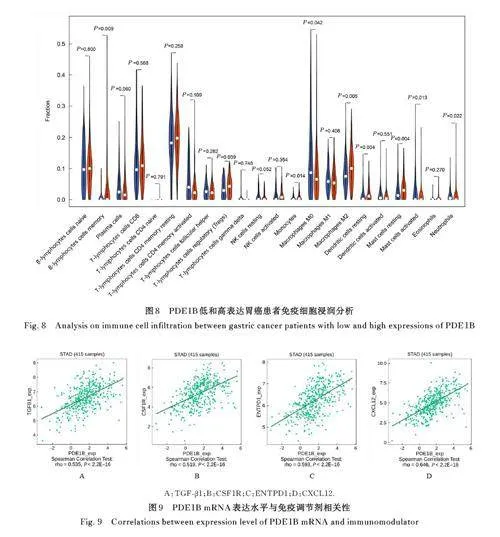
2. 6 PDE1B mRNA表达水平与免疫微环境相关性 TISIDB在线网站分析结果显示:PDE1B与调节性T淋巴细胞( r=0. 488)、 髓源性抑制细胞( r=0. 474) 和巨噬细胞( r=0. 617) 呈正相关关系( Plt;0. 01)。CIBERSORT 法分析结果显示:与PDE1B低表达胃癌患者比较, PDE1B 高表达胃癌患者促进肿瘤的调节性T 淋巴细胞、单核细胞和M2 型巨噬细胞浸润均明显增加(Plt;0. 05)。见图7 和8。
2. 7 PDE1B mRNA 表达水平与免疫抑制剂和药物敏感性相关性 PDE1B mRNA表达水平与免疫抑制剂转化生长因子β (transforming growth factor-β,TGF-β)1( r=0. 535)、 集落刺激因子1受体( colonystimulating factor-1 receptor,CSF1R)(r=0. 519)、免疫激活剂外核苷三磷酸二磷酸水解酶1(ectonucleoside triphosphate diphosphohydrolase 1,ENTPD1)(r=0. 593) 和CXC 趋化因子配体12(CXC chemokine ligand 12, CXCL12)(r=0. 646)呈正相关关系(Plt;0. 01)。PDE1B 高表达胃癌患者胃癌组织对氟尿嘧啶(-0. 3lt;r lt;-0. 1)、甲氨蝶呤(-0. 3lt;r lt;-0. 1)和地西他滨(-0. 3lt;r lt;-0. 1)等药物较为敏感(Plt;0. 05)。见图9 和10。
2. 8 PDE1B mRNA 表达水平与胃癌患者临床病理特征相关性 与癌旁正常组织比较,胃癌患者胃癌组织中PDE1B mRNA 表达水平明显降低(Plt;0. 01)。与PDE1B 低表达胃癌患者比较, PDE1B高表达胃癌患者总体生存率明显降低(Plt;0. 05)。与T1-T2 期胃癌患者比较, 肿瘤T3-T4 期胃癌患者胃癌组织中PDE1B mRNA 表达水平明显升高(Plt;0. 01)。见图11。
3 讨 论
早期胃癌的诊断筛查并不困难,但因其晚期治疗效果不佳,因此预后很差[9]。目前胃癌临床综合治疗主要为手术及术后放化疗,其效果并不理想,含铂类药物一线化疗方案对治疗进展期胃癌已达到疗效瓶颈[10-12]。因此,开发新的治疗方法和药物仍是当前研究的重点。
本研究结果显示: PDE1B 胃癌患者与临床病理特征有密切关联,与癌旁正常组织比较,胃癌患者胃癌组织中PDE1B mRNA 表达下调,与肾透明细胞癌[13] 的报道结果一致。在不同分期和分级的胃癌样本中,晚期和发生远处转移的胃癌组织中PDE1B mRNA 表达水平明显升高,PDE1B 是胃癌患者预后的独立危险因素。
PDE1B 是PDE1 的1 种亚型, 其可被细胞内钙/钙调蛋白激活, 是一种双底物环磷酸腺苷(cyclic adenosine monophosphate, cAMP) 和cGMP 酯酶[14]。研究[13] 显示:PDE1B 可以促进肾透明细胞癌细胞增殖和抑制细胞凋亡。但PDE1B在胃癌发生发展中的作用尚不清楚。研究[15-16] 显示: 细胞内cAMP/cGMP 信号通路的干扰与肿瘤的发生有密切关联。cGMP 表达上调可抑制肿瘤的生长[17-18]。YAMASHITA 等[19] 发现: cGMP 可通过抑制线粒体功能抑制胰腺导管腺癌的肿瘤干性。PDE1B 对cGMP 的亲和力高于cAMP[20]。本研究结果显示:PDE1B 参与了cGMP-PKG 通路,提示PDE1B 可能通过降低细胞内cGMP 水平,促进肿瘤的发生发展,形成负向生存功能导致患者生存时间缩短。
肿瘤免疫微环境的变化对癌症的发生发展具有重要作用,肿瘤免疫微环境可能与胃癌患者的“生存功能” 有关。本研究结果显示: PDE1B 高表达与M2 巨噬细胞、调节性T 淋巴细胞和单核细胞的高浸润水平有关。粒细胞-巨噬细胞集落刺激因子促使单核细胞分化转变为巨噬细胞后,PDE1B mRNA 表达水平明显升高,并参与病理性血管重塑[21]。肿瘤免疫微环境中M2 巨噬细胞百分率升高会损害CD8+T 淋巴细胞的抗肿瘤免疫功能,促使肿瘤发生免疫逃逸[22]。本研究结果显示:PDE1B mRNA 表达水平与免疫激活剂CXCL12 和ENTPD1 水平呈正相关关系。CXCL12 是C-X-C 趋化因子受体4 (C-X-C chemokine receptor type 4,CXCR4) 唯一的配体, 能够促进血管生成, 减少细胞凋亡和肿瘤坏死[23]。CXCL12/CXCR4 轴不仅可以驱动卵巢癌细胞的增殖和侵袭,还能通过触发上皮-间充质转化过程诱导卵巢癌的顺铂耐药[24-25]。研究[26] 显示:CXCL12 通过调控CXCR4/非典型趋化因子受体3( atypical chemokine receptor 3, ACKR3)促使M2 型丙酮酸激酶(pyruvate kinase isozymetype M2, PKM2) 转化为低酶活性的二聚体, 促进磷酸戊糖途径或有氧糖酵解(Warburg 效应) 过程, 从而满足肿瘤细胞的高能量需求。ENTPD1既可由免疫细胞表达,也可由部分肿瘤细胞表达,通过结合细胞外腺嘌呤核苷三磷酸(adenosinetriphosphate,ATP),将其转化为细胞外腺苷从而发挥抑制免疫应答的作用[27]。肿瘤微环境中ENTPD1 高表达与CD8+T 淋巴细胞耗竭有关[28]。调节性T 淋巴细胞可能在肿瘤微环境中上调ENTPD1,从而导致免疫抑制和促进肿瘤生长[29]。PDE1B 表达与免疫细胞和免疫分子呈正相关关系,提示PDE1B 积极参与肿瘤免疫微环境的形成。PDE1B 表达可能参与调节免疫细胞在微环境中的疏密分布, 其中部分免疫细胞也可能具有调节PDE1B 表达的能力,PDE1B 分子与相关免疫细胞互相作用,与部分细胞形成正反馈调节,而与另一部分细胞形成负反馈调节。因此, PDE1B 很可能是肿瘤微环境中的重要成员,通过参与调节肿瘤免疫微环境和促进血管生成影响胃癌的发生发展。
本研究结果显示: PDE1B 高表达的肿瘤组织对氟尿嘧啶、甲氨蝶呤和地西他滨等药物较为敏感,且PDE1B 高表达对胃癌患者生存时间具有负向生存功能, PDE1B 可能成为胃癌免疫治疗潜在的靶向性分子。
综上所述, PDE1B 可独立影响胃癌患者的不良生存预后, 胃癌组织中PDE1B 高表达与M2 巨噬细胞和单核细胞等免疫激活分子ENTPD1 及CXCL12 的高浸润水平有关, PDE1B 可能参与肿瘤微环境的改变,而PDE1B 高表达的胃癌组织对氟尿嘧啶和甲氨蝶呤等药物敏感。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:杨希参与研究设计、数据分析和论文撰写,袁琴和杨兰参与论文撰写指导,张文杰参与论文审校。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global
cancer statistics 2020: GLOBOCAN estimates of
incidence and mortality worldwide for 36 cancers in
185 countries[J]. CA Cancer J Clin, 2021, 71(3):
209-249.
[2] PARK E H, JUNG K W, PARK N J, et al. Cancer
statistics in Korea: incidence, mortality, survival, and
prevalence in 2021[J]. Cancer Res Treat, 2024, 56(2):
357-371.
[3] ITO Y, MIYASHIRO I, ISHIKAWA T, et al.
Determinant factors on differences in survival for gastric
cancer between the United States and Japan using
nationwide databases[J]. J Epidemiol, 2021, 31(4):
241-248.
[4] GALLUZZI L, VITALE I, AARONSON S A, et al.
Molecular mechanisms of cell death: recommendations
of the Nomenclature Committee on Cell Death 2018[J].
Cell Death Differ, 2018, 25(3): 486-541.
[5] SCHMAUCK-MEDINA T, MOLIÈRE A,
LAUTRUP S, et al. New hallmarks of ageing: a 2022
Copenhagen ageing meeting summary[J]. Aging, 2022,
14(16): 6829-6839.
[6] COLLADO M, BLASCO M A, SERRANO M.
Cellular senescence in cancer and aging[J]. Cell, 2007,
130(2): 223-233.
[7] ZHUO S H, CHEN Z M, YANG Y B, et al. Clinical
and biological significances of a ferroptosis-related gene
signature in glioma[J]. Front Oncol, 2020, 10: 590861.
[8] AHLUWALIA P, AHLUWALIA M, MONDAL A K,
et al. Immunogenomic gene signature of cell-death
associated genes with prognostic implications in lung
cancer[J]. Cancers, 2021, 13(1): 155.
[9] OKI E, TOKUNAGA S, EMI Y, et al. Surgical
treatment of liver metastasis of gastric cancer:
a retrospective multicenter cohort study (KSCC1302)[J].
Gastric Cancer, 2016, 19(3): 968-976.
[10]AL-BATRAN S E, HOZAEEL W, JÄGER E.
Combination of trastuzumab and triple FLOT
chemotherapy (5-fluorouracil/leucovorin, oxaliplatin,
and docetaxel) in patients with HER2-positive metastatic
gastric cancer: report of 3 cases[J]. Onkologie, 2012,
35(9): 505-508.
[11]BANG Y J, VAN CUTSEM E, FEYEREISLOVA A,
et al. Trastuzumab in combination with chemotherapy
versus chemotherapy alone for treatment of HER2-
positive advanced gastric or gastro-oesophageal junction
cancer (ToGA): a phase 3, open-label, randomised
controlled tria[l J]. Lancet, 2010, 376(9742): 687-697.
[12]MITSUI Y, SATO Y, MIYAMOTO H, et al.
Trastuzumab in combination with docetaxel/cisplatin/S-1
(DCS) for patients with HER2-positive metastatic
gastric cancer: feasibility and preliminary efficacy[J].
Cancer Chemother Pharmacol, 2015, 76(2): 375-382.
[13]ZHAO C G, MO L P, LEI T, et al. MiR-5701
promoted apoptosis of clear cell renal cell carcinoma cells
by targeting phosphodiesterase-1B [J]. Anticancer
Drugs, 2021, 32(8): 855-863.
[14]CHEUNG W Y. Cyclic 3',5'-nucleotide
phosphodiesterase[J]. Biochem Biophys Res Commun,
1970, 38(3): 533-538.
[15]BOLGER G B. The cAMP-signaling cancers: clinicallydivergent
disorders with a common central pathway[J].
Front Endocrinol, 2022, 13: 1024423.
[16]ZHANG H Y, KONG Q B, WANG J, et al. Complex
roles of cAMP-PKA-CREB signaling in cancer [J].
Exp Hematol Oncol, 2020, 9(1): 32.
[17]KUMAZOE M, TAKAI M K, HIROI S, et al. The
FOXO3/PGC-1β signaling axis is essential for cancer
stem cell properties of pancreatic ductal
adenocarcinoma[J]. J Biol Chem, 2017, 292(26):
10813-10823.
[18]KUMAZOE M, SUGIHARA K, TSUKAMOTO S,
et al. 67-kDa laminin receptor increases cGMP to induce
cancer-selective apoptosis[J]. J Clin Invest, 2013,
123(2): 787-799.
[19]YAMASHITA M, KUMAZOE M, ONDA H, et al.
PPAR/PDK4 pathway is involved in the anticancer
effects of cGMP in pancreatic cancer [J]. Biochem
Biophys Res Commun, 2023, 672: 154-160.
[20]SONNENBURG W K, SEGER D, BEAVO J A.
Molecular cloning of a cDNA encoding the “61-kDa”
calmodulin-stimulated cyclic nucleotide
phosphodiesterase. Tissue-specific expression of
structurally related isoforms[J]. J Biol Chem, 1993,
268(1): 645-652.
[21]BENDER A T, OSTENSON C L, GIORDANO D,
et al. Differentiation of human monocytes in vitro with
granulocyte-macrophage colony-stimulating factor and
macrophage colony-stimulating factor produces distinct
changes in cGMP phosphodiesterase expression[J].
Cell Signal, 2004, 16(3): 365-374.
[22]CHOW A, SCHAD S, GREEN M D, et al. Tim-4+
cavity-resident macrophages impair anti-tumor CD8+
Tcell immunity[J]. Cancer Cell, 2021, 39(7):
973-988.
[23]KRYCZEK I, LANGE A, MOTTRAM P, et al.
CXCL12 and vascular endothelial growth factor
synergistically induce neoangiogenesis in human ovarian
cancers[J]. Cancer Res, 2005, 65(2): 465-472.
[24]GUO Q, GAO B L, ZHANG X J, et al. CXCL12-
CXCR4 axis promotes proliferation, migration,
invasion, and metastasis of ovarian cancer[J]. Oncol
Res, 2014, 22(5/6): 247-258.
[25]ZHANG F, CUI J Y, GAO H F, et al. Cancerassociated
fibroblasts induce epithelial-mesenchymal
transition and cisplatin resistance in ovarian cancer via
CXCL12/CXCR4 axis[J]. Future Oncol, 2020,
16(32): 2619-2633.
[26]LUKER K E, LUKER G D. The CXCL12/CXCR4/
ACKR3 signaling axis regulates PKM2 and
glycolysis[J]. Cells, 2022, 11(11): 1775.
[27]ROCCONI R P, STANBERY L, TANG M, et al.
ENTPD1/CD39 as a predictive marker of treatment
response to gemogenovatucel-T as maintenance therapy
in newly diagnosed ovarian cancer[J]. Commun Med,
2022, 2: 106.
[28]THELEN M, LECHNER A, WENNHOLD K, et al.
CD39 expression defines cell exhaustion in tumorinfiltrating
CD8+ T cells-letter[J]. Cancer Res, 2018,
78(17): 5173-5174.
[29]GU J, NI X H, PAN X X, et al. Human CD39hi
regulatory T cells present stronger stability and function
under inflammatory conditions[J]. Cell Mol Immunol,
2017, 14(6): 521-528.

