靶向抑制磷脂酰肌醇3 —激酶110β因子的表达对人胃癌细胞生长影响的实验研究
许慈++蔡懿婷++董晴晴++王碧君++戴强++朱黎明


[摘要] 目的 探討沉默磷脂酰肌醇3-激酶(PI3K)p110β因子的表达对人胃癌细胞生长的影响。 方法 运用RNA干扰技术,合成靶向抑制PI3Kp110β的小干扰RNA(siRNA)序列并分别瞬时转染人胃癌细胞株AGS、SGC7901和MKN45(si-PI3Kp110β),作为实验组,未转染的细胞为空白对照组(Con),转染无义序列的siRNA为阴性对照组(si-NC)。采用RT-PCR和Western Blot方法验证瞬时转染后PI3Kp110β mRNA和蛋白在空白对照组(Con)、阴性对照组(si-NC)和实验组(si-PI3Kp110β)细胞中的表达水平,并通过MTT法检测细胞增殖及Annexin V-FITC/PI双染法检测AGS细胞凋亡率的情况。 结果 小分子干扰RNA(siRNA)瞬时转染人胃癌细胞株AGS、SGC7901和MKN45后,能有效下调PI3Kp110β在细胞内的表达水平。与阴性对照组(si-NC)比较,静默PI3Kp110β因子可减少AGS细胞的增殖(P < 0.05),并明显增加AGS细胞的凋亡率(P < 0.01)。 结论 小分子干扰RNA可有效下调PI3Kp在人胃癌细胞中的表达,沉默PI3Kp110β因子可有效抑制胃癌肿瘤细胞的增殖,促进细胞凋亡,提示针对PI3Kp110β 蛋白的干预治疗有可能成为抑制胃癌细胞生长的一个新的治疗方法。
[关键词] 磷脂酰肌醇3-激酶p110β; RNA干扰;胃肿瘤;增殖;凋亡
[中图分类号] R734 [文献标识码] A [文章编号] 1673-7210(2016)12(b)-0028-05
Study on the effects of target inhibiting phosphoinositide 3-kinases p110beta on the growth of human gastric cancer cells
XU Ci CAI Yiting DONG Qingqing WANG Bijun DAI Qiang ZHU Liming▲
Department of Gastroenterology, No.3 People′s Hospital Affiliated to Shanghai Jiaotong University School of Medicine, Shanghai 201999, China
[Abstract] Objective To study the effect of PI3Kp110β silencing on growth of human gastric cancer cells in vitro. Methods The small interfering RNA sequence targeted by PI3Kp110β and negative sequence was transfected into gastric carcinoma cells including AGS, SGC7901 and MKN45 for 48 h respectively by RNA interfering (si-PI3Kp110β group). Other two groups include untransfected cells (Con group) and nonsense siRNA sequence transfected cells (si-NC group). The mRNA and protein expression of PI3Kp110β were determined by reverse transcriptase polymerase chain reaction (RT-PCR) and Western blotting. The cellular proliferation was measured by MTT assay, and cell apoptosis was determined by flow cytometry in AGS cells. Results The expression level of PI3Kp110β was downregulated significantly in si-PI3Kp110β group in three human gastric carcinoma cell lines AGS, SGC7901 and MKN45. The cell proliferation was decreased (P < 0.05) and cell apoptosis was significantly increased (P < 0.01) in si-PI3Kp110β group compared with si-NC group in AGS cells. Conclusion The expression of PI3Kp110β in gastric cancer cells is effectively decreased with RNA interference. Silencing PI3Kp110β expression can effectively inhibit the proliferation of gastric carcinoma cells and induce cell apoptosis. siRNA targeting PI3Kp110β may become one of the methods to treat gastric carcinoma.
[Key words] PI3Kp110β; RNA interference; Gastric neoplasm; Proliferation; Apoptosis
胃癌是常见的消化道肿瘤,在我国胃癌患者5年生存率低,寻找关键的肿瘤信号调节因子,可为其治疗带来突破。研究发现,磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)信号通路在肿瘤转移以及耐药中发挥重要作用[1]。PI3K家族分为3种亚型,深入研究的是ⅠA型PI3K,由p85调节亚单位和p110催化亚单位组成,可被细胞表面酪氨酸激酶受体所激活。p110有α、β和δ 3个亚型组成。其中,编码p110β蛋白的PIK3CB基因在肿瘤增殖与迁移中的发挥的作用越为明显[2-4]。
笔者前期研究发现,PI3Kp110β在人胃癌组织中表达的阳性率高于正常癌旁组织,在分化越低、浸润程度越深以及淋巴结转移的胃癌组织中,其表达程度越高,提示PI3Kp110β的表达可能与胃癌的分化程度以及临床分期等关系密切[5]。本研究拟在此基础上,采用RNA干扰技术转染人胃癌细胞株,观察干扰前后PI3Kp110β在各胃癌细胞株中的表达,深入探讨PI3Kp110β对人胃癌细胞增殖与凋亡的影响。
1 材料与方法
1.1 细胞株、试剂以及仪器
人胃癌细胞株AGS、MKN45及SGC7901(购自中国科学院上海细胞生物学研究所,保存),均为贴壁生长的细胞,传代培养于含10%胎牛血清(Gibco)的RPMI1640培养液中(37℃、5%CO2)。
cDNA逆转录试剂盒(TAKARA,大连宝生物公司);2×TaqPCR MasterMix和Trizol试剂(北京天根生化公司);BCA法蛋白定量试剂盒(Pierce公司);PI3Kp110β抗体(Abcam公司,Ab32569);β-actin抗体(Sigma公司);辣根过氧化酶标记的山羊抗兔和抗小鼠的二抗(Goat Anti-Rabbit IgG,Goat Anti-Mouse IgG HRP Conjugated)(北京康为世纪公司);增强型化学发光试剂(ECL)(Bio-Rad公司);噻唑蓝(MTT)粉、二甲基亚砜(DMSO)(Sigma公司);Annexin V-FITC/PI凋亡试剂盒(BD公司)。
PCR仪(AB Applied Biosystems);Fusion FX7化學发光仪(Vilber Lourmat公司);流式细胞仪(BD公司);荧光显微镜(Olympus公司)。
1.2 siRNA转染
将培养的3种人胃癌细胞株AGS、SGC7901和MKN45接种于6 mm培养皿中(细胞密度为3×105个/皿),分为实验组(si-PI3Kp110β)和阴性对照组(si-NC或siFAM-NC),分别转染PI3Kp110β siRNA和不含(或含)绿色荧光的无义序列。采用脂质体Lipofectamine RNAiMAX转染试剂(美国Invitrogen公司)进行转染,先采用OPTI-MEM(Gibco)培养,siRNA转染6 h后,在培养皿中均加入等体积的含20%胎牛血清的RPMI1640培养液,24 h后更换新的含10%胎牛血清RPMI1640培养液并继续孵育48 h。PI3Kp110β-siRNA序列,正义链:5′-GUUGGAAUGAACCACUGGAAUUU-3′,反义链:5′-AAAUUCCA?鄄 GUGGUUCAUUCCA-3′;阴性对照序列,正义链:5′-UUCUCCGAACGU?鄄GUCACGU-3′,反义链:5′-ACGUGACACGUUCGGAGAA-3′;上述序列由上海吉玛制药公司合成。
1.3 逆转录以及聚合酶链式反应(RT-PCR)
采用Trizol法提取细胞总RNA,Nanodrop 2000仪器(Thermo公司)测量RNA浓度。PIK3CB引物序列和内参照GAPDH引物序列由上海生工技术服务有限公司合成。PIK3CB引物上游:5′-TATTTGGACTTTGCGACAAGACT-3′;下游:5′-TCGAACGTACTGGTCTGGATAG-3′,产物大小190 bp。GAPDH引物上游:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游:5′- GGCTGTTGTCATACTTCTCATGG-3′,产物大小197 bp。PCR反应条件:95℃ 3 min;94℃ 30 s,57℃30 s,72℃ 30 s,共30个循环;72℃延伸10 min。所得PCR产物行1.5%琼脂糖凝胶(含0.1%核酸染色试剂,泛博生物公司)电泳,100V电压40 min。将凝胶在化学发光仪上进行成像、拍照和分析。
1.4 蛋白质印迹法
在细胞中加入含蛋白酶抑制剂(PIC,Sigma公司)的RIPA裂解液(上海申能博彩公司)100 μL/皿;冰上裂解抽提细胞蛋白,BCA法进行蛋白定量;每一样本取20 μg蛋白质,加入适量1×SDS上样缓冲液(碧云天公司),煮沸5~10 min后置于冰上。配好8%十二烷基磺酸钠-聚丙烯酰胺凝胶,上样、垂直电泳、转膜、5%脱脂奶粉封闭,1 h后分别加入特异性PI3Kp110β抗体(1∶1000)和内参照β-actin抗体(1∶5000),4℃冰箱摇床孵育过夜;分别加入对应的二抗,室温摇床上孵育1 h,TBS-T液体洗膜3次,每次10 min,在膜上加入ECL发光液进行显影,用化学发光仪进行摄像和拍照。PI3Kp110β蛋白分子质量为123 kD,β-actin为42 kD。
1.5 MTT法检测细胞增殖
胃癌细胞株AGS转染48 h后,以5×103/孔的密度将实验组(si-PI3Kp110β)和阴性对照组(si-NC)细胞分别接种于96孔板,以未转染任何siRNA的胃癌细胞株AGS作为空白对照组(CON),每组设4个复孔,分别于接种后24、48、72 h加入5 mg/mL MTT试剂20 μL/孔,37℃培养箱孵育4 h,弃MTT,加入DMSO 100 μL/孔,0.5 h后于波长570 nm处测定吸光度(A)值。细胞增殖率=实验孔A值/空白孔A值×100%。上述MTT实验均重复3次。
1.6 Annexin V-FITC/PI双染法检测细胞凋亡率
在AGS细胞中,将转染PI3Kp110β-siRNA序列和NC-siRNA序列72 h的细胞以及空白对照组细胞用预冷的PBS洗涤2次;用无酚红的0.25%胰酶-EDTA消化,加入缓冲液制成细胞悬液,离心,予PBS洗涤2次,每组加入缓冲液400 μL;先后加入Annexin V-FITC和PI染色液各5 μL,室温避光放置15 min,上流式细胞仪检测细胞凋亡率。凋亡实验重复3次,取均值。
1.7 统计学方法
采用SPSS 15.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 小干扰RNA转染效率检测
将带绿色荧光标记的阴性对照序列(siFAM-NC)转染人胃癌细胞株AGS,48 h后荧光显微镜下观察,见细胞质和胞核均有点状或小片状绿色荧光显示(图1A,封三),与普通光镜下相同位置细胞图片相比(图1B,封三),约80%以上的细胞均有不同程度的绿色荧光显示,表明siRNA序列可有效转染AGS细胞。
2.2 人胃癌细胞株中si-PI3Kp110β干扰效率检测
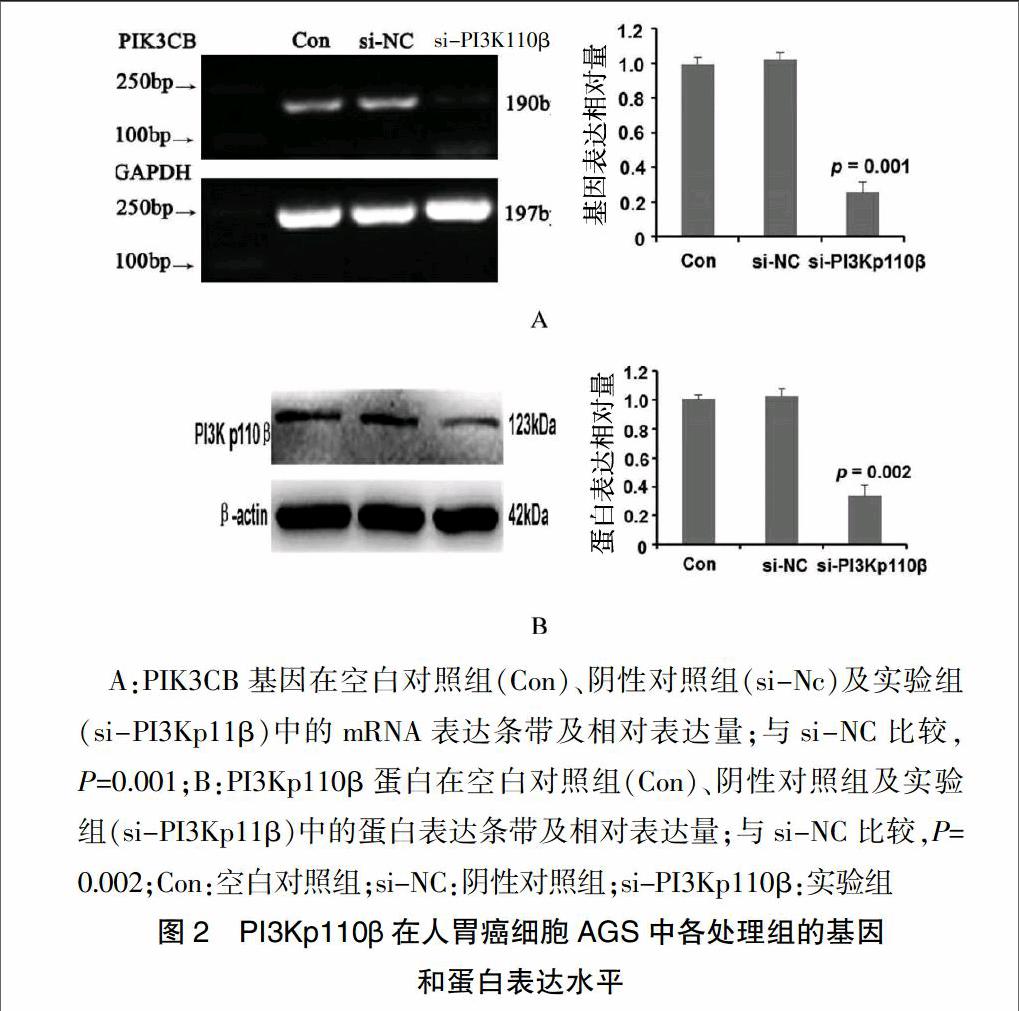
为了检测PI3Kp110βsiRNA的干扰效率,运用RT-PCR检测PIK3CB mRNA表达,Western Blot法分析PI3Kp110β蛋白表达水平。结果显示,在AGS细胞中,与阴性对照组(si-NC)相比,实验组(si-PI3Kp110β)中PIK3CB基因表达明显下降,差异有高度统计学意义(P=0.001),同时,实验组(si-PI3Kp110β)蛋白表达水平也显著下降,差异有高度统计学意义(P=0.002);而空白对照组(Con)与阴性对照组(si-NC)比较,差异无统计学意义(P > 0.05)(图2)。用RT-PCR方法检测SGC7901和MKN45细胞中的各组PIK3CB mRNA水平与AGS结果相似(图3)[1]。表明si-PI3Kp110β转染上述3种人胃癌细胞株后可有效下调PIK3CB基因及其蛋白产物PI3Kp110β在细胞内的表达。
A:PIK3CB基因在空白對照组(Con)、阴性对照组(si-Nc)及实验组(si-PI3Kp11β)中的mRNA表达条带及相对表达量;与si-NC比较,P=0.001;B:PI3Kp110β蛋白在空白对照组(Con)、阴性对照组及实验组(si-PI3Kp11β)中的蛋白表达条带及相对表达量;与si-NC比较,P=0.002;Con:空白对照组;si-NC:阴性对照组;si-PI3Kp110β:实验组
图2 PI3Kp110β在人胃癌细胞AGS中各处理组的基因
和蛋白表达水平
在SGC7901细胞中,与si-NC比较,P=0.004;在MKN45细胞中与si-NC比较,P=0.001;Con:空白对照组;si-NC:阴性对照组;si-PI3Kp110β:实验组
图3 PI3Kp110β在SGC7901和MKN45细胞中
PI3Kp110β基因表达条带及相对表达量
2.3 沉默PI3Kp110β的表达对胃癌细胞增殖的影响
为了检测PI3Kp110β蛋白对人胃癌细胞株增殖的作用,MTT实验结果表明,培养24、48、72 h后,阴性对照组(si-NC)AGS细胞增殖率分别为(100.45%±7.58)%、(106.16%±8.39)%、(106.71%±3.60)%;实验组(si-PI3Kp110β)细胞增殖率分别为(96.86%±7.64)%、(96.31%±6.77)%、(92.07%±5.68)%。实验组(si-PI3Kp110β)的细胞增殖率在各时间点,较阴性对照组(si-NC)相比均有下降,其中作用72 h时间点的两组细胞增殖能力差异有统计学意义(P < 0.05)(图4)。表明瞬转si-PI3Kp110β下调PI3Kp110β表达可减少AGS细胞的增殖。
与si-NC比较,*P < 0.05;si-NC:阴性对照组;PI3Kp110β:实验组
图4 siRNA转染AGS细胞24、48、72 h的细胞增殖率
2.4 沉默PI3Kp110β的表达对胃癌细胞凋亡的影响
Annexin V-FITC/PI双染的流式细胞学结果显示,转染72 h后,空白对照组(Con)、阴性对照组(si-NC)以及实验组(si-PI3Kp110β)细胞早期凋亡率分别为(2.07%±0.75)%、(2.48%±0.73)%、(23.88%±4.48)%。与阴性对照组(si-NC)相比,实验组(si-PI3Kp110β)细胞凋亡率明显增加,差异有高度统计学意义(P < 0.01)(图5);而阴性对照组(si-NC)与空白对照组(Con)相比,细胞凋亡率差异无统计学意义(P > 0.05)。由此可表明转染si-PI3Kp110β 72 h后可明显增加AGS细胞的凋亡率。
与si-NC比较,*P < 0.01;Con:空白对照组;si-NC:阴性对照组;PI3Kp110β:实验组
图5 siRNA转染AGS细胞72 h各组细胞早期凋亡率比较
3 讨论
PI3K/Akt通路是体内重要生长因子通路之一,主要作用是激活细胞内的抗凋亡机制,促进细胞生长和增殖[6]。PI3K功能异常与许多疾病如慢性炎症和肿瘤相关[7]。在此通路中,Ⅰ型PI3K研究最为广泛,具备磷脂酰肌醇激酶以及丝氨酸-苏氨酸蛋白激酶的双重活性[8]。该通路的异常,导致细胞增殖、代谢能力增强,抑制凋亡信号,导致肿瘤的发生发展[9]。研究发现,PI3K中催化亚单位P110β在G蛋白偶联受体信号通路[10]、细胞周期调控[11]、DNA复制[12]和细胞代谢[13]中起作用,另有研究表明,P110β在人乳腺癌、类卵巢癌以及前列腺癌中表达增高[14-16],可能是结肠腺瘤发展为结肠癌的重要原因之一[17]。笔者前期临床研究发现,PI3Kp110β在人胃癌组织中的水平显著高于相应的癌旁组织,胃癌患者中PI3Kp110β表达水平强阳性患者的5年生存率显著低于PI3Kp110β表达水平弱阳性或阴性患者,预示胃癌组织中PI3Kp110β水平的表达的高低能提示胃癌患者的预后[5]。
在此基礎上,本文先合成靶向抑制PI3Kp110β的小干扰RNA序列,转染人胃癌细胞株,后运用PCR和Western Blot法,检测转染靶向抑制PI3Kp110β的小干扰RNA后肿瘤细胞株中PIK3CB基因表达以及PI3Kp110β蛋白表达水平,发现靶向抑制PI3Kp110β的小干扰RNA转染胃癌细胞可有效降低细胞中PI3Kp110β的表达。
有研究表明,运用RNA干扰技术,在乳腺癌[18]、子宫内膜癌[19]和恶性胶质瘤[20]中可抑制PI3Kp110β的表达,有效抑制该肿瘤细胞的增殖并诱导其凋亡,从而抑制该肿瘤细胞的生长。本研究通过MTT实验证实肿瘤细胞的增殖能力在序列转染后受抑制,且细胞凋亡率有显著增加。以上结果表明,下调人胃癌细胞AGS中PI3Kp110β的水平可能起到抑制肿瘤细胞的增殖以及促进肿瘤细胞的凋亡的作用。
综上所述,本实验研究发现PI3Kp110β siRNA瞬时转染人胃癌细胞可有效下调肿瘤细胞中PI3Kp110β的表达,并抑制人胃癌细胞的增殖,促进其凋亡。提示抑制PI3Kp110β 可能成为抗胃癌细胞生长的一个新靶点。
[参考文献]
[1] Engelman JA. Targeting PI3K signaling in cancer:opportunities,challenges and limitations [J]. Nature Reviews of Cancer,2009,9(8):550-562.
[2] Ye ZW,Ghalali A,H?觟gberg J,et al. Silencing p110β prevents rapid depletion of nuclear pAkt [J]. Biochem Biophys Res Commun,2011,415(4):613-618.
[3] Chen H,Mei L,Zhou L,et al. PTEN restoration and PIK3CB knockdown synergistically suppress glioblastoma growth in vitro and in xenografts [J]. J Neurooncol,2011,104(1):155-167.
[4] De Laurentiis A,Pardo OE,Palamidessi A,et al. The catalytic class I(A)PI3K isoforms play divergent roles in breast cancer cell migration [J]. Cell Signal,2011,23(3):529-541.
[5] 许慈,程芃,戴强,等.磷脂酰肌醇3-激酶p110β在胃癌中的表达及其与预后的关系[J].内科理论与实践,2012, 7(4):310-312.
[6] Billottet C,Banerjee L,Vanhaesebroeck B,et al. Inhibition of class I phosphoinositide 3-kinase activity impairs proliferation and triggers apoptosis in acute promyelocytic leukemia without affecting atra-induced differentiation [J]. Cancer Res,2009,69(3):1027-1036.
[7] Cantley LC. The phosphoinositide 3-kinase pathway [J]. Science,2002,296(5573):1655-1657.
[8] Fruman DA,Meyersand LRE,Cantley LC. PhosPhoinositide 3-kinases [J]. Annu Rev Biochem,1998,67:481-507.
[9] Vivanco I,Sawyers CL. The phosphatidylinositol 3-Kinase AKT pathway in human cancer [J]. Nat Rev Cancer,2002, 2(7):489-501.
[10] Guillermet-Guibert J,Bjorklof K,Salpekar A,et al. The p110beta isoform of phosphoinositide 3-kinase signals downstream of G protein-coupled receptors and is functionally redundant with p110gamma [J]. Proc Natl Acad Sci USA,2008,105(24):8292-8297.
[11] Marques M,Kumar A,Cortes I,et al. Phosphoinositide 3-kinases p110alpha and p110beta regulate cell cycle entry,exhibiting distinct activation kinetics in G1 phase [J]. Mol Cell Biol,2008,28(8):2803-2814.
[12] Marques M,Kumar A,Poveda AM,et al. Specific function of phosphoinositide 3-kinase beta in the control of DNA replication [J]. Proc Natl Acad Sci USA,2009,106(18):7525-7530.
[13] Jia S,Liu Z,Zhang S,et al. Essential roles of PI(3)K-p110beta in cell growth, metabolism and tumorigenesis [J]. Nature,2008,454(7205):776-779.
[14] Cheng JQ,Godwin AK,Bellacosa A,et al. AKT2,a pulative oncoding a member of a subfamily of protein-serine/threonine kinase,is amplified in human ovarian carcinomas [J]. Proc Natl Acad Sci USA,1992,89(19):9267-9271.
[15] Zhu Q,Youn H,Tang J,et al. Phosphoinositide3-OH kinase p85alpha and p110beta are essential for androgen receptor transactivation and tumor progression in prostate cancers [J]. Oncogene,2008,27(33):4569-4579.
[16] Ciraolo E,Iezzi M,Marone R,et al. Phosphoinositide 3-kinase p110beta activity:Key role in metabolism and mammary gland cancer but not development [J]. Sci Signal,2008,1(36):ra3.
[17] Shuhua W,Tangyue L,Qinghai M,et al. Expression of PI3Kp110α and PI3Kp110β in the colorectal conventional adenoma,serrated lesions and adenoma with canceration and their significance [J]. Int J Clin Exp Pathol,2015,8(12):16026-16035.
[18] Crowder RJ,Phommaly C,Tao Y,et al. PIK3CA and PIK3CB inhibition produce synethetic lethality when combined with estrogen deprivation in estrogen receptor positive breast cancer [J]. Cancer Res,2009,69(9):3955-3962.
[19] An HJ,Cho NH,Yang HS,et al. Targeted RNA interference of phosphatidylinositol3-kinase p110-beta induces apoptosisand proliferation arrest in endometrialcarcinoma cells [J]. J Pathol,2007,212(2):161-169.
[20] Pu P,Kang C,Zhang Z,et al . Downregulationof PIK3CB by siRNA suppresses malignantglioma cell growth in vitro and in vivo [J]. Technol Cancer Res Treat,2006,5(3):271-280.
(收稿日期:2016-09-02 本文編辑:程 铭)

