大黄酚对H2O2诱导EA.hy926 细胞凋亡的改善作用及其机制
[摘 要] 目的:探讨大黄酚对过氧化氢(H2O2)诱导EA. hy926细胞氧化损伤的作用,并阐明其对支气管肺发育不良(BPD)的治疗作用及其相关机制。方法:分别采用25、50、100、200、400、800和1 600 μmol·L-1 H2O2及0、8、16、32、64、128 和256 μmol·L-1大黄酚诱导EA. hy926 细胞,CCK-8法检测不同浓度H2O2 和大黄酚处理后EA. hy926 细胞活性。将细胞分为对照组、模型组(200 μmol·L-1H2O2)、低剂量大黄酚组(8 μmol·L-1大黄酚和200 μmol·L-1 H2O2) 和高剂量大黄酚组(256 μmol·L-1大黄酚和200 μmol·L-1 H2O2)。Western blotting 法检测各组细胞质和细胞核中凋亡诱导因子(AIF) 蛋白表达水平,免疫荧光法检测各组细胞AIF 核转位情况,试剂盒检测各组细胞中超氧化物歧化酶(SOD)活性和丙二醛(MDA)、含半胱氨酸的天冬氨酸蛋白酶(Caspase)-8及Caspase-9水平。结果:不同浓度H2O2 作用下,EA. hy926 细胞呈倒置S 形细胞活性曲线,细胞活性良好,半数抑制浓度(IC50) 为261. 52 μmol·L-1,采用200 μmol·L-1 H2O2 干预24 h 诱导建立细胞模型。随着大黄酚药物浓度升高,EA. hy926 细胞活性无明显变化(Pgt;0. 05), 采用8 和256 μmol·L-1 大黄酚进行细胞干预。Westernblotting 法检测,与对照组比较,模型组细胞核中AIF 蛋白表达水平明显升高(Plt;0. 05),细胞质中AIF 蛋白表达水平明显降低(Plt;0. 05);与模型组比较,低和高剂量大黄酚组细胞核中AIF 蛋白表达水平均明显降低(Plt;0. 05),细胞质中AIF 蛋白表达水平均明显升高(Plt;0. 05)。免疫荧光法检测,对照组细胞AIF 定位于细胞核内较少;与对照组比较,模型组细胞AIF 核转位阳性值明显升高(Plt;0. 05);与模型组比较,低和高剂量大黄酚组细胞AIF 核转位阳性值均明显降低(Plt;0. 05)。与对照组比较,模型组细胞中SOD 活性明显降低(Plt;0. 05),MDA 水平明显升高(Plt;0. 01);与模型组比较,低和高剂量大黄酚组细胞中SOD 活性均明显升高(Plt;0. 05),MDA 水平均明显降低(Plt;0. 05 或Plt;0. 01);各组细胞中Caspase-8和Caspase-9水平比较差异均无统计学意义 (Pgt;0. 05)。结论:大黄酚通过抑制氧化应激和AIF 核转位改善H2O2诱导的EA. hy926 细胞凋亡,有助于治疗BPD。
[关键词] 大黄酚; 支气管肺发育不良; 凋亡诱导因子; 核转位; 细胞凋亡; 氧化应激
[中图分类号] R725.6 [文献标志码] A
支气管肺发育不良(bronchopulmonarydysplasia,BPD) 是威胁早产儿生命的常见慢性呼吸系统疾病, 可以导致反复住院并引起多种后遗症,严重影响患儿生活质量,远期影响甚至可能持续至青春期和成年期,给患儿、家庭和社会带来巨大的经济和心理负担[1]。研究[2] 显示: 经典型BPD 发病率已明显降低,然而新型BPD 发病率呈上升趋势。不同于以肺部感染及炎症、肺纤维化和氧化应激为特征的经典型BPD,新型BPD 以肺泡结构简化、毛细血管形态畸形、间质细胞变化和纤维增生为主要特征。目前,BPD 的潜在发病机制及其具体病因尚未完全阐明,仍然缺乏有效的治疗手段和干预药物,是全球性的妇幼重点健康问题[1]。
生命早期高浓度氧暴露是最终导致BPD 的独立危险因素[3]。氧化应激在高氧诱导的肺泡上皮细胞和血管内皮细胞损伤中发挥重要作用,细胞凋亡过度是氧化应激导致肺泡上皮细胞和血管内皮细胞损伤的重要机制之一[4]。研究[5] 发现: 肺泡上皮细胞和血管内皮细胞过度凋亡是BPD 的重要组织学特点,肺组织凋亡细胞数随高氧暴露时间延长而明显增加。新型BPD 病理损伤明显减轻, 因此内源性凋亡途径激活可能在新型BPD 的发生发展中发挥重要作用,凋亡诱导因子(apoptosis-inducingfactor, AIF) 核转位是内源性凋亡通路激活的标志[6-7]。当机体处于高氧刺激下,活性氧(reactiveoxygen species, ROS) 产生增加和线粒体通透性转变孔开放,致使线粒体内膜电位丧失、基质肿胀及外膜破裂,AIF 由线粒体释放并向细胞核转移,启动细胞凋亡程序。
大黄是我国传统中草药, 已证实有助于治疗BPD[8-9]。蒽醌类化合物是大黄的主要有效化学成分,其中大黄酚结构较为简单,可由此合成其他蒽醌类化合物[10]。研究[11] 显示:大黄酚可以减轻肺损伤, 但大黄酚改善BPD 的临床疗效及其作用机制尚未完全阐明。因此本研究以人脐静脉内皮细胞株EA. hy926 通过过氧化氢(hydrogen peroxidesolution, H2O2) 诱导其凋亡建立高氧损伤模型,探讨大黄酚治疗对EA. hy926 高氧损伤细胞模型AIF 核转位及氧化应激的影响, 旨在为BPD 的治疗提供参考。
1 材料与方法
1. 1 细胞、主要试剂和仪器 人脐静脉内皮细胞株EA. hy926 (CL-0272) 购自武汉普诺赛生命科技公司。H2O2 溶液(CAS: 7722-84-1)、大黄酚粉(CAS: 481-74-3)、N-N- 二甲基乙酰胺(CAS:127-19-5) 和聚山梨酯80 (CAS:9005-65-6) 均购自上海阿拉丁生化科技公司,胰蛋白酶(25200056)和DMEM 培养基(12100046) 均购自美国Gibico公 司, 胎 牛 血 清(fetal bovine serum,FBS)(FSP500) 购自上海依科赛生物尔科技公司, 超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA) 检测试剂盒、含半胱氨酸的天冬氨酸蛋白酶(cysteinyl aspartatespecific proteinase, Caspase)-8 活性检测试剂盒、Caspase-9 活性检测试剂盒、Hoechst 染色试剂盒、细胞核蛋白和细胞浆蛋白抽提试剂盒、BCA 检测试剂盒及蛋白浓度测定试剂盒均购自江苏海门碧云天生物技术研究所, CCK-8 检测试剂盒(K1018)购自美国APExBIO公司,AIF抗体(17984-1-AP)和HistoneH3 (17168-1-AP) 均购自武汉Proteintech公司, β -actin (T0022) 购自江苏Affinity 公司。CO2 培养箱购自美国赛默飞公司,酶联免疫检测仪购自美国NanoDrop 公司,聚焦光学显微镜购自日本Nikon 公司。
1. 2 大黄酚和 H2O2应用液制备和 EA. hy926细胞培养 大黄酚采用N-N-二甲基乙酰胺和聚山梨酯-80 溶解后混匀,实验前用0. 9% 氯化钠溶液稀释至0、8、16、32、64、128 和256 μmol·L-1 药物浓度。取453 μL 30% H2O2 溶液配制为母液后,定容至100 mL 备用。本研究已通过广东省妇幼保健院医学伦理委员会批准,伦理审查编号:202001075。采用含1% 青-链霉素和10% FBS 的DMEM 培养基进行培养,EA. hy926 细胞复苏后,置入37 ℃、5% CO2培养箱中培养,显微镜下观察EA. hy926 细胞生长至汇合后,采用0. 25% 胰酶消化细胞,分瓶传代培养,备用。
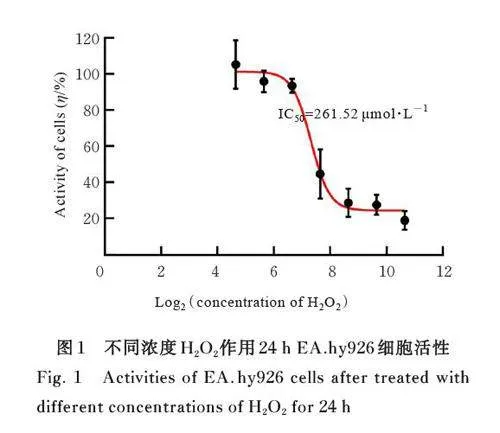
1. 3 CCK-8法检测不同浓度H2O2处理后EA. hy926细胞活性 取对数生长期 EA. hy926 细胞,采用0. 25% 胰酶消化细胞,DMEM 培养基稀释细胞使细胞密度为1×105 mL-1,将细胞悬液转移至96 孔细胞培养板中,分别用浓度为25、50、100、200、400、800 和1 600 μmol·L-1 H2O2 溶液干预24 h 后,根据CCK-8 试剂盒说明书操作,采用酶标仪检测波长450 nm 处细胞吸光度(A) 值,计算细胞活性。细胞活性= (实验孔A 值-对照孔A 值) /对照孔A 值×100%。
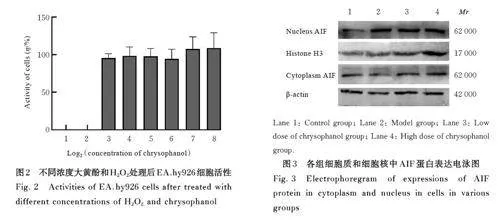
1. 4 CCK-8法检测不同浓度大黄酚和H2O2处理后EA. hy926细胞活性 取对数生长期 EA. hy926细胞, 稀释至细胞密度为1×105 mL-1 的细胞悬液,接种于96 孔细胞培养板, 待细胞贴壁汇合后, 生理盐水溶解大黄酚溶液至0、8、16、32、64、128和256 μmol·L-1 浓度梯度, 细胞中加入不同浓度的大黄酚溶液和200 μmol·L-1 H2O2 溶液, 共同培养24 h,根据CCK-8 试剂盒说明书操作,采用酶标仪检测波长450 nm 处细胞A 值, 计算细胞活性。细胞活性= (实验孔A 值-对照孔A 值) /对照孔A 值×100%。
1. 5 实验分组 取对数生长期 EA. hy926 细胞,分为对照组、模型组、低剂量大黄酚组和高剂量大黄酚组。对照组EA. hy926 细胞不作处理; 模型组EA. hy926 细胞加入200 μmol·L-1 H2O2溶液,培养24 h; 低和高剂量大黄酚组细胞培养至汇合后, 分别加入8 和256 μmol·L-1 大黄酚溶液及200 μmol·L-1 H2O2溶液,干预24 h。
1. 6 Western blotting 法检测各组细胞核和细胞质中 AIF 蛋白表达水平 收集各组 EA. hy926细胞,按照细胞核蛋白和细胞浆蛋白抽提试剂盒说明书操作,分离提取细胞核和细胞质中蛋白,-80 ℃保存备用。取各组EA. hy926 细胞, 磷酸盐缓冲液(phosphate buffer saline,PBS) 清洗后裂解,收集细胞总蛋白,将提取的蛋白进行细胞质和细胞核中AIF 蛋白定量, 分离得到的细胞质蛋白和细胞核蛋白通过SDS-PAGE 电泳, 转移至PVDF 膜上,5% 脱脂奶粉封闭1 h 后, 孵育AIF (1∶ 1 000)、Histone H3 (1∶ 5 000) 和β-actin (1∶ 10 000) 一抗, TBST 溶液中漂洗3 次, 二抗室温孵育1 h,TBST 溶液中漂洗3 次, 经ECL 成像显影。采用Image J 软件分析蛋白条带灰度值, 以Histone H3和β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
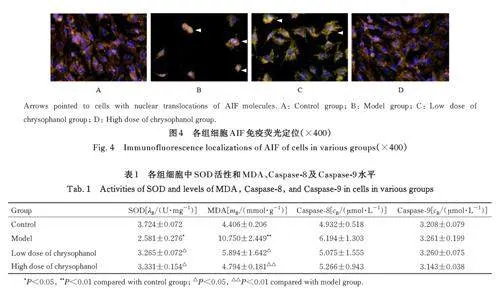
1. 7 免疫荧光法检测各组细胞 AIF 核转位情况 取对数生长期EA. hy926 细胞株,制备为细胞悬液, 接种至共聚焦皿中。按照上述分组干预后,PBS 漂洗3 次, 每次5 min, 4% 多聚甲醛固定,室 温 作 用 15 min, PBS 缓 冲 液 漂 洗 3 次,0. 3%Triton X-100 溶液作用10 min, PBS 缓冲液漂洗3 次, 使用10% 正常山羊血清封闭, 室温静置孵育2 h,加入一抗,4 ℃孵育过夜,PBS 缓冲液漂洗3 次, 再加入二抗, 室温孵育1 h, PBS 缓冲液漂洗3 次, 加入Hoechst 染色剂染色, 使用抗荧光淬灭封片液封片, 于光学显微镜下观察并拍照, 每组随机选取3 个视野, 采用Image J 软件对发生AIF 核转位的细胞进行计数, 计算各组细胞AIF 核转位阳性值。AIF 核转位阳性值= 实验组AIF 核转位阳性细胞数/对照组AIF 核转位阳性细胞数。
1. 8 采用试剂盒检测各组细胞中 SOD 活性和MDA 水平 收集细胞上清液,按照 SOD和 MDA检测试剂盒说明书操作,各组细胞待测溶液加入至96 孔细胞培养板中,采用酶标仪于波长450 nm 和532 nm 处检测细胞A 值, 按照试剂盒说明书方法计算各组细胞中SOD 活性和MDA 水平。
1. 9 采用试剂盒检测各组细胞中 Caspase-8 和Caspase-9 水平 取对数生长期 EA. hy926 细胞,1∶ 3 传代至75T 培养瓶中, 待细胞贴壁汇合后按照上述分组干预24 h,用胰蛋白酶消化细胞,按照Caspase-8 和Caspase-9 活性检测试剂盒说明书操作,检测各组细胞中Caspase-8 和Caspase-9 水平。
1. 10 统计学分析 采用 SPSS 22. 0 和 GraphpadPrism 8. 0 统计软件进行统计学分析。各组细胞活性、细胞核和细胞质中AIF 蛋白表达水平、AIF 核转位阳性值、细胞中SOD 活性和MDA 水平及Caspase-8 和Caspase-9 水平均符合正态分布, 以x±s 表示,多组间样本均数比较采用单因素方差分析, 组间样本均数两两比较采用LSD-t 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 不同浓度 H2O2处理后 EA. hy926 细胞活性 EA. hy926 细胞呈倒置S 形细胞活性曲线,细胞活 性 良 好,半 数 抑 制 浓 度(median inhibitionconcentration,IC50) 为261. 52 μmol·L-1,本研究采用200 μmol·L-1 H2O2 干预24 h 诱导建立细胞模型。见图1。
2. 2 不同浓度大黄酚和H2O2处理后EA. hy926细胞活性 随着大黄酚药物浓度的升高,EA. hy926细胞活性无明显变化,差异无统计学意义(Pgt;0. 05)。本研究采用8 和256 μmol·L-1大黄酚进行细胞干预。见图2。
2. 3 各组细胞核和细胞质中 AIF 蛋白表达水平 与对照组(1. 296±0. 014) 比较,模型组细胞核中AIF 蛋白表达水平(1. 692±0. 026) 明显升高(Plt;0. 05), 细胞质中AIF 蛋白表达水平(0. 910±0. 523) 明显降低(Plt;0. 05)。与模型组比较,低和高剂量大黄酚组细胞核中AIF 蛋白表达水平(1. 583±0. 051 和1. 069±0. 043) 均明显降低(Plt;0. 05), 细胞质中AIF 蛋白表达水平(1. 566±0. 060 和1. 096±0. 013) 均明显升高(Plt;0. 05)。见图3。
2. 4 各组细胞 AIF核转位情况 对照组细胞 AIF定位于核内较少。与对照组(1. 00±0. 00) 比较,模型组细胞AIF 核转位阳性值(4. 00±0. 82) 明显升高(Plt;0. 05)。与模型组比较, 低和高剂量大黄酚组细胞AIF 核转位阳性值(2. 25±0. 95 和1. 50±0. 58) 均明显降低(Plt;0. 05)。见图4。
2. 5 各组细胞中 SOD 活性和 MDA、Caspase-8及Caspase-9水平 与对照组比较,模型组细胞中SOD 活性明显降低(Plt;0. 05),MDA 水平明显升高(Plt;0. 01)。与模型组比较, 低和高剂量大黄酚组细胞中SOD 活性均明显升高(Plt;0. 05),MDA 水平均明显降低(Plt;0. 05 或Plt;0. 01)。各组细胞中Caspase-8 和Caspase-9 水平比较差异均无统计学意义(Pgt;0. 05)。见表1。
3 讨 论
脐静脉内皮细胞株Ea. hy926 的结构和功能均与人肺泡微血管内皮细胞相似, 可广泛用于构建BPD 肺泡体外模型[12]。氧化应激在高氧诱导的肺泡上皮细胞和血管内皮细胞损伤中发挥重要作用,而H2O2 诱导的氧化应激细胞模型普遍用于研究内皮细胞发生氧化损伤的机制及药物对氧化损伤的保护作用[13]。本研究设置不同浓度梯度H2O2 溶液干预EA. hy926 细胞24 h 后,细胞活性呈倒置S 形细胞活性曲线,提示造模成功。
氧化应激和细胞凋亡是BPD 发生发展的重要机制[4-5]。本研究结果显示:在血管内皮细胞高氧损伤模型中,大黄酚可升高SOD 活性和降低MDA水平,提示其具有抗氧化应激作用。此外,与对照组比较,给予大黄酚和H2O2共同处理后Ea. hy926 细胞活性无明显差异,提示大黄酚有助于减轻高氧诱导的EA. hy926 细胞凋亡。
过度细胞凋亡是氧化应激诱导肺泡上皮细胞和血管内皮细胞损伤的重要病理生理机制[14]。研究[15] 证实:肺泡上皮细胞和血管内皮细胞过度凋亡是BPD 的重要组织学特点, 肺组织凋亡细胞数与BPD 肺损伤程度存在显著正相关关系。由线粒体损伤介导的内源性凋亡通路和由死亡受体激活的外源性凋亡通路是目前已知的2 种细胞凋亡途径,均被证实参与了BPD 的病理过程[8,16]。外源性凋亡通路激活启动于Fas 与其受体结合,随后与细胞质Fas 相关死亡结构域蛋白和Caspase-8 结合,进一步形成死亡诱导信号复合体,最终活化Caspase-3,并启动细胞程序化死亡程序[17]。内源性凋亡通路是由于细胞受促凋亡因子刺激作用下,线粒体跨膜电位明显降低,线粒体膜通透性明显升高,从而导致多种促凋亡蛋白,如AIF 和细胞色素C 的释放,细胞色素C 可先后激活Caspase-9 和Caspase-3 (依赖于Caspase 的凋亡途径),AIF 则经核定位信号转移至细胞核,直接引起染色体聚集和DNA 等大分子断裂(非Caspase 依赖性通路), 最终引起细胞凋亡[18]。新型BPD 病理损伤较传统BPD 明显减轻, 因此内源性凋亡通路可能在新型BPD 中发挥关键作用[6]。本研究结果显示: 各组细胞中Caspase-8 和Caspase-9 水平比较差异均无统计学意义;与对照组比较,模型组细胞质中AIF 蛋白表达水平明显降低,细胞核中AIF 蛋白表达水平明显升高;而大黄酚干预下细胞质中AIF 蛋白表达水平较模型组明显升高,而细胞核中AIF 蛋白水平明显降低, 提示轻度BPD 主要为AIF 核转位引发的非Caspase-3 依赖性凋亡通路发挥作用, 大黄酚可有效抑制AIF 核转位引起的EA. hy926 细胞凋亡。而H2O2 处理和大黄酚干预后Caspase-9 水平变化不明显,可能与Caspase-9 为线粒体损伤激活的Caspase依赖性通路的下游分子,而AIF 核转位反映线粒体损伤后凋亡蛋白的早期变化有关,且AIF 的激活依赖于腺苷二磷酸核糖聚合酶-1,而非依赖于Caspase的外源性和内源性细胞凋亡信号通路[19-20]。
综上所述,大黄酚通过抑制氧化应激和AIF 核转位,改善H2O2诱导的EA. hy926 细胞凋亡,提示大黄酚有助于治疗BPD。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:李思琪参与实验操作、数据统计学分析和论文撰写,陈广道参与实验设计、论文指导和审校,曾其毅参与研究选题。
[参考文献]
[1] 中华医学会儿科学分会新生儿学组, 中华儿科杂志
编辑委员会. 早产儿支气管肺发育不良临床管理专家
共识[J]. 中华儿科杂志, 2020, 58(5): 358-365.
[2] VOYNOW J A. “New” bronchopulmonary dysplasia
and chronic lung disease[J]. Paediatr Respir Rev, 2017,
24: 17-18.
[3] 魏文新,梅花,刘春枝,等. miR-876-3p在高氧诱导新
生大鼠支气管肺发育不良模型中的表达分析[J]. 中国
小儿急救医学,2023,30(1): 57-61.
[4] 杨 威, 陈运彬, 王文建, 等. 骨髓间充质干细胞外泌
体在高氧诱导的新生大鼠支气管肺发育不良模型中的
修复作用[J]. 广东医学, 2023, 44(8): 962-969.
[5] 卢红艳, 张 婷, 王秋霞, 等. 内质网应激相关的蛋白
激酶R样内质网激酶-转录活化因子4-CCAAT/增强子
结合蛋白同源蛋白通路参与支气管肺发育不良大鼠肺
细胞凋亡[J]. 中华实用儿科临床杂志, 2015, 30(4):
305-309.
[6] 郑 瑜, 厉 兰, 胡绘平, 等. 自噬体及凋亡小体对新
生小鼠支气管肺发育不良调控作用[J]. 河北医科大学
学报, 2020, 41(11): 1296-1300.
[7] 曾 玥, 罗思晴, 马鑫喆, 等. N-甲基-4-异亮氨酸环孢
素通过抑制线粒体通透性转换孔减轻凋亡诱导因子的
核易位和细胞凋亡[J]. 宁夏医科大学学报, 2022,
44(7): 663-668, 676.
[8] 尹玲玲, 唐丽君, 黄为民. 大黄对新生大鼠支气管肺发
育不良的保护作用[J]. 中华实用儿科临床杂志, 2019,
34(1): 60-63.
[9] 郭 亮, 叶贞志, 唐丽君, 等. 大黄对氧应激诱导大
鼠新型支气管肺发育不良的保护作用研究及机制
探讨[J]. 国际医药卫生导报, 2019, 25(15):
2414-2416, 2436.
[10]王亦君, 冯舒涵, 程锦堂, 等. 大黄蒽醌类化学成分和
药理作用研究进展[J]. 中国实验方剂学杂志, 2018,
24(13): 227-234.
[11]SONG G H, ZHANG Y, YU S P, et al. Chrysophanol
attenuates airway inflammation and remodeling through
nuclear factor-kappa B signaling pathway in asthma[J].
Phytother Res, 2019, 33(10): 2702-2713.
[12]丁悦, 黄为民, 唐丽君. 人EGFL7真核表达载体的构
建及稳定转染EA.hy926细胞系的建立[J]. 现代医学
与健康研究(电子版), 2022,6(23): 1-4.
[13]章良, 孙浩博, 杜和坤, 等. miR-26a-5p对H2O2诱导
的EA.hy926血管内皮细胞损伤的影响[J]. 山西医科
大学学报,2023,54(8): 1083-1091.
[14]GILFILLAN M, BHANDARI A, BHANDARI V.
Diagnosis and management of bronchopulmonary
dysplasia[J]. BMJ, 2021, 375: n1974.
[15]ZHANG X Y, XU J, WANG J J, et al. Reduction of
microRNA-206 contributes to the development of
bronchopulmonary dysplasia through up-regulation of
fibronectin 1[J]. PLoS One, 2013, 8(9): e74750.
[16]李 娟, 蔡 成, 龚小慧, 等. 长链非编码RNA
MALAT1与细胞凋亡诱导因子在早产儿支气管肺发育
不良中表达及意义[J]. 临床儿科杂志, 2019, 37(8):
583-586.
[17]ORNING P, LIEN E. Multiple roles of caspase-8 in cell
death, inflammation, and innate immunity[J]. J Leukoc
Biol, 2021, 109(1): 121-141.
[18]白丹, 阴怀清, 武师润, 等. 高胆红素血症新生大鼠
脑组织凋亡诱导因子、细胞色素C表达的实验研究[J].
中西医结合心脑血管病杂志, 2023, 21(15):
2785-2789.
[19]BANO D, PREHN J H M. Apoptosis-inducing factor
(AIF) in physiology and disease: the tale of a repented
natural born killer[J]. EBioMedicine, 2018, 30: 29-37.
[20]MONDAL A, ROBERGE J, GILLERAN J, et al.
Bone morphogenetic protein inhibitors and mitochondria
targeting agents synergistically induce apoptosis-inducing
factor (AIF) caspase-independent cell death in lung
cancer cells[J]. Cell Commun Signal, 2022, 20(1): 99.

