2024年诺贝尔生理学或医学奖:微RNA开创基因调控新纪元

从RNA到微RNA
对于大多数人来说,微RNA可能是一个陌生的概念,但它在我们的生命活动中扮演着至关重要的角色。
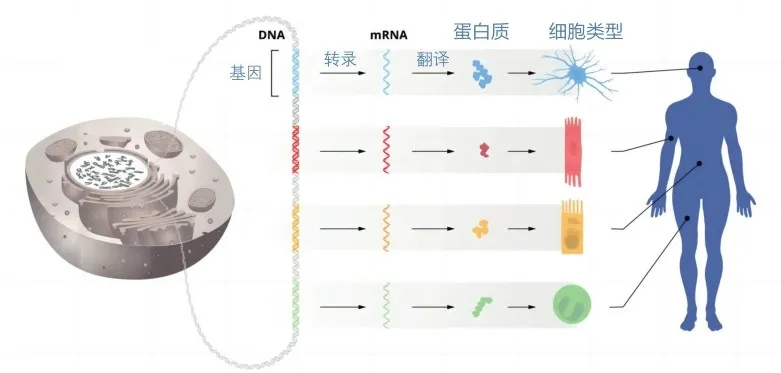
根据分子生物学的“中心法则”,生命物质(如蛋白质)的遗传和合成遵循一个明确的流程:DNA(脱氧核糖核酸)转录成RNA,RNA随后翻译成蛋白质。蛋白质不仅参与这一过程,还协助DNA进行自我复制。简而言之,DNA中的遗传信息通过RNA的转录过程,最终编码成蛋白质。
人体组织由多种不同的细胞构成,如肌肉细胞、神经细胞等,它们各自执行着独特的功能,这些细胞的功能差异源于基因调控。基因调控确保每个细胞只激活与其功能相关的基因。例如,肌肉细胞的主要功能是收缩,它们通过收缩产生力量,实现身体的运动;而神经细胞负责传递大脑与神经元之间的信息。微RNA是一种非编码RNA,它是基因调控的关键,其长度仅为21~23个核苷酸,因此以“微”称之是十分贴切的。安布罗斯和鲁夫昆的开创性发现表明微RNA在基因调控中发挥着关键作用,能够间接或直接参与基因表达。微RNA通过与信使RNA(mRNA)互补配对,可以下调基因的表达,如抑制翻译、促进mRNA剪切和脱腺苷化等过程。这一发现揭示了一种全新的基因调控机制,对于人类及其他多细胞生物具有重要意义。
在分子遗传学的开创阶段,科学家发现的生物学原则是遗传信息从DNA传递到RNA,再编码产生蛋白质。然而,在20世纪60年代,科学家发现,被称为转录因子的特殊基因可以与DNA中的特定区域结合,并控制基因转录成mRNA的过程,从而调控遗传信息的表达,进而生成特定的蛋白质。随着时间的推移,研究人员鉴定出了数千种转录因子,人们曾认为基因调控的主要原理已经得到解决,而微RNA的发现扩展了我们对基因调控机制的理解,揭示了一个更为复杂和精细的调控网络。
新的基因调控机制
在20世纪80年代,安布罗斯和鲁夫昆通过实验研究揭示了一个重要的生物学现象:尽管人体内所有细胞的DNA都存储着相同的遗传信息,但为了适应不同的功能需求,必须精确调控基因的活性,确保特定的基因组在特定细胞类型中被激活。
通过对秀丽隐杆线虫的研究,安布罗斯和鲁夫昆发现了两种突变基因—lin-4和lin-14。这两种基因在发育过程中的激活时间不同,导致了遗传程序的缺陷。此外,安布罗斯先前的研究已经表明,lin-4可能是lin-14的抑制因子,但lin-14活性的阻断机制尚不明确。
随后,在哈佛大学新成立的实验室中,安布罗斯对lin-4进行了深入分析,发现 lin-4产生了一种非常短的RNA分子(后被称为微RNA),这种分子并不编码蛋白质。这一发现提示科学家,lin-4产生的微RNA可能是抑制lin-14的关键因素。与此同时,在美国麻省总医院和哈佛医学院新成立的实验室中,鲁夫昆对lin-14的调控机制进行了研究。他发现lin-4并没有减少lin-14的mRNA的产生,而是在基因表达的后期阶段,通过抑制蛋白质的形成来实现调控。在实验中,鲁夫昆还观察到lin-14的mRNA中有一个特定的片段,对于lin-4发挥其抑制作用至关重要。
安布罗斯和鲁夫昆彼此分享并比较了他们的研究成果,最终得出了一个革命性的结论:lin-4的微RNA与lin-14的mRNA的特定片段具有互补性,这种互补序列的匹配是lin-4抑制lin-14活性的分子机制。
在后续的实验中,安布罗斯和鲁夫昆进一步发现,lin-4的微RNA通过与lin-14的mRNA中的互补序列结合,关闭了lin-14的基因表达,从而阻断了lin-14蛋白的产生。可以说,他们发现了由一种之前未知的RNA类型—微RNA及其介导的一种全新的基因调控机制。1993年,这些开创性的研究成果以两篇论文的形式在《细胞》杂志上公开发表。
然而,如同所有新发现和新生事物一样,最初科学界对此保持了沉默。这一发现与传统的从DNA到RNA,再到蛋白质的遗传信息流路径不同,一些研究人员甚至认为这可能只是秀丽隐杆线虫特有的基因调控现象,可能并不适用于人类和其他更复杂的动物。
转机出现在2000年,鲁夫昆的研究团队发现了由let-7基因编码的另一种微RNA。随后,其他研究人员也陆续发现了多种微RNA,并揭示了单个微RNA可以调节多个不同基因的表达,而单个基因也可能受到多个微RNA的调控,从而协调整个基因网络。这些发现逐渐改变了科学界的看法。
现在,科学家已经知道,人类基因组编码了超过1000个微RNA,它们在基因调控中发挥着重要作用。这证明了微RNA基因调控是一个全新的维度,并且这一调控机制在多细胞生物中是普遍存在的。
微RNA的应用价值
1998年诺贝尔生理学或医学奖得主路易斯·伊格纳罗博士曾强调:诺贝尔奖的科学成果不应仅仅被珍藏,而应普及至大众,以惠及社会。那么,微RNA的发现具有哪些现实意义呢?
简而言之,微RNA在生物体的发育和功能中扮演着关键角色,它不仅能够揭示多种疾病的机理,还能用于疾病的治疗、疫苗和药物的研发,甚至在农业领域也大有可为,科学家可以通过微RNA调控作物生长,从而提高产量。
微RNA的基因调控机制在自然界中已存在数亿年,它使得生物体得以更精细地进化。在人类这一复杂高级的生物体中,微RNA发挥着不可或缺的作用。没有微RNA的调控,人类的神经细胞无法发育成大脑,肌肉细胞也无法形成肌肉。
此外,微RNA的研究已经扩展到了疾病诊断和治疗领域。例如,let-7是科学家研究得最为深入的微RNA之一,研究表明,与正常细胞相比,它在多种肿瘤细胞中的表达水平较低。因此,let-7能够靶向HMGA2蛋白,抑制细胞增殖,从而发挥抑癌作用,有助于癌症的预防和治疗。此外,let-7的表达水平与细胞分化程度成反比,这使得它有望成为低分化肿瘤的生物标志物,为癌症的诊断和治疗提供了新的线索。最新的研究还发现,let-7与食道癌的放化疗敏感性密切相关,为食道癌的治疗提供了新的方向。
除了癌症,微RNA还与多种疾病存在关联。事实上,微RNA的突变已被证实可导致一系列先天性疾病,包括听力损失、视力障碍以及骨骼疾病。此外,与微RNA相互作用的蛋白质发生突变,还可能引发胸膜肺母细胞瘤家族性肿瘤易感综合征(DICER1),这是一种罕见但严重的疾病,它增加了患者罹患多种癌症的风险。因此,通过调节微RNA的活性,我们有望预防和治疗多种类型的癌症。
微RNA的应用潜力在生物医药产业中也扮演着重要角色,并有望在未来发挥更大的作用。通过利用微RNA,科学家们正在研发多种新药物和疫苗,以治疗肝炎、癌症等各类疾病。例如,在丙型肝炎病毒感染过程中,肝脏会释放出一种名为微R-122的特殊微RNA,它与大多数微RNA不同,它发挥的是激活作用而非抑制作用,可增强丙肝病毒相关基因的表达,加剧感染。因此,通过抑制微R-122的活性,便有可能令丙型肝炎患者恢复健康。丹麦的一家制药公司已经开发了一种名为Miravisen的药物,这是一种微R-122拮抗剂,专门用于治疗丙型肝炎。Miravisen已经成功通过了I期和II期临床试验,临床试验结果表明,该药物在人体内是安全的,并且能够有效降低丙肝病毒的表达水平。

在农业领域,微RNA展现出了巨大的增产潜力。它几乎参与了植物生长发育和新陈代谢的每一个环节,从叶片的发育和形成(涉及微R156、微RNA165/166、微R319等),到气孔的发育(与微R824相关),再到侧根的形成(与微R164相关),以及从营养生长向生殖生长的转变(与微R172相关)和花的发育过程中(与微R172、微R159相关),微RNA都扮演着关键角色。此外,作物在面对不良环境条件,如病害、干旱、高温、高盐、营养缺乏等时,其机体内微RNA的表达也会发生异常变化。这表明,微RNA在农作物性状改良和逆境适应性方面,是遗传育种和生产中的潜在靶标。例如,水稻的抗寒能力就与微R319密切相关,通过调控微R319,我们有望提高水稻在寒冷地区的产量。
在日常生活中,微RNA同样发挥着重要作用。研究人员发现,皮肤衰老与微RNA的表达密切相关。微R29a和微R34a这两种微RNA在衰老皮肤中的表达量显著增加,其中微R29a与真皮层的胶原蛋白水平紧密相关,而微R34a与β-连环蛋白有关。此外,微R-203作为表皮状态的分子标记,其表达水平与表皮干细胞的活性相关。利用这些稳定的分子标记,我们可以开发新的护肤品,通过调节微RNA来促进真皮层产生更多蛋白质,从而实现抗衰老、增强皮肤弹性、减轻皱纹等效果,使人们焕发青春光彩。
微RNA的潜力正逐渐被发掘,它们在多个领域展现出巨大的应用前景。从在医学上为疾病治疗提供新策略到提高作物的产量和抗逆性,再到在美容护肤中延缓皮肤衰老,微RNA正以其独特的方式改善我们的生活。随着科技的不断进步,我们有理由相信,这些微小分子将在未来的科学研究和实际应用中发挥更加重要的作用,为人类带来更多的福祉。

维克托·安布罗斯
维克托·安布罗斯(Victor Ambros),1953年出生于美国新罕布什尔州汉诺威。1979年从美国麻省理工学院获得博士学位,1979—1985年在麻省理工学院做博士后研究。他于1985年成为哈佛大学的首席研究员。1992年至2007年,他任美国达特茅斯医学院教授,目前是美国麻省理工学院医学院的教授。

加里·鲁夫昆
加里·鲁夫昆(Gary Ruvkun),1952年出生于美国加利福尼亚州伯克利市。1982年,他在美国哈佛大学获得生物物理学博士学位,于1985年成为美国麻省总医院和哈佛大学医学院的首席研究员,目前是该校遗传学教授。
【责任编辑】张小萌

