火龙果果实心腐病病原鉴定及初始侵染点研究



摘要 为了有效防控火龙果心腐病,以田间果实心腐病分离菌株为材料,采用ITS 基因序列分析以及室内、田间活体接种方法,对病原菌进行鉴定,并确定初始侵染点及病原菌生物学特性。结果显示,火龙果心腐病在田间导致部分幼果黄化脱落或幼果果皮提前转红,果实内部褐变腐烂。经分离、鉴定明确所获得的致病菌株为桃吉尔霉Gilbertella persicaria。病原菌的初始侵染点为雌花的柱头,孢囊孢子可直接或通过花粉带菌定殖在雌花柱头上,随着授粉授精、果实发育造成心腐。病原菌的最适生长温度为30 ℃,最适pH 为5,光照不利于产孢。以上结果表明,桃吉尔霉可通过侵染柱头引起火龙果心腐病。建议在授粉后及时割除花瓣或进行药剂防治,减少初侵染源量从而减轻桃吉尔霉对火龙果果实的为害。
关键词 火龙果; 心腐病; 桃吉尔霉; 侵染点; 定殖
中图分类号 S436.6 文献标识码 A 文章编号 1000-2421(2024)06-0253-08
火龙果属仙人掌科(Cactaceae)量天尺属(Hylo⁃cereus spp.)或蛇鞭柱属(Seleniereu spp.)植物[1],起源于墨西哥、中美洲以及南美洲[2],在我国海南、广东、广西、云南、贵州等地均有大面积栽培[3]。火龙果果实营养丰富、功能独特,具有较高经济价值、营养价值和药用价值,市场前景广阔[4]。但是,火龙果在高温高湿的气候环境下,易受病原菌侵染,影响火龙果的品质和产量。目前,国内外记载的侵染火龙果果实的病原菌有Enterobacter cloacae[5]、Gilbertellapersicaria[6]、Collectotrichum gloeosporioides[7]、Bipo⁃laris cactivora[8]、Neoscytalidium dimidiatum[9]等,可引起果实软腐病、果腐病、溃疡病和湿腐病等,但尚未见火龙果心腐病方面的报道。早在2013 年,广东省多个火龙果园发现火龙果心腐病,因发生率较低,未引起重视;2018 年9 月初,广州市从化区的火龙果种植基地红肉、白肉和双色品种均有心腐病发生,如‘红冠1 号’‘红冠2 号’‘双色1 号’等,整个产果季均有发病,其中9-11 月为发病高峰期,田间发病率约为10%。
果实心腐病的病因一般有2 类:一种是环境、营养、激素等因素导致代谢失调引起的生理性病害,如Larrigaudière[10]报道梨黑心病,因受到冷胁迫或二氧化碳胁迫而形成的水浸状褐变,果心呈黑褐色,组织塌陷形成空腔等;另一类是由病原菌侵染导致的侵染性病害,如苹果霉心病[11]、菠萝心腐病[12]、枇杷心腐病[13]、桃心腐病[14]和石榴心腐病[15]。目前,多数研究主要集中在心腐病病情分布、侵染性病害的病原菌鉴定和防治方法等领域,而关于心腐病侵染点和侵染方式报道较少,仅苹果霉心病有较为系统的研究,并有研究者推测带菌的螨虫可能是苹果霉心病的传播介体[16]。
火龙果心腐病是一种新发病害,严重影响火龙果产量和品质,为了减少此病害导致的损失,本研究通过植物病理学方法明确火龙果心腐病的病因,确定病原菌的初始侵染位点和生物学特性,以期为病害的田间防控提供参考。
1 材料与方法
1.1 病原菌分离
在广东省广州市从化火龙果基地采集发病‘红冠1 号’和‘红冠2 号’火龙果果实,在病健交界处切取大小为5 mm × 5 mm 的组织块,采用组织分离法[17]分离病原菌,通过单孢分离得到纯培养物。
1.2 接种方法和初始侵染位点确定
1)离体接种。田间随机采摘花后13 d 的健康‘红冠1 号’火龙果幼果,用75% 乙醇擦拭果面及果顶进行消毒,利用注射器自果实果顶注射接种浓度为1×106 个/mL 孢子悬浮液1 mL,以注射接种1 mL无菌水作为对照。于28 ℃下保湿培养3 d,观察和记录发病情况。每次接种5 个果实,重复3 次。
2)活体接种和初始侵染位点确定。①柱头接种:‘红冠1 号’火龙果开花后12 h,田间向花柱孔口分别滴入500、100 μL 和用毛笔涂抹柱头3 次孢子悬浮液(浓度1×105 个/mL);以滴入或涂抹等量无菌水为对照,套袋保湿24 h 后剪掉花瓣,各处理分别随机选取同一天开放、长势一致的火龙果花30 朵进行接种。每隔2 d 观察和记录接种果实的发病情况,统计发病率,每个处理重复3 次。②花粉接种:于授粉日晚上,收集‘红冠2 号’火龙果花粉,将病原菌孢囊孢子与花粉分别以每克花粉0.6×105 个和1.2×105个孢囊孢子的比例充分混匀,用毛笔在‘红冠1 号’火龙果的柱头上涂抹花粉与孢子混合物3~5 次,以涂抹不含病原菌孢囊孢子的花粉为对照,套袋保湿24 h后剪掉花瓣。接种数量和统计处理同“① 柱头接种”;③果顶接种:于‘红冠1 号’火龙果开花后第5天,在田间用毛笔蘸孢子悬浮液(浓度1×105个/mL)涂抹果顶3 次,对照组涂抹3 次无菌水,接种后套袋保湿24 h。各处理分别随机选取长势一致的火龙果果实30 个,每2 d 观察和记录接种果实的发病情况,统计发病率,重复3 次。
1.3 病原菌鉴定
1) 病原菌形态学鉴定。将经单孢分离得到纯培养物接种于PDA 培养基上,26 ℃培养2~3 d,观察病原菌的菌落形态和显微形态并拍照。同时,测量孢子囊的直径、囊轴的纵横径以及孢囊孢子的大小[18];用1% 亚甲基蓝染色液将孢囊孢子染色,以观察孢囊孢子的附属丝[19]。
2) 病原菌ITS 序列扩增。用TaKaRa 基因组DNA 提取试剂盒提取真菌DNA。分别用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′) 对序列进行扩增。PCR 反应体系(25 μL):DNA 模板1 μL,上下游引物各1 μL(10 μmol/L),2×Taq MasterMix 12.5 μL,ddH2O 9.5 μL。ITS 扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,共30 个循环;最后72 ℃延伸10 min。PCR产物委托华大基因(深圳)股份有限公司纯化和测序,将测序结果上传至NCBI 数据库(http://www.ncbi.nlm.nih.gov)进行Blast 分析。
1.4 病原菌对温度、pH值和光照敏感性测定
将菌饼(直径d=5 mm)接种至培养基中,置于不同培养环境中,待有菌落直径达到7.0 cm 左右时,用十字交叉法测量菌落直径,培养24 h 后统计产孢量,每个处理重复5 次。分析温度、pH 值和光照对病原菌菌丝生长和产孢的影响。
1)温度敏感性测定。将病原菌接种到PDA 培养基后,分别置于14、18、22、26、30、34、38 和42 ℃下恒温避光培养。
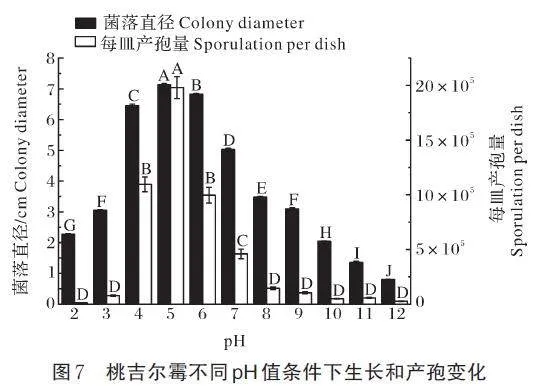
2)pH 值敏感性测定。用HCl 和NaOH 调节PDA 培养基的pH 值。将病原菌接种至pH 值2、3、4、5、6、7、8、9、10、11 和12 的PDA 培养基上,最适温度避光培养。
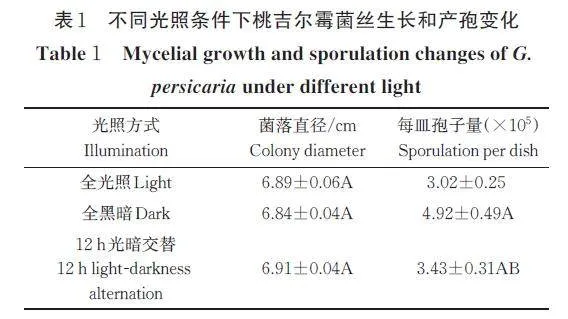
3)光照敏感性测定。将病原菌接种至PDA 培养基,分别置于全光照、全黑暗、光暗交替(12 h 光/12 h暗)的培养箱内,最适温度和pH 下培养。
1. 5 数据分析
采用Excel 2007、SPSS 25.0 和 Origin 2021 软件进行统计分析及图表制作,MEGA-X 软件中邻接法(neighbor-joining,NJ)构建系统发育树,应用邓肯氏新复极差检验法(DMRT 法)进行差异显著性分析。
2 结果与分析
2.1 心腐病田间症状
火龙果心腐病自幼果期开始感病,田间发病症状表现可分为2 类。第一类:开花后7 d 左右幼果黄化、脱落,剖开后果肉变褐(图1A,B);第二类:果实发育受阻,果面提前转红,剖开后内部果肉褐色或深褐色腐烂(图1C~E),若幼果发病严重,病原菌随着果实发育不断由内而外扩展,果实外表皮局部黄化,后呈现水浸状腐烂,剖开后果肉内部呈深褐色腐烂(图1F,G)。由图1 可见,感病果实均表现典型的心腐症状。分离10 个心腐病病果,共76 个组织块,获得47 个菌株,包括曲霉属(Aspergillus sp.)、镰孢菌属Fusarium sp.)、平脐蠕孢属(Bipolaris sp.)、刺盘孢属(Colletotrichum sp.)和吉尔霉属(Gilbertella sp.),其中吉尔霉分离频率最高达39.5%,确定为优势菌株,命名为HLGXF。
2.2 致病性测定
1) 离体接种。离体注射接种3 d 后,接种果实幼果外果皮局部转红,果面未见病斑,注射无菌水的果实(CK)表面未见明显变化(图2A),剖开后可见接种果实内部呈褐色,而对照果实不发病(图2B)。对发病组织进行再分离,得到与原分离菌株相同的病原菌,符合柯赫氏法则,证明HLGXF 为火龙果果实心腐病的致病菌。
2)病原菌田间接种。采用柱头涂抹孢子悬浮液和用带菌花粉涂抹柱头的方式进行田间接种。接种8~10 d 后果实陆续发病,且发病症状与田间发病症状相同,部分幼果黄化脱落,而未脱落的幼果表现为果实发育受阻、剖开后果肉变褐。通过柱头接种病原菌的处理在接种后10 d 果皮提前转红,剖开后果肉内部褐化腐烂(图3A),通过花粉接种病原菌的处理发病进程较柱头接种的慢1~2 d,接种后16 d 未脱落的幼果果皮未提前转红,但果肉的果顶处出现褐变(图3C)。柱头和花粉无菌水处理的对照均未发病(图3B,D)。
2.3 病原菌初始侵染点
柱头滴入500 μL 孢子悬浮液的处理,于接种后48 h 火龙果子房腐烂,未发育成果实。柱头滴入100μL 孢子悬浮液的处理果实早期生长发育正常,于接种后第8 天开始陆续发病,55.6% 的接种幼果黄化,剖开后内部呈现褐色腐烂;11.1% 的果实果皮转红未脱落,剖开后可见果实内部呈褐色腐烂,总发病率为66.7%。柱头涂抹3 次孢子悬浮液的处理,于接种后第8~10 天果实开始陆续发病:9.1% 的幼果黄化,剖开后可见内部呈现褐色腐烂;72.8% 果实的果面转红,果实未脱落,剖开后内部表现心腐病病状,总发病率为81.9%。用带菌花粉(每克花粉1.2×105 个孢囊孢子)涂抹雌蕊柱头,9 d 后陆续发病,76.5% 的果实黄化,剖开后可见果实内部腐烂;接种16 d 后剖开未脱落的果实,5.9% 的果实表现心腐,总发病率为82.4%;用带菌花粉(每克花粉0.6×105 个孢囊孢子)涂抹雌蕊柱头,9 d 后陆续发病,31.3% 的幼果黄化,剖开后果实内部表现心腐病病状,接种16 d 后剖开未脱落果实,18.8% 的果实表现心腐,总发病率为50.1%。向授粉5 d 后幼果的果顶涂抹桃吉尔霉孢子悬浮液,接种果实直至成熟未表现心腐症状,表明桃吉尔霉不能通过定殖在健康幼果的果顶导致心腐。以上接种方式的空白对照均未发病。
由此可见,桃吉尔霉孢囊孢子可直接或通过花粉带菌定殖在柱头上,依靠柱头的水分和营养物质萌发芽管,进而延长成菌丝侵入子房,随着果实发育,菌丝不断扩展造成果实内部腐烂;定殖在柱头的孢囊孢子数量影响为害程度,孢子量多为害迅速且严重,导致花脱落或者幼果黄化脱落,孢子量少果实果面提前转红,不脱落,果实内部呈褐色腐烂状,较接近田间发病症状。
2.4 病原菌的鉴定
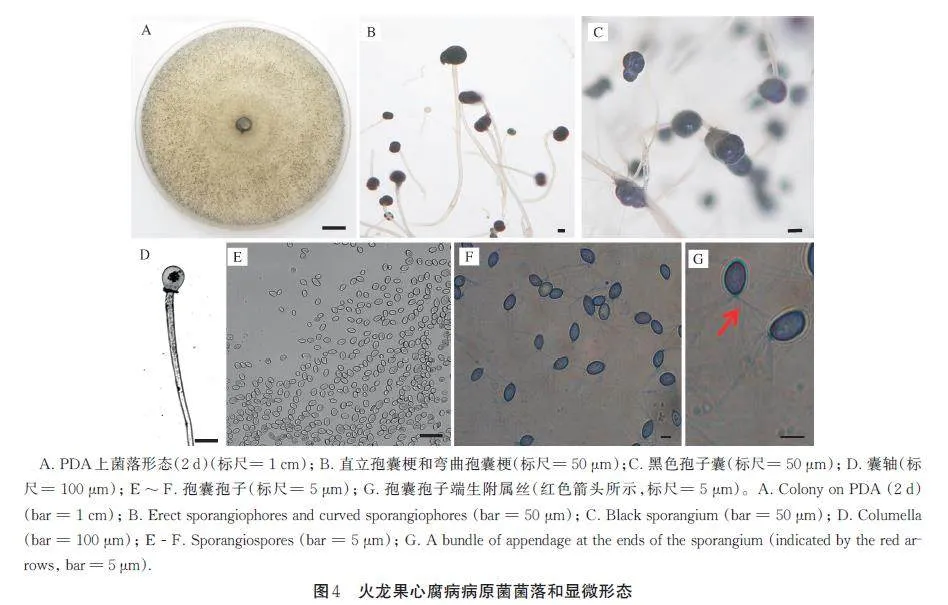
1) 病原菌形态。HLGXF 菌株在PDA 平板上,菌落呈圆形、扩展,菌丝致密,30 ℃培养2 d 后,菌落表面可见大量黑色孢子囊(图4 A)。菌丝体无假根和匍匐菌丝。孢囊梗浅褐色,多数直立,少数弯曲,无分枝,顶端产生1 个黑色球形孢子囊,直径101.66~176.20 μm,平均135.43 μm(图4B,C)。囊轴呈卵形、无色,大小为(67.35~147.56) μm×(44.91~119.62) μm,孢子囊壁破裂时留有囊领(图4D)。孢囊孢子卵圆形或短椭圆形(图4E)。卵圆形孢囊孢子的直径为5.43~10.00 μm,平均8.45 μm;椭圆形孢囊孢子的大小为(7.70~13.78) μm×(5.65~9.05) μm,平均9.96 μm×7.16 μm。经染色可清楚观察到孢囊孢子两端有一束附属丝(图4F,G)。根据病原菌的培养特性和形态特征,初步鉴定为接合菌门、接合菌纲、毛霉目、笄霉科、吉尔霉属。
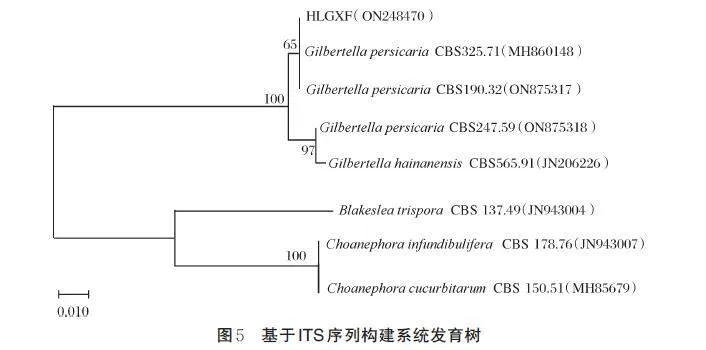
2)病原菌ITS序列分析。以HLGXF菌株的基因组DNA为模板,通过ITS引物进行PCR扩增,测序后得到长度为648 bp的序列。将测序结果提交至NCBI数据库(登录号为ON248470),经Blast 分析,菌株HLGXF 与G. persicaria 序列相似度为99.84%。从GenBank 中选取基因序列进行系统发育分析,构建系统发育树,系统发育树每个分支的支持强度都通过1 000 次重复的自展检验数值进行评估。结果发现,菌株HLGXF 与G. persicaria 聚为一个进化支(图5)。
结合形态学分析,可确定病原菌为毛霉目、笄霉科、吉尔霉属、桃吉尔霉G. persicaria。
2.5 温度、pH值和光照对病原菌生长的影响
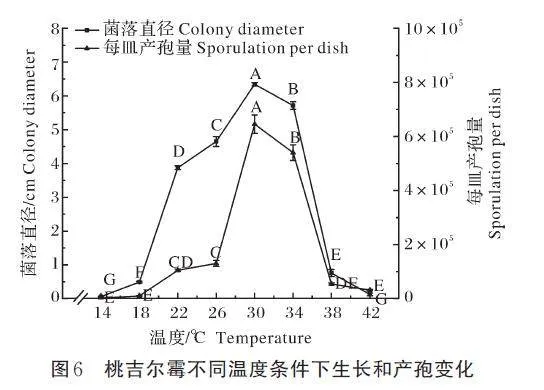
病原菌在14~42 ℃条件下均能生长和产孢,有较广的温度适应范围,其中最适温度均为30 ℃。在30 ℃恒温条件下避光培养,18 h 后菌落直径可达6.35 cm,24 h 后产孢可达6.46×105 个/皿,菌丝生长速率和产孢速率极显著高于其他温度(P=0.01)。在低于14 ℃或高于42 ℃的温度下,菌丝不能生长或产孢(图6)。
病原菌菌丝在pH值为2~12均能生长和产孢,其中最适pH 均为5。在30 ℃避光条件下,于pH 为5 的PDA 上培养桃吉尔霉,18 h 后菌落直径可达7.14 cm,24 h 后产孢可达1.98×106 个/皿,菌丝生长速率和产孢速率极显著高于其他pH 值(P=0.01)。在pH 为5和6 时,菌丝致密且边缘整齐,气生菌丝发达(图7)。
在连续光照、连续黑暗和12 h 光暗交替的条件下,病原菌的菌丝生长速率无显著性差异。黑暗有利于病原菌产孢,产孢量为4.92×105 个/皿,极显著高于光照培养下的产孢量(P=0.01)(表1)。
3 讨论
Guo 等[20]和林珊宇等[21]报道桃吉尔霉主要侵染成熟火龙果,引起采后贮藏期果实腐烂;林筑蘋等[22]报道桃吉尔霉可感染花器造成花苞水浸状腐烂;郑樊等[23]关于桃吉尔霉在田间为害症状的报道比较全面,认为桃吉尔霉可为害火龙果花瓣、鳞片、幼果和成熟果实,造成整个花冠和鳞片的软腐,发病部位初期产生水渍状病斑。以上研究均未提及桃吉尔霉可引起幼果的心腐病。郑樊等[23]认为幼果发病引起果肉变为暗褐色软腐状,病原菌是先引起果面水渍状软腐,进而向内扩展到幼果内部;而本研究通过柱头和花粉接种实验证实了桃吉尔霉也可以通过花器官带菌侵入果实内部,导致心腐,并由内而外扩展,进而引起果实表面的软腐;用1×105 个/mL 的孢子悬浮液涂抹果顶的接种方式,果实未表现心腐症状,说明桃吉尔霉不会通过果顶侵入引起果实心腐,但是果顶接种也未引起软腐,与郑樊等[23]报道不一致,主要原因是桃吉尔霉的接菌量和田间湿度不足,如果增加接种浓度和湿度,是否会导致果顶的软腐有待进一步研究。本研究对桃吉尔霉为害火龙果有了更全面的认知。
本研究中用桃吉尔霉孢囊孢子直接接种柱头和带菌花粉授粉的接种方式确定桃吉尔霉导致果实心腐的初始侵染位点。桃吉尔霉可以在柱头上定殖,依靠柱头的水分和营养物质萌发侵入子房,造成火龙果心腐病,但是定殖在柱头的孢囊孢子的量影响为害症状,如接种1×105 个/mL 桃吉尔霉孢囊孢子悬浮液500 μL 后,病原菌对花器官为害严重,导致果实授粉不成功,未发育就腐烂脱落;但是柱头涂抹3 次孢子悬浮液可以使授粉成功的火龙果在果实发育的不同阶段呈现典型的心腐症状,与田间发病症状相似。定殖在柱头的孢囊孢子在什么范围内,可引起火龙果典型的心腐病有待于进一步研究。
通过对温度、酸度和光照敏感性分析,本研究认为桃吉尔霉喜酸、耐高温,全黑暗有利于其产孢,该病原菌对温度和pH 适应性的研究结果与前人较为相似,而对光照的敏感性未有一致结论。郑樊等[23]认为连续光照最有利于菌丝生长,而Guo 等[6]证明黑暗为其最适生长条件,本研究通过实验证明,光照条件对菌丝生长无显著影响,但是对病原菌产孢有显著影响,全黑暗培养条件有利于病原菌产孢。造成差异的原因可能是菌株的来源不同。火龙果开花结果时正值高温高湿环境,有利于桃吉尔霉在田间生长繁殖。火龙果授粉后,萎蔫的花瓣上产生的大量孢囊孢子是主要初侵染来源,带菌的花瓣若接触到健康果实,会引起果实表面水渍状软腐;花瓣上的孢囊孢子侵染花柱头,可引起火龙果内部腐烂,或提前黄化落果,或提前转红心腐,建议在授粉后及时割除花瓣或进行药剂防治,减少初侵染源量从而减轻桃吉尔霉对火龙果果实的为害。
参考文献 References
[1] 曾建飞. 中国植物志: 第五十二卷第一分册[M]. 北京:科学出版社, 1999:282.ZENG J F.Flora of China:volume 52 section1[ M].Beijing:Science Press, 1999:282(in Chinese).
[2] LE BELLEC F,VAILLANT F,IMBERT E.Pitahaya( Hy⁃locereus spp.):a new fruit crop,a market with a future[J].Fruits,2006,61(4):237-250.
[3] 赵玉山. 我国火龙果产量跃居全球第一[J]. 中国果业信息2023,40(2):52.ZHAO Y S.The output of pitaya in China hasjumped to the top in the world [J].China fruit news, 2023,40(2):52(in Chinese).
[4] 黄凤珠,陆贵锋,黄黎芳,等. 火龙果种质资源收集保存与初步评价[J]. 西南农业学报,2016,29(4):920-924.HUANG FZ,LU G F,HUANG L F,et al.Collection and evaluation ofpitaya germplasm resources[J].Southwest China journal of agriculturalsciences,2016,29(4):920-924 (in Chinese withEnglish abstract).
[5] 林武镇,廖富荣,陈细红,等. 火龙果细菌性软腐病菌的分离与鉴定[J]. 植物病理学报,2015,45(2):220-224.LIN W Z,LIAO F R,CHEN X H,et al. Isolation and identification ofthe pathogen causing soft rot in Hylocereus undatus[J]. Actaphytopathologica sinica,2015,45(2):220-224 (in Chinesewith English abstract).
[6] GUO L W,WU Y X,HE H X,et al.A new fruit rot disease inHylocereus costaricensis in Yunnan Province of China[J].Journalof fruit science,2014,31(1):111-114.
[7] 朱迎迎,李敏,高兆银,等. 火龙果炭疽病病原菌的鉴定及生物学特性研究[J]. 南方农业学报,2016,47(1):59-66.ZHUY Y,LI M,GAO Z Y,et al.Identification and biological characteristicsof anthracnose pathogen from pitaya(Hylocereus un⁃dulatus)[J].Journal of southern agriculture,2016,47(1):59-66( in Chinese with English abstract).
[8] 刘月廉,周娟,赵志慧,等. 广东省火龙果腐烂病病原鉴定[J].华中农业大学学报,2011,30(5):585-588.LIU Y L,ZHOUJ,ZHAO Z H,et al.Identification of pathogen causing fruit rotof Hylocereus undatus in Guangdong Province[J]. Journal ofHuazhong Agricultural University,2011,30(5):585-588 (inChinese with English abstract).
[9] 张荣,刘爱媛,白成艳,等. 火龙果溃疡病的症状观察和病原菌鉴定[J]. 果树学报,2013,30(5):854-856.ZHANG R,LIUA Y,BAI C Y,et al.Symptom observation and pathogen identificationon canker disease of pitaya[J]. Journal of fruit science,2013,30(5):854-856 (in Chinese with English abstract).
[10] LARRIGAUDIÈRE C,LENTHERIC I,PUY J,et al. Biochemicalcharacterisation of core browning and brown heartdisorders in pear by multivariate analysis[J].Postharvest biologyand technology,2004,31(1):29-39.
[11] DAI P B,JIANG Y Y,LIANG X F,et al.Trichothecium rose⁃um enters‘ fuji’ apple cores through stylar fissures[J]. Plantdisease,2020,104(4):1060-1068.
[12] VIGNASSA M,MEILE J C,CHIROLEU F,et al.Pineapplemycobiome related to fruitlet core rot occurrence and the influenceof fungal species dispersion patterns[J/OL]. Journal offungi,2021,7(3) :175[2023-11-10]. https://doi. org/10.3390/jof7030175.
[13] 林雄杰,王贤达,范国成,等. 枇杷心腐病病原菌鉴定及其防治药剂室内毒力测定[J]. 植物保护学报,2016,43(5):828-835.LIN X J,WANG X D,FAN G C,et al.Identification ofthe pathogen of loquat core-rot disease and laboratory toxicitytest of fungicides[J].Journal of plant protection,2016,43(5):828-835( in Chinese with English abstract).
[14] MUKHTAR I,QUAN X,CHOU T,et al.First report of Tal⁃aromyces funiculosus causing fruit core rot of peach( Prunus per⁃sica) in China[J/OL].Plant disease,2019,103(8):2124[2023-11-10].https://doi.org/10.1094/PDIS-11-18-2050-PDN.
[15] ALOI F,RIOLO M,SANZANI S M,et al. Characterizationof Alternaria species associated with heart rot of pomegranatefruit[J/OL].Journal of fungi,2021,7(3):172[2023-11-10].https://doi.org/10.3390/jof7030172.
[16] 任艺华. 苹果霉心病菌侵染特征与防治技术研究[D]. 杨凌:西北农林科技大学,2020.REN Y H.Study on infection characteristicsand control techniques of apple mould heart disease[D]. Yangling:Northwest A amp; F University,2020 (in Chinesewith English abstract).
[17] 方中达. 植病研究方法[M].3 版. 北京:中国农业出版社,1998:122-125.FANG Z D.Research methods of plant diseases[M]. 3rd ed. Beijing:China Agriculture Press,1998:122-125(in Chinese).
[18] 蒋政华,王泽新,张慧颖,等. 桃软腐病的病原菌鉴定与高效防治药剂筛选[J]. 果树学报,2021,38(7):1136-1146. JIANGZ H,WANG Z X,ZHANG H Y,et al.Identification ofthe pathogen causing soft rot of peach and screening of highlyeffective fungicides[J].Journal of fruit science,2021,38(7):1136-1146( in Chinese with English abstract).
[19] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979:111-114. WEI J C. Handbook of fungal identification[M]. Shanghai:Shanghai Scientific amp; Technical Publishers,1979:111-114(in Chinese).
[20] GUO L W,WU Y X,MAO Z C,et al.Storage rot of dragonfruit caused by Gilbertella persicaria[J].Plant disease,2012,96(12):1826.10.1094/PDIS-07-12-0635-PDN.
[21] 林珊宇,贤小勇,韦小妹,等. 广西火龙果采后病害主要病原菌分离与鉴定[J]. 中国南方果树,2018,47(2):6-12.LIN SY,XIAN X Y,WEI X M,et al.Isolation and identification ofpathogens for the postharvest diseases in pitaya fruits[J].South China fruits,2018,47(2):6-12 (in Chinese with Englishabstract).
[22] 林筑蘋, 蔡志濃, 謝廷芳, 等. 紅龍果花期與幼果濕腐病(病原Gilbertella persicaria)之藥劑篩選與田間防治[J]. 台灣農業研究, 2020, 69(3):207-217.LIN Z P, CAI Z N, XIE TF, et al.Chemical screening and field trials for controlling pitayaflower wet rot caused by Gilbertella persicaria [J].Taiwanagricultural research, 2020, 69(3):207-217 (in Chinese withEnglish abstract).
[23] 郑樊,徐刚,仇芳,等. 海南省火龙果软腐病病原菌的鉴定及生物学特性[J]. 植物保护,2019,45(4):137-142.ZHENG F,XU G,QIU F,et al.Identification and biological characteristicsof the pathogenic fungus causing the soft rot of Hylocereus cos⁃taricensis in Hainan,China[J].Plant protection,2019,45(4):137-142( in Chinese with English abstract).
(责任编辑:边书京)
基金项目:广东省大学生创新创业训练计划项目(S202210564151);广东省科技厅项目(粤科农字〔2021〕151 号KTP20210078);阳江市科技专项(阳科通[2021]50 号)

