肌纤维E2信号促进小鼠急性损伤骨骼肌内的巨噬细胞胞葬

关键词:E2信号;急性肌损伤;巨噬细胞胞葬;炎症
随着经济与科技的发展,我国每年出于机械因素(骨折、手术、挤压、生物试剂注射)和血运因素(缺血)而造成的急性骨骼肌创伤的患者数以千万计,所引起的急性骨骼肌炎症正在严重地危害人体健康[1-3]。相对于雌激素水平高的患者,雌激素水平低下的患者在遭到急性骨骼肌创伤后,更容易导致机体内稳态失衡和急性肾衰[4-6];若得不到及时而有效的控制,炎性肌肿胀的持续时间将延长[7-9],容易导致肌萎缩、肌减少症、糖尿病肌病等慢性炎症发生[10-12]。由此,对急性骨骼肌创伤的发生发展研究,对于及时有效控制急性骨骼肌损伤病情有重大的指导意义。
雌激素主要为雌二醇(E2),E2能减缓组织炎症,且炎症的撤退与组织的愈合均与雌激素水平以及雌激素受体(ER)相关[13-15]。巨噬细胞胞葬作用与表型相关,是机体的一个重要生物效能,是指巨噬细胞能够通过识别凋亡细胞(如淋巴细胞、血管内皮细胞、卫星细胞等)后产生特定信号,继而对凋亡细胞的内吞、消化、清除[16-18]。而骨骼肌纤维E2信号对急性损伤骨骼肌的免疫调控鲜有报道。卵巢是雌性哺乳动物主要分泌E2的器官,本研究采用OVX鼠作为实验组动物模型,探讨肌纤维E2信号对急性损伤骨骼肌纤维内巨噬细胞表型与功能的影响,为临床治疗急性骨骼肌炎提供一定的理论基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 150 只C57BL/6 雌鼠,33 只C57BL/6雄鼠,8~12周龄,体质量为18~22 g,均购自南方医科大学实验动物中心。实验操作均遵循佛山大学实验动物伦理委员会指南并通过相关审核(伦理批号:20230906)。
1.1.2 主要试剂与仪器 C2C12 细胞(ATCC);CTX(100 μg/mL,Sigma);4-他莫昔芬(4-OHT)、雌二醇(E2),(Sigma-Aldrich);TUNEL 细胞凋亡检测试剂盒(上海翊圣生物公司);兔抗ERα多克隆抗体、小鼠抗ERβ单克隆抗体(Abcam);PE标记F4/80抗体、PE标记CD11b抗体、Pacific Blue 标记CD45、eFluor 405 标记MHC-II抗体(ThermoFisher);APC 标记CX3CR1 抗体(博奥森);大鼠抗小鼠CD11b、大鼠抗小鼠F4/80(eBioscience);兔抗小鼠Dystrophin(Abcam);羊抗大鼠Cy3、羊抗大鼠Alexa Fluor 488(ThermoFisher);羊抗兔Alexa Fluor 488、羊抗兔555、羊抗小鼠Alexa Fluor488、大鼠抗小鼠eMHC(Abcam);细胞膜染色试剂盒(PKH67,上海泽叶生物公司);干扰素- γ (IFN- γ,Ramp;D);Transwell 细胞培养板(康宁);Ficoll Plus 1.083(索莱宝);多维高清流式细胞仪、FACS Aria II细胞分选仪(BD);荧光显微镜(奥林巴斯);实时荧光定量PCR仪器(ABI Step One Plus);酶标仪(ThermoFisher)。
1.2 方法
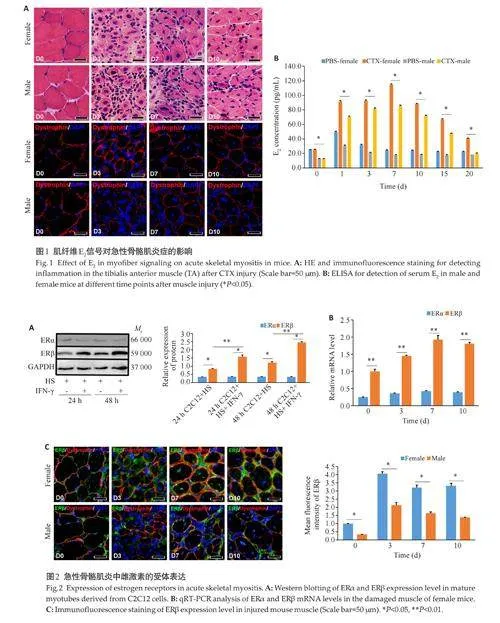
1.2.1 动物实验 取雄鼠与雌鼠各21 只,将30 μL 的CTX溶液(50 μg/mL)注射到小鼠(两性别均需)双侧胫骨前肌(TA),制备急性骨骼肌损伤模型。根据不同的实验需求,在急性肌损伤后0、1、3、7、10、15、20 d经颈椎脱位处死小鼠。收集小鼠的血液,用ELISA方法测定不同时间段小鼠血清中的雌激素E2表达水平。另外收集TA肌肉标本并用液氮冷却的异戊烷快速冷冻。提取0、3、7、10 d雄鼠与雌鼠的损伤肌组织总RNA,qRT-PCR检测ERα与ERβ的RNA表达水平,引物由序列合成见表1。
取雌鼠18 只,随机平均分为CTX+PBS 组、CTX+Estradiol组与CTX+4-OHT组,6只/组。雌鼠经胫骨前肌注射CTX(50 μg/mL)1 d后,每日接受PBS(50 μL/小鼠,0.01 mol/L)、E2 (50 μL/小鼠,50 μg/mL)或4-OHT(50 μL/小鼠,2 mg/mL)的皮下注射(下同)。ELISA方法测定D0、D14 小鼠血清中的雌激素E2表达水平。另取雌鼠9 只,进行卵巢去势处理,ELISA测定D0、D14、D28小鼠血清中的雌激素E2表达水平。
根据Ficoll Plus 1.083 试剂盒的操作说明,通过密度梯度离心法从B6小鼠脾脏中提取单个核细胞,用波长为254 nm的UV照射30 min,促使细胞凋亡,后用PKH67(1∶250)标记凋亡细胞(ACs),以备体外共培养实验使用。
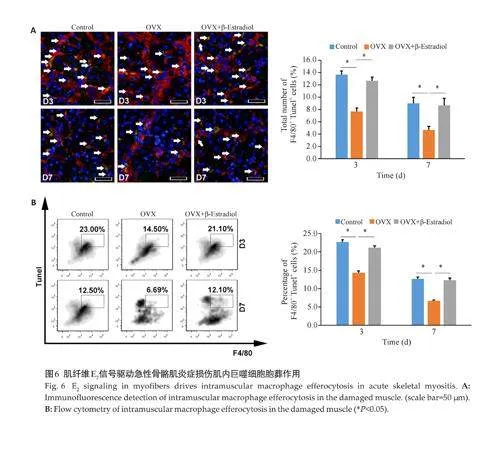
1.2.2 HE 与免疫荧光染色 取雌鼠30 只,雄鼠12 只。雌鼠随机分为Control 组、Control+Estradiol 组、Control+4-OHT 组、OVX组和OVX+Estradiol 组(6 只/组)。在骨骼肌损伤3、7 d后,取材。使用冰冻切片机切出厚度为 6 μm的组织样本冰冻切片,放置-20℃冰箱备用。取出冰冻切片,放置室温,用HE和免疫荧光染色:丙酮固定,添加一抗(Dystrophin, 1∶200),4℃孵育过夜。PBS 冲洗,依次加入相对应的二抗组合(羊抗兔555,1∶600)室温孵育1 h。PBS冲洗,DAPI核染。根据TUNEL细胞凋亡检测试剂盒指示,将冰冻切片进行F4/80-Tunel双染。HE与免疫荧光检测雌鼠组与雄鼠组不同时间(D0、D3、D7、D10)损伤肌内炎性渗出情况,免疫荧光检测损伤肌内ERβ的表达。HE与免疫荧光检测所有组别D3、D7 的炎性渗出情况。免疫荧光检测Control 组、OVX组和OVX+β-Estradiol 组胞葬巨噬细胞(F4/80+Tunel+)、肌纤维再生(eMHC)的差异。
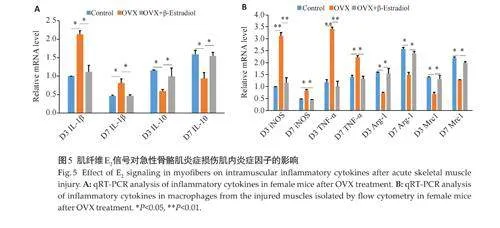
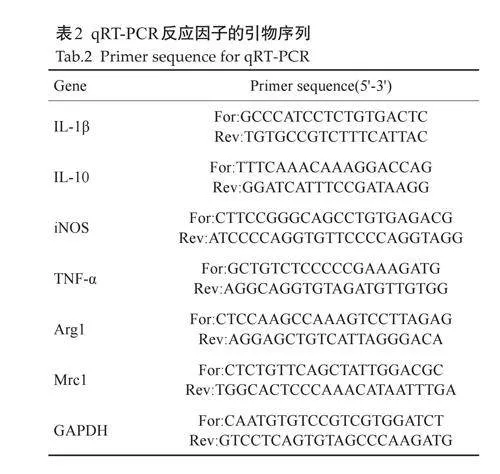
1.2.3 流式细胞术体内检测 取未经OVX处理的雌鼠24 只作为Control 组,经OVX处理的雌鼠48 只作为处理组(OVX组和OVX+β-Estradiol组,n=24)。在骨骼肌损伤3、7 d后,其中OVX+β-Estradiol组雌鼠需CTX胫骨前肌注射1 d后,需要每日接受β-Estradiol(50 μL/只,50 μg/mL)。取材将损伤肌剪碎匀浆,用0.2%胶原酶II于37 ℃条件下消化骨骼肌匀浆。过滤,离心收集细胞,重悬于PBS 中,封闭Fc 段,添加荧光抗体(抗CD45-Pacific Blue、抗F4/80-PE、抗CD11b-PE、抗MHC-IIeFluor、抗CX3CR1-APC、抗Tunel-FITC,1∶100),多维高清流式细胞分析仪分析单核巨噬细胞的比例、巨噬细胞的表型、胞葬巨噬细胞比例的差异,流式细胞术分选不同组别的巨噬细胞。qRT-PCR检测不同组别的损伤肌组织炎症因子(IL-1β、IL-10)、流式细胞术分选后巨噬细胞内炎症因子(iNOS、TNF-α、Arg-1、Mrc1)的RNA表达水平,引物序列见表2。
1.2.4 C2C12 细胞体外培养 在37 ℃、5% CO2的细胞培养箱中于含有10% 胎牛血清和青霉素-链霉素(100 μg/mL)的DMEM/F12中用直径为6 cm细胞培养皿培养C2C12 细胞。当培养的C2C12 细胞覆盖70%~80%的细胞培养皿面积时,用分化培养基(添加2%HS)培养72 h,将细胞分化为肌管,用IFN-γ(3 ng/mL)促炎24 h、48 h。用总蛋白提取试剂盒提取细胞的总蛋白,用Western blotting法检测肌管不同时间点的ERα、ERβ蛋白表达。
1.2.5 体外细胞共培养模型与巨噬细胞胞葬作用分析与1.2.4 同样的条件用Transwell 细胞共培养皿培养C2C12 细胞(5×105),当细胞分化为肌管后,用IFN-γ(3 ng/mL)促炎24 h,且用β-Estradiol(1.0 nmol/L)和(或)4-OHT(0.1 μmol/L)处理24 h。另外,将6%的巯基乙酸盐培养基(2 mL)注入B6小鼠腹腔。72 h后从腹腔灌洗液中分离巨噬细胞。
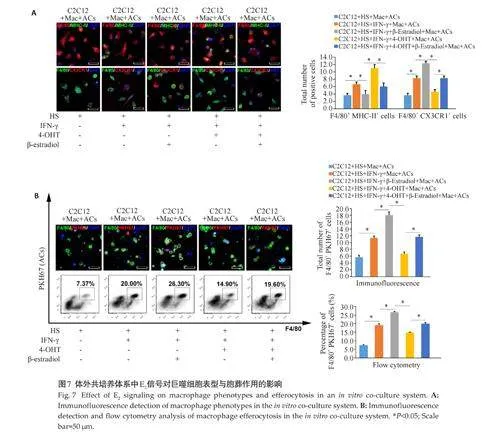
将C2C12 肌管与腹腔巨噬细胞以1∶2 的比例共培养4 h。在测定共培养体系中巨噬细胞胞葬作用前45 min,将PKH67标记的ACs(3×106)加入共培养体系,分为5组:C2C12+HS+Mac+ACs组、C2C12+HS+IFN-γ+Mac+ACs 组、C2C12+HS+IFN-γ+β-Estradiol+Mac+ACs 组、C2C12+HS+IFN- γ+4-OHT+Mac+ACs 组和C2C12+HS+IFN‑γ+4-OHT+β-Estradiol+Mac+ACs组。采用抗F4/80、抗MHC-II、抗CXCR1、PKH67等荧光试剂对共培养体系中的巨噬细胞与(或)凋亡细胞进行标记,免疫荧光和流式分析共培养体系中各组的巨噬细胞表型与巨噬细胞胞葬作用。
1.3 统计学分析
图片均采用Image J处理。采用IBM SPSS 22.0统计学软件进行统计分析。数据表达方式用均数±标准差。One-way ANOVA法用于多组间比较。当Plt;0.05表示差异具有统计学意义。
2 结果
2.1 骨骼肌纤维E2影响损伤骨骼肌内炎症
HE 与免疫荧光结果显示(图1A),相同时间内(D3、D7、D10),相较于雌鼠,雄鼠损伤肌内炎性细胞渗出更为严重。采用ELISA方法检测肌损伤后不同时间点雄性、雌鼠血清中的E2,结果显示,于同一时间内,雌鼠血清中E2水平高于雄鼠的(Plt;0.05,图1B),与预期相符合。体外培养C2C12 成肌细胞,蛋白电泳结果显示,相较于Control组(C2C12+HS),炎性培养组ERβ的表达水平升高(Plt;0.05),而ERα的表达则无升高(图2A)。且在统一处理水平下,ERβ的表达水平高于ERα(Plt;0.05)。提取雌鼠损伤肌的RNA,qRT-PCR结果显示,ERβ的表达水平随着时间的推移先上升后下降,而在同一时间点内,ERβ的表达水平显著高于ERα(Plt;0.05,图2B)。免疫荧光染色显示,肌损伤后,且相同时间点内,雌鼠损伤肌内总ERβ的表达显著高于雄鼠的,且雌鼠肌纤维内ERβ的表达也显著高于雄鼠表达(Plt;0.05,图2C)。
2.2 肌纤维E2调控损伤骨骼肌内单核巨噬细胞渗出
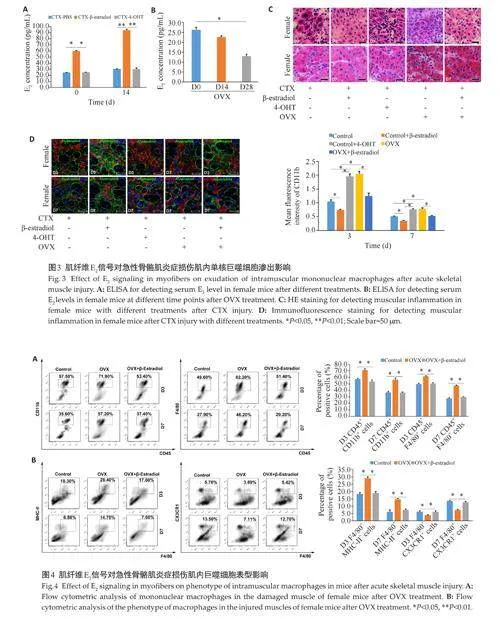
ELISA检测D0与D14两个时间点血清中的E2(图3A),较于CTX-PBS(Control)组,给予β-Estradiol处理的E2表达水平显著升高(Plt;0.05),而4-OHT组差异则无统计学意义(Pgt;0.05)。OVX组的血清E2在小鼠卵巢去势14 d 表达水平有所下降,但差异无统计学意义(Pgt;0.05);在28 d表达水平下降(图3B)。HE与免疫荧光结果显示(图3C、D),相较于Control组(单纯CTX处理),β-Estradiol处理组炎症显著减轻,而4-OHT处理组或者OVX组炎症显著加重,且以单核巨噬细胞增多为主;相较于OVX组,OVX组给予β-Estradiol 处理后,炎症显著减轻。
流式结果显示(图4A、B),相较于Control组,OVX组渗出的单核巨噬细胞增多,且M1 巨噬细胞(F4/80+MHC-II+ )增多(Plt;0.05),M2 巨噬细胞(F4/80+CX3CR1+)减少(Plt;0.05);相较于OVX组,OVX组给予β-Estradiol处理后,炎症减轻,且M1、M2巨噬细胞的比例得以矫正。qRT-PCR检测OVX处理后雌鼠损伤肌内炎症因子结果显示,相较于Control 组,OVX组促炎因子IL-1β上调、抗炎因子IL-10下调(Plt;0.05,图5A)。予以β-Estradiol 处理后,OVX组促炎因子IL-1β、抗炎因子IL-10均得以矫正。qRT-PCR检测OVX处理后的雌鼠巨噬细胞内炎症因子结果显示,相较于Control组,OVX组促炎因子iNOS、TNF-α上调,抗炎因子Arg-1、Mrc1 显著下调(Plt;0.05,图5B),予以β-Estradiol 处理后,OVX组促炎因子、抗炎因子均得以矫正。
2.3 肌纤维E2调控损伤骨骼肌内巨噬细胞胞葬
免疫荧光与流式细胞术检测结果显示(图6A、B),相较于Control 组,OVX 组损伤肌内胞葬巨噬细胞(F4/80+Tunel+)比例、数目显著下调(Plt;0.05),予以β-Estradiol 处理后,OVX 组损伤肌内胞葬巨噬细胞(F4/80+Tunel+)比例、数目得以矫正。免疫荧光检测共培养体系中M1、M2表型,结果显示(图7A),炎性处理后,较之于C2C12+HS+IFN-γ+Mac+ACs组,4-OHT处理组M1 巨噬细胞增多(Plt;0.05),M2 巨噬细胞减少(Plt;0.05)。而后加入β-Estradiol处理,M1、M2 的表达趋势则得以矫正。免疫荧光与流式细胞术检测结果显示(图7B),炎性处理后,较之于C2C12+HS+IFN-γ+Mac+ACs 组,给予β-Estradiol 处理胞葬巨噬细胞(F4/80+PKH67+)数目、比例上调(Plt;0.05);4-OHT处理组胞葬巨噬细胞趋势相反,而在此基础上加入一定剂量的β-Estradiol处理后,胞葬巨噬细胞数目、比例得以矫正。
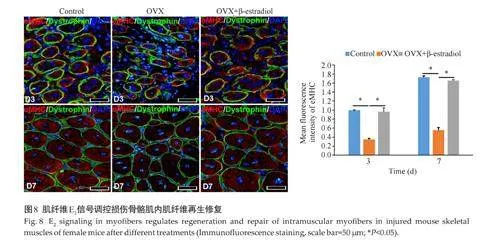
2.4 肌纤维E2调控损伤骨骼肌内肌纤维再生修复
免疫荧光结果显示,相较于Control组,OVX组损伤骨骼肌内肌纤维再生修复(eMHC)下调(Plt;0.05),而给予一定剂量的β-Estradiol 肌注处理后,OVX组损伤骨骼肌内肌纤维再生修复下调的趋势得以矫正(图8)。
3 讨论
出于机械、血运因素引起的肢体创伤必定会牵连骨骼肌,而目前急性骨骼肌炎转归机制鲜有报道。文献报道骨骼肌纤维在急性损伤后,在一定范围内通过促进肌卫星池中的肌卫星细胞增殖、分化,生成成熟的肌管,具有自我修复能力[19-21]。但如果超过了一定范围,例如大面积骨骼肌损伤,肌纤维会形成错乱或瘢痕修复,甚至转变为慢性骨骼肌炎[22, 23]。因此,探究影响急性骨骼肌炎的因素对于临床治疗急性骨骼肌创伤尤为重要。
E2主要由卵巢、胎盘分泌,少量由肝脏、肾上腺分泌,对内分泌系统、心血管系统、肌体的代谢、骨骼的生长和成熟,皮肤等各方面均有明显的影响[24]。在一项肌细胞减少症的研究中,E2通过与ERα结合,刺激肌卫星细胞增殖分化,从而延缓肌细胞减少症的进程[25]。另外,Chaiyasing 等[26]在研究CTX导致小鼠急性肌损伤后,E2和两种激素的功能雌激素受体(ERα和ERβ)在肌再生和形态发生的过程中表明ERβ比ERα更能促进肌再生。进一步说明,E2通过与ER结合参与骨骼肌炎症调控;但在不同类别的骨骼肌炎症中,E2参与调控骨骼肌炎症的主导ER可能是不同的。
在急性骨骼肌损伤中,雄鼠损伤肌内炎性细胞渗出要显著多于雌鼠的,无论是雄鼠,还是雌鼠,均是D3时炎症最为严重。而雄鼠血清中的E2表达水平显著低于雌鼠的,且血清中E2的表达水平随着时间的推移先上升后下降,D7达至顶峰。相较于炎性细胞渗出情况,血清中E2的表达具有一定的滞后性。体内外结果也发现,小鼠急性骨骼肌损伤后,ER和ERβ上调显著,ERα上调不明显。且ERβ的表达趋势与血清中E2的一致。由此说明,肌纤维E2信号有可能通过与ERβ结合,以调控损伤肌内的炎性细胞渗出,趋势与Chaiyasing[26]等的研究结果一致。
为了进一步揭示肌纤维E2信号对急性骨骼肌炎的影响,将部分雌鼠进行OVX处理。文献报道,雌鼠在OVX处理28 d 后,雌鼠的血清E2水平可以显著下调[27]。ELISA法验证,结果与文献报道相符。体外试剂β-Estradiol和4-OHT可作为体内E2的激动剂与阻断剂,前者可作为E2模拟物的存在,后者通过与ER结合形成4-OHT-ER 复合物,从而竞争性抑制E2与ER 的结合[28]。对急性骨骼肌损伤的雌鼠注射4-OHT,测定小鼠血清中的E2水平,发现E2的表达水平不受4-OHT的影响,与预期结果相符合,直接证明了4-OHT对于E2来说是竞争与ER 结合的抑制物。HE 结果显示,相较于Control组(单纯CTX处理),OVX小鼠、给予4-OHT试剂肌注的小鼠的炎性细胞渗出要显著增高。给予OVX小鼠β-Estradiol肌注后,炎性细胞渗出下调。由此进一步说明,肌纤维E2信号通过与ERβ结合以调控损伤肌内的炎性细胞渗出,影响急性骨骼肌炎转归。
免疫荧光结果显示渗出的炎性细胞以单核巨噬细胞为主。且相较于Control组,OVX小鼠M1巨噬细胞显著上调,M2巨噬细胞显著下调,予以β-Estradiol肌注后,M1、M2巨噬细胞渗出的比例得以矫正。说明肌纤维E2信号与ERβ结合后,通过调控损伤肌内巨噬细胞的表型以影响骨骼肌炎转归。巨噬细胞胞葬作用是巨噬细胞的一个重要功能,主要由M2巨噬细胞主导。免疫荧光和流式细胞术结果分析发现,较于Control 组,OVX组小鼠损伤肌内胞葬巨噬细胞比例、数目(胞葬作用)显著下调。为了排除体内复杂因素的干扰,采用体外共培养体系进行确认。结果发现,在炎性环境中,相较于C2C12+HS+IFN-γ+Mac+ACs 组,给予β-Estradiol处理后,M2 表达与巨噬细胞胞葬作用均显著上调;给予4-OHT处理的C2C12组M2表达与巨噬细胞胞葬作用均显著下调,而在4-OHT处理的基础上加以一定剂量的β-Estradiol 处理,原本M2 表达和巨噬细胞胞葬作用的下调趋势得以矫正。由此说明,肌纤维E2信号通过影响损伤肌内巨噬细胞的表型以调控巨噬细胞胞葬。
胞葬作用的重要后续效应是促进组织修复,胚胎肌球蛋白(eMHC)可以评估骨骼肌再生修复程度[29]。为了验证损伤肌内巨噬细胞胞葬作用是否与促进急性骨骼肌炎中损伤肌肌修复相关,采用免疫荧光进行Dystrophin-eMHC双染。结果显示,相较于Control组,OVX组小鼠损伤肌肌再生修复显著下调,而给予β-Estradiol 处理后,OVX组小鼠损伤肌肌再生修复下调趋势得以矫正。由此,我们推测,在急性骨骼肌损伤后,机体骨骼肌会有一个由炎症加剧至炎症撤退、骨骼肌纤维修复的过程。此时机体内的E2具有抗炎作用,但在相同炎性条件刺激下,E2的表达水平在不同性别、不同身体构造或生理机能的情况下会有所不同,直接影响炎症的转归。
综上,本研究结果显示急性骨骼肌损伤后,肌纤维E2信号活化可通过与ERβ结合,促进损伤骨骼肌内巨噬细胞表型由M1向M2转变,促进损伤肌内巨噬细胞胞葬,从而促使肌炎症撤退与肌再生修复。另外,研究表明,E2-ERβ信号可能通过ERK1/2 MAPK、p38 MAPK、JNK MAPK或PI3K信号途径调控炎症转归[30,31]。但在急性骨骼肌炎中,E2-ERβ信号的下游分子以及巨噬细胞胞葬作用的具体信号途径尚待深入挖掘。

