SPHK1靶向NF-κB信号通路调控胃癌细胞的迁移与侵袭
关键词:胃癌;鞘氨醇激酶-1;NF-κB;迁移;侵袭
胃癌(GC)是消化系统中最常见的恶性肿瘤之一[1]。据调查,GC在全球发病率呈逐年递增趋势[2]。其发病率和死亡率在中国所有癌症类型中排名第3,占全球GC新发病例和相关死亡病例的44.0%和48.6%[3]。GC患者多采用手术治疗、放化疗以及免疫治疗,但临床疗效及预后不佳[4,5]。高侵袭与转移性能力是肿瘤保持恶性的重要特征。然而到目前为止,导致癌症转移的复杂机制还远远没有被完全理解。因此,为明确GC转移机制急需寻找潜在的治疗靶点。
鞘氨醇激酶1(SPHK1)是一种保守的脂质激酶,可将鞘氨醇磷酸化进而生成鞘氨醇-1-磷酸,已被发现在肿瘤进展不同阶段中发挥着各种功能[6]。SPHK1 是SPHK家族蛋白中的一员,是介导细胞各个方面的关键信号分子,并在多种致癌过程中发挥核心作用,包括细胞增殖、迁移与侵袭[7, 8]。据研究,SPHK1是结直肠癌细胞中的激活因子,通过调控特定信号通路表达来促进癌症发生发展[9-11]。在胰腺癌组织中,SPHK1表达上升,并通过分析患者ROC 曲线表明低生存率与高表达的SPHK1密切相关[12]。SPHK1在非小细胞肺癌组织和细胞系中表达上调。过表达SPHK1增加了癌细胞的增殖和迁移能力[13]。核因子-κB(NF-κB)是转录因子家族中的一员,是免疫、炎症和癌症的关键调节因子[14]。抑制鼻咽癌细胞中NF-κB信号转导作用,可大大降低靶基因对癌细胞的增殖、侵袭能力[15]。同时,NF-κB通路的激活增加了卵巢癌中TRIM52对肿瘤介导的恶性行为[16]。然而,尚不清楚SPHK1 是否与GC恶性进展过程中的NF-κB信号通路有关,因而需要对SPHK1 进行深入探究。本研究旨在利用生物数据库与体内外实验分析SPHK1在GC发生发展中的作用及其潜在的通路分子机制,从而为GC治疗带来新方向。
1 材料和方法
1.1 材料
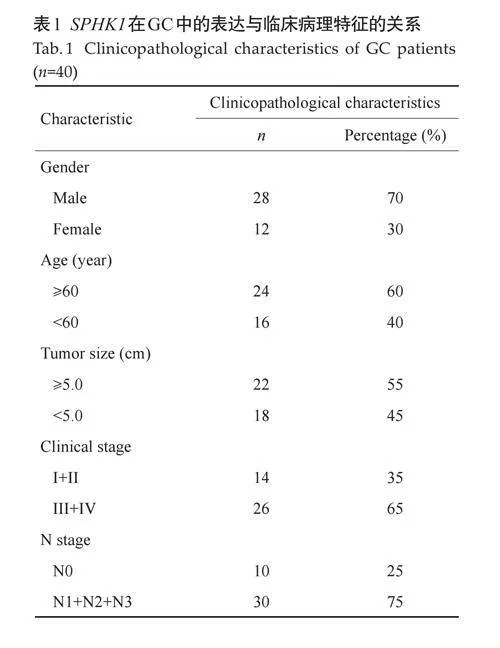
1.1.1 患者样本 选取2023年6月~12月在蚌埠医科大学第一附属医院胃肠外科行手术切除的GC患者40例(男28例,女12例,年龄35~75岁),经患者术前书面知情同意后获得该40 例患者的非癌性胃组织样本(术中病理切片结果证实为正常组织)纳入本研究。从医疗记录中检索患者临床特征,包括性别、年龄、肿瘤大小和肿瘤分期等(表1)。本研究经蚌埠医科大学伦理委员会批准[伦理批号: 第(2023)311,(2023)405号]。
1.1.2 主要试剂 PDTC(MCE);RPMI 1640培养基、胰酶、胎牛血清(Gibco);小鼠多克隆抗体SPHK1、P65、p-P65、p-PI3K、MKI67 以及单克隆抗体GAPDH、PI3K、VEGFA、IL-17( Proteintech);总RNA提取试剂盒、逆转录、定量PCR试剂盒(Novoprotein)。引物合成于生工生物工程(上海)股份有限公司。慢病毒合成于上海吉玛制药技术有限公司。
1.2 方法
1.2.1 公共数据库检索 TIMER2.0 (http://timer.cistrome. org)数据库分析SPHK1 在泛癌中的表达。GEPIA(http://gepia. cancer-pku.cn)数据库搜索SPHK1相关基因表达及关联。HPA(https://www.proteinatlas.org)数据库检索SPHK1与MKI67的IHC结果。Kaplan-Meier plotter(https://kmplot.com)数据库预测GC患者预后。cBioportal(https://www.cbioportal.org)数据库下载与SPHK1在GC中共表达的前500个潜在靶基因。DAVID(https://david.ncifcrf.gov)数据库分析检索生物富集通路。微生信(http://www.bioinformatics.com.cn)网站在线编辑处理下载数据并产生气泡图。KEGG(https://www. kegg.jp)数据库检索相关信号通路。
1.2.2 免疫组织化学(IHC) IHC检测组织中SPHK1与MKI67的表达。临床40例GC组织和40例匹配的非癌性组织按照标准程序进行操作。具体步骤如固定、脱水、包埋、制片、染色等,经一抗(SPHK1/1∶200,MKI67/1∶2000)、二抗(山羊抗兔ZSGB-BIO/1∶3000)孵育后进行DAB染色,然后显色并采集图片评分。所有切片由2名病理科医师独立进行盲审评分。同样染色操作评分可参考张浩等[17]的研究。
1.2.3 细胞培养 人GC细胞株MGC-803、AGS、MKN-1、HGC-27 与正常胃上皮细胞GES-1 均购自中国科学院上海生命科学研究院,均在RPMI 1640完全培养液中于37 ℃、5%CO2的恒温细胞培养箱中培养,待细胞生长至合适密度时消化传代。
1.2.4 Western blotting 提取细胞蛋白并进行浓度测定。取等量的蛋白样品进行电泳,电泳完成后将蛋白凝胶转移至0.45 μm的PVDF膜上进行转膜。结束后将其浸入封闭液中封闭60 min。3次洗膜后,加入稀释相应一抗并在4℃冰箱中过夜孵育。次日洗膜,与二抗稀释室温摇床孵育90 min。洗膜后检测PVDF膜上的蛋白印迹信号。
1.2.5 qRT-PCR 提取细胞RNA并测定浓度和纯度,将其逆转录为cDNA。将得到的cDNA以GAPDH为内参,按照试剂盒操作方法进行qRT-PCR,检测目的基因表达情况。采用相对定量的方法(2-ΔΔCT) 计算基因的mRNA表达水平。相应引物序列如下:SPHK1引物上游:5'-TGGCATCTGCTGAACTCATTT-3';下游:5'-TGCAGCGAGGTCTAATTGTTT-3';GAPDH 引物上游:5'-GAGAAGTATGACA CAGCCTCAA-3';下游:5'-GCCATCACGCCTG ACA GTTT-3'。
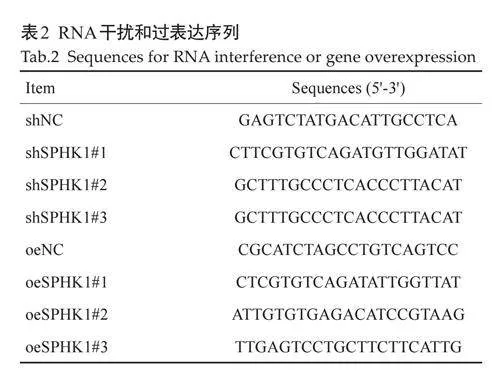
1.2.6 SPHK1 的RNA干扰和过表达 将人GC细胞系HGC-27与MGC-803进行铺板,当培养密度达到70%~80%,然后分别采用SPHK1 干扰(载体:GV382)、过表达(载体:GV492)和对照慢病毒载体对上述细胞进行敲低与过表达转染,6 h 后更换含培养基,3 d 后用含1 μg/mL嘌呤霉素的培养基筛选稳定表达细胞株。针对SPHK1慢病毒转染序列如表2。
1.2.7 细胞划痕实验 调整细胞密度为2.0×106/孔后铺板于6 孔板中,待显微镜下观察细胞融合成单层状态时,用无菌200 μL枪头在孔内垂直均匀划线,继续置于培养箱中培养。在0、24 h 时通过倒置显微镜(放大倍数×40)观察并随机分5 个区域拍照,得到的图片通过Image J 软件进行处理并计算划痕迁移率。
1.2.8 Transwell 迁移和侵袭实验 将悬浮于0.2 mL的无血清培养基中的稳转株细胞置于Transwell板的上孔(1×104/孔),将含有0.6 mL 的完全培养基装入下孔。37 ℃培养24 h后,用棉签将上腔的细胞完全去除,将下腔的细胞用4%多聚甲醛固定,并用0.1%结晶紫染色。然后在倒置显微镜(放大倍数×200)上随机分5个区域拍照计数,取平均值。对于侵袭试验,实验过程与迁移试验相似,只是在细胞装载之前,Transwell上孔加入50 μL的基质胶并孵育1 h。
1.2.9 裸鼠背部成瘤模型 4~5周龄雌性裸鼠12只购自杭州子源实验动物科技有限公司,在SPF环境下饲养。将裸鼠随机分为4 组(n=3):shNC 组、shSPHK1 组、oeNC组和oeSPHK1组。将构建稳转株或GC细胞200 μL(2×107/只)皮下注射于裸鼠背部。2周后,在麻醉(0.7%戊巴比妥钠)下,采用颈椎脱臼法处死小鼠。然后,切除异种移植肿瘤,拍照并称重。本研究经蚌埠医科大学动物伦理委员会批准(伦理批号:第[(2023)574]号)。
1.3 统计学处理
所有统计数据采用Prism 9.0(Graphpad Software)、ImageJ软件进行分析。数据以均数±标准差表示。采用单因素方差分析检验、两样本t检验。Plt;0.05为差异有统计学意义。所有实验均重复3次。
2 结果
2.1 SPHK1在GC组织中的表达
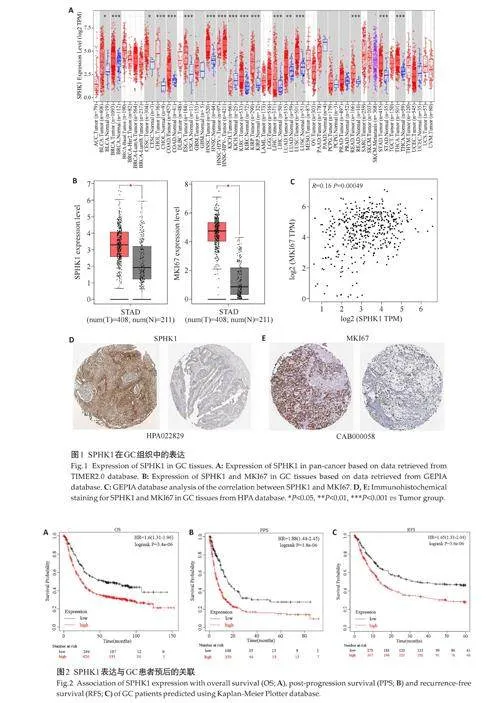
基于TIMER2.0 数据库,SPHK1 表达水平在15 种癌症类型中上调,在2种癌症类型中下调,其中在GC组织中表达(Plt;0.001,图1A)。利用GEPIA数据库,SPHK1与MKI67在GC组织(n=408)中的表达水平均高于正常组织(n=211)(Plt;0.05,图1B)。此外,两者表达水平呈正相关(Plt;0.001,图1C)。HPA数据库显示,GC组织中SPHK1与MKI67的染色程度上调(图1D、E)。
2.2 SPHK1表达与GC患者预后的关联
GC 患者中高表达的SPHK1 预示着较差的总生存期(OS,Plt;0.001,图2A)和进展后总生存期(PPS,Plt;0.001,图2B)以及更差的无复发生存期(RFS,Plt;0.001,图2C)。
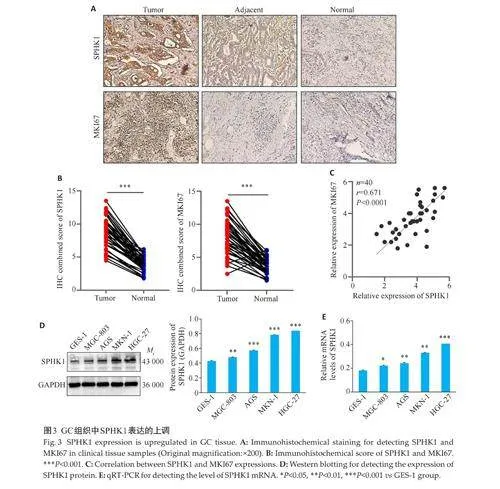
2.3 GC组织中SPHK1表达的上调
IHC结果显示,SPHK1 与MKI67 在GC组织的阳性染色强度均高于非癌性胃组织(图3A)。GC组织切片中SPHK1 与MKI67 蛋白的综合染色评分也高于正常组织切片(Plt;0.001,图3B)。同时,两种蛋白相对表达量呈的正相关(Plt;0.0001,图3C)。此外,Western blotting与qRT-PCR结果显示,SPHK1 在HGC-27 细胞系中高表达,在MGC-803细胞系中低表达,差异有统计学意义(Plt;0.05,图3D、E)。
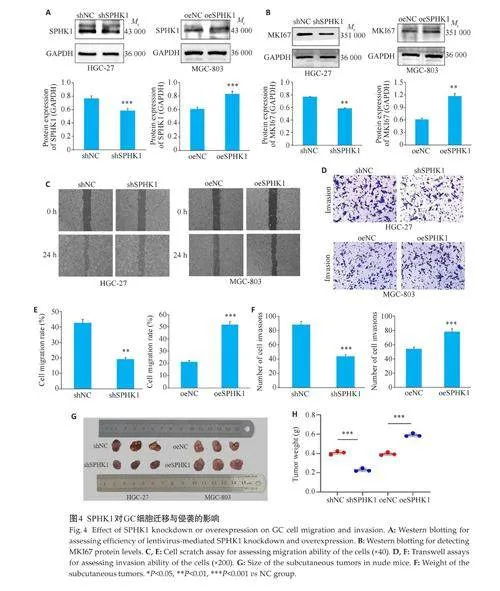
2.4 SPHK1对GC细胞迁移与侵袭的影响
Western blotting结果显示,shSPHK1组SPHK1的表达下调(Plt;0.001),而oeSPHK1组SPHK1的表达上调(Plt;0.01,图4A)。shSPHK1组MKI67蛋白表达受到抑制(Plt;0.01),而oeSPHK1 组的MKI67 蛋白表达上调(Plt;0.05,图4B)。此外,细胞划痕实验表明,与NC组相比,转染shSPHK1 的HGC-27 细胞在24 h 时,细胞的迁移率降低,转染oeSPHK1 的MGC-803 细胞在24 h时,细胞的迁移率增加,差异有统计学意义(Plt;0.01,图4C、E)。Transwell 侵袭实验显示,与NC 组相比,shSPHK1 组HGC-27 细胞的侵袭能力减弱,oeSPHK1 组MGC-803细胞的侵袭能力上调,差异有统计学意义(Plt;0.01,图4D、F)。此外,裸鼠成瘤实验显示,与NC组相比,shSPHK1组肿瘤大小和质量减小,而oeSPHK1组增加,差异有统计学意义(Plt;0.001,图4G、H)。
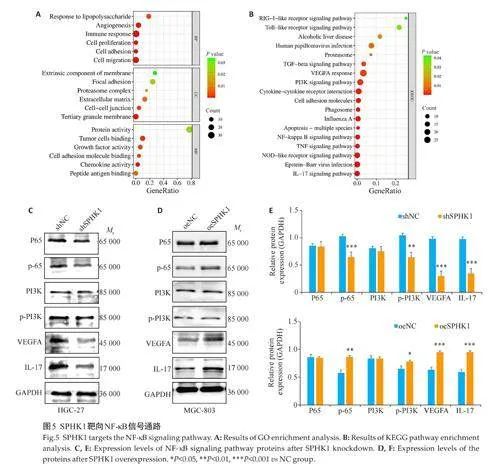
2.5 SPHK1靶向NF-κB信号通路
基于cBioportal 数据库下载与SPHK1 在GC中共表达的前500个潜在靶基因,DAVID数据库分析潜在靶基因并下载SPHK1mRNA富集相关数据,利用微生信网站处理并得出SPHK1相关潜在靶基因参与GC生物过程、细胞组成与分子功能中的细胞黏附、迁移及血管生成等(Plt;0.05,图5A)。KEGG通路显示NF-κB、PI3K富集其中(Plt;0.05,图5B)。与NC组相比,shSPHK1组抑制了磷酸化P65(p-P65)与PI3K(p-PI3K)水平,而总蛋白P65、PI3K无明显变化。VEGFA与IL-17表达水平也受到抑制(Plt;0.05,图5C、E)。相反,SPHK1过表达则增强了这一表现(Plt;0.05,图5D、F)。
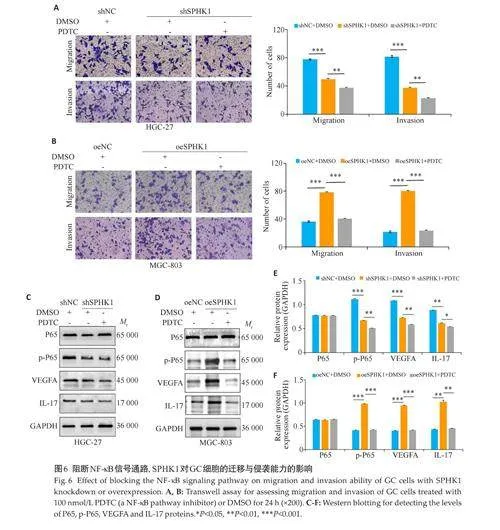
2.6 阻断NF-κB信号通路,SPHK1对GC细胞的迁移与侵袭能力的影响
利用PDTC(NF-κB信号通路抑制剂)处理前期已构建的病毒稳转株细胞24 h。Transwell迁移与侵袭实验结果显示,与shSPHK1+DMSO组相比,shSPHK1+PDTC组的细胞迁移与侵袭能力下调(Plt;0.05,图6A)。与oeSPHK1+DMSO组相比,oeSPHK1+PDTC组的细胞迁移与侵袭能力也下调(Plt;0.05,图6B)。同样,p-P65、VEGFA和IL-17蛋白水平变化中,shSPHK1+PDTC组、oeSPHK1+PDTC组与对照组相比,其表达量下降,差异有统计学意义(Plt;0.05,图6C~F)。
3 讨论
鞘氨醇激酶家族蛋白参与多种癌症进展过程[18],如S1PR1信号通过增强肿瘤细胞中趋化因子的表达来促进GC转移[19]。SPHK1通过刺激Akt/FoxO3a 信号传导下调凋亡蛋白表达来抵抗GC细胞凋亡[20]。SPHK2 在GC组织中表达上调,对GC发挥致癌作用[21, 22]。基于生物信息学分析,SPHK1在GC组织中的表达高于正常胃组织以及高表达的SPHK1预测更差的生存期。这与我们的研究结果一致,IHC结果显示SPHK1与MKI67在GC组织中表达上调且两者呈正相关。MKI67 是肿瘤细胞恶性增殖因子。随着MKI67 指标的建立,MKI67已发展成为癌症患者诊断和预后评估的标准[23]。以上数据提示SPHK1可能是GC进展中的恶性因子。
远处转移是GC患者高死亡率的原因之一[24]。肿瘤转移是一个多阶段的过程。肿瘤细胞的迁移和侵袭是转移过程中的关键环节[25]。SPHK1在乳腺癌[26]和前列腺癌[27]中已经证明了肿瘤细胞的迁移和侵袭功能。与上述研究结果类似,我们的数据显示敲低SPHK1抑制GC细胞的迁移和侵袭,而过表达SPHK1则相反。此外,裸鼠背部成瘤实验结果显示敲低SPHK1可抑制肿瘤的生长,而过表达SPHK1则会加速肿瘤生长。据此,我们的研究数据进一步证实了SPHK1在肿瘤进展中的重要作用。据报道,SPHK1 可激活多种癌症相关信号通路,如结直肠癌中的TRAF6/ULK1通路[28]、膀胱癌中的NONO/STAT3 通路[6]以及非小细胞肺癌的JAK/mTOR通路[13]。本课题主要研究集中在NF-κB通路,SPHK1对其它通路的影响将在我们未来的研究中深入挖掘。NF-κB信号通路在肿瘤相关活动中发挥重要作用,如细胞增殖、迁移与侵袭[29,30]。靶向调控SPHK1转录激活NF-κB/p65 磷酸化可促进结直癌进展[31]。基因代谢组学分析显示SPHK1通过NF-κB激活促进口腔鳞状细胞癌的生长与转移[32]。有研究发现,NF-κB/P65与GC恶性转移可能存在关联[33]。在本研究中,SPHK1激活了GC细胞中磷酸化NF-κB信号通路。利用PDTC(NF-κB通路抑制剂)[34, 35]干预SPHK1敲低和过表达细胞株,结果显示,抑制NF-κB信号通路后,SPHK1 减弱了对GC细胞迁移与侵袭的作用,表明NF-κB参与了SPHK1介导的GC细胞的迁移、侵袭,继而提示SPHK1可能调控NF-κB促进GC的转移。VEGFA是重要的血管生成因子,与GC侵袭、转移有关[36, 37]。IL-17与免疫细胞共同作用,促进肿瘤转移[38]。VEGFA、IL-17 可能是NF-κB信号通路的转录靶点[39]。本研究显示,敲低SPHK1下调了p-P65、VEGFA和IL-17,而过表达SPHK1 结果则相反。据此,我们推测SPHK1靶向NF-κB信号通路调节VEGFA/IL-17表达进而调控GC进展。然而本研究还存在一些不足之处:SPHK1 激活NF-κB通路与其他相互作用蛋白共同调控促进GC转移的机制还亟需进一步探索。在裸鼠成瘤模型中亦未进行深入验证SPHK1调控NF-κB通路的促癌作用。
综上所述,本研究表明SPHK1在GC中表达上调,同时靶向NF-κB信号通路促进GC细胞的增殖、迁移与侵袭,继而促进肿瘤的发生发展。因此,SPHK1可作为GC患者治疗过潜在新靶点。

