CEP192过表达可作为胃癌患者不良预后的生物标志物并通过调控G2/M期关键蛋白的表达影响肿瘤细胞恶性增殖



关键词:胃癌;CEP192;不良预后;增殖;细胞周期
胃癌位列全球第5大常见恶性肿瘤,其晚期5年生存率极低[1, 2]。为改善此状况,探索新型生物标志物及胃癌发展的分子机制至关重要[3, 4]。随着精准医学进展,胃癌的分子病理学研究不断深化,引领诊疗新方向[5-8]。CEP192,作为中心体蛋白的重要成员[9],主要参与人体有丝分裂中心体成熟和双极纺锤体组装过程[10, 11]。近年来,越来越多的研究开始关注CEP192 在肿瘤发生、发展中的作用。研究表明CEP192在肝细胞癌中显著高表达,与肿瘤免疫微环境密切相关并可作为评估肝癌患者预后的新型标志物[12]。此外,CEP192被证明是非酒精性脂肪肝病(NAFLD)进展为肝细胞癌(HCC)过程中的一个新型基因,其高表达与患者总体生存率降低显著相关[13]。沉默CEP192促进细胞周期进程中G0/G1 期的细胞比例,减少G2/M期细胞比例,阻碍细胞周期的进展,抑制肿瘤细胞的生长[14]。然而,CEP192在胃癌中的研究尚未见报道,其具体的生物学功能和作用机制有待进一步揭示。
本研究综合生物信息学和临床病例数据,深入探讨了CEP192 对胃癌患者预后及肿瘤细胞恶性增殖的影响。通过分子生物学、细胞生物学和组织病理学等多种研究手段,我们分析了CEP192在胃癌组织中的表达模式,并探究了其与胃癌患者临床病理特征、预后之间的关联。同时,我们还研究了CEP192在胃癌细胞增殖过程中的作用机制,旨在为胃癌的早期诊断、治疗策略制定及预后评估提供新的科学依据和有效方法。
1 材料和方法
1.1 资料采集
本研究对2013 年1 月~2018 年2 月在我院接受胃癌根治术的患者进行了回顾性分析。纳入的患者需满足以下条件:经病理学检查确诊为原发性胃癌,且成功施行胃癌根治术并达到R0切除标准。排除标准包括合并其他组织来源的恶性肿瘤、临床资料不完整以及术后5年内因非胃癌原因去世的患者。最终,我们筛选出了109例患者,相关资料,基线信息,如性别、年龄、术前外周血癌胚抗原(CEA)和肿瘤相关抗原199(CA199)水平、病理组织学类型、肿瘤大小及临床病理学分期等;通过电话随访或门诊复查收集的术后5 年生存情况;从医院病理科调取的手术病理蜡块,用于后续的免疫组织化学染色分析。本研究获得蚌埠医科大学第一附属医院伦理委员会的批准(伦理批号:伦科批字[2023]399号)。
1.2 在线数据库验证
利用TIMER2.0(http://timer. cistrome. org/)挖掘CEP192 在人类56 种常见恶性肿瘤中的表达情况。通过UALCAN(ualcan. path. uab. edu)及GEPIA(http://gepia.cancer-pku.cn/)中的TCGA队列挖掘CEP192 在胃癌中的表达情况。
1.3 免疫组织化学染色及积分光密度值(IOD)值分析
将患者的胃癌及其邻近的正常组织制备成石蜡切片,然后采用免疫组织化学染色法进行标记。染色过程包括脱蜡水化、抗原修复、抑制内源性过氧化物酶活性、血清封闭等步骤,采用一抗CEP192(1∶100,Proteintech,武汉三鹰)和二抗(兔聚合物法检测系统,PV-6001,中杉金桥,北京)进行孵育。利用DAB显色技术,并通过苏木素复染、分化、返蓝等步骤进行染色强化。完成染色后,对切片进行封片处理,并通过扫描获取实验数据。最终,我们使用Image Pro Plus软件对免疫组织化学染色的结果进行IOD的定量分析[15]。
1.4 生物学功能预测
利用cBioPortal 数据库(https://www. cbioportal.org)检索CEP192基因及其共表达基因,共获得2781个相关基因,设定相关系数绝对值大于4,共选定1248个相关基因;通过DAVID 生物信息学资源库(htpps://david.ncifcrf.gov)获取相关基因GO及REACTOME功能富集列表,其中GO富集项目涵盖了生物过程、细胞组成和分子功能3 个方面;利用Bioinformatics 在线作图工具(www.bioinformatics.com.cn)对富集结果进行可视化处理。利用UCSC Xena(https://xena.ucsc.edu/)获取胃癌数据集基因表达丰度值表,该数据集包含60 489 个基因和407 个样本。通过基迪奥生物平台的GSEA静态工具进行基因集功能富集分析(基因排序方式选择Signal2Noise)。
1.5 细胞培养,转染及分组
MGC-803 细胞用含有10% 胎牛血清(Gibco)的DMEM(Gibco)培养基进行培养,待细胞生长至对数生长期,0.25%胰酶(Beyotime)消化细胞,接种于6 孔板(Corning)中。分别设置short hairpin RNA negativecontrol (sh-NC)组,sh-CEP192 组,lentiviral vectornegative control (LV-NC)组,LV-CEP192 组,根据实验分组转染不同的慢病毒原液(上海吉凯生物有限公司)。具体为[16]:细胞接种于96 孔板,培养24 h,根据MOI 值每孔加入1 μL的1×108 TU/mL病毒原液,继续培养24 h后更换为完全培养基,嘌呤霉素(2 μg/mL,Beyotime)筛选稳转细胞株用于后续实验验证。
1.6 CCK-8细胞增殖实验
将转染后的细胞接种于96孔板,细胞密度为2×103/孔,设置sh-NC组,sh-CEP192组,LV-NC组,LV-CEP192组,每组分别设置3个复孔。37 ℃、5% CO2培养箱中继续培养24、48、72 h,更换为含10%的CCK-8试剂(Beyotime)的培养基孵育2 h,酶标仪检测吸光度值A450 nm[17]。
1.7 Western blotting实验
收集各组细胞,RIPA 裂解液裂解细胞,BCA(Beyotime)法测定总蛋白浓度。蛋白质经10% 的SDS-PAGE凝胶分离,转移至PVDF膜(Millipore),5%脱脂奶粉(Solarbio)室温封闭1 h,4 ℃冰箱中孵育一抗CEP192(1∶1000)、GAPDH(1∶2000)、PLK1(1∶1000)、CyclinB1(1∶1000)、CDK1(1∶1000)(Proteintech)过夜,TBST 洗膜,室温孵育辣根酶标记二抗(中山金桥,1∶4000)1 h,凝胶成像仪曝光条件,Image J 软件处理并分析结果。
1.8 裸鼠皮下成瘤实验
6~8周龄雄性BALB/c裸鼠购自江苏集萃药康有限公司。随机分为sh-NC组,sh-CEP192组,LV-NC组和LV-CEP192组, 3只/组,饲养于SPF级环境下。将稳定转染的各组细胞加入0.25%胰酶消化,PBS重悬细胞制成密度为1×108/mL的悬液。取100 μL细胞悬液接种于裸鼠背部皮下,于接种后第14天处死小鼠,瘤体拍照并称重,肿瘤体积(mm3)=(长径×短径2)/2。收集肿瘤组织研磨提取总蛋白,并采用Western blotting法检测组织中PLK1、CyclinB1及CDK1蛋白表达水平。
1.9 统计学方法
数据分析使用SPSS 26.0软件。计数资料采用n(%)表示,通过卡方检验进行组间比较。计量资料使用均数±标准差表示,符合正态分布的数据采用t检验进行两独立样本的比较,非正态分布的数据采用非参数检验(Mann-Whitney U检验)。为了评估患者的生存状况,我们绘制了K-M曲线。通过单因素和多因素Cox回归分析探究影响胃癌患者术后5年生存率的风险因素。利用ROC曲线分析了CEP192表达水平在预测患者术后5年生存率方面的价值。Plt;0.05时认为差异具有统计学意义。
2 结果
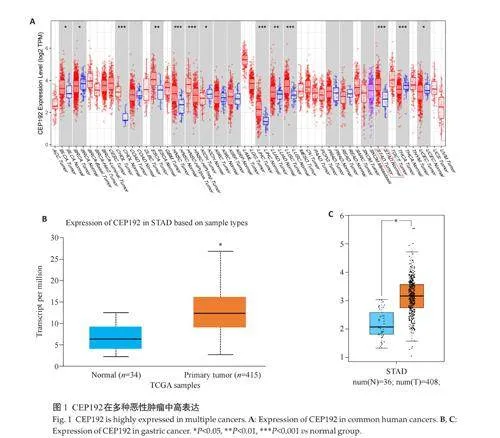
2.1 CEP192在多种恶性肿瘤中高表达
TIMER2.0 数据库分析显示,与正常组织相比,CEP192在包括胃腺癌(STAD)在内的多种肿瘤组织中高表达(图1A)。CEP192在胃癌组织中的表达水平均高于癌旁组织(Plt;0.05,图1B、C)。
2.2 CEP192在胃癌组织中表达升高
免疫组织化学染色结果显示,CEP192在胃癌组织中的表达高于癌旁组织,且主要定位于癌细胞胞质中(t=28.15,Plt;0.001,图2)。
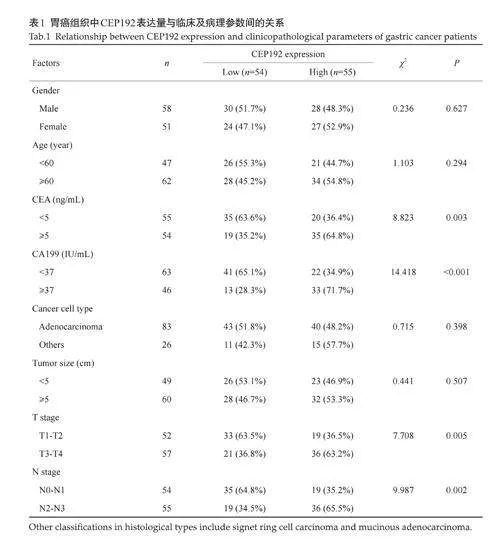
2.3 胃癌组织中CEP192 的表达与临床病理参数显著相关
根据胃癌组织中CEP192 表达相对IOD值的中位数(2.75),将患者分为CEP192 低表达组(n=54)和CEP192高表达组(n=55)。胃癌组织中CEP192表达水平与外周血CEA和CA199 水平、T分期及N分期相关(Plt;0.05,表1)。
2.4 CEP192的表达对胃癌患者术后5年生存率的影响
CEP192高表达组患者的胃癌根治术后5年生存率明显低于CEP192低表达组的患者(Plt;0.05,图3)。
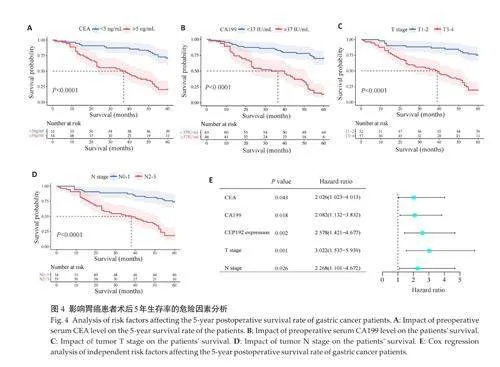
2.5 CEP192是影响胃癌患者术后5年生存率的危险因素
单因素分析结果显示,性别、年龄、病理组织学类型、肿瘤大小对胃癌患者术后5年生存率无统计学意义(Pgt;0.05)。CEP192高表达、CEA≥5 ng/mL、CA199≥37IU/mL、T3-4期和N2-3期可能是影响胃癌患者术后5年生存率的危险因素(图4A~D, Plt;0.05)。Cox回归进一步验证显示,CEP192 高表达是胃癌患者术后5 年生存率的一个独立危险因素(Plt;0.05),该结果与CEA≥5 ng/mL、CA199≥37 IU/mL、以及肿瘤分期(T3-4 期和N2-3 期)对胃癌远期预后的影响相平行(Plt;0.05,图4E)。
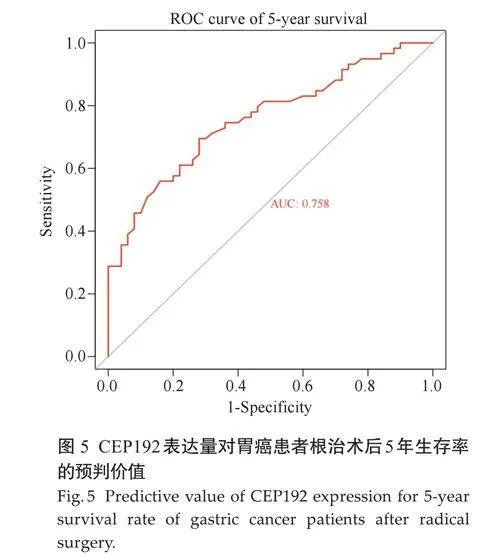
2.6 CEP192对胃癌患者的远期预后具有预测价值
ROC曲线下面积为0.758,CEP192 的截断值对应的相对表达量为2.745,敏感度为0.695,特异度为0.720(Plt;0.05,图5)。
2.7 CEP192可能参与调控胃癌的生物学功能
GO 富集分析显示,生物学过程富集在细胞周期、凋亡、DNA复制调控等条目,细胞定位富集在中心体、胞质、染色体等条目,分子功能富集在ATP 酶活性调控、解螺旋酶活性调控、DNA聚合酶活性调控等条目(图6A)。REACTOME 富集在细胞周期、G2/M期转化调控PLK1 活性、TP53 活性调控等生物学过程(图6B)。同时GSEA基因集富集进一步分析结果显示,CEP192 及其共表达基因在细胞周期、G2/M转化、G2/M检查点正向调控(图6C~E),在细胞凋亡、错配修复、TP53 活性调控中呈负向调控(图6F~H)。
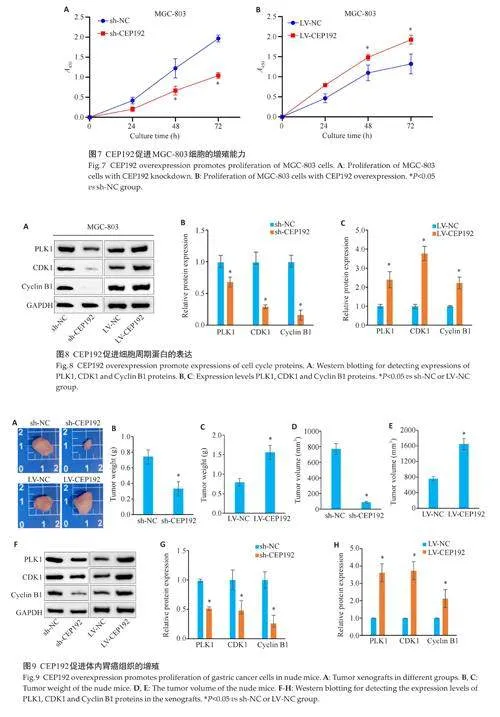
2.8 CEP192促进胃癌细胞的增殖能力
CCK-8 实验结果显示,与sh-NC对照组相比,sh-CEP192处理组显著降低了MGC-803细胞的增殖能力;同时,与LV-NC对照组相比,LV-CEP192处理组则显著增强了MGC-803细胞的增殖能力,差异具有统计学意义(Plt;0.05,图7)。
2.9 CEP192可能通过调节G2/M期关键蛋白的表达促进胃癌细胞恶性增殖
干扰CEP192后中心体蛋白激酶PLK1表达水平下降,过表达CEP192后PLK1蛋白表达水平升高(Plt;0.05,图8)。敲低CEP192后CDK1与Cyclin B1蛋白表达水平明显下降,过表达呈上升趋势(Plt;0.05,图8)。
2.10 CEP192促进裸鼠肿瘤的增殖能力
敲低CEP192裸鼠肿瘤的体质量显著减少,瘤体明显缩小(Plt;0.05,图9A~E)。免疫印迹结果示,敲低CEP192后肿瘤组织中PLK1、CDK1、Cyclin B1表达降低,而过表达使其蛋白水平上升(Plt;0.05,图9F~H)。
3 讨论
本研究发现CEP192在胃癌组织中高表达,与胃癌患者不良预后显著相关,体内外实验发现CEP192促进胃癌细胞的增殖能力,可能与调控细胞周期进程中G2/M期关键蛋白水平有关。这一发现不仅为CEP192 在胃癌中的作用机制提供了新的见解,也为胃癌的治疗提供了新的潜在靶点。
细胞能够正常的有丝分裂依赖于中心体,多种肿瘤的发生发展与中心体异常扩增密切相关,这提示中心体可能成为诊断肿瘤的生物标志物之一[18-21]。CEP192参与哺乳动物细胞有丝分裂纺锤体的形成,是中心体复制启动过程和中心体微管成核的关键因素,其缺失可能导致中心体功能丧失,促进肿瘤发生发展[22-24]。CEP192的异常表达已被证实与肿瘤的发生、发展及预后密切相关。在肝细胞癌中,CEP192的高表达与肿瘤分期及患者不良预后相关,沉默CEP192后细胞周期抑制肿瘤增殖和自我更新能力,可能作为肝癌的潜在预后标志物[12]。CEP192作为非酒精性脂肪肝病进展为肝细胞癌过程中的一个新型调控基因,其高表达与患者生存率降低明显相关[13]。沉默CEP192 后G2/M期细胞数量减少,细胞周期进展受到阻滞,抑制肿瘤细胞的生长[14]。本研究通过公共数据库发现CEP192 在包括胃癌在内的多种恶性肿瘤中显著升高,通过免疫组化实验证实CEP192 在胃癌组织中的表达高于癌旁组织,说明CEP192可能在胃癌中发挥癌基因的作用。通过采集临床患者的病例资料发现, CEP192 与外周血CEA、CA199 水平、T分期、N分期相关,提示CEP192 可能参与胃癌的恶性进展,且CEP192高表达患者的生存率较低表达患者更低,是影响胃癌患者术后5年生存率的独立危险因素,提示CEP192在胃癌中的表达水平与患者的不良预后显著相关。据此,我们推测,CEP192在胃癌中高表达与患者预后不良相关。
为进一步探讨CEP192对胃癌生物学功能的影响,我们通过生信分析发现CEP192显著富集于细胞周期,并于G2/M转化期调控PLK1的活性。由于中心体复制在细胞周期进程中是一个严格的调控过程,细胞周期及相关蛋白的改变可能导致中心体异常扩增[25-27]。在G2/M期,CDK1-CyclinB1复合物作为启动有丝分裂的触发因子,其活性受到抑制可能会导致G2/M期阻滞并引起中心体异常扩增[28-30]。而PLK1,一种负责调节G2到M期的中心体有丝分裂激酶,作为CDK1-CyclinB1 的上游基因,激活CDK1-CyclinB1,在多种肿瘤中显著高表达,参与肿瘤发生发展[31, 32]。 基于以上理论,我们假设CEP192 可能通过调控细胞周期进程中PLK1/CDK1/CyclinB1信号影响胃癌细胞的恶性增殖。通过体内外实验,我们发现,CEP192 促进胃癌细胞的增殖能力,小鼠肿瘤组织的成瘤特性以及G2/M 期关键蛋白PLK1、CDK1、CyclinB的表达,说明抑制CEP192 的活性可能会导致G2/M 期阻滞和中心体异常扩增,CEP192 可能是启动胃癌细胞有丝分裂的触发因子。这一发现为CEP192 对胃癌生物学行为影响的揭示提供理论依据。
然而,本研究仍存在一定的不足:首先,本研究是一项回顾性研究,存在病例选择偏倚及资料收集的局限性。其次,本研究纳入病例数有限,所得结果需要进一步扩大样本量进行验证。此外,本研究初步探索了CEP192影响胃癌患者远期预后的可能作用机制,其可能参与的其他分子机制仍需进一步验证。
综上,CEP192 在胃癌组织中高表达,与患者的不良预后相关,其可能通过调控G2/M期关键蛋白表达影响肿瘤细胞的恶性生物学行为,该分子有望成为评估胃癌患者预后的潜在靶标。

