透骨消痛胶囊调控Nav1.7减轻膝骨关节炎小鼠软骨细胞退变
关键词:透骨消痛胶囊;Nav1.7;软骨退变;膝骨关节炎
膝骨关节炎(KOA)是一种常见于中老年人群,以膝关节软骨退变为主要病理的膝关节疾病[1-3]。依据祖国传统医学理论,KOA的核心病机是“本痿标痹”,疾病的根本在于肝肾不足,标为风湿痹痛,因此治疗应补肝肾祛风湿,以缓解症状和延缓病情进展。透骨消痛胶囊(TGXTC,巴戟天、白芍、川芎和肿节风组成)作为福建中医药大学附属第二人民医院的常用院内制剂,在缓解关节疼痛、改善关节功能及延缓软骨退变方面具有显著的疗效[4-6]。
研究证实,电压门控钠离子通道α亚型1.7(Nav1.7)主要存在于背根神经节神经元[7-9],与疼痛的发生和发展密切相关[10-12]。通过不同途径向OA 大鼠模型递送Nav1.7的选择性阻滞剂可以显著减轻OA大鼠的疼痛症状。近期研究显示,OA软骨细胞胞质中Nav1.7表达上升,且参与OA软骨细胞外基质代谢,对OA软骨退变的进展有重要的调控作用[13]。既往研究主要集中在Nav1.7表达与疼痛感知之间的关系[14-16],缺乏对其在软骨细胞退变及炎症反应中的角色的详细探讨,而Nav1.7 在KOA软骨细胞退变中具体调控机制的研究较少,且尚未明确Nav1.7 是否参与透骨消痛胶囊延缓KOA进程的作用机制。此外,透骨消痛胶囊对KOA的疗效研究多集中于整体症状改善[17],缺乏深入的分子机制探讨。本研究旨在通过体内和体外实验,深入分析Nav1.7在KOA软骨细胞退变中的功能,并探索透骨消痛胶囊通过调控Nav1.7对KOA的潜在保护作用机制,为KOA的分子靶向治疗提供新的理论依据,并为透骨消痛胶囊的临床应用提供科学支持。
1 材料和方法
1.1 实验动物
40 只2 月龄SPF 级雄性C57BL/6 小鼠购自SlACANIMAL[合格证号:SCXK(沪)2017-0005)]。小鼠饲养于福建中医药大学实验动物中心,并获得伦理审批[伦理批号:FJTCM IACUC-2023057]。
1.2 药物与试剂
透骨消痛胶囊(福建中医药大学附属第二人民医院);甲苯胺蓝染色液(北京索莱宝生物科技有限公司);双氯芬酸钠(国药集团致君坪山制药有限公司);Nav1.7、环氧合酶-2(COX-2)、基质金属蛋白酶-13(MMP-13)、MMP-3(武汉三鹰生物技术有限公司);ADAMTS-4 解聚蛋白酶4(ADAMTS-4)、ADAMTS-5(Bioss Biotechnology);Nav1.7、GADPH引物由福州尚亚生物技术有限公司设计与合成,Nav1.7 引物序列(5'-3'):AAGATGGAGACAGAGATGACGATT;GGAAGGTGGAGAGATGGTAGAG。GADPH 引物序列(5'-3'): TGGAAAGCTGTGGCGTGATG;TACTTGGCAGGTTTCTCCAGG。
1.3 仪器
DM2700P 电子显微镜(徕卡),ELX800 全自动酶标仪(BIO-TEK),GelDoc 2000 凝胶成像系统(Bio-Rad),CFX96荧光定量PCR仪(Bio-Rad)等。
1.4 方法
1.4.1 动物分组、造模及干预 40 只2 月龄C57BL/6 小鼠采用随机数字表法将其分为空白组(n=10)和造模组(n=30)。造模组小鼠采用Hulth 法建立KOA模型,再随机分为3 组:模型组、透骨消痛胶囊组和阳性药物组(双氯芬酸钠缓释胶囊),10只/组。阳性药物组和透骨消痛胶囊组分别给予10 mg/kg 的双氯芬酸钠灌胃[1]和368 mg/kg透骨消痛胶囊灌胃,给药剂量依据动物体质量计算,给药频率为6次/周,持续4周。
1.4.2 组织取材及含药血清的制备 在最后一次药物灌胃结束后,用5%异氟醚对实验动物进行吸入麻醉处死。将收集的各组膝关节软骨组织放置于超低温环境保存备用。通过眼球采血获取的血清放置在-80 ℃冰箱中保存。选择15%透骨消痛胶囊含药血清进行24 h干预,以进行后续实验。
1.4.3 软骨组织形态学观察 HE染色步骤:小鼠膝关节组织切片后,脱蜡、苏木精染色、漂洗、返蓝、伊红染液染色、梯度乙醇脱水、梯度二甲苯透明、中性树脂封固,显微镜下观察。番红O-固绿染色步骤:样本脱蜡,番红O染色、漂洗、固绿染色、漂洗、乙醇分化水洗、番红O复染、水洗,中性树脂封固,显微镜下观察。甲苯胺蓝染色:骨组织二甲苯脱蜡,梯度乙醇至水。切片甲苯胺蓝染色30 min,自来水冲洗2 min,丙酮分化至软骨细胞紫蓝色清晰可见,乙醇脱水,滴加二甲苯透明,中性树胶封片,显微镜观察。
1.4.4 软骨组织中Nav1.7 mRNA变化情况 RNA从软骨组织提取后进行逆转录合成cDNA,用于实时PCR分析基因表达。步骤包括Trizol裂解、氯仿萃取、异丙醇沉淀、乙醇洗涤,并使用DEPC 水复溶。逆转录后的cDNA通过qPCR定量,Nav1.7基因表达量通过2-ΔΔCt法计算。
1.4.5 Western blotting检测软骨组织中Nav1.7、MMP-3、ADAMTS-5、COX-2 蛋白表达 软骨组织样本在液氮中研磨并用组织裂解液处理。通过4 ℃下振荡和离心提取蛋白上清。用BCA法测定蛋白浓度,然后将上清与上样缓冲液混合后变性。SDS-PAGE电泳后,蛋白转移到PVDF 膜,进行封闭后,Nav1.7(1∶1000)、MMP-3(1∶1000)、ADAMTS-5(1∶1000)、COX-2(1∶1000)一抗和GAPDH(1∶1000)二抗孵育,最后用化学成像系统显影分析。
1.4.6 小鼠软骨细胞模型制备 10 ng/mL IL-1β刺激软骨细胞24 h,成功建立软骨细胞KOA退变模型[18, 19]。
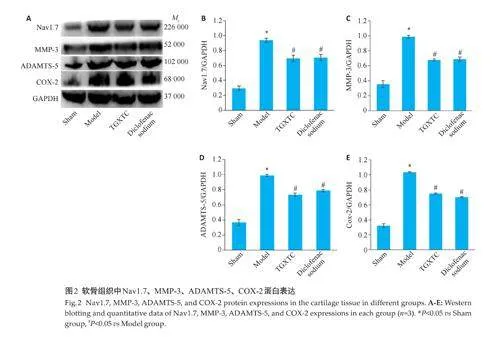
1.4.7 荧光原位杂交(FISH)检测软骨细胞中Nav1.7的表达 使用http://www. generalbiol. com/筛选并合成DIG标记的Nav1.7 RNA探针。软骨细胞固定于37 ℃、4%多聚甲醛1 h,蛋白酶-K孵育2 h。杂交缓冲液37 ℃孵育1 h,加入500 nmol/L Nav1.7 探针,42 ℃过夜。次日梯度洗涤,加入DIG标记探针,42 ℃下孵育3 h,封闭30 min。PBS 洗涤,室温下抗DIG-HRP 抗体反应30 min,避光处理CY3-TSA 5 min。DAPI 染色8 min,荧光显微镜下观察。
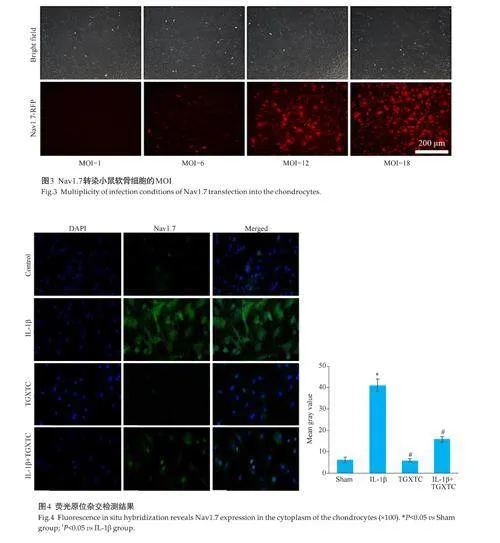
1.4.8 构建Nav1.7 沉默的小鼠软骨细胞 通过慢病毒包被的质粒进行sh-Nav1.7 转染小鼠软骨细胞。将对数生长期的小鼠软骨细胞接种于6 孔板中,每孔加入5 μg/mL聚醚与Nav1.7,最佳感染复数(MOI)设置为1、6、12、18。感染50 h后,获取荧光图像。
1.4.9 Real-time PCR检测Nav1.7敲低条件下透骨消痛胶囊对IL-1β 诱导的小鼠软骨细胞中Nav1.7 表达变化Real-time PCR检测方法同1.4.4。
1.4.10 Western blotting检测Nav1.7敲低条件下透骨消痛胶囊对IL-1β 诱导的小鼠软骨细胞中MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、COX-2 的蛋白表达变化 Western blotting检测方法同1.4.5。条带进行封闭后,MMP-3(1∶1000)、MMP-13(1∶1000)、ADAMTS-4(1∶1000)、ADAMTS-5(1∶1000)、COX-2(1∶1000)一抗和GAPDH(1∶1000)二抗孵育,化学成像系统显影分析。
1.4.11 统计学分析 采用SPSS 26.0软件进行统计学分析。计量资料以均数±标准差表示,对统计数据进行正态性及方差齐性检验,对于符合正态分布的数据采用单因素方差分析法,方差齐的数据采用最小显著差法检验,方差不齐的数据采用Games-Howell 法;不符合正态分布的数据采用非参数检验进行比较。以Plt;0.05为差异有统计学意义。
2 结果
2.1 一般情况观察
空白组小鼠皮毛光亮,对外界刺激(如轻拍鼠笼)快速反应,动作灵活,活动力强;模型组小鼠皮毛黯淡,对外界刺激反应较慢,加强刺激后才表现出短距离跛行,食量下降,膝关节肿胀明显,不欲活动。透骨消痛胶囊组和阳性药物组小鼠膝关节肿胀程度与模型组相比有所缓解,对外界刺激反应更为敏感,食量增多。
2.2 软骨组织病理改变情况
HE染色可见:空白组关节软骨层连续完整,软骨下骨结构清晰;模型结构部分缺损,严重破坏。透骨消痛胶囊组和阳性药物组软骨层结构基本完整,相较于模型组破坏程度改善。番红O-固绿染色可见:空白组软骨四层结构完整,软骨基质丰富且染色鲜红;模型组浅表层粗糙,番红O染色显著减弱,部分区域失染;透骨消痛胶囊组和阳性药物组软骨结构相对清晰完整,且软骨基质的番红O染色明显增强。甲苯胺蓝染色可见:模型组软骨层厚度与空白组相比明显变薄,透骨消痛胶囊组和阳性药物组的软骨厚度与模型组相比关节结构破坏程度显著减轻(图1)。
2.3 各组软骨组织中Nav1.7 mRNA水平
Real-time PCR 结果显示,模型组软骨组织中Nav1.7 mRNA水平与空白组比较显著上升(Plt;0.05);与模型组对比,透骨消痛胶囊组(2.10±0.06)和阳性药物组(2.03±0.04)软骨组织中Nav1.7 mRNA水平下降(Plt;0.05)。
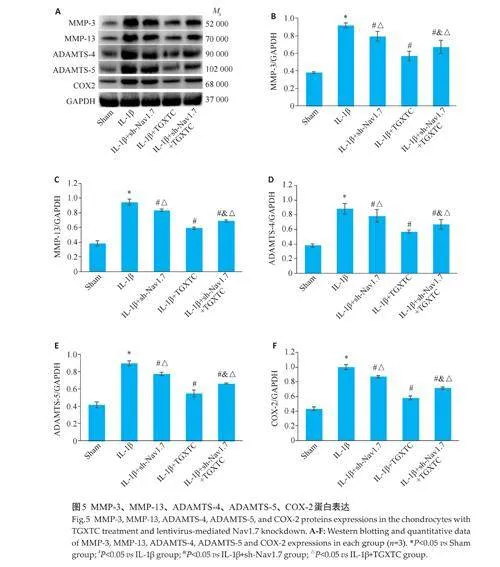
2.4 各组软骨组织中Nav1.7、MMP-3、ADAMTS-5、COX-2蛋白表达
Western blotting 结果显示,模型组软骨组织中Nav1.7、MMP-3、ADAMTS-5、COX-2 蛋白表达与空白组比较上升(Plt;0.05);与模型组对比,透骨消痛胶囊组和阳性药物组软骨组织中Nav1.7、MMP-3、ADAMTS-5、COX-2蛋白表达下降(Plt;0.05,图2)。
2.5 Nav1.7转染小鼠软骨细胞的MOI
当MOI为12 h,细胞存活率最高,Nav1.7的转染效率最佳(图3)。
2.6 FISH检测结果
FISH结果显示,Nav1.7主要集中在软骨细胞质中(图4)。使用IL-1β诱导后,软骨细胞中Nav1.7的相对拷贝数增加(绿色荧光)(Plt;0.05)。透骨消痛胶囊干预后,Nav1.7的荧光强度降低(Plt;0.05)。
2.7 Real-time PCR检测Nav1.7敲低条件下透骨消痛胶囊对IL-1β诱导的软骨细胞Nav1.7 mRNA水平变化
Real-time PCR 结果显示,IL-1β 组软骨细胞中Nav1.7 mRNA水平较空白组上升(Plt;0.05);与IL-1β组相比,IL-1β+TGXTC 组和IL-1β+sh-Nav1.7 组的软骨细胞中Nav1.7 mRNA 水平下降(Plt;0.05);与IL-1β+TGXTC组相比,IL-1β+sh-Nav1.7+TGXTC组的软骨细胞中Nav1.7 mRNA水平下降(Plt;0.05)。
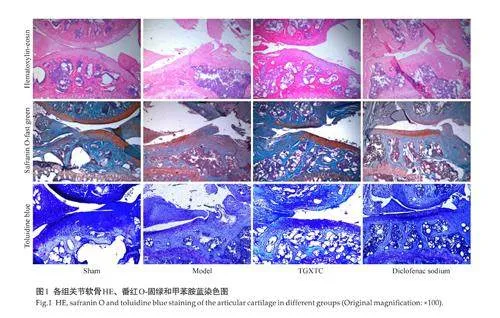
2.8 Western blotting 检测Nav1.7 敲低条件下透骨消痛胶囊对IL-1β 诱导的软骨细胞MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、COX-2的蛋白表达影响
Western blotting 结果显示,模型组与空白组相比较,软骨细胞中MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、COX-2 蛋白表达上升(Plt;0.05),Nav1.7敲低后,透骨消痛胶囊对IL-1β诱导的小鼠软骨细胞中MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、COX-2调控作用减弱(Plt;0.05,图5)。
3 讨论
透骨消痛胶囊是福建中医药大学刘献祥教授在治疗骨痹方面的经验方,该方由巴戟天、白芍、川芎和肿节风四味中药配伍而成,具有补肾柔肝、活血祛风的功效,符合KOA“本痿标痹”的主要病机。课题组前期已建立透骨消痛胶囊的质量标准[20],并进行了透骨消痛胶囊的急性毒性实验,证实透骨消痛胶囊安全性较好[21]。课题组亦开展了透骨消痛胶囊的药代动力学研究、化学空间分析[22, 23],证实透骨消痛胶囊具有较好的吸收和穿透特性,且在治疗KOA方面存在多靶点、多途径分子作用机制。
双氯芬酸钠在临床上被广泛用于治疗KOA,其在减轻疼痛和改善功能方面效果显著[24-26],因此本研究选择双氯芬酸钠作为阳性对照药物。小鼠软骨组织病理染色结果显示,透骨消痛胶囊组干预后能有效缓解关节结构破坏程度,表明透骨消痛胶囊可以发挥有效的软骨保护作用。透骨消痛胶囊可通过多种机制延缓软骨退变,包括抗氧化、抗炎、抑制KOA软骨基质代谢紊乱等[27-30],这些机制的协同作用使透骨消痛胶囊在预防和治疗软骨退变方面显示出疗效。MMP-13被认为是参与软骨退变的标志,其特征在于它能够特异性地切割Ⅱ型胶原蛋白,从而参与软骨的降解[31-33]。ADAMTS5通过降解软骨基质中的聚集蛋白多糖,导致软骨失去缓冲和抗压能力,进而导致软骨结构性破坏和退化[34-36]。COX-2在软骨退变中的作用主要通过其诱导的前列腺素E2 生成来实现,前列腺素E2 不仅促进炎症反应,还上调基质金属蛋白酶的表达,从而增强软骨基质降解,并诱导软骨细胞凋亡,进一步推动软骨退变[37-39]。本研究体内实验结果显示,透骨消痛胶囊不仅改善KOA小鼠关节结构破坏程度,减少MMP-3、ADAMTS-4、ADAMTS-5等软骨降解酶的表达,还能降低KOA小鼠模型中Nav1.7的mRNA与蛋白表达量。因此,本研究验证透骨消痛胶囊可通过抑制KOA软骨基质代谢紊乱发挥有效的软骨保护作用,在此基础上发现Nav1.7 参与透骨消痛胶囊的作用机制。
为了进一步探索透骨消痛胶囊是否能通过调控Nav1.7发挥延缓KOA软骨退变的作用,本研究在体外培养小鼠软骨细胞,构建Nav1.7沉默的小鼠软骨细胞,并使用IL-1β诱导KOA模型。体外培养的软骨细胞在受到IL-1β诱导后,细胞质内的Nav1.7荧光强度和mRNA水平显著提高,而透骨消痛胶囊干预可以显著抑制异常升高的Nav1.7的荧光强度和mRNA水平。在细胞实验中再次证实了透骨消痛胶囊可以抑制软骨分解代谢基因(如MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、COX-2)表达水平升高,当选择性抑制Nav1.7时,透骨消痛胶囊对IL-1β 诱导的小鼠软骨细胞中MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、COX-2 调控作用减弱,这与既往有关Nav1.7 的研究[40]结果一致,该研究也表明通过阻断Nav1.7来发挥降低啮齿类动物骨关节炎疼痛模型的作用。这一发现也得到了其他学者支持,其指出Nav1.7 可作为骨关节炎的软骨细胞调节剂和治疗靶点[41]。在此基础上,从Nav1.7调控KOA软骨细胞退变角度,本研究揭示了透骨消痛胶囊可通过调控Nav1.7,改善软骨细胞外基质代谢紊乱,延缓KOA软骨细胞退变。
综上所述,本研究通过动物和细胞实验发现,在KOA 小鼠软骨组织和软骨细胞中,Nav1.7、MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、COX-2均高表达,透骨消痛胶囊干预能降低其表达;但在Nav1.7敲低后,透骨消痛胶囊对这些蛋白的调控作用减弱。因此,透骨消痛胶囊可通过调控Nav1.7,改善软骨细胞外基质代谢紊乱,延缓KOA软骨细胞退变,其具体的作用机制有待进一步研究。

