肝豆补肾汤通过激活ERK信号通路减少Wilson病TX小鼠异常精子生成并促进生精细胞增殖

关键词:Wilson 病;肝豆补肾汤;铜沉积;ERK信号通路;精子发生
Wilson 病(WD)又名肝豆状核变性,是一种由ATP7B基因突变引起的铜代谢异常的常染色体隐性遗传病[2, 3]。ATP7B主要在肝脏中表达,正常情况下通过胆汁促进体内过量铜的排泄。由于ATP7B功能障碍,WD患者体内铜沉积过多。近年来,WD导致生殖系统损害的问题逐渐引起重视。研究指出,WD女性患者的异常妊娠结局中自然流产最为常见,其中未经治疗的患者中更容易观察到自然流产,即使成功分娩也存在出生缺陷[4, 5]。男性患者则会出现性腺功能低下、乳房发育、阳萎、不育等症状[6, 7]。除了生殖内分泌方面的变化,在WD男性患者身上还存在少精、弱精、生育力下降等问题[8]。研究表明,铜在男性生殖中起着特殊作用,性腺中铜过载会使精子质量恶化并干扰生殖功能,并可能通过自噬、氧化应激及生精细胞凋亡损伤睾丸[9-11]。目前,WD的主要治疗方法是使用金属螯合剂从体内清除过量的铜;尽管WD的现代医学治疗对一些患者有效,但目前疗法存在局限性。约50%的WD患者在治疗期间仍会出现神经系统症状,甚至恶化情况[12]。约1/3 的WD患者出现药物不良反应,青霉胺被用作有症状的WD患者的一线治疗药物[13],反而存在更多的不良反应,如恶心、呕吐、皮疹、发热甚至系统性红斑狼疮等[14, 15]。考虑到后代的健康,由WD引起的生殖障碍的男性患者需要更安全的药物。
课题组前期对WD患者进行大样本证候学调查显示,该病主要证候为瘀血、痰浊,与湿热密切相关,痰瘀互结为其主要病因病机,也是其发病的核心证候[16]。临床和动物实验研究表明[17-19],由我院自主研发的肝豆灵片/汤可通过促进WD患者及模型小鼠尿铜排泄、改善肝肾功能和脑血管损伤、促进神经干细胞分化等作用治疗WD并且疗效显著。但WD临床症状复杂,仅通过临床表现和生理或生化检查进行诊断会忽视生殖系统损害。本课题组前期通过中医证候学调查发现,WD伴男性生殖损害的中医病因病机可总结为肾虚为本,痰湿、瘀血为标[16, 20]。肾藏精,主生殖,只有肾气充实,生长发育、生殖功能才能正常,基于以上调查研究及“肾主生殖”理论,我们在肝豆灵的基础上添加了补肾药物治疗WD患者合并生殖功能障碍。我们前期进行的临床及基础实验研究发现GDBSD可以有效改善WD生殖系统的损害[8, 21-25]。
细胞外调节蛋白激酶(ERK)信号通路是细胞增殖和凋亡信号网络的核心[26, 27],在精原干细胞周期性活动期间,ERK信号通路被周期性激活,以维持精原干细胞的增殖和分化[28, 29]。ERK信号通路的异常会严重损害睾丸功能,从而影响男性生殖。有研究指出,长期铜暴露可诱导动物睾丸组织损伤,引起细胞凋亡并影响生殖功能[30]。因此,减少睾丸组织中的凋亡并促进细胞增殖可能是治疗WD男性生殖障碍的基本策略之一。前期研究发现,WD铜沉积可能通过抑制ERK信号通路诱导下丘脑-垂体组织细胞凋亡从而影响生殖激素水平,进而导致WDTX小鼠的生育能力下降,而GDBSD可以逆转WDTX 小鼠下丘脑-垂体-性腺轴的损害情况[21, 22, 31]。临床研究也证明,GDBSD可以明显改善WD患者的生殖损害[23-25]。然而,除了垂体源性影响外,目前尚不明确中医药治疗该病对睾丸、附睾组织、精子发生过程以及生育力的影响,以及ERK信号通路在这一过程中的作用机制。故本研究通过U0126抑制剂的干预,推测WD模型TX小鼠铜稳态失衡可能通过ERK信号通路直接损伤其睾丸组织及精子发生异常。本实验基于ERK信号通路研究GDBSD对铜沉积诱导的WD雄性TX小鼠睾丸精子发生异常的作用。
1 材料和方法
1.1 实验动物
4周龄WDTX小鼠购自杰克逊实验室(美国)。将60只纯合雄性TX小鼠(体质量20±5 g)随机分为4组:WD模型、青霉胺组、GDBSD组、GDBSD+U0126组(n=15),并以15只正常DL小鼠(20±5 g)为对照组。每组小鼠都关在单独通风的笼子,并允许自由出入,动物房温度控制在20~25 ℃,湿度50%~60%,适应性喂养至12周龄后进行实验。该实验经安徽中医药大学动物实验伦理委员会审核通过(伦理批号:2024027)。
1.2 实验药品
肝豆补肾汤为安徽中医药大学第一附属医院(安徽省中医院)院内制剂,肝豆灵片(皖药制字:Z20050071),加中药颗粒剂熟地黄、当归、菟丝子、益母草、杜仲、枸杞子、淫羊藿组成,颗粒剂由广东一方制药提供。青霉胺片(0.125 g/粒,国药准字:H31022286,上海上药信宜药厂有限公司),U0126(cell signaling)。使用方法:DMSO溶解后再以生理盐水稀释,可以抑制ERK1/2信号通路的活化。5-溴-2-脱氧尿嘧啶(BrdU,Sigma-Aldrich)。
1.3 方法
1.3.1 分组处理、给药及取材 GDBSD组每天同一时间给予GDBSD药液灌胃,0.2 mL/(10 g·d);青霉胺组以青霉胺药液灌胃(0.09 g/kg);WD模型组给予同体积的生理盐水灌胃,连续28 d;GDBSD+U0126 组每天给予GDBSD药液灌胃0.2 mL/(10 g·d),加每天下午同一时间腹腔注射U0126(20 mg/kg),连续28 d。实验结束前1 d,每组取3 只小鼠分别于早晚各注射1 次BrdU(100 μL/mg)。实验结束的次日早晨,小鼠予以1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,眼球取血后,选择5只/组小鼠,将左侧睾丸组织置入4%多聚甲醛溶液中进行固定处理;取右侧小块睾丸组织予以2.5%戊二醛固定制备电镜切片;取附睾组织取精液检测精液质量并制备精子涂片;另外5只小鼠取出睾丸组织于-80 ℃快速冷冻保存;小鼠右侧附睾组织用4%多聚甲醛固定,制备病理切片,左侧附睾组织予以2.5%戊二醛固定剂(4 ℃预冷)固定制备电镜切片。
1.3.2 检测睾丸组织中的铜含量 将睾丸组织放入烧瓶中,加入硝酸4 mL和高氯酸1 mL浸泡过夜。然后,加入3 mL按4∶1配制的hNO3HCLO4混酸消化液,在电热板上消化,直至无色透明,并加入少量去离子水去酸。冷却后,用去离子水定容至10 mL,以等量的混合酸消解液作为消解样品,空白样品按同样方法制备。用铜标准备用溶液配制标准应用溶液。将铜元素标准系列、试剂空白溶液和消解样品溶液导入原子吸收光谱仪重复测定。
1.3.3 HE染色法观察小鼠睾丸和附睾的病理结构以及精子结构 用4%多聚甲醛溶液固定附睾24~48 h。石蜡包埋后制成连续切片,切片厚度为4 μm。切片放入66 ℃干燥箱中烤20~30 min,于二甲苯溶液中脱蜡3次,5 min/次。将切片依次在100%、95%、80%乙醇中复水3 min。将复水后的切片投入苏木素染液(XinleBiotechnology)浸染2~5 min,使用1%盐酸酒精分化数秒,蒸馏水冲洗后将切片置于95%乙醇中复水2 min。将切片置于伊红染液(Xinle Biotechnology)浸染数秒后,置于100%乙醇中脱水处理。最后将切片依次浸入苯酚-二甲苯、二甲苯I、II进行透明处理2 min,予以中性树胶封片,在光学显微镜下观察结果。染色结果显示,苏木素染成蓝色,胞浆被曙红染成红色[28]。
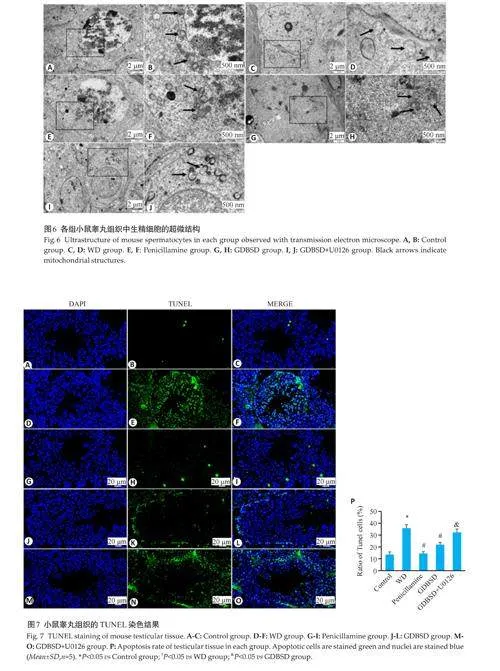
1.3.4 电子显微镜观察睾丸生精细胞和精子超微结构新鲜睾丸及附睾组织予以2.5%戊二醛固定6~12 h后取出,用PBS液体冲洗干净, 使用1%锇酸固定1~2 h。睾丸组织依次经过30%、50%的乙醇脱水处理,投入70%乙醇醋酸铀中进行包埋前染色。然后依次使用85%、90%、100%乙醇进行脱水处理。脱水后将组织投入环氧丙烷中处理1~2 h,投入纯环氧树脂中浸泡2~3 h。经纯环氧树脂包埋后分别在40 ℃、60 ℃烤箱中烤12、48 h。取出包埋块进行切片,切片厚度为70 nm。将干燥完毕带有样品的铜网投入3%醋酸铀-枸橼酸铅双染色,通过电子显微镜(JEM1400)观察。
1.3.5 TUNEL法标记睾丸组织凋亡细胞 用TUNEL细胞凋亡检测试剂盒(安徽欣乐生物技术有限公司)处理组织切片。切片在66 ℃的烘干箱中烘烤20~30 min,然后在二甲苯中浸泡3次,5 min/次。依次用100%、95%、80%乙醇复水3 min。用蒸馏水和PBS漂洗3 次,加入20 μg/mL不含脱氧核糖核酸酶的蛋白酶K,37 ℃孵育。用TdT酶+荧光标记液(TdT酶+荧光标记液=1∶9)滴入切片,室温黑暗孵育60 min,用PBS漂洗3 次。将带有抗荧光猝灭安装介质(包含DAPI)的切片贴片,用数字切片扫描仪扫描荧光切片。
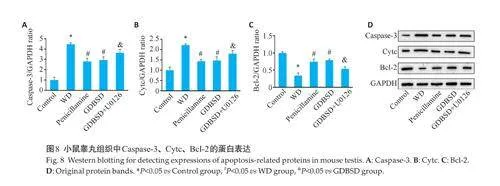
1.3.6 免疫印迹检测细胞凋亡和ERK信号通路相关蛋白 睾丸组织用RIPA细胞裂解缓冲液(Beyotime)裂解,冰浴匀浆,提取总蛋白。根据TRAKRA产品目录配置凝胶。将5XSDS-PAGE上样缓冲液按1:4加入收集的蛋白质样品中,沸水浴中加热15 min,使蛋白质完全变性。在每孔SDS-PAGE胶中加入5~10 μL蛋白质样品。在恒压80 V条件下,电泳1 h。将与胶条尺寸相同的滤纸和预切的PVDF膜( 甲醇中浸泡2~3 min),在转移缓冲液中浸泡5 min,恒流转膜。加入Western封闭液(5%脱脂奶粉),室温封闭2 h。分别加入ERK1/2(稀释比例1∶1000),p-ERK1/2(稀释比例1∶1000),Cytc抗体(稀释比例1∶2000),Caspase-3抗体(稀释比例1∶3000)和Bcl-2 抗体(稀释比例1∶2000),在4 ℃下封闭过夜。按照1∶1000用二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗,室温孵育1.2 h。采用ECL发光试剂盒(德国达姆施塔特米利波尔)检测蛋白质并通过Image J软件分析蛋白质水平。
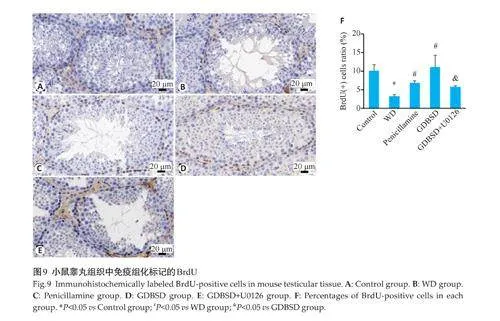
1.3.7 免疫组化标记BrdU阳性细胞 按以上方法制备石蜡切片。将组织切片于二甲苯溶液中脱蜡3次,分别于100%、95%、80%的乙醇中复水3 min,洗去乙醇,直到切片干净透明。抗原高压修复:在高压锅内配制2000 mL pH 为6.0 的柠檬酸盐修复液。将切片放入3%H2O2中室温孵育,并分别用蒸馏水、PBS-T冲洗3次。滴加一抗(BrdU),置于37 ℃培养箱孵育60 min,PBS-T冲洗3 次,滴加二抗,并置于37 ℃培养箱孵育30 min,PBS-T冲洗3次。滴加DAB显色剂,显微镜下控制显色时间,出现阳性终止显色,并用蒸馏水冲洗干净。苏木素染色2~5 min,水洗干净;1%盐酸酒精分化后水洗干净。碳酸锂溶液蓝化30 s后水洗干净。置于100%乙醇脱水,二甲苯透明处理后中性树胶封片。TUNEL染色后通过显微镜观察结果。染色结果:细胞核呈蓝色,阳性表达位置为棕色。运用 Image J 软件定量检测各组小鼠睾丸组织内 BrdU阳性细胞比例。
1.3.8 精液质量检测 小鼠麻醉处死后,立即取一侧附睾尾放入装有3 mL生理盐水的小烧瓶内,用眼科剪充分剪碎。将悬液通过4 层滤纸过滤,获得精子滤液,采用精子分析系统(CASA),放大倍数为250倍,测量精子参数。观察5 个不同区域来估计精子活力。在精子计数板上加入少量精子滤液,在40 倍光学显微镜下进行精子计数。将精子滤液滴在干净的玻片上,均匀铺开,在室温下自然干燥,伊红染色后,用光学显微镜在200倍显微镜下观察涂片,并根据形态计算精子畸形率。计算公式:
精子活动率(%)=活动精子数/精子总数×100%
精子畸形率(%)=畸形精子/精子总数×100%
1.3.9 生育力实验 每组取5只雄性小鼠,分别与同代成年育龄正常雌性小鼠按1∶2的比例关笼饲养。每天早晨观察雌性小鼠阴道栓的形成。确认雌性小鼠怀孕后将雌雄鼠分笼饲养。待成年雌性小鼠生产后,记录生育率及产仔数。各组雄性小鼠与雌性成年小鼠至少交配2月。
1.4 统计学分析
采用SPSS 23.0软件进行统计分析,计量资料采用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD法。Plt;0.05为差异具有统计学意义。
2 结果
2.1 小鼠睾丸铜含量
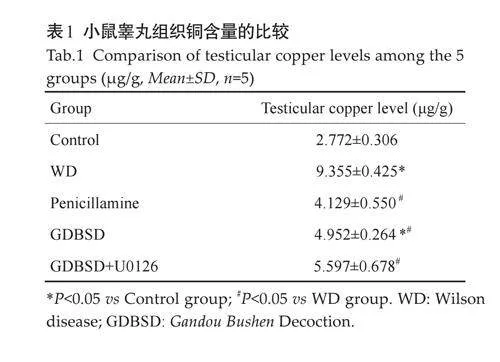
WD 模型组小鼠睾丸组织铜含量均高于对照组(Plt;0.05)。经过青霉胺治疗后,小鼠睾丸铜含量下降,与对照组相比差异无统计学意义(Pgt;0.05)。GDBSD组小鼠睾丸铜含量低于WD模型组(Plt;0.05),与正常组相比仍有差异。GDBSD+U0126组小鼠睾丸组织铜含量均高于GDBSD组(表1)。
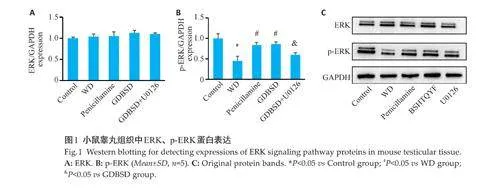
2.2 ERK信号通路验证
在5 组中未观察到总ERK 蛋白表达水平的差异。WD模型组p-ERK蛋白的表达水平低于对照组(Plt;0.05)。青霉胺处理后,小鼠睾丸组织中p-ERK蛋白表达水平增加,GDBSD组的蛋白表达趋势与青霉胺组一致,GDBSD+U0126 组和WD 组睾丸组织中p-ERK水平差异无统计学意义(Pgt;0.05,图1)。
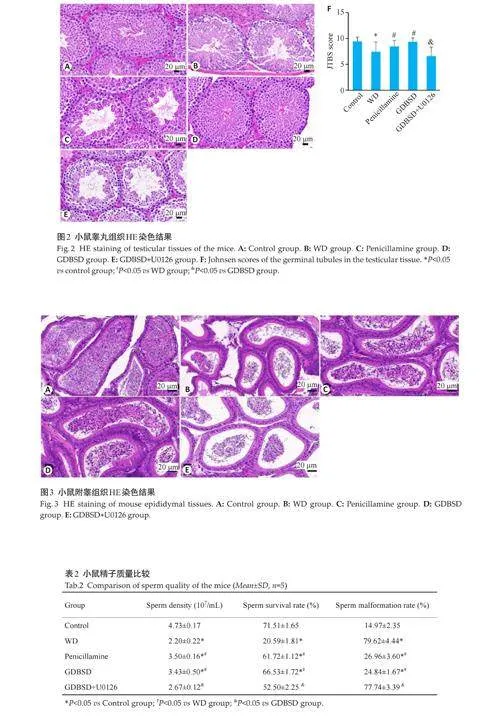
2.3 小鼠睾丸组织病理形态和Johnsen评分
对照组的睾丸组织具有完整的生精小管结构,各级生精细胞正常分布,从外到内包括精原细胞、初级和次级精母细胞以及精子,紧密而规则地排列。WD模型组生精小管排列松散、紊乱,细胞间隙增宽,生精细胞数量减少。在青霉胺组和GDBSD组中,睾丸组织中的生精小管结构正常,小管壁的基底膜完整,生发细胞排列整齐,生精细胞的层数高于WD模型组。GDBSD+U0126组的睾丸组织破坏比GDBSD组更严重,细胞排列松散,所有生精细胞水平均有不同程度的降低(图2A~E)。与对照组相比,WD模型组得分降低,导管腔精子生成减少;青霉胺和GDBSD组的得分明显高于WD模型组;GDBSD+U0126组的精子改善受到抑制(Plt;0.05,图2F)。
2.4 精子质量分析
对照组附睾内细胞排列紧密,管腔内可见大量成熟精子;WD模型组和GDBSD+U0126组仅有少量精子充满部分空的附睾导管腔;与WD模型组相比,青霉胺组和GDBSD组的附睾导管间隙减小,导管腔内可见大量精子,尽管其绝对数量仍少于对照组;GDBSD +U0126组对增加精子数量的促进作用被抑制(图3)。
与对照组相比,WD模型组的精子密度和存活率降低,畸形率升高(Plt;0.05)。与WD组比较,青霉胺组小鼠的精子密度和存活率增加,畸形率降低;GDBSD组小鼠精子的数量和质量提高(Plt;0.05)。GDBSD+U0126组改善精子密度、活力和畸形率的效果受到抑制;WD模型组和GDBSD+U0126组的精子存活率和畸形率差异无统计学意义(表2)。
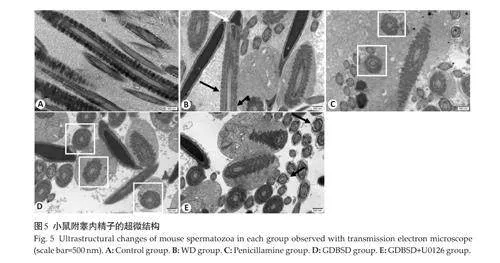
对照组的精子分为头部和尾部,精子尾部细长,精子结构正常。其余各组均有不同形态的异常精子。在WD模型组中观察到许多尾部卷曲的精子和有头无尾的精子。青霉胺组和GDBSD组精子结构正常,畸形精子数量少。GDBSD+U0126组具有大量畸形精子,如尾部卷曲和头部畸形精子(图4)。
在对照组中,精子尾部中部的线粒体鞘排列紧密且结构完整。WD模型组的精子结构被破坏,并且观察到线粒体鞘中段的结构破坏和异常精子头。青霉胺组和GDBSD组的精子结构总体正常,线粒体鞘排列紧密,线粒体无明显肿胀,9+2 结构清晰,纤维致密。在精子尾部中部的横切面中,GDBSD+U0126组的线粒体结构被破坏甚至消失,线粒体鞘不连续(图5)。
2.5 小鼠生精细胞的超微结构
对照组精母细胞中染色质均匀,细胞器丰富,线粒体结构正常。WD模型组显示线粒体结构显著肿胀和线粒体嵴消失。用青霉胺和GDBSD处理后,精母细胞中的线粒体结构基本恢复,未观察到明显的线粒体肿胀。施用U0126阻断ERK信号通路激活导致精母细胞中异常线粒体结构增加(图6)。
2.6 小鼠睾丸组织的细胞凋亡
WD模型组中凋亡细胞的数量高于对照组,用青霉胺和GDBSD治疗后,睾丸组织凋亡减少(Plt;0.05)。施用U0126以阻断ERK信号通路激活后,GDBSD对睾丸组织中细胞凋亡的抑制作用被逆转,与GDBSD组相比,细胞凋亡增加(Plt;0.05,图7)。
与对照组相比,WD模型组睾丸中促凋亡蛋白Cytc和Caspase-3的表达水平升高,抗凋亡蛋白Bcl-2的表达水平降低(Plt;0.05)。青霉胺处理后,小鼠睾丸组织中凋亡相关蛋白Cytc 和Caspase-3 的表达减少,Bcl-2 的表达增加(Plt;0.05)。GDBSD组的蛋白表达趋势与青霉胺组一致。在给予U0126以阻断ERK信号通路的激活后,小鼠睾丸组织中Cytc和Caspase-3蛋白的表达水平高于GDBSD组,Bcl-2 的表达减少(Plt;0.05)。TUNEL染色显示凋亡细胞的数量高于GDBSD组,这与蛋白质表达水平的结果一致(图8)。
2.7 小鼠睾丸组织中的细胞增殖
对照组睾丸组织细胞排列规则紧密,各级细胞排列有序,增殖细胞数量较多。WD模型组的睾丸组织显示大量精母细胞缺失、生精小管空泡化和细胞增殖减少(Plt;0.05)。GDBSD改善小鼠睾丸组织结构并增加细胞增殖(Plt;0.05)。尽管青霉胺改善了睾丸组织的结构损伤,但细胞增殖没有明显改善。GDBSD+U0126组抑制了GDBSD对细胞增殖的促进作用(Plt;0.05,图9)。
2.8 雄性TX小鼠的生育力
比较5组雄性小鼠的生育能力,结果显示,与对照组相比,WD模型组其同笼雌鼠妊娠率及产仔率均下降(Plt;0.05)。经过GDBSD治疗后,其同笼雌鼠妊娠率及产仔率均有一定程度提高,且差异均有统计学意义(Plt;0.05)。GDBSD+U0126 组小鼠其生育能力较GDBSD组有一定程度下降(Plt;0.05,表3)。
3 讨论
生殖系统损害可能是WD的首发症状[32]。研究表明,WD的男性患者可能会出现生殖系统损害的症状,如阳痿、乳房发育和不育[33]。并且,患WD的男性精子活力明显低于未患WD的男性[34]。在生理状态下,精子的产生和成熟取决于下丘脑-垂体-睾丸轴的调节。对WD男性患者的研究表明,大多数成年患者对促性腺激素释放激素、黄体生成素和卵泡刺激素的反应降低[33]。WD男性患者通常伴随功能障碍性HPT。但由于金属螯合剂的局限性,WD男性的生殖损害亟需更加安全有效的治疗药物。WD男性患者合并生殖损害的中医病因病机是以肾虚为本,痰湿、瘀血为标[20]。本课题组前期采用本院制剂肝豆灵活血祛瘀散结的基础上,加以补肾固本之品,经长期临床及基础实验研究,发现GDBSD可有效改善WD男性的生殖损害[8,22,25],但目前尚缺乏关于GDBSD针对WD男性生育能力及性腺靶器官睾丸及精子发生相关的机制研究。故本实验基于前期课题组研究以ATP7B基因缺失的雄性TX小鼠睾丸、附睾组织、精子及生育力为主要观察对象,进一步探究GDBSD对WD除下丘脑-垂体轴外的性腺器官睾丸、附睾及精子发生的影响及具体机制。
影响精子发生的重要原因之一是生精细胞的增殖与凋亡[35]。生精细胞异常的凋亡,会造成雄性生精功能损伤,包括精子密度及活力的下降。为确定WD对雄性TX小鼠生殖能力的损害及GDBSD是否对其病理形态及生育能力具有改善作用,我们分别对每组进行了睾丸、附睾及精子HE染色、透射电镜超微结构观察、睾丸生精小管Johnson评分、TUNEL染色、免疫组化和精液质量检测。结果表明,与对照组相比,WD模型组睾丸组织结构破坏,生精细胞数量减少,凋亡数量增多,Johnson评分明显降低,导管腔精子生成减少,畸形精子增多;青霉胺和GDBSD治疗后,小鼠睾丸结构恢复,细胞凋亡减少,细胞增殖增加。Johnson评分有所升高,精子密度和精子活力显著增加,畸形精子减少。同时,本研究发现,与对照组相比,模型组小鼠其生育能力受到影响,其同笼雌鼠的妊娠率及产仔率均降低。运用中药干预后,可改善小鼠的生育能力,使得其同笼雌鼠的妊娠率及产仔率提高。这证实了WD模型TX小鼠存在睾丸组织结构的破坏、精子发生异常和生育力的下降,以及GDBSD对TX小鼠睾丸、精子发生和生育能力的显著保护作用。
ERK作为丝裂原活化蛋白激酶(MAPK)家族的关键成员,在细胞增殖、分化以及凋亡中占有主导地位[26, 27]。研究表明,ERK信号通路参与生殖过程,与生殖系统损伤密切相关[36-38]。MEK(MAPK激酶/ERK激酶)激活ERK 信号通路并使ERK 磷酸化,被激活的ERK从细胞质转移到细胞核[39]。在睾丸组织中,p-ERK主要存在于精原细胞、细线期至粗线期的初级精母细胞及伸长的精子细胞核中[40],可促进精子活化活力和顶体反应[41]。同时,在初级精母细胞的减数分裂[42]和精子成熟[29]中可以看到活化的p-ERK蛋白。值得注意的是,铜沉积可以通过ERK信号通路和线粒体凋亡通路破坏性激素稳态和对人绒毛外滋养层细胞的细胞毒性,从而导致显著的生殖毒性[43]。本课题组前期实验结果也显示,WD铜沉积可能抑制ERK的磷酸化,导致下丘脑神经元和垂体细胞凋亡增加,从而影响生殖激素的释放及生育能力下降[31]。但在睾丸组织中未有报道。研究发现,ERK信号通路也与细胞凋亡密切相关,并参与调节下游凋亡因子(Bax、Caspase-3、Bcl-2)的表达[44]。本研究发现,WD模型组相比于对照组睾丸组织铜含量明显升高,p-ERK蛋白表达减少,ERK信号通路磷酸化受到抑制,Cytc 和Caspase-3 促凋亡蛋白的表达增加Bcl-2 抗调亡蛋白的表达减少,睾丸HE染色结果显示生精小管排列松散、紊乱,细胞间隙增宽,生精细胞数量减少,精子HE染色显示9+2结构被破坏。这表明铜暴露可能通过抑制ERK的磷酸化而促进睾丸生精细胞凋亡,从而影响精子发生异常。
本研究已证明GDBSD可改善TX小鼠睾丸损伤及精子发生异常,研究结果显示,经青霉胺及GDBSD治疗后,与WD模型组相比,睾丸组织铜水平明显下降,我们推测GDBSD可以减轻铜沉积,从而影响ERK磷酸化水平。故进一步探讨GDBSD与ERK信号通路的关系。Western blotting实验显示,与WD模型组对比,GDBSD组及青霉胺组促凋亡蛋白Cytc 和Caspase-3 的表达下调以及抗凋亡蛋白Bcl-2的表达上调,且p-ERK蛋白表达增加,总ERK水平无明显差异,提示GDBSD可能促进ERK磷酸化,从而激活ERK信号通路。因此,我们使用ERK信号通路抑制剂U0126进一步明确GDBSD对ERK信号通路的影响。与GDBSD组相比,应用U0126后的p-ERK蛋白水平降低,总ERK水平无明显差异,且观察到睾丸组织铜含量显著升高,睾丸组织结构破坏明显,提高了Cytc和Caspase-3蛋白水平,降低了Bcl-2蛋白水平,睾丸增殖细胞数量较少,检测到明显的细胞凋亡,精子质量下降,生育能力也有所降低,GDBSD的治疗效果受到抑制。以上结果进一步证明,GDBSD通过激活ERK信号通路可改善WD中铜沉积诱导的睾丸生精细胞凋亡和增殖状况及精子发生异常。
综上所述,本研究认为WD铜沉积可能通过抑制ERK信号通路的磷酸化,促进下游促凋亡蛋白Cytc和Caspase-3 的表达,抑制抗凋亡蛋白Bcl-2 的表达,直接损伤睾丸组织,主要表现为生精细胞结构异常,细胞凋亡增多、增殖减少,并诱导精子发生异常和生育力的下降。GDBSD通过激活ERK信号通路改善睾丸生精细胞增殖和凋亡状况,以治疗WD铜沉积诱导的雄性TX小鼠异常精子发生和生育功能。然而,GDBSD治疗WD男性生殖的分子机制研究仍有许多未解之谜。接下来将进一步探讨GDBSD的最优剂量和长期疗效,并在更大样本量和临床试验中验证其安全性和有效性,并通过生物信息分析及体内外实验等多种方法进一步探究GDBSD治疗WD伴男性生殖障碍相关的分子机制,以及它们是否存在正负反馈。本实验结果发现青霉胺及GDBSD对WD的男性生殖损害均具有改善作用,现代研究表明中西医结合治疗WD具有良好的效果[45],西药与GDBSD联合运用或许对于WD的治疗效果更佳,这有待进一步探索。总之,本研究从细胞凋亡相关分子机制角度阐明了GDBSD改善WD雄性TX小鼠睾丸损伤及精子发生异常的发病机制,为GDBSD在WD伴男性生殖损害患者中的临床应用提供了理论依据,为中医药治疗WD提供了新的方向。

