高中化学三版教材有关乙烯的几个问题探讨






摘 要: 在比较高中化学三版教材以及广泛借鉴专业书籍、学术论文的基础上,提出乙烯制备实验和石蜡油分解实验的优化方案,建议根据不同的教学需求和现实条件灵活进行实验教学;拓展介绍乙烯氧化反应和加成反应的相关知识;考虑到知识的准确性和学生的学情,建议对乙烯结构中的键角进行更正说明。
关键词: 高中化学; 乙烯; 教材比较
文章编号: 10056629(2024)12009206
中图分类号: G633.8
文献标识码: B
乙烯是高中阶段初学有机化合物的代表物质,相关知识位于教材必修2及选择性必修3。基于《普通高中化学课程标准(2017年版2020年修订)》要求编写的人教版、鲁科版和苏教版高中化学教材是现行的三个主要版本教材,使用过程中教师往往相互参考借鉴以便改进教学。不同版本的教材中关于乙烯的几个问题存在一定的模糊性,笔者尝试逐一分析和探讨,以期为一线教学提供启示。
1 乙烯实验室制备方法的优化与比较
乙烯的加成和氧化实验是高中有机化学学习的重点之一,课堂实验要求快捷、简便、安全的乙烯制备方法。人教版和鲁科版选择性必修3给出的实验室制备乙烯的方法基本一致:在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1∶3)的混合液20mL,放入碎瓷片防止暴沸,迅速升温至170℃,使乙醇发生消去反应得到乙烯[1,2]。但苏教版选择性必修3给出的方法则是将2g P2O5与4mL 95%的乙醇混合并加热[3]。邢其毅等编写的《基础有机化学》中描述为:“将醇和酸(硫酸、磷酸等)一起加热,可以使醇分子失去一分子水转变为烯。这是实验室制备烯常用的方法。[4]”以上均提到可以用乙醇与浓硫酸或P2O5(P2O5与水反应即生成磷酸)共热的方法制备乙烯,本文基于教材所给实验方案探讨课堂上制备乙烯的可行性。
1.1 乙醇和浓硫酸共热制乙烯的不足与优化
乙醇和浓硫酸都是实验室常备药品,原料易于获取。实际操作该实验时,由于乙烯仅在高于170℃时才会生成,因此整个过程升温较慢,时长需10~20min,不适合课堂进行。此外,由于浓硫酸的强氧化性和脱水性,导致实验过程中存在许多副反应。如乙醇会被浓硫酸炭化附着于瓶壁,难以清洗;加热至140℃时会生成乙醚,炭化后的碳与浓硫酸反应生成SO2,乙醚和SO2存在环境污染问题;乙烯产率很低,气流生成不稳,容易倒吸,存在安全隐患等。
许多学者针对这一实验进行了改进研究。根据乙醇的分子间脱水以及分子内脱水机理(见图1)[5],在酸催化的作用下,羟基质子化,转化为容易离去的基团水,同时形成碳正离子。较低温度条件(140℃)下,另一个乙醇分子的氧原子进攻碳正离子,同时氢离子离去,发生亲核取代生成乙醚;较高温度条件(170℃)下,碳正离子的正电性增大了β碳原子与氢原子之间共价键的极性,较易失去一个质子,接着一对电子转移到碳碳之间,中和正电荷发生消去反应生成乙烯。
那么,为什么高温条件下更容易发生分子内脱水生成乙烯呢?在酸催化形成碳正离子的基础上,亲核取代断裂O—H键、消去反应断裂C—H键,O、 H间的电负性差值为1.4,C、 H间的电负性差值为0.4,O—H键的极性更大,较低温度下即可断裂生成乙醚。当温度升高至170℃时,外界供给的能量已经能够断裂βC—H键,同时由于分子热运动加剧,分子间距离变大,还有存在空间位阻等原因,使得分子内脱水生成乙烯比分子间脱水生成乙醚更容易发生[6]。
以上各步中,第二步生成碳正离子的速率最慢,是整个反应的决速步。有学者提出可使乙醇和浓硫酸提前混合并长时间静置促使乙醇充分质子化脱去水分子,以缩短反应时间,然后再迅速升温至170℃促使其发生分子内脱水生成乙烯。同时适当降低浓硫酸比例,以减少其带来的炭化、氧化等副反应。实验证明,取7.5mL乙醇和7.5mL浓硫酸1∶1混合并静置超过12h,课堂实验时,从开始加热到检验乙烯性质完成(溴的四氯化碳溶液和酸性高锰酸钾溶液退色)仅需6min左右,且炭化程度减小,不存在挂壁现象,乙烯产率增大,气流稳定而充足,极大地提高了反应效率[7]。
1.2 乙醇和P2O5共热制乙烯的不足与优化
P2O5具有强脱水性,将其与乙醇混合制乙烯,具有副反应少、反应速率快等优点。但由于P2O5具有强烈的腐蚀性和毒性,中学实验室通常难以获得。若将P2O5溶于乙醇,常温下反应就立即发生,发出剧烈的“吱吱”声响,放出大量的热,体系温度迅速升高至80℃以上[8],乙醇迅速气化(乙醇的沸点为78℃),试管中有大量白雾涌出。由于此时乙醇和P2O5反应主要生成磷酸酯,为无色液体,沸点较高[9,10],因此产生的白雾主要是未反应的乙醇以及携带少量P2O5粉末,生成的乙烯很少,经碱液洗气后很难使酸性高锰酸钾溶液退色。陆燕海等人发现当温度升高到150~160℃时,磷酸酯发生断键,才能持续稳定地生成乙烯[11]。此外,若按教材所示用酒精灯直接加热反应装置,温度较难控制,由于升温较快会使反应液暴沸,伴随乙醇大量气化,气体夹带反应液可能会冲出试管,存在安全隐患。
另外,教材要求使用95%的乙醇进行实验,这是因为此时P2O5会和少量溶剂水反应生成磷酸,氢离子的催化作用促使乙醇质子化继而发生消去反应生成乙烯。同时,体系中的水又不能太多,否则过多的水将P2O5完全转化为磷酸,无法使乙醇脱水成烯。实验证实,只要保证乙醇的质量分数在90%以上,就能获得很好的实验效果[12]。
还有多位学者对教材实验的装置进行了改进。如由于原料一经混合反应就立即发生,会有大量乙醇气化损失,因此可以通过分液漏斗添加乙醇,必要时还可以增加乙醇的冷凝回流装置,以增大乙醇的利用率;通过硅油浴进行实验,由于硅油黏度小易清洁,且燃点高,可使温度平稳升高至200℃左右,能够连续且平稳地产生乙烯,并使溴的四氯化碳溶液和酸性高锰酸钾溶液退色,时间约3min,成功率很高[13]。
1.3 乙醇与浓硫酸或P2O5共热制乙烯的方案比较
通过梳理乙醇与浓硫酸或P2O5共热制乙烯的实验方案,结合改进后的措施,两种方案的优劣如表1所示,一线教师可根据实际需求和实验室条件灵活进行实验。
1.4 通过乙烯利与氢氧化钠反应制乙烯
乙醇与浓硫酸或P2O5的共热实验均安排在后期选修阶段乙醇的相关内容中,若在此之前课堂上要制取乙烯进行相关实验时,还可以选择更为简便快捷的方式,即用40%的乙烯利水溶液和NaOH固体混合制取乙烯。
乙烯利,分子式为C2H6ClO3P,化学名称为2氯乙基膦酸。生产生活中常用40%的乙烯利水溶液作为植物生长调节剂,催熟瓜果蔬菜。乙烯利在pH<3的酸性溶液中比较稳定,在pH>3的溶液中则分解释放出乙烯[14]。因此,向40%的乙烯利水溶液中加入NaOH固体增大pH,常温下即可快速制取乙烯,且几乎不存在副反应,制备装置简单。反应的方程式为:
ClCH2CH2PO(OH)2+4NaOH
CH2CH2↑+Na3PO4+NaCl+3H2O
一般农业用乙烯利就可以满足实验要求,药品获取方便,网上即可自行购买,价格低廉且低毒友好。若要减慢反应速率,可将NaOH与水按照质量比为2∶1配成浓溶液,即可产生平稳的乙烯气流[15]。
2 石蜡油分解实验的优化及教材编排差异分析
现行三版教材必修2中,鲁科版在“观察·思考”栏目[16]、苏教版在课后习题均设置了石蜡油分解实验[17]。回溯上一版旧教材,人教版原先在“科学探究”栏目曾经设置这一实验[18],新教材删去了[19];鲁科版原先并未安排此实验[20],新教材增加了;苏教版新旧两个版本则保持一致[21]。教材中石蜡油的分解实验方案基本一致,即将浸透了石蜡油的矿渣棉放置于硬质玻璃管的底部,碎瓷片作为催化剂,通过给碎瓷片加强热,石蜡油挥发的蒸气通过炽热的碎瓷片表面发生裂化及裂解,生成能使酸性高锰酸钾溶液或溴的四氯化碳溶液退色的气态烯烃。
很多教师在教学时存在疑问,为什么不将石蜡油分解实验设置为“固体和液体加热制取气体”的典型装置,而是要将硬质大试管横置,分开放置反应物和催化剂呢?这是因为石蜡油的裂化温度大约为500℃,裂解温度大约为600℃,但石蜡油的沸点却只有大约300℃[22]。倘若混合石蜡油和碎瓷片,体系温度将维持在石蜡油的沸点附近,无法达到裂化或裂解成气态烯烃所需的温度。
按照教材方案进行实验时存在一些不足。第一,实验时间较长。教材中选用碎瓷片或素瓷片做催化剂(素瓷片是未上釉的瓷片),主要利用其中的Al2O3。Al2O3含量高的瓷片气孔率低,反应物附着率低,催化效果一般;气孔率高的瓷片Al2O3含量低,催化效果也一般[23],导致实验时间长达10min以上,不适用于课堂演示教学。第二,实验产气较少、现象不明显,成功率较低。在用酒精灯加热碎瓷片至裂化、裂解所需温度的过程中,由于酒精灯升温较慢,且反应前体系温度就已经达到石蜡油的沸点,因此大量石蜡油会以蒸气形式逸出,在经过碎瓷片时,还未达到反应温度即已散失,导致产生烯烃的总量较小,实验成功率低。
多位学者基于中学实际开展了改进研究。基于上述分析,教材方案的不足主要来源于两个方面:一是催化剂效率较低,二是石蜡油蒸气来不及反应即逸散损失。张思澳等将实验方案改进为直接选取无水Al2O3作为催化剂,并将其提前加热至裂化、裂解温度,然后向其中逐滴滴加石蜡油并保持石蜡油不没过催化剂(保证催化剂表面温度),结果表明大约1min产生的气体即可使酸性高锰酸钾溶液或溴的四氯化碳溶液退色[24]。周梦茜等在此基础上通过给酒精灯外加防风罩,以提高加热效率,并将催化剂改为3g MnO2粉末进行实验,结果显示5s产生的气体即可使酸性高锰酸钾溶液退色[25]。但在选用MnO2进行实验时,需要注意的是,MnO2因其氧化性助燃以及可能分解产生氧气的特点,在与可燃的石蜡油共热时存在爆炸风险,因此课堂实验时应格外注意,尽量避免[26]。
除了实验本身,还应关注新、旧以及不同版本的教材对于石蜡油分解实验的处理。尝试揣摩编者意图,认为人教版删去这一实验,可能一方面由于课堂实施难度较大,另一方面由于其对学生学习乙烯性质的必要性不强,因此弱化处理。而新鲁科版教材增加石蜡油分解实验的目的主要在于通过酸性高锰酸钾溶液和溴的四氯化碳溶液退色证明生成物具有与烷烃不同的性质,从而引出烯烃代表物(即乙烯)的学习。新旧两版苏教版教材将其设置为课后习题,且没有给出实验方案,因此并不要求课堂上进行相关实验。实际教学中,一线教师可以根据自己的教学设计和现实条件灵活选择石蜡油分解实验是否实施以及如何实施,以促进学生的认知发展作为最终旨归。
3 乙烯氧化反应和加成反应的知识拓展
3.1 乙烯与酸性高锰酸钾溶液反应的产物
现行三版教材必修2在介绍乙烯与酸性高锰酸钾溶液的反应时,均只提及乙烯被酸性高锰酸钾溶液氧化,并未涉及具体生成物。人教版选择性必修3在第三章第五节“有机合成”中列出了各类有机物与酸性高锰酸钾溶液反应的方程式,见图2[27]。鲁科版选择性必修3在“烯烃和炔烃及其性质”部分中也明确提到:“烯烃在酸性KMnO4溶液的作用下,分子中的不饱和键完全断裂时生成羧酸、二氧化碳或酮。用酸性KMnO4溶液氧化碳碳双键可以缩短碳链。[28]”
具体来讲,当烯烃与酸性高锰酸钾溶液反应时,若为冷的高锰酸钾溶液,在中性或稀碱性条件下,烯烃会被氧化为邻位二醇,自身被还原为MnO2。但用高锰酸钾做氧化剂时,通常会在氧化性更强的酸性条件下,这时“CH2”会被氧化为CO2,“RCH”会被氧化为羧酸RCOOH,“R2C”会被氧化为酮R2CO,自身被还原为Mn2+。因此,乙烯与酸性高锰酸钾溶液反应的产物即为CO2和Mn2+[29]。必修阶段学生普遍关注反应产物,且乙烯作为学生刚刚学完各类无机物后新接触的有机物,其与酸性高锰酸钾溶液反应的方程式运用无机氧化还原原理完全可以理解,相关除杂习题中也屡屡涉及乙烯与酸性高锰酸钾溶液反应氧化产物的问题,因此实际教学中教师在保证知识科学性和准确性,并不超越学生现有认知的基础上可以对乙烯与酸性高锰酸钾溶液反应的方程式进行适当补充,未来在学习选择性必修3关于有机合成的相关内容时可将知识贯通处理,促进知识的系统化和结构化。
3.2 乙烯与溴在不同溶剂中加成反应的差异
三版教材在呈现乙烯与卤素单质的加成反应时,均选取乙烯与溴的四氯化碳溶液的反应作为实例。关于烯烃和卤素的加成反应,在室温和惰性溶剂中,反应速率就已经很快,立即便能看到溶液退色,生成邻二卤代烃。不同卤素的反应活性为F2>Cl2>Br2>I2,其中F2与烯烃的反应过于激烈,易使碳链断开;Cl2与烯烃的反应也很激烈,工业上常采用溶剂稀释以及添加负催化剂的方法调控反应平稳进行;I2与烯烃为可逆反应,且平衡倾向于生成烯烃的一边。因此,中学课堂演示加成反应实验时选取Br2最为合适[30]。
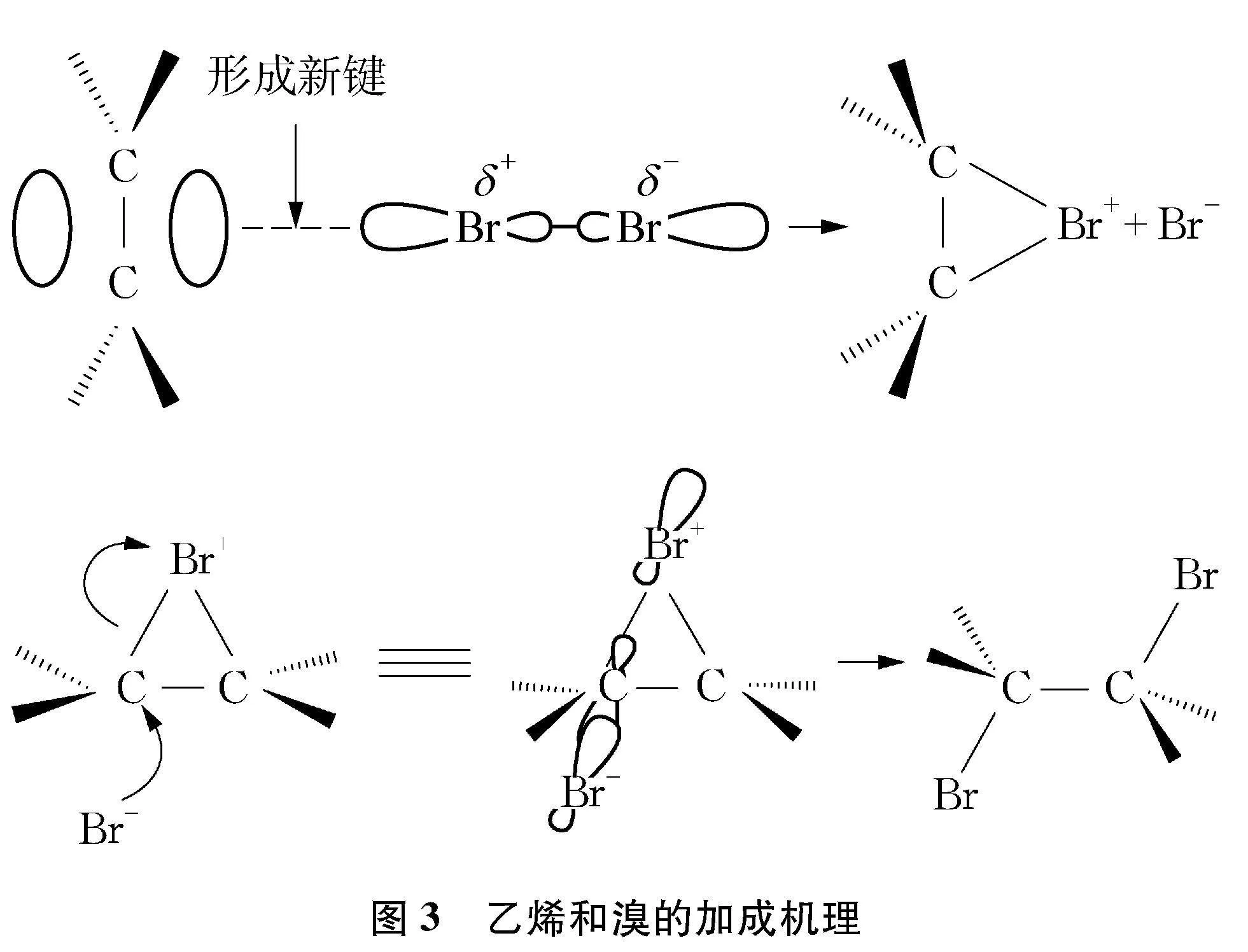
一线教师在讲解乙烯和溴的加成反应时,常常将溴水和溴的四氯化碳溶液混为一谈。要厘清此问题,首先要清楚乙烯和Br2的加成机理(见图3)。乙烯与Br2的反应属于亲电加成,Br2在乙烯π电子的诱导下发生极化,靠近π电子的一端呈正电性,远离π电子的一端呈负电性。其中呈正电性的溴原子进攻乙烯碳碳双键间的π电子形成π络合物,转化为环状溴鎓离子,同时另一个呈负电性的溴原子以Br-的形式离去。接着,Br-从溴鎓离子三元环的反面与碳原子结合,促使三元环打开,进而生成1,2二溴乙烷[31]。这一过程中,四氯化碳作为溶剂起提供反应介质的作用,由于乙烯和Br2都是非极性分子,都易溶于非极性溶剂四氯化碳中,像这样反应物处于同一相中能够加快反应速率。
如果是乙烯与溴水反应,由于水是极性溶剂,更有利于极化Br2异裂为阴阳离子,促使反应进行。此外,体系中除Br-外还存在大量水分子,两者均可以作为亲核试剂进攻溴鎓正离子,得到1,2二溴乙烷和2溴乙醇的混合物,实验中几乎看不到油状液滴生成且反应溶液的pH明显下降,可知主要产物为2溴乙醇(同时生成HBr)。因此,一线教师在表述乙烯与溴在不同溶剂中的反应实质及产物时,切勿一概而论,出现科学性错误。
4 乙烯结构中的键角
人教版选择性必修3在呈现乙烯结构时如图4所示,其中键角∠HCH及∠HCC均标注为120°[32]。
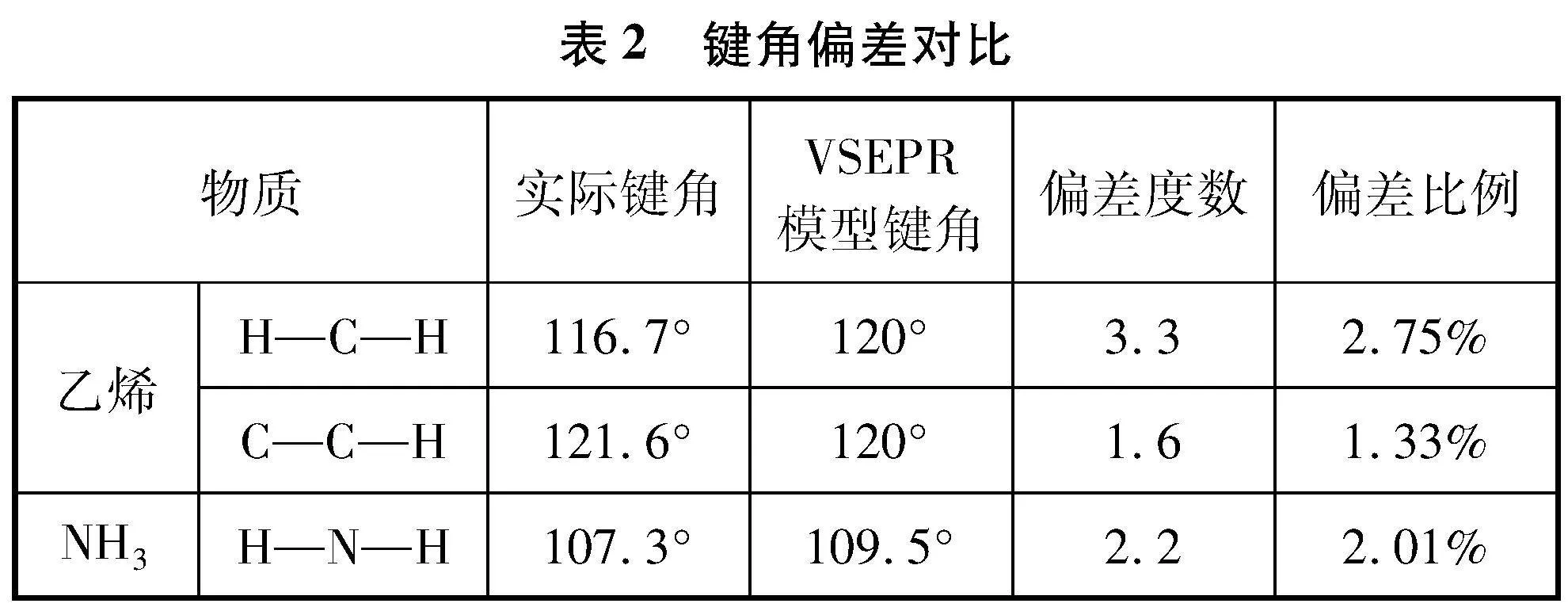
对于含有重键的分子来说,π键电子对虽然不能决定分子的基本构型,但对键角有一定影响。由于电子云密度越大,排斥力越强,因此通常单键与单键之间的键角较小,单键与双键、双键与双键之间的键角较大。乙烯分子中,由于重键的存在,负电荷更为集中,使键角∠HCH略小于120°。资料显示,乙烯的键角∠HCH及∠HCC分别为121.6°和116.7°(见图5),并指出“键角之间的这种差别是由于键的不等同性而引起的”[33]。
那么人教版教材关于乙烯键角的简化标注是否合理呢?如表2所示,乙烯键角的偏差程度与NH3接近,而NH3键角的偏差是“物质结构与性质”模块学习的重点。因此,乙烯键角角度偏差的绝对值及相对比例并非小到可以忽略。由于“有机化学基础”模块的学习位于“物质结构与性质”模块之后,此时学生已经可以理解乙烯的键角相对于VSEPR模型出现偏差的原因。因此此处乙烯的键角不建议简化标注,教师在课堂上也应给予更正。
5 结语
教材是课程的载体,是教师教学的直接依据,也是学生获取信息的重要来源。教材的编写具有权威性和普适性,一纲多本的教材编写模式也为教材的创新性呈现提供了更大的空间。一线教师需在实际教学过程中,在熟读本地区版本教材的基础上,鼓励借鉴不同版本、不同年代甚至不同国家的教材内容,从中体会教材变迁和组织的逻辑脉络与价值功能,并对其进行优势整合,以便更好地服务于教学。同时,在广泛的教学实践中,要秉持一种开放、好奇与怀疑的心态,善于发现、勇于质疑,用批判性的眼光去审视教材中的内容。通过开展实验和调查,阅读相关专业书籍、学术论文等多种渠道对教材内容进行不断地验证、补充和完善,充分挖掘教材的育人价值。
参考文献:
[1][27][32]王晶, 郑长龙主编. 普通高中教科书·化学选择性必修3·有机化学基础[M]. 北京: 人民教育出版社, 2021: 61~62, 85, 34.
[2][28]王磊主编. 普通高中教科书·化学选择性必修3·有机化学基础[M]. 济南: 山东科学技术出版社, 2021: 52, 31.
[3]王祖浩主编. 普通高中教科书·化学选择性必修3·有机化学基础[M]. 南京: 江苏凤凰教育出版社, 2021: 81.
[4][5][33]邢其毅, 裴伟伟, 徐瑞秋, 裴坚. 基础有机化学(第4版)[M]. 北京: 北京大学出版社, 2016: 291, 338.
[6]侯月芳. 乙醇在浓硫酸催化下, 温度不同产物不同之因探析[J]. 天津职业院校联合学报, 2014, 16(2): 59~61.
[7]王宇凤, 敬鳗力. 高中化学实验的项目式教学——乙醇消去反应制备乙烯的实验探究[J]. 化学教育(中英文), 2021, 42(13): 21~27.
[8]陈雨, 丁伟. P2O5催化乙醇脱水反应实验改进[J]. 化学教学, 2015, (6): 65~67.
[9]项斯芬, 严宣申, 曹庭礼等. 无机化学第四卷[M]. 北京: 科学出版社, 1995: 266.
[10]马世昌. 化学物质辞典[M]. 西安: 陕西科学技术出版社, 2002: 911~913.
[11][12]陆燕海, 王强. P2O5催化乙醇制乙烯实验反应条件的探究[J]. 化学教学, 2010, (8): 14~16.
[13]程素芳, 王慧. 五氧化二磷催化乙醇脱水反应制乙烯实验的改进[J]. 化学教学, 2021, (10): 68~70.
[14]黄勇良. 用乙烯利制备乙烯的方法[J]. 化学教学, 2012, (7): 46~47.
[15]应春晓. 乙烯性质实验的再改进[J]. 化学教学, 2019, (4): 69~71.
[16]王磊主编. 普通高中教科书·化学必修2[M]. 济南: 山东科学技术出版社, 2021: 92.
[17]王祖浩主编. 普通高中教科书·化学必修2[M]. 南京: 江苏凤凰教育出版社, 2021: 68.
[18]宋心琦主编. 普通高中课程标准实验教科书·化学必修2[M]. 北京: 人民教育出版社, 2004: 67.
[19]王晶, 郑长龙主编. 普通高中教科书·化学必修2[M]. 北京: 人民教育出版社, 2021: 67~68.
[20]王磊主编. 普通高中课程标准实验教科书·化学2(必修)[M]. 济南: 山东科学技术出版社, 2004: 66~69.
[21]王祖浩主编. 普通高中课程标准实验教科书·化学2(必修)[M]. 南京: 江苏教育出版社, 2004: 68.
[22][25]周梦茜, 景一丹, 肖小明. 石蜡油分解实验改进——以人教版、鲁科版和苏教版为例[J]. 化学教与学, 2019, (1): 85~86.
[23]梁弘文, 武衍杰, 冯求荣. 石蜡油分解制乙烯实验改进[J]. 教育与装备研究, 2020, 36(8): 40~42.
[24]张思澳, 王继璋. 石蜡油分解演示实验改进[J]. 化学教学, 2016, (6): 63~65.
[26]朱马尔. 石蜡油催化裂化改进实验中使用MnO2催化之风险[J]. 中学化学教学参考, 2023, (4): 34~35.
[29][30]尹冬冬. 有机化学上册(2版)[M]. 北京: 高等教育出版社, 2010: 83~85.
[31]王彦广等. 有机化学( 4版)[M].北京: 化学工业出版社, 2020: 95~97.

