二价铜离子配位平衡实验的创新设计

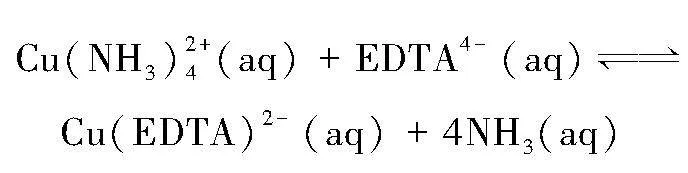

摘 要: 催化剂浓度是决定反应速率非常重要的因素,实验通过设计Cu2+与不同配体进行作用后形成的不同催化剂浓度,在对过氧化氢鲁米诺发光体系催化过程中产生不同强度和时长的荧光,从而展现Cu2+与不同配体之间的配位平衡。
关键词: 铜离子配位平衡; 催化剂浓度效应; 鲁米诺试剂; 实验设计
文章编号: 10056629(2024)12007103
中图分类号: G633.8
文献标识码: B
《普通高中化学课程标准(2017年版2020年修订)》强调,开展以实验为主的多种探究活动,重视教学内容的结构化设计,促进学生学习方式的转变[1]。人教版高中化学选修2《化学反应原理》为了让学生了解配合物的特征和结构,设置了配合物的合成以及相互转化的内容,不同配合物中配位键的强度有大有小,配合物有的很稳定,有的很不稳定[2]。在配合物的教学中,多数教学设计利用无水硫酸铜和胆矾的宏观差异作为教学情境,但在解释配位键的形成时,使用的却是铁离子显色实验、氯化银沉淀的溶解等,这与学生认知发展联系得不够紧密,难以有效帮助学生利用问题情境,经历证据推理、科学探究的过程发展核心素养。
1 问题的提出
很多化学同行对配位平衡与催化剂的浓度效应有较多的实验探究,如针对不同用量的催化剂对双氧水分解进行了实验研究,发现一定范围内增加催化剂用量可以提高反应速率[3]。催化剂能在不改变反应总的标准摩尔吉布斯自由能变前提下,可以加快反应的速率,是因为它改变了反应的途径,降低了反应的活化能,它参与(反应与生成)了具体的反应过程[4]。在一个反应机理中,其中某一个基元步骤进行的速率远较其他速率慢,则该速率控制步骤决定了总的反应速率,该速率控制步骤称为限速步骤,简称“决速步”。催化剂作用,或直接作为决速步的反应物,或间接提高决速步反应物的浓度,进而提高决速步反应速率,所以催化剂的浓度往往是一个决定反应速率的重要因素。在配位平衡实验的设计中,往往通过改变作为催化剂的配合物浓度,从而改变外在的实验现象,实现对配位平衡的观察与追踪。
借鉴同行的实验研究,综合考虑实际因素,本研究利用不同配合能力的配体与二价铜离子配合,以此改变铜离子浓度来影响对过氧化氢的催化作用,通过观察鲁米诺试剂发出荧光的强度与时长,来探究配位平衡的移动。在教学中,结合Cu2+配合物的形成及其对反应的影响,学习配合物的结构和性质,帮助学生利用分组实验,亲历“实验探究”过程发展核心素养。
2 实验原理
2.1 平衡原理
过渡金属元素Cu2+可以与不同的配体如H2O、 Cl-、 NH3、EDTA(乙二胺四乙酸)等,形成稳定性不同的配合物。配合物的内界部分解离,存在着配位平衡。配位化合物的稳定性一般用配位平衡常数Kθ稳表示,此值越大表明配位反应进行得越彻底,配位化合物越稳定[5]。配位化合物遇到与中心原子配位平衡常数Kθ稳更大的配体,即配位能力更强的配体,则会发生取代,配位平衡向生成更稳定的配合物方向移动,中心原子的浓度将进一步下降。过渡金属元素铜的二价离子电子排布为[Ar]3d94s0,还可与4p杂化,存在多个空轨道,可以与许多配体形成稳定性不同的配合物(见表1)。
2.2 反应速率
鲁米诺,又名发光氨,在碱性溶液中会形成一种二价阴离子。此二价阴离子易被过氧化氢分解产生的活性氧(或单氧)氧化,发出处于蓝光波长的可见荧光。由于该过程中,过氧化氢发生分解反应生成活性氧的过程比较慢,速率受催化剂Cu2+浓度的影响较大,是一个决速步的慢反应[6]。该反应过程的快慢决定了整个发光过程的速率,即决定了发光的强度和时长,我们通过观察发光强度和时长来探究不同配体对二价铜离子的配合能力。
3 实验用品
3.1 药品
鲁米诺(天津市致远化学试剂有限公司)、25%的过氧化氢、无水碳酸钠、碳酸氢钠、碳酸氢铵、25%的氨水、硫酸铜晶体、EDTA、蒸馏水
3.2 仪器
电子天平、100mL锥形瓶2个、250mL烧杯1个、2000mL烧杯2个、磁力加热搅拌器、50mL量筒3个、胶头滴管3支、1000mL试剂瓶2个、100mL试剂瓶1个、玻璃棒、洗瓶
4 实验步骤
4.1 实验试剂的配制
称取7.5g EDTA药品,溶于100mL蒸馏水中,然后装入A号试剂瓶中备用。
量取30mL25%的过氧化氢溶液于2000mL烧杯中,加蒸馏水稀释至1000mL,搅拌均匀,然后装入B号试剂瓶中备用。
另取一个2000mL烧杯,加入4.0g无水碳酸钠,加蒸馏水至500mL,搅拌溶解后,再加入0.2g鲁米诺粉末,继续搅拌溶解。待鲁米诺全部溶解后,继续逐次加入24.0g碳酸氢钠、0.5g碳酸氢铵、20滴25%的氨水、0.4g硫酸铜晶体(约0.0016mol,起催化作用),继续搅拌数分钟。待全部溶解后,加蒸馏水稀释至1000mL,继续搅拌均匀,然后装入C号试剂瓶中备用[7]。
4.2 实验操作与现象
在室温下,取用两个相同批次规格的锥形瓶,分别标签为一、二后备用。用量筒按表2的实验操作要求每次量取50mL的B试剂,分别倒入到两个锥形瓶中。另取两支干净量筒(分别对应于标签为一、二的两个锥形瓶),各量取C试剂50mL,用胶头滴管分别在两支量筒内滴入10滴蒸馏水和10滴A试剂,用玻璃棒搅拌均匀。关闭教室遮光布,然后将两支量筒中的试剂同时倒入到对应的两个锥形瓶中,观察并记录实验产生荧光的强度及持续的时长。
4.3 实验结果与讨论
实验的结果显示,实验一发出的荧光强度明显比实验二要强,但发光的时间很短,维持强荧光的时间在25秒左右。而实验二发出的荧光强度虽弱,但发光的时间较长,荧光强度减弱得较慢,保持120秒仍可见到明显的荧光。
这说明实验一的过氧化氢分解速率较快,实验二的过氧化氢分解速率较慢。这是由于在实验一中铜离子与氨分子形成的配合物稳定性较弱,溶液中铜离子浓度高;而加入EDTA后,氨分子被配合能力更强的配体EDTA代替,配位平衡向生成Cu(EDTA)2-的方向移动,形成更稳定的配合物,使溶液中起催化作用的铜离子浓度进一步降低,催化过氧化氢分解的能力减弱,使得单位时间内产生的活性氧少,鲁米诺荧光的强度较弱,
但由于反应物的量相同,所以保持荧光的时间变长。反应的方程式如下:
5 小结
将热力学的配位化学平衡与动力学的催化反应机理两类实验融合,在绚丽的鲁米诺荧光现象中,让学生体验实验过程的趣味性,将抽象的反应理论转化为直观的实验现象,不仅克服了实验理论理解难、现象呈现难的困惑,而且增强了学生对化学理论的信服力,并在此过程中培养了学生的实验操作和实验解读能力,发展了学生“证据推理”“科学探究”的化学学科核心素养。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020.
[2]王晶, 郑长龙主编. 化学选择性必修2·化学反应原理[M]. 北京: 人民教育出版社, 2020: 97.
[3][5]沈银行. 对催化剂的拓展探究[J]. 化学教学, 2019, (9): 79~82.
[4]傅献彩, 侯文华. 物理化学(第六版)(下册)[M]. 北京: 高等教育出版社, 2022: 304.
[6]宋天佑, 程鹏, 徐家宁, 张丽荣. 无机化学(第四版)·上册[M]. 北京: 高等教育出版社, 2019: 389.
[7]顾仲良. 化学反应速率影响因素的实验研究——过氧化氢鲁米诺发光反应的应用[J]. 中学化学教学参考, 2020, (17): 35~37.

