三组难溶物之间转化反应的实验探究









摘 要: 对Mg(OH)2与Fe(OH)3、 BaCO3与BaSO4、 AgCl与AgI三组难溶物之间的转化反应进行实验探究,借助数字化传感器分别测定体系中的pH、电导率和电势的变化,将三组体系中难溶物之间的转化过程通过数据曲线的变化进行直观呈现,判断三组沉淀之间能否转化以及相互转化的方向,解决了现行高中教材实验中这三组沉淀转化步骤繁杂且耗时长的问题,有助于学生从微观上理解沉淀溶解平衡。
关键词: 电导率; pH; 电势; 沉淀转化; 实验探究
文章编号: 10056629(2024)12008006
中图分类号: G633.8
文献标识码: B
1 问题的提出
2017年版2020年修订的高中化学课程标准对沉淀溶解平衡的内容要求是:“认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。[1]”该部分教学是以沉淀的生成和解离为核心,对沉淀溶解平衡的建立、沉淀的溶解和生成、沉淀的转化三部分内容进行学习梳理,这其中又以沉淀的转化最为复杂。四个版本教材选择的难溶电解质代表物质如表1所示,以它们为例,对较复杂体系中沉淀溶解平衡的相关知识进行学习理解,并迁移应用到生产和生活实际中。
整体上看,大部分沉淀溶解平衡侧重于理论分析,实践操作较少,可能原因在于沉淀溶解平衡的建立时间较长,又或沉淀的转化操作较为复杂。教材中对于沉淀的转化操作实验主要有两种:第一种以人教版为例,AgCl转化为AgI。先向过量NaCl溶液加入少量AgNO3溶液制得AgCl,再加入少量的NaI溶液,沉淀变黄说明AgCl转化为AgI,通过观察沉淀颜色的转变判断沉淀的转化。但在实际的教学中,学生可能会存在这样的疑问,假如Cl-与Ag+结合速率比较慢,还没来得及与NaCl发生反应的AgNO3会不会直接与新加入的NaI反应生成AgI呢?这样的话也会产生相同的现象,该怎么样证明;第二种以鲁科版为例,将沉淀的上层清液倾去,对沉淀洗涤2~3次,再加入相应的试剂验证沉淀的转化。若再严谨一点,加上检验沉淀是否洗涤干净的操作,整体耗时较长,不利于在课堂中进行演示。
数字化实验在促进学生认知、丰富实验探究等方面都有别于传统实验,尤其是在宏观现象与微观探析结合方面发挥了独特的实验教学功能[2]。查阅文献发现,利用手持技术大部分是探究沉淀溶解平衡的建立和影响沉淀溶解平衡的因素[3],而对沉淀的转化探究的比较少。本文利用pH传感器、电导率传感器和ORP(氧化还原)传感器,选取三组典型的沉淀Mg(OH)2与Fe(OH)3、 BaCO3与BaSO4以及AgCl与AgI进行实验探究,以寻找效果明显、操作简单、耗时较短的适合课堂演示的沉淀转化实验方案。
2 实验设计思路
沉淀的转化是一种难溶电解质的溶解和另一种难溶电解质的生成过程,沉淀发生转化时,体系中对应离子的种类和浓度会发生改变。利用离子种类和浓度的不同,结合离子性质的差异,体系中的电导率、酸碱性、氧化性或还原性等性质会发生相应的变化。借助不同传感器测定体系中的电导率等性质的变化,分析得出对应离子种类和浓度的变化情况,进而判断沉淀转化能否进行和沉淀转化的方向。例如BaCO3+SO2-4BaSO4+CO2-3,该沉淀转化反应理论上若是能正向进行,随着CO2-3浓度的增大,体系的碱性应该增强,由于SO2-4和CO2-3的摩尔电导率不同,溶液的导电性也会发生改变,体系中的pH和电导率也会产生对应的变化。借助pH传感器和电导率传感器测出体系中pH和电导率的变化情况,反向可以推测该反应能否正向进行。
3 实验准备
实验仪器:烧杯、胶头滴管、药匙、夹持装置、磁力搅拌器、威尼尔pH、ORP传感器和电导率传感器、数据采集器、电脑及配套软件
实验药品:蒸馏水(电导率为4~6μS/cm)、AgCl固体、AgI固体、BaCO3固体、BaSO4固体、Mg(OH)2固体、Fe(OH)3固体、KCl溶液、KI溶液、Na2CO3溶液、Na2SO4溶液、MgCl2溶液、FeCl3溶液(注:为减小固体溶解带来的数据影响,所加盐均选用浓溶液,且下面所有实验组均取自同一试剂瓶中的溶液。蒸馏水中的离子浓度太低,导致pH传感器不能较好地测出蒸馏水的pH,曲线会发生波动。)
4 实验探究Mg(OH)2与Fe(OH)3之间的转化
4.1 实验过程
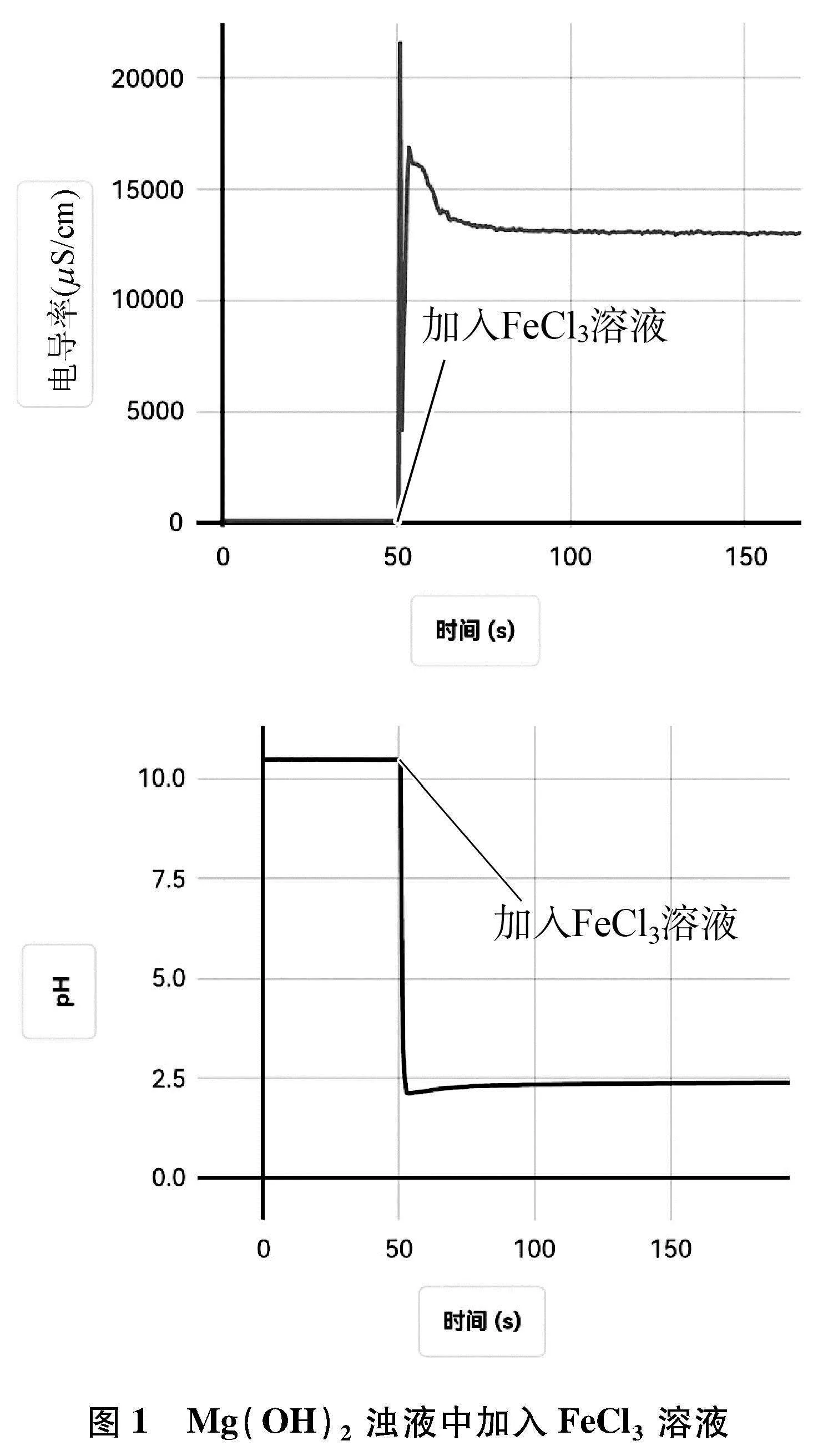
(1) 向盛有60mL蒸馏水的烧杯中,加入Mg(OH)2固体,用磁力搅拌器搅拌,待数据稳定后,向其中加入1滴管FeCl3溶液,用电导率传感器和pH传感器测其中的电导率和pH的变化,采集数据如图1所示。
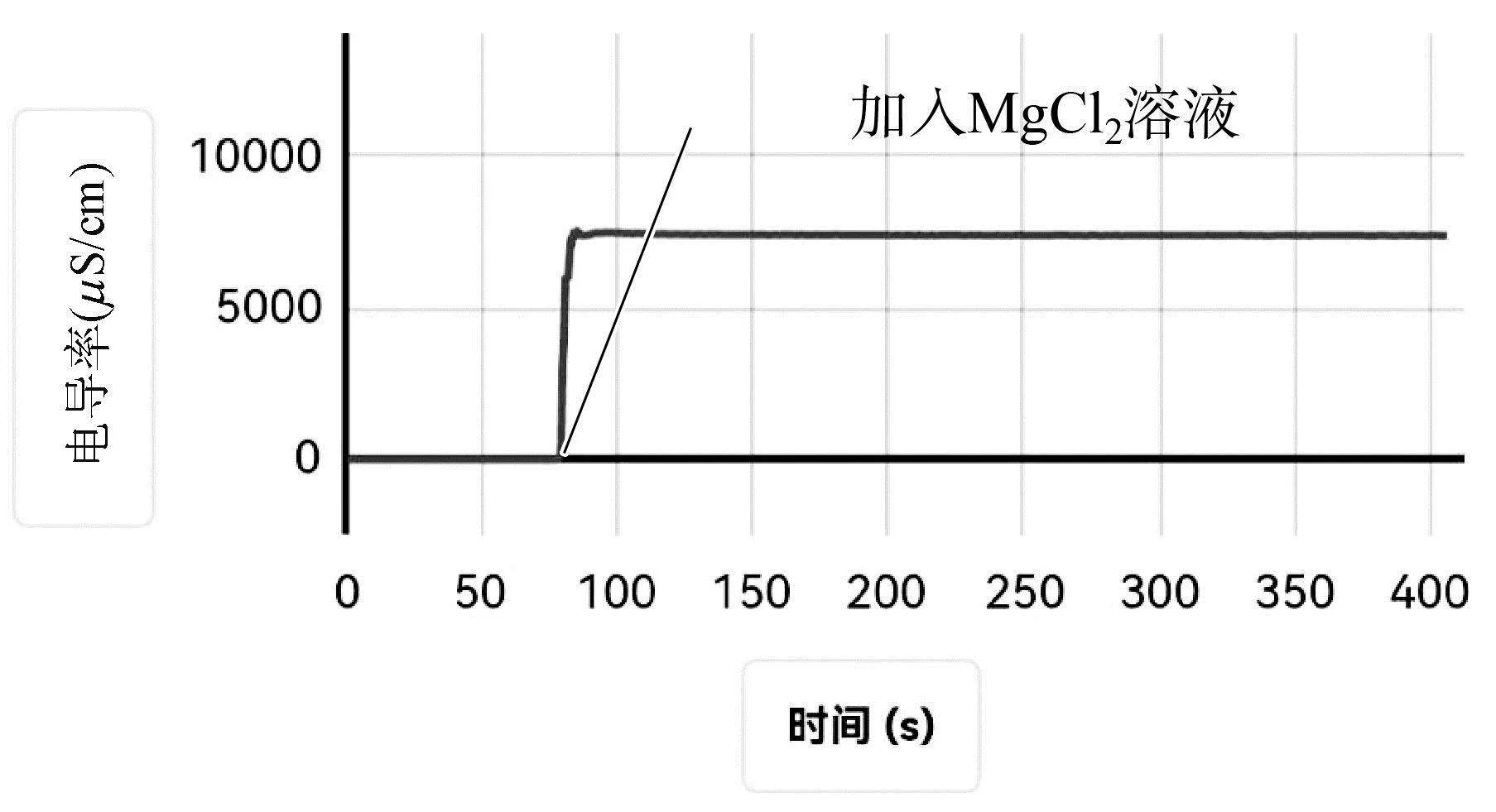
(2) 向盛有60mL蒸馏水的烧杯中,加入Fe(OH)3固体,用磁力搅拌器搅拌,待数据稳定后,向其中加入1滴管MgCl2溶液,用电导率传感器和pH传感器测其中的电导率和pH的变化,采集数据如图2所示。
4.2 数据分析
4.3 实验结论
凡在一定的温度和一定的溶剂中,只要溶液极稀,同一种离子的摩尔电导率都是同一数值[4],不同离子的摩尔电导率则不同。发生沉淀转化时,体系中的离子种类和浓度会发生改变,电导率曲线也会发生相应的变化。向浊液中加入盐溶液时,难溶电解质导电率很小,加入盐溶液后,若体系中的电导率是迅速增加后逐渐减小,说明该沉淀转化反应能发生,若体系中的电导率是迅速增大后不发生改变,则说明该沉淀转化不能发生。
由于FeCl3溶液和MgCl2溶液均存在盐的水解平衡,对沉淀转化体系中的pH会产生较大的影响,所以借助pH的变化不能对Mg(OH)2与Fe(OH)3之间的转化做出判断。但若加入的盐不发生水解时,能否借助pH传感器进行判断呢?下面,我们借助手持技术进行实验探究此种类型沉淀的转化。
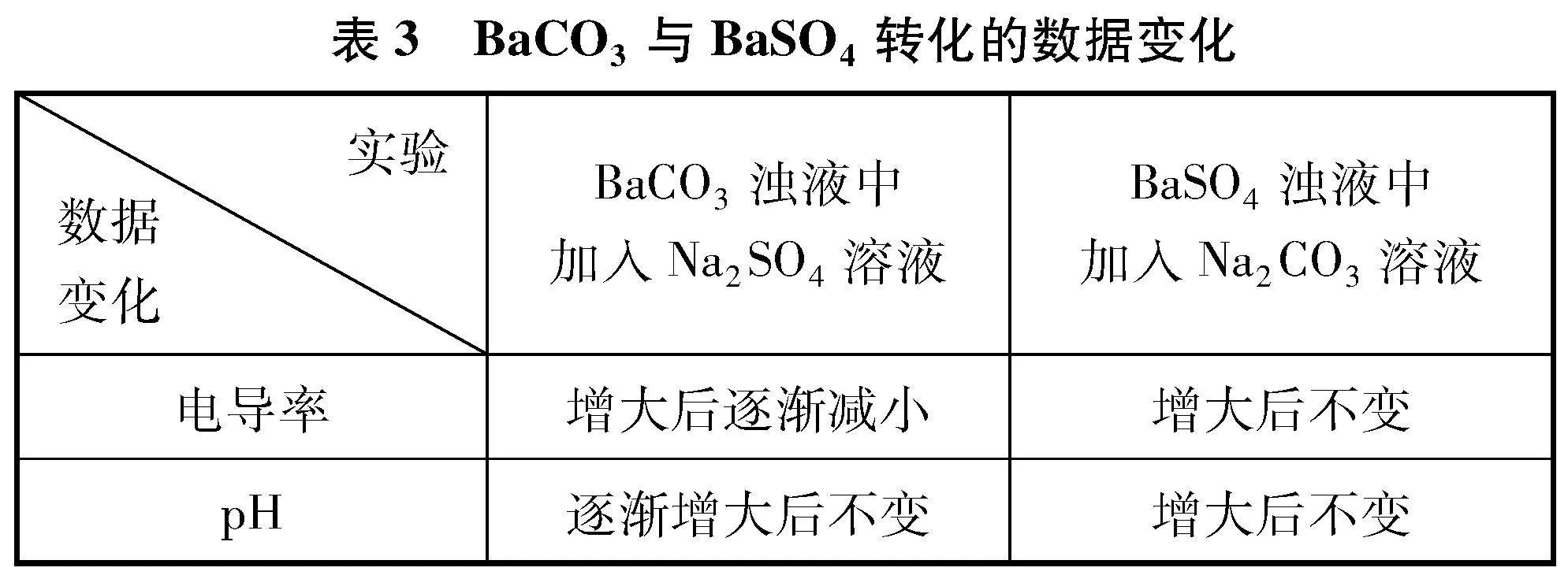
5 实验探究BaCO3与BaSO4之间的转化
5.1 实验过程
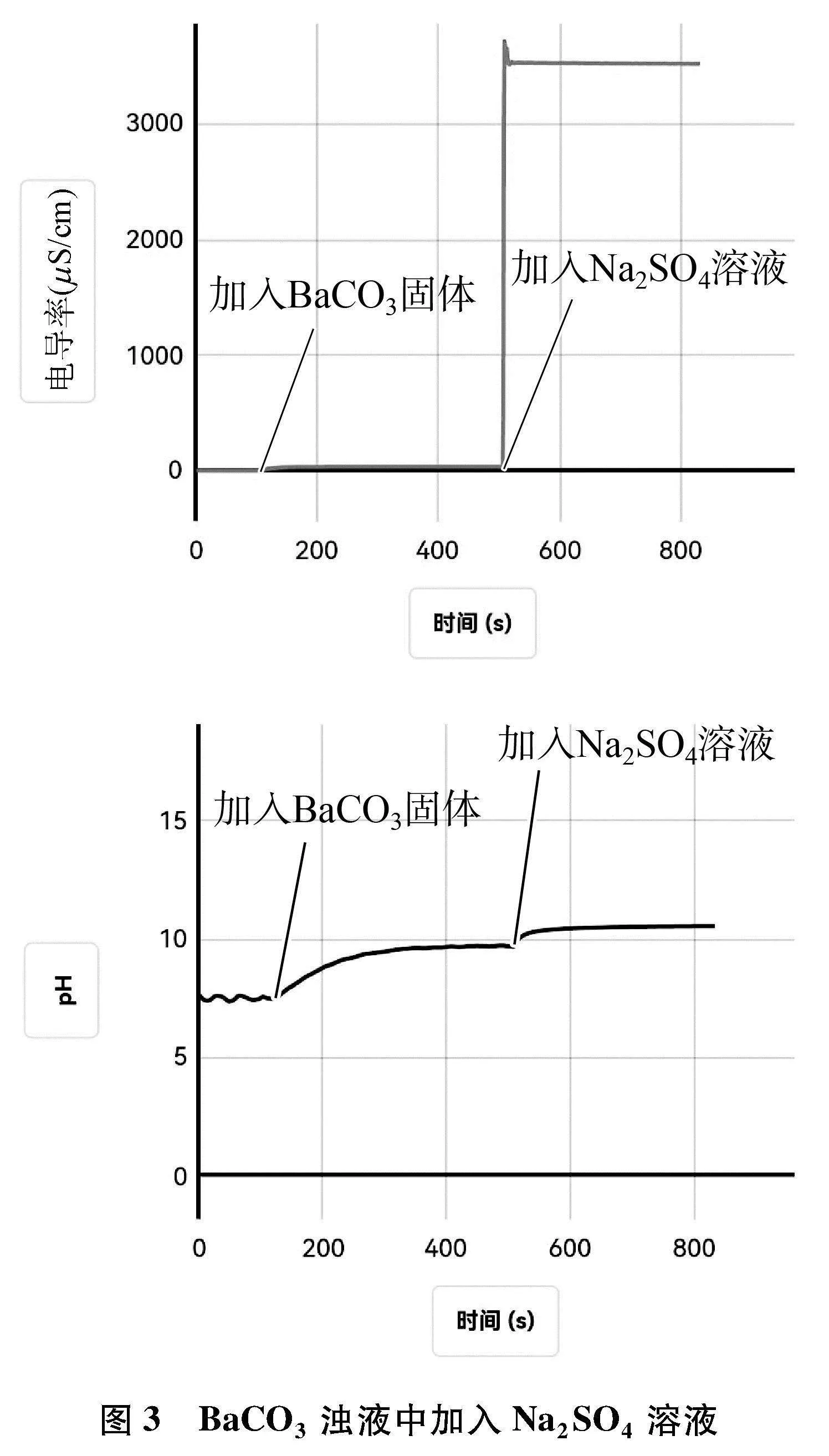
(1) 向盛有60mL蒸馏水的烧杯中,加入BaCO3固体,用磁力搅拌器搅拌,待数据稳定后,向其中加入1滴管Na2SO4溶液,用电导率传感器和pH传感器测其中的电导率和pH的变化,采集数据如图3所示。
(2) 向盛有60mL蒸馏水的烧杯中,加入BaSO4固体,用磁力搅拌器搅拌,待数据稳定后,向其中加入1滴管Na2CO3溶液,用电导率传感器和pH传感器测其中的电导率和pH的变化,采集数据如图4所示。
5.2 数据分析
对比两个实验的电导率曲线变化差别很大,说明用电导率的变化可以判断BaCO3与BaSO4的转化方向。因此,借助电导率和pH的变化都可以判断BaCO3与BaSO4转化方向。
5.3 实验结论
当向难溶电解质的浊液中,加入中性盐溶液,发生沉淀转化时,若生成能水解的离子时,溶液的pH会发生改变,对应的pH曲线也会产生对应的变化趋势,这种情况下可以借助pH传感器来判断沉淀转化的方向。
对比实验BaCO3浊液中加入Na2SO4溶液与实验Mg(OH)2浊液中加入FeCl3溶液,二者的电导率曲线变化均是先增大后逐渐减小,说明沉淀转化可以进行;对比实验BaSO4浊液中加入Na2CO3溶液与实验Fe(OH)3浊液中加入MgCl2溶液,二者的电导率曲线变化均是增大后不发生改变,可以借助电导率曲线变化说明沉淀转化很难进行。
通过实验4和5发现,电导率传感器是判断沉淀转化方向的一个很好的实验工具,那么是不是沉淀转化的方向判断都可以借助电导率传感器进行呢?下面我们对AgCl与AgI之间的转化进行探究。
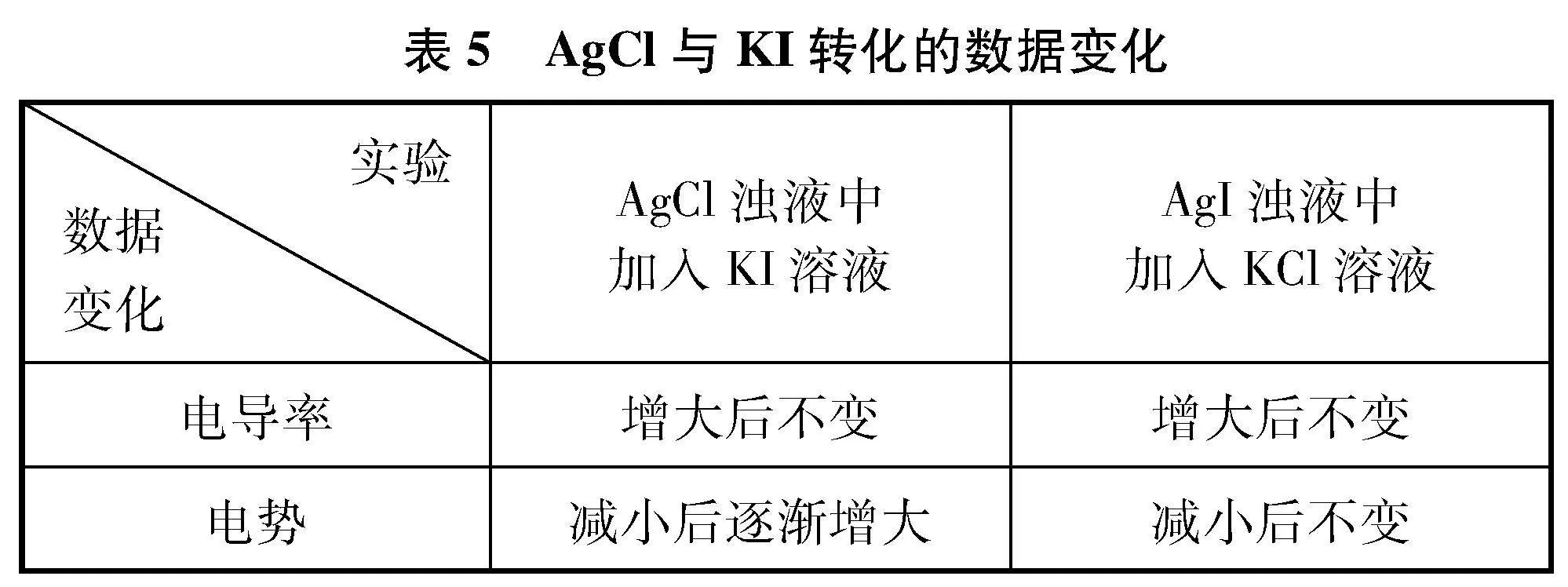
6 实验探究AgCl与AgI之间的转化
6.1 实验过程
由于I-和Cl-均不发生水解,体系中的pH变化几乎很小,所以下面的实验将pH传感器换为ORP传感器。电势反映了在电极上进行反应时得失电子的能力[5],电极电势越负,越容易失去电子,查阅文献[6]标准电极电势如表4所示,由于I-和Cl-按照物质的量1∶1进行转化,且二者的电势数值差别较大,当I-转化为Cl-,体系中的电势会升高,反之,则会减小。因此,可以借助ORP传感器测定体系中电势的变化趋势,进而判断I-和Cl-的浓度变化。
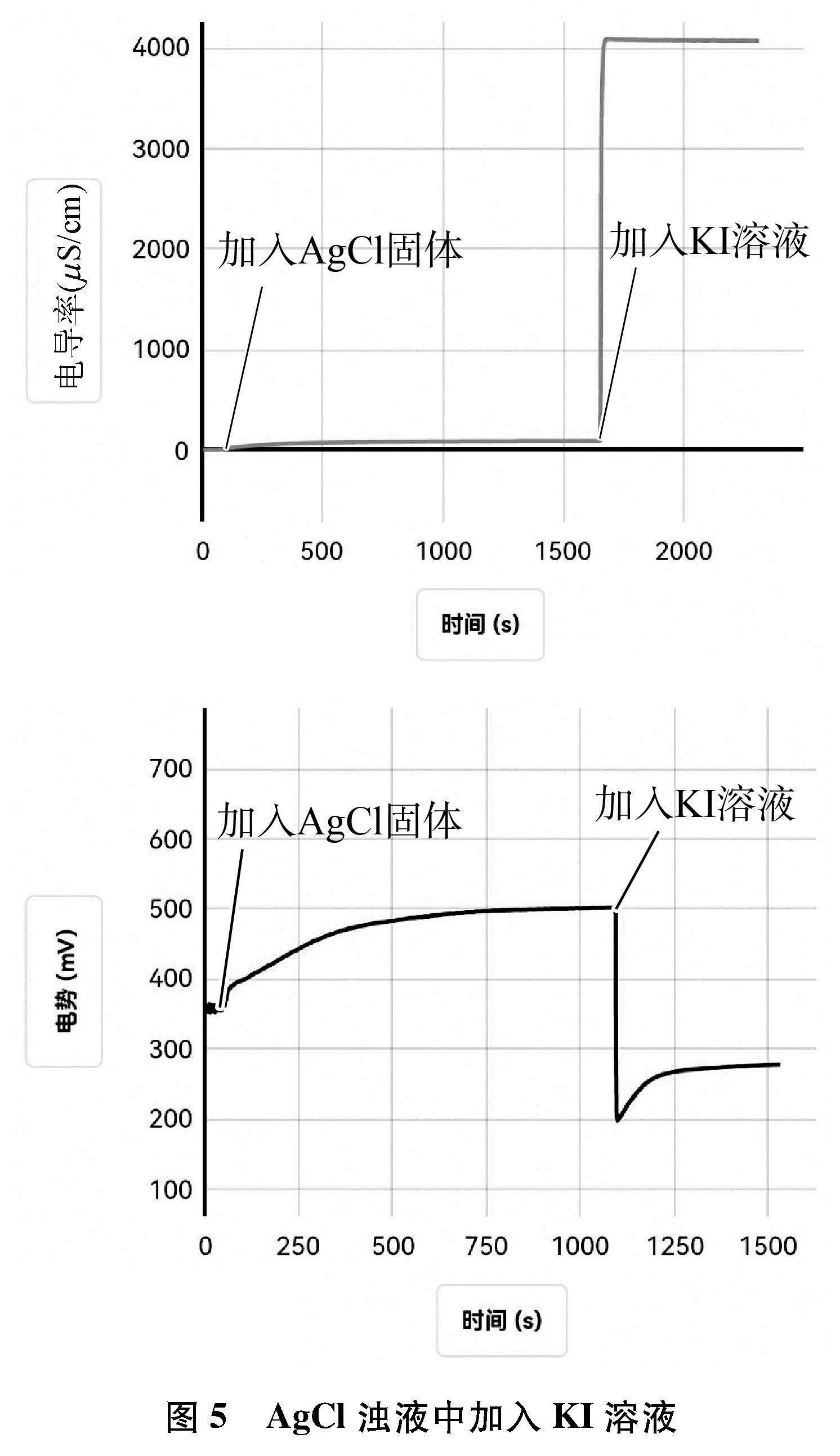
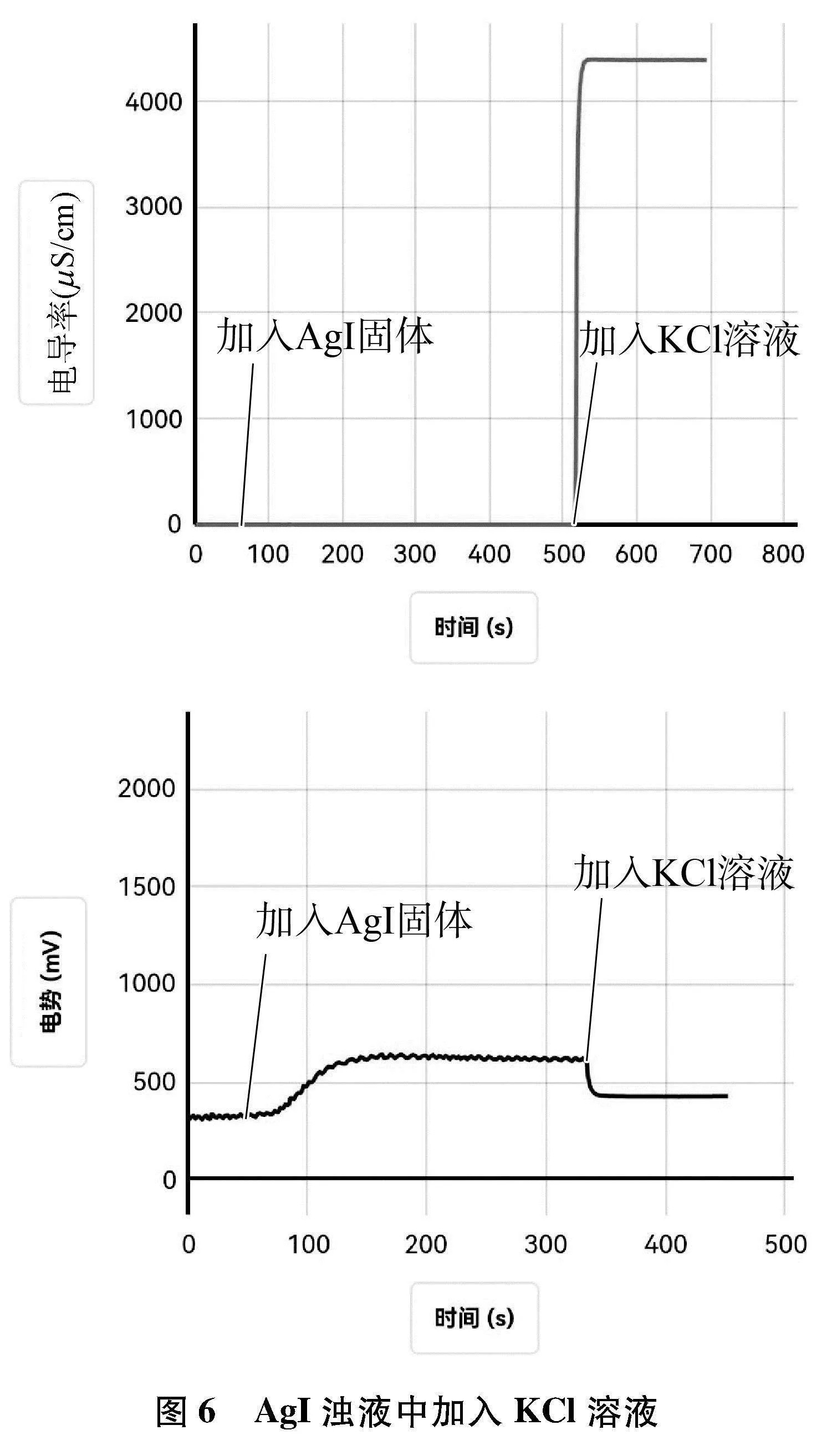
(1) 向盛有60mL蒸馏水的烧杯中,加入AgCl固体,用磁力搅拌器搅拌形成饱和溶液,待数据稳定后,再向其中加入1滴管KI溶液,用电导率传感器和ORP传感器测其中的电导率和电势的变化,采集数据如图5所示。
(2) 向盛有60mL蒸馏水的烧杯中,加入AgI固体,用磁力搅拌器搅拌形成AgI浊液,待数据稳定后,再向其中加入1滴管KCl溶液,用电导率传感器和ORP传感器测其中的电导率和电势的变化,采集数据如图6所示。
6.2 数据分析
6.3 实验结论
当向难溶电解质的浊液中,加入具有还原性或氧化性离子的溶液,发生沉淀转化时,体系的电导率和电势会发生改变,这种情况下可以借助电导率传感器和电势传感器来判断沉淀转化的方向。
利用电势传感器判断AgCl与AgI的转化方向,若是电势变化是先减小后逐渐增大,则该沉淀能发生转化,若电势变化是减小后不发生改变,则说明该沉淀转化反应不能进行。此变化趋势与前面用电导率判断Mg(OH)2与Fe(OH)3、 BaCO3与BaSO4的转化是一致的。综上三个沉淀转化的实验得出,若利用电导率变化判断沉淀转化的方向时,需离子的摩尔电导率有差别。
7 实验反思
本实验探究利用手持技术,将微观的粒子之间的转化通过直观的数据变化呈现出来,更加科学和严谨;将理论分析转化为实践操作,能让学生更深入地认识到沉淀的转化和沉淀转化的方向问题,为一线教学提供参考。直接选择难溶电解质进行沉淀转化的实验探究,而不是用现制沉淀的方法,既解决了前面学生提出的“未来得及反应”的问题,也解决了对沉淀洗涤和检验等繁琐的实验操作问题。实验装置简单、便携,实验过程快捷,实验现象明显且准确,利于在课堂上演示。
另外,本实验探究也可以结合沉淀溶解平衡的建立进行教学演示,这些难溶电解质在加水溶解的过程中,电导率、pH和电势等的变化,都是微观粒子性质的呈现。通过实践这三组转化实验,建议可以选择测AgCl溶解的电导率或电势变化,或者测Mg(OH)2溶解的电导率和pH变化,在课堂中演示沉淀溶解平衡的建立实验,理由是体系相对简单,建立平衡的实验时间也较短,数据变化较明显;建议选择测Mg(OH)2到Fe(OH)3的电导率的变化、测BaCO3到BaSO4的pH变化、测AgCl到AgI的电势变化,在课堂中演示沉淀的转化实验,理由是数据变化直观明显,转化时间短。
不足的是,虽然本实验中使用的相同溶液的浓度都一致,但是受实验室条件的制约,实验试剂不全,没有对教材中其他的沉淀转化进行实验探究,只能选择几组物质作为代表进行;实验试剂不纯,试剂的浓度无法精准配制,导致实验探究只能通过曲线的变化趋势判断沉淀的转化方向,而无法定量进行求算,期待后继的探究能进一步完善。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 34.
[2]徐睿. 中学化学数字化实验的新趋势[J]. 化学教学, 2020, (9): 31~33.
[3]杜博, 沈子稚, 肖艳. 基于“证据推理”素养的沉淀溶解平衡教学设计[J]. 化学教学, 2021, (6): 61~62.
[4][5][7]傅献彩等. 物理化学·下册(第五版)[M]. 北京: 高等教育出版社, 2006: 21~22, 77~78.
[6]宋天佑等. 无机化学·上册(第四版)[M]. 北京: 高等教育出版社, 2019: 450~457.

