苦参中苦参碱与苦参素提取研究

摘 要:本文采用苦参为原料,经纯水提取,料液比为1∶10,将甲醇进行醇沉。在酸性条件下,乙酸乙酯萃取除杂pH为1~3,在强碱条件下三氯甲烷萃取除杂pH为10~13。合并三氯甲烷有机相浓缩至干,得到苦参碱高含量粗品,用丙酮溶解做重结晶,冷却析出,得到高纯度苦参碱。利用氧化还原反应完成苦参碱与苦参素间的相互转化,转化率>95%,从原料方面降低了生产成本且操作步骤简单,解决了工业化生产问题。同时,苦参碱与苦参素相互转化,达到了纯度超过98%的原料药级别,为苦参碱与苦参素单体的提取和纯化技术提供了科学依据。
关键词:苦参碱;苦参素;提取;结晶
中图分类号:R 284 文献标志码:A
苦参(Sophora flavescens),别名野槐、好汉枝、苦骨、地骨、地槐、山槐子、川参、凤凰爪和牛参等,是一种传统中药材,自古以来便在中国和亚洲其他国家的民间医药中占有重要地位。随着现代科学技术发展,研究人员开始通过现代医学和药理学方法,探究苦参及其主要活性成分——苦参碱(Matrine)与苦参素(Oxymatrine,又名氧化苦参碱)的药效机制与应用价值。
目前,苦参尚未由人工引种栽培,生长于海拔1500m地区的山坡、沙地、草坡、灌木林以及田野,主要分布于中国大陆、朝鲜、日本、印度以及俄罗斯等地。苦参有清热、燥湿、杀虫和利尿的功效。多用于治疗热痢、便血、黄疸、尿闭、赤白带下、阴肿、阴痒、湿疹、湿疮、皮肤瘙痒、疥癣、麻风以及滴虫性阴道炎等[1]。
1 苦参概况
作为苦参的主要生物碱成分,苦参碱和苦参素具有显著的抗炎、抗病毒、抗肿瘤效果以及可用于免疫调节等多方面的药理活性。现代研究表明,苦参碱和苦参素在治疗心血管疾病、肝病、皮肤病等方面具有良好的效果,尤其是在中药制剂和复合制剂中的应用中,更凸显其潜在的医疗价值。
1.1 不同产地苦参中3种生物碱含量
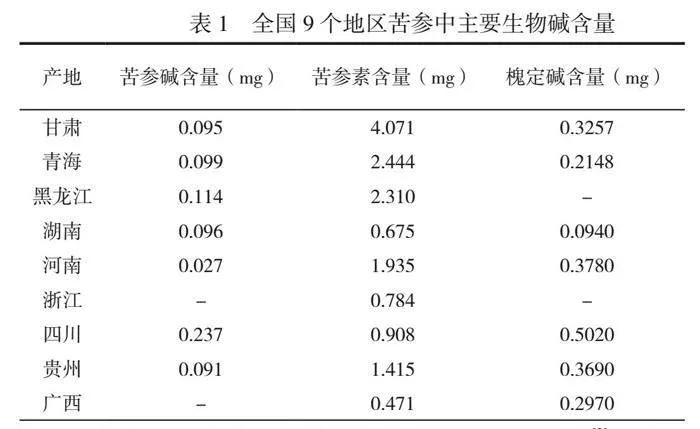
用高效液相色谱仪方法测定9个地区苦参中主要生物碱的含量,结果见表1。
在各产地的苦参中,苦参素均比苦参碱含量高[2],其中产自甘肃的苦参的苦参素含量最高,其次是青海,产自广西的苦参素最低,因此采购苦参应选产地为甘肃、青海一带的苦参[3]。
1.2 生物碱的提取与分离技术
1.2.1 生物碱的提取
国内、外主要用水提、醇提和超临界萃取等方法提取生物总碱,再用层析等方法分离各单体。陈静等发表在《广东化工》的论文试验结果表明,纯水对苦参碱和苦参素的提取效果优于乙醇溶液,在纯水用量是苦参饮片质量的10倍、超声时间45min、温度80℃的条件下,苦参碱和苦参素的总浸出率为46.5%。仝燕发表在《中国实验方剂学》的论文中以总生物碱提取率为指标,考察冷浸、渗漉和水煎煮3种提取工艺。以总生物碱和氧化苦参碱含量为指标,结果表明,最佳提取工艺为1%醋酸水溶液冷浸3次。付起凤等对超声法提取苦参中苦参碱和苦参素效果的提取时间、提取温度、提取频率和提取次数4个影响因素进行正交试验,结果表明,苦参药材粗粉在提取温度50℃、提取时间0.5h、超声频率35kHz、提取1次的条件下,可达到最佳提取效果。陈远谷等[4]比较了沸水煎煮提取、乙醇提取、酸水提取、碱性乙醇回流提取、乙醇超声提取和碱性氯仿超声提取6种方法提取的苦参生物碱后,所得结论如下:碱性氯仿超声提取法取得的总生物碱含量最高,碱性乙醇回流提取法和乙醇超声提取法与其接近;碱性氯仿超声提取法取得的氧化苦参碱含量最高;乙醇超声提取法取得的槐定碱含量最高;沸水煎煮提取法取得的苦参碱含量最高。综合考虑提取率、生产成本和安全性,乙醇超声提取法最佳。
1.2.2 生物碱的分离技术
利用生物碱不同的碱性,可以对其进行分离。向总生物碱的盐类水溶液中添加碱性试剂,使生物碱游离,控制碱性的强弱或加碱量,就可以分离出不同碱性的生物碱。例如分离出萝芙木中的生物碱,当pH=2时分离出弱碱,当pH≈6~7时分离出中强碱,当pH=10时分离出强碱[5]。这样分离后得到的仍然是混合物,但可以达到初步分离的目的。利用生物碱不同的吸附性能,用氧化铝、硅胶、硅藻土和酸性白土等,通过吸附层析法和薄层层析法进行分离。
金志敏发表了专利论文《一种从苦参总碱中分离苦参碱和氧化苦参碱的方法》。所述方法如下:先检测苦参中苦参总碱的含量,然后将苦参总碱溶于水中,加入金属卤化物MYz和HY溶液,所述M为三价Fe、Cu、Zn、Al或Mn、z为M的化合价,Y、N分别为独立的Cl、Br或I。在温度60℃~100℃下搅拌反应,反应结束后,冷却至0℃~30℃,静置析出晶体,过滤得到滤饼A和滤液A。氧化苦参碱留在滤液A中,滤饼A为苦参碱晶体粗品。詹原尧在试验中用离子交换法和醇提法提取、分离、纯化苦参碱和氧化苦参碱,利用氧化苦参碱难溶于乙醚的性质,在三氯甲烷浓缩液中加入乙醚,使氧化苦参碱析出、沉淀、过滤并分离,乙醚层含苦参碱,沉淀层为氧化苦参碱。他又用薄层层析法、纸层析与标准品对照法判断从苦参中提取的是否为苦参碱和氧化苦参碱。结果表明,用薄层层析法测定出氧化苦参碱的极性大于苦参碱。
1.3 生物碱的纯化技术
1.3.1 硫氰化铬铵沉淀生物碱
用硫氰化铬铵沉淀生物碱时,通常先用酸调节碱性溶液,得到pH约为2。然后滴加饱和的硫氰化铬铵水溶液,使沉淀完全。过滤后将沉淀溶解于丙酮中,加入硫酸银饱和水溶液,硫氰化铬根转为银盐沉淀,生物碱则转为硫酸盐,溶解于溶液中。继续加入精确计算量的氯化钡水溶液,使过量的硫酸根离子成为硫酸钡和氯化银并析出。生物碱的硫酸盐变为盐酸盐,过滤除掉沉淀。将溶液蒸发干就可以得到生物碱的盐酸盐。
1.3.2 离子交换树脂
除了运用上述办法分解生物碱的硫氰化铬盐外,还可以将生物碱的硫氰化铬盐的丙酮溶液通过氯型阴离子交换树脂,直接得到生物碱的盐酸盐,或者通过阳离子交换树脂,用氨水洗脱,就可以得到游离的生物碱。
1.3.3 磷钨酸试剂沉淀生物碱
用磷钨酸试剂沉淀生物碱,先将碱溶液用硫酸酸化,然后加入10%的磷钨酸水溶液,完全过滤沉淀。用水洗涤沉淀,加入适量固体碳酸钾,研磨均匀。干燥后放入索氏提取器中,用无水乙醇提取至不显生物碱反应,回收溶剂就可以得到水溶性生物碱。如果含有少量无机盐,用无水乙醇反复处理几次就可以除去。
2 苦参碱和苦参素的测定
苦参成分主要包括苦参碱、苦参素、槐果碱、氧化槐果碱和槐定碱等多种生物碱,其中苦参碱、苦参素的含量最高。
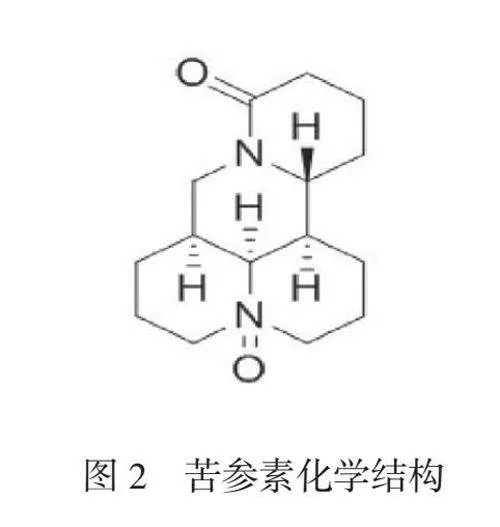
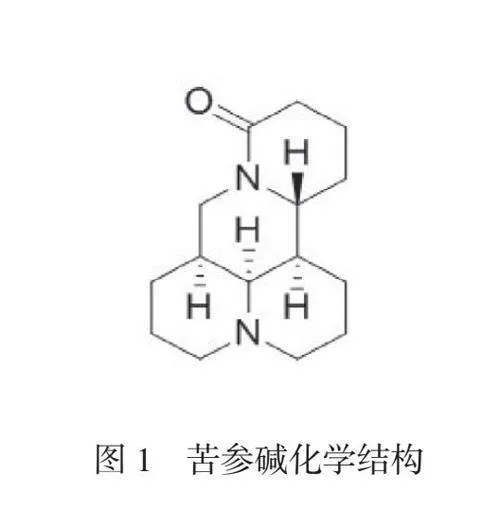
苦参碱分子式为C15H24N2O,化学结构如图1所示。苦参素分子式为C15H24N2O2,化学结构如图2所示。
苦参药材来自甘肃省,为秋季采收,由陕西联同通用标准技术服务有限公司鉴定。根据《中华人民共和国药典》规定的药材粉碎方法粉碎,精密称定适量样品到50 mL容量瓶,经甲醇超声溶解后转移到容量瓶中,用甲醇定容至刻度。检测波长为220nm,流动相为乙腈∶0.02%醋酸铵-三乙胺水溶液(V/V)=30∶70。
所选苦参原药材中苦参碱与苦参素含量测定结果色谱图如图3所示。其中横坐标的时间即色谱分析过程中的流动时间;纵坐标单位mAU是一个通常用于表征色谱峰大小的单位,反映了样品中各个组分的浓度。检测结果为苦参碱含量0.25%,苦参素含量1.88%。
3 苦参碱的分离纯化
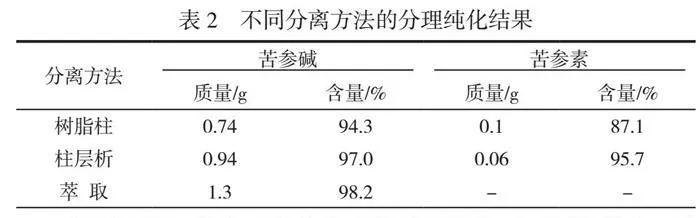
将原料用纯水回流提取3次,每次1h,过滤后合并滤液,再浓缩至浸膏状,相对密度约为1.1。经检测,药渣中无苦参碱和苦参素[6]。通过树脂柱分离纯化、柱层析分离和萃取分离3种方法进行分离纯化,分别提取浓缩浸膏50g,得到苦参碱与氧化苦参碱,具体结果见表2。
结果表明,苦参碱与苦参素的性质很相近,用溶媒法、重结晶、硅胶柱层析或者氧化铝柱层析分离苦参素,实际得到的都是含有苦参碱或者氧化槐果碱的混合结晶。直接萃取比传统方法,加入大量乙醚的方法简单得多,且消耗溶剂少,易于回收套用,成本低且安全性高。所以单独做苦参碱萃取方法比较优于其他方法。
4 苦参化与纯化
4.1 试验步骤
4.1.1 氧化反应
取苦参碱含量约95%的50g苦参,用10倍30%的双氧水溶液搅拌至完全溶解,放入磁力加热搅拌器升温60℃反应,保温,当反应1h、5h、10h、15h、24h、30h时分别取样检测,用薄层色谱硅胶板跟踪检测24h,反应基本完全。浓缩反应液,用盐酸将浓缩液调至强酸性,用乙酸乙酯萃取1次,保留水相,用氢氧化钠水溶液将水相调至强碱性,加三氯甲烷,置于分液漏斗中,充分搅拌,混匀后静置2h,分层后收集下层三氯甲烷,继续萃取,加3倍三氯甲烷重复上述操作3次,合并三氯甲烷,减压浓缩至少量,放置于4℃冰箱内过夜结晶,过滤烘干后经高效液相色谱仪检测,苦参碱含量为98.2%。
4.1.2 还原反应
取苦参素含量约95%的50g苦参,用15倍10%的稀盐酸充分搅拌溶解。在常温下加入锌粉1.5g,缓慢搅拌,当反应1h、5h、10h、15h、24h和30h时分别取样检测,用薄层色谱硅胶板跟踪检测15h,反应基本完全。浓缩反应液,用盐酸将浓缩液调至强酸性,用乙酸乙酯萃取1次,保留水相。用氢氧化钠水溶液将水相调至强碱性,加三氯甲烷,置于分液漏斗中,充分搅拌混匀后静置2h,分层后收集下层三氯甲烷有机相,继续萃取。加3倍三氯甲烷,重复上述操作3次,合并三氯甲烷有机相减压浓缩至干,加6倍丙酮加热完全溶解,缓慢降温至室温结晶。经高效液相色谱仪检测,用高效液相色谱仪检测过滤的晶体苦参碱,其中苦参素为99.1%。
4.2 试验结果与分析
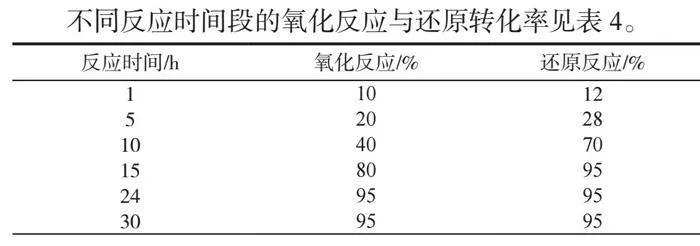
不同反应时间段的氧化反应与还原转化率见表4。
4.2.1 反应时间的影响
氧化反应结果随时间的变化规律如下:由薄层色谱可看出,随着时间延长,苦参碱的转化率不断提高,至24h时反应已经完全进行,因此将24h作为最佳反应时间,不需要延长时间[7]。
还原反应结果随时间的变化规律如下:由薄层色谱可看出,随着时间延长,苦参碱的转化率不断提高,至15h时反应已经完全进行,因此将15h作为最佳反应时间,不需要延长时间[7]。
4.2.2 反应温度的影响
本文试验中,反应时间固定,根据反应摩尔比计算反应需要的氧化剂与还原剂的计量比,在不同反应温度的单因素条件下进行试验,最终确定在60 ℃的条件下,双氧水总摩尔比为4∶1,在氧化反应24h的条件下,苦参碱可以比较完全地转化成苦参素[8]。在不同反应温度的单因素下进行试验,最终确定在常温条件下,锌粉总摩尔比为5∶1,还原不用加热反应15h的条件,苦参素可以比较完全地转化成苦参碱。经过简单结晶,可获得纯度gt;98%的目标产物,从而提高了苦参碱与苦参素的收率[9]。
5 结论
本文研究了低污染的苦参总碱用纯水提取、苦参碱与苦参素的分离纯化以及苦参碱与氧化苦参碱间氧化还原的一系列步骤。虽然在天然物的提取、分离等处理技术中有机溶剂的使用是不可缺少的,但是本文使用的提取过程减少了有机溶剂的使用,无论是在收率还是纯度上,本文方法都有较大优势。在生产过程中,使用这样的操作方法可以将操作人员所受的身体伤害降至最低,并减少了药物成品残留和环境污染,为以后的工业生产提供了有利条件。
参考文献
[1]李茹,陈蕊,李聪旭.正交试验优选苦参生物碱渗漉提取工艺的研究[J].黑龙江畜牧兽医,2015(21):200-202.
[2]赵玉英,郭敏杰.苦参中生物碱含量测定[J].北京医科大学学报,1992(5):419-420.
[3]徐馨,周庆民,冯万宇,等.响应面法优化苦参总生物碱提取工艺的研究[J].现代化农业,2014(8):52-54.
[4]陈远谷,李春燕,王若焱,等.不同提取方法对苦参中生物碱提取率的影响[J].山地农物生物学报,2015(34):41-45.
[5]付起凤,曹琦,吕邵娃.正交法优化苦参中苦参生物碱的超声提取工艺[J].中医药信息,2015(32):11-13.
[6]穆甲骏.苦参生物碱的分离纯化及其性能研究[D].郑州:河南工业大学,2015.
[7]郝彦、汪宝琪.苦参碱和氧化苦参碱的研究概况[J].西北药学杂志,1996(5):331-334.
[8]李霞.苦参生物碱的吸脱附研究及氧化苦参碱的分离[D].济南:山东大学,2013.
[9]于海红.苦参粗提液中氧化苦参碱和苦参碱的分离与纯化[D].鞍山:辽宁科技大学,2014.

