gga-miR-130b-3p在鸡脂肪相关组织中的表达规律及其靶基因的生物信息学分析

摘要:为探究gga-miR-130b-3p对鸡脂肪沉积的作用,以江苏省家禽科学研究所自主培育的矮小品系S3系和引进的国外肉鸡品种隐性白羽鸡为试验素材,检测gga-miR-130b-3p在2个品种0日龄、2周龄、8周龄、14周龄、16周龄肝脏、腹脂、腿肌和肌内脂肪细胞中的表达变化,并对靶基因进行预测、分析。结果显示,0 W与 16 W 肝脏组织中gga-miR-130b-3p的表达水平存在明显品种差异,且在S3系鸡中gga-miR-130b-3p的表达水平显著高于隐性白羽鸡(Plt;0.05);与其他周龄相比,0 W时腹部脂肪组织中gga-miR-130b-3p的表达量较高(Plt;0.01);在腿肌组织中,2个品种间8 W与14W时gga-miR-130b-3p的表达有显著性差异(Plt;0.05),隐性白羽鸡8 W的表达显著高于S3系鸡,14 W时S3系鸡的表达显著高于隐性白羽鸡(Plt;0.05);在腹脂细胞和肌内脂肪细胞中,gga-miR-130b-3p分化4 d后的表达均显著高于增殖期(Plt;0.01)。靶基因预测分析表明,gga-miR-130b-3p共预测到70个交集靶基因。GO和KEGG分析结果表明,ULK2和GRB10是gga-miR-130b-3p的预测靶基因。综合所述,gga-miR-130b-3p在鸡不同发育时期的表达存在显著的品种和组织差异性,gga-miR-130b-3p很可能是通过ULK2和GRB10调控脂肪沉积。
关键词:鸡;gga-miR-130b-3p;组织;细胞;表达分析;脂肪沉积
中图分类号:S831.2" 文献标志码:A
文章编号:1002-1302(2024)23-0181-06
李瑞瑞,宗" 毅,赵振华,等. gga-miR-130b-3p在鸡脂肪相关组织中的表达规律及其靶基因的生物信息学分析[J]. 江苏农业科学,2024,52(23):181-186.
doi:10.15889/j.issn.1002-1302.2024.23.025
收稿日期:2023-11-09
基金项目:现代农业产业技术体系建设专项(编号:CARS-41-Z05);江苏省种业振兴揭榜挂帅项目[编号:JBGS(2021)109、JBGS(2021)029];国家家养动物种质库建设项目(2023);国家自然科学基金(编号:32102538);广东省自然科学基金(编号:2022A1515012014)。
作者简介:李瑞瑞(1998—),女,山东泰安人,硕士,主要从事家禽遗传育种研究。E-mail:liruirui117@163.com。
通信作者:向" 海,博士,副教授,主要从事动物遗传育种与繁殖研究。E-mail:xh@fosu.edu.cn。
鸡肉是一种高蛋白、低脂、低胆固醇的食品,在人们的日常餐桌上占有重要地位。近年来,优质肉鸡生长性能不断改良,但同时也伴随着腹部脂肪的过度沉积。腹部脂肪的过度沉积会降低饲料转化效率,而脂肪沉积在肌肉中则会提高嫩度和风味[1]。因此,有效控制家禽脂肪沉积,对于优质肉鸡培育和肉质改善是非常有意义的。
microRNAs(miRNAs)长度为21~30个碱基,它是一种小的、非编码的RNA分子,附着在mRNA的3′-非翻译区域(3′-UTR)上,作用主要是负向调节靶基因[2]。gga-miR-130b-3p是属于miR-130/301家族的一种多功能因子,在不同疾病与生物学过程中均发挥了作用。miR-130b-3p在不同的癌症类型中具有组织特异性,如gga-miR-130b-3p过表达,可以在甲状腺腺瘤[3]和上皮性卵巢癌[4]中作为癌基因,也可以在乳腺癌[5-6]和卵巢癌[7]中发挥抑癌作用。miR-130b通过靶向Sp1转录因子抑制肌母细胞增殖并促进肌源分化[8],miR-130b-3p通过靶向CHD9在结直肠癌肿瘤发生中起致癌作用[9],miR-130b通过靶向PTEN可显著促进膀胱癌细胞的迁移、侵袭和增殖[10]。
近年来,有文献报道miR-130b-3p不但参与了疾病调控,同时也参与了哺乳动物脂肪代谢的调控过程。miR-130b可降低人类肌肉细胞的靶基因PPARGC1A的表达,在人类肥胖相关代谢疾病发病机制中起关键作用[11];miR-130b可以调控参与胆固醇脂蛋白运输的关键蛋白质的表达[12];gga-miR-130b-3p在鸡上研究还有很大的空间可以完善。有研究报道gga-miR-130b-3p通过靶向IBDV基因组和抑制SOCS5来抑制传染性法氏囊病病毒的复制[13]。目前,对于gga-miR-130b-3p与优质肉鸡脂肪沉积(腹脂和肌内脂肪沉积)的直接关系尚未见详细报道。矮小型S3系鸡是通过导入矮小基因(dw)并经多个世代的选育所形成的遗传性能稳定的品系种,体质量低于正常鸡40%左右,但脂肪沉积也更严重[14-15],是研究脂肪沉积的理想模型。研究表明,性连锁矮小鸡的GHR基因突变能引起胫骨变短、肌肉量变少、基础代谢率降低、血液胰岛素样生长因子1(IGF-1)含量降低、血液生长激素含量升高、耐热性升高、饲料利用率升高[16]等一系列生理和表型性状的改变。本研究以江苏省家禽科学研究所自主选育的矮小品系S3和隐性白羽鸡(RR)为试验材料,分析gga-miR-130b-3p在肝脏、腹脂、腿肌组织、腹脂和肌内脂肪细胞增殖期和分化期的表达差异,将为明确miR-130b-3p对脂肪沉积的作用提供重要的前期研究基础。
1" 材料与方法
1.1" 试验材料
试验动物:0日龄(0 W)、2周龄(2 W)、8周龄(8 W)、14周龄(14 W)、16周龄(16 W)江苏省家禽科学研究所矮小品系S3系鸡(DW)和隐性白羽肉鸡(RR)各6羽。S3系鸡是利用矮小基因DW培育而成的优质肉鸡,体型较小,生长速度较慢;隐性白羽肉鸡属于快大型肉鸡,体型较大、生长周期短、肉质好。试验鸡由江苏省家禽科学研究所邵伯试验基地提供,鸡饲养期为2022年5—10月;试验在江苏农业科学院家禽研究所完成。
主要仪器:高压灭菌锅(TOMY/SX-500,日本TOMY公司),分光光度计(NanoDrop 2 000)、CO2细胞培养箱(3111),均购自美国Thermo公司;PCR扩增仪(CFX96)、荧光定量PCR扩增仪(9902),均购自美国applied biosystems公司。
主要试剂和耗材:胎牛血清(FBS,以色列BI公司),青链霉素混合液(美国Gibco公司),DME/F12培养基(SH30023.01,美国HyClone公司),D-HANKS(北京Solarbio公司),Ⅰ型胶原酶(北京英坊科技有限公司),油酸(美国Sigma公司),总RNA提取试剂盒(DP419)、miRcute增强型miRNA cDNA第一链合成试剂盒(KR211-02)、miRcute增强型miRNA荧光定量检测试剂盒(FP411-02)均购自天根生化科技(北京)有限公司,75%乙醇(德州名德消毒科技有限公司),15 mL离心管、10 cm培养皿、12孔板,均购自美国Corning公司。
1.2" 样品采集
对不同周龄试验鸡的肝脏、腹脂和腿肌进行取样,将收集到的样品快速的放到液氮中进行冷冻,在-80 ℃的环境下进行保存待用。
1.3" 细胞培养
将S3系7日龄母鸡置于盛有75%乙醇的烧杯中直至死亡,取腹部脂肪和腿部肌肉,放入装有 D-HANKS 的6 cm进口培养皿内,清洗2~3次。
将腹脂组织剪成小碎块,然后转移至15 mL的进口离心管中,再加入1.0~1.5倍的0.1% Ⅰ型胶原酶,在37 ℃培养箱中进行1 h消化,直至变成肉糜,再加入等体积的全培养基,使其停止消化,使用尼龙膜过滤后收集滤液并离心,去除上清液后使用10%的全培养基悬浮细胞沉淀,将培养皿放入 37 ℃ 细胞培养箱中培养。细胞融合至70%时进行传代铺板。
将腿部肌肉组织剪碎后,转移至15 mL的进口离心管中,再加入1.0~1.5倍的0.1% Ⅰ型胶原酶,置于37 ℃培养箱中进行1.5 h消化,直至变成肉糜,再加入等体积的全培养基,使其停止消化,然后进行离心。吸取上清液至T25瓶中,添加完全培养基装满T25,放入37 °C细胞培养箱中倒置培养。细胞融合至70%时进行传代铺板。
细胞传代后继续培养融合至70%,未添加油酸组的为增殖期细胞,另一组用0.1%油酸诱导分化并将此时定义为分化0 h,收集增殖期分化后1、4、6 d 的细胞。
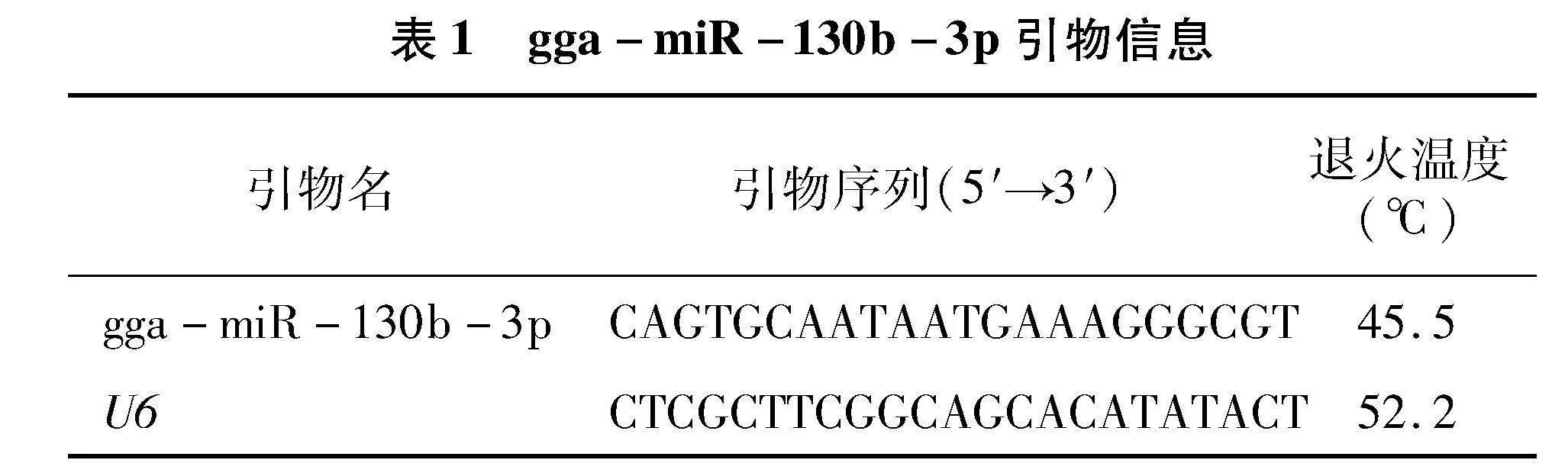
1.4" 引物设计与合成
本项目拟在前期工作的基础上,以miRbase中的鸡gga-miR-130b-3p序列(登录号:MIMAT0026503)为切入点,采用 miRNAs Design v1.01软件,以U6为内参,设计1条引物并由生工生物工程有限责任公司进行合成。引物信息见表1。
1.5" 反转录合成与QPCR试验
利用miRNA提取分离试剂盒对不同组织和细胞样本中的总RNA进行提取,RNA浓度和纯度采用紫外分光光度计检测(1.8≤D260 nm/D280 nm≤2.0)。使用加A法,每个样本取3 μL总RNA进行反转录,然后放置于-20 ℃冰箱保存。
miRNA的荧光定量检测使用SYBR Green Ⅰ嵌合荧光法,以U6为内参考基因在Aplied Biosystems 7500荧光定量PCR系统进行PCR反应。每个样本重复2次,参照日龄为矮小品系S3鸡0 W的表达量,内参基因为U6。miRNA相对表达采用2-ΔΔCT方法进行计算。
1.6" 靶基因预测及功能分析
本研究采用3种在线软件TargetScan、miRDB、miRmap等,筛选出gga-miR-130b-3p调控的下游靶基因。为了避免单一软件预测到的靶基因过少,并降低预测结果的假阳性,所以对3个软件预测中至少出现2次的基因进行选取。采用DAVID、KOBAS 3.0等在线工具,对得到的目标基因进行了GO功能分析和KEGG pathway富集分析。
1.7" 数据处理
利用2-ΔΔCT方法,对gga-miR-130b-3p在鸡各组织中的表达水平进行比较研究。结果以“平均值±标准偏差”为标准。使用SPSS 26.0软件对其进行了单因素方差分析,Plt;0.05表示差异显著,Plt;0.01表示差异极显著。
2" 结果与分析
2.1" gga-miR-130b-3p在肝脏组织中的表达
由图1可知,gga-miR-130b-3p在0 W和 16 W 肝脏组织中的表达存在明显的品种特异性(Plt;0.05)。DW的表达量在5个时间点的表达均高于RR。RR在0 W的表达显著高于其他周龄(Plt;0.05)。RR在8 W时,gga-miR-130b-3p的表达量较0、14周龄显著降低(Plt;0.05)。
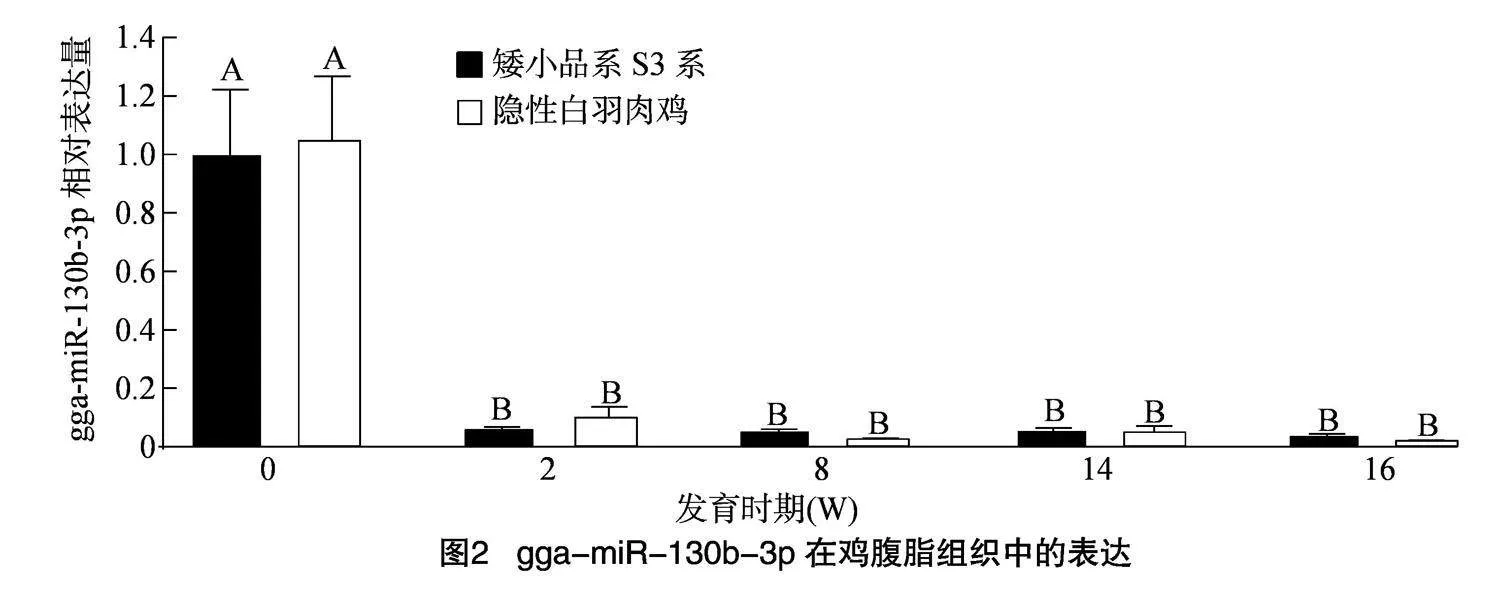
2.2" gga-miR-130b-3p在腹脂组织中的表达
由图2可知,gga-miR-130b-3p在2个品种腹脂组织中的表达模式有一定的差异。gga-miR-130b-3p在RR与DW中0 W时表达量最高且极显著高于其他周龄(Plt;0.01),而在2 W后gga-miR-130b-3p的表达相对稳定,至16 W仍保持在这种低表达水平。
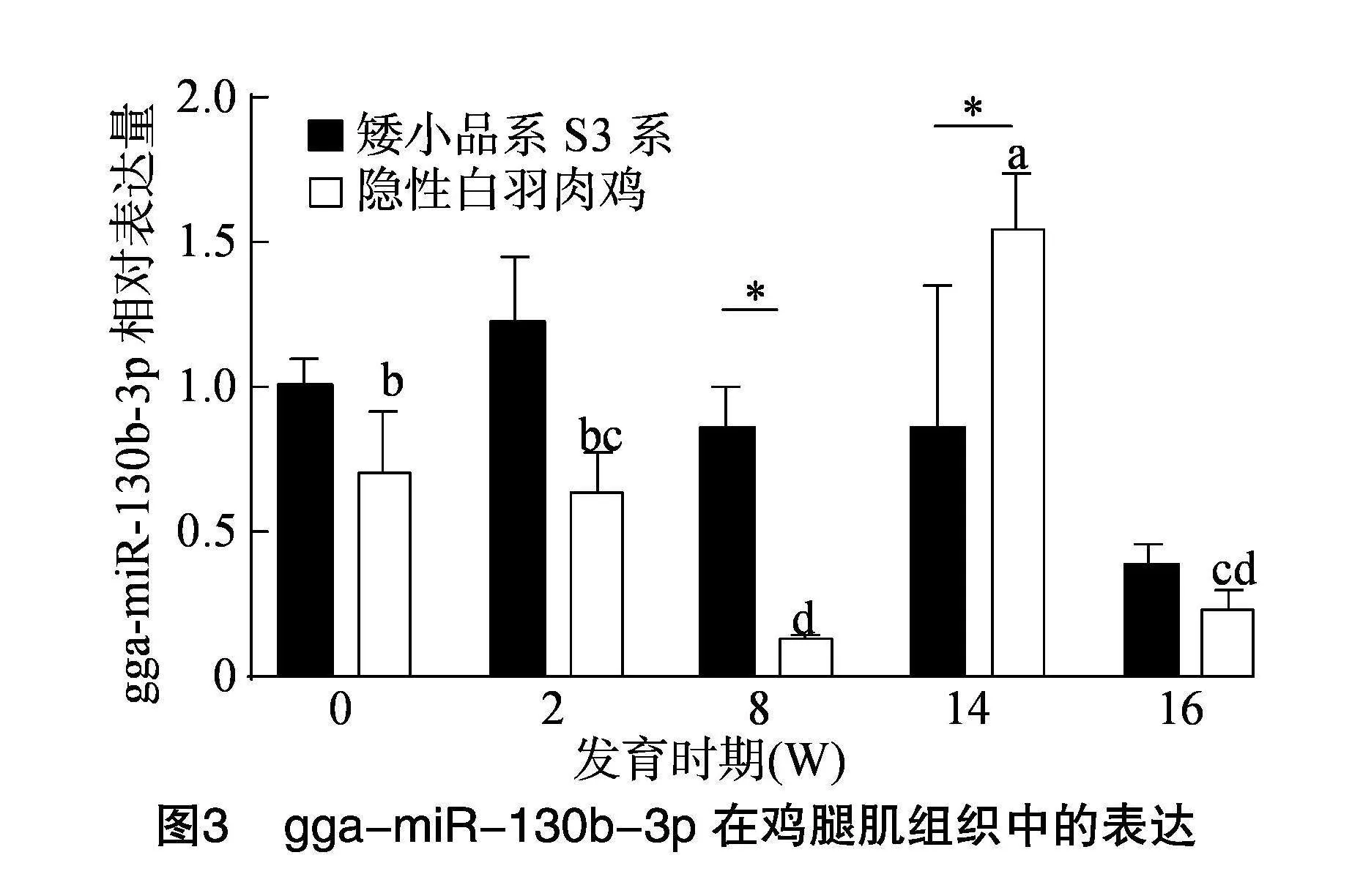
2.3" gga-miR-130b-3p在腿肌中的表达
由图3可知,在8 W与14 W的腿肌肉组织中,gga-miR-130b-3p的表达有明显的品种差异(Plt;
0.05),在8 W时,在DW中,gga-miR-130b-3p的表达明显高于RR,但在14 W时,gga-miR-130b-3p的表达明显低于RR(Plt;0.05)。DW各周龄间gga-miR-130b-3p的表达量无显著差异(Pgt;0.05);在RR,gga-miR-130b-3p的表达在8 W时最低,至14 W时则显著升高。
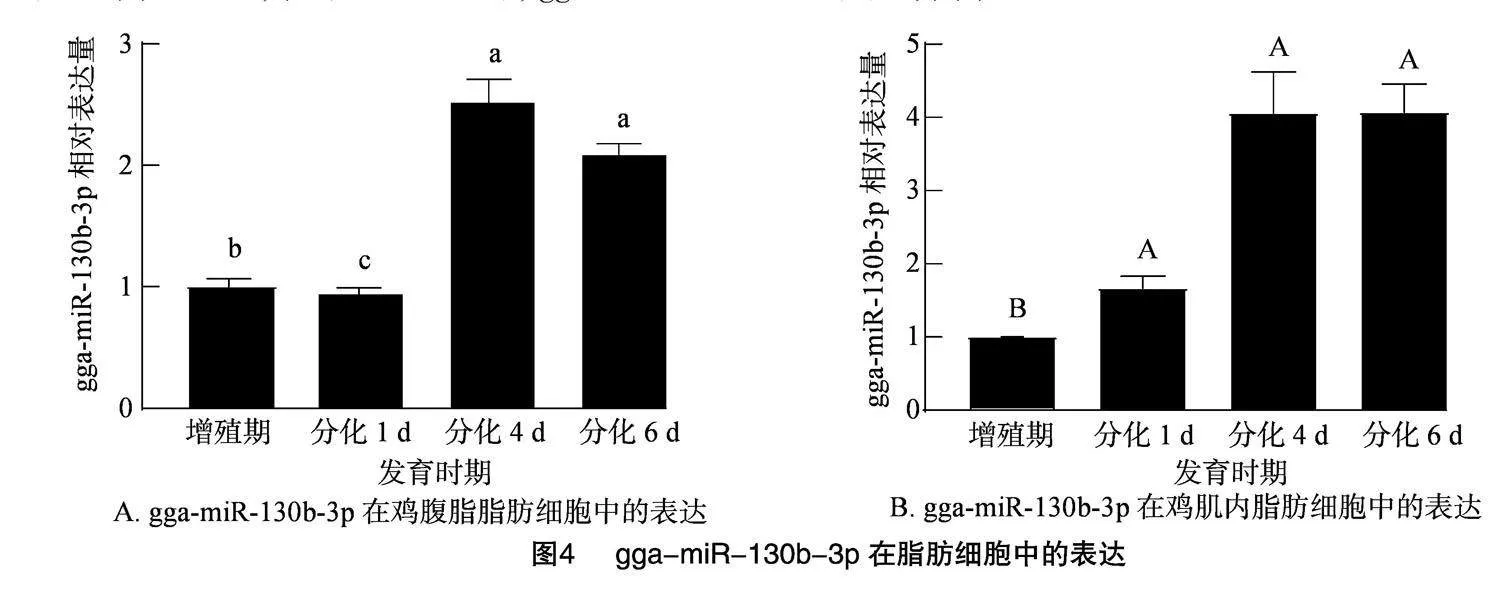
2.4" gga-miR-130b-3p在脂肪细胞中的表达
在鸡腹脂脂肪细胞中,由图4-A可知,分化 4 d 和6 d,gga-miR-130b-3p的表达显著高于增殖期(Plt;0.05);在肌内脂肪细胞中,图4-B可知,gga-miR-130b-3p在分化期的表达极显著高于增殖期(Plt;0.01),在分化4 d达到高峰,且至6 d时维持高表达量。
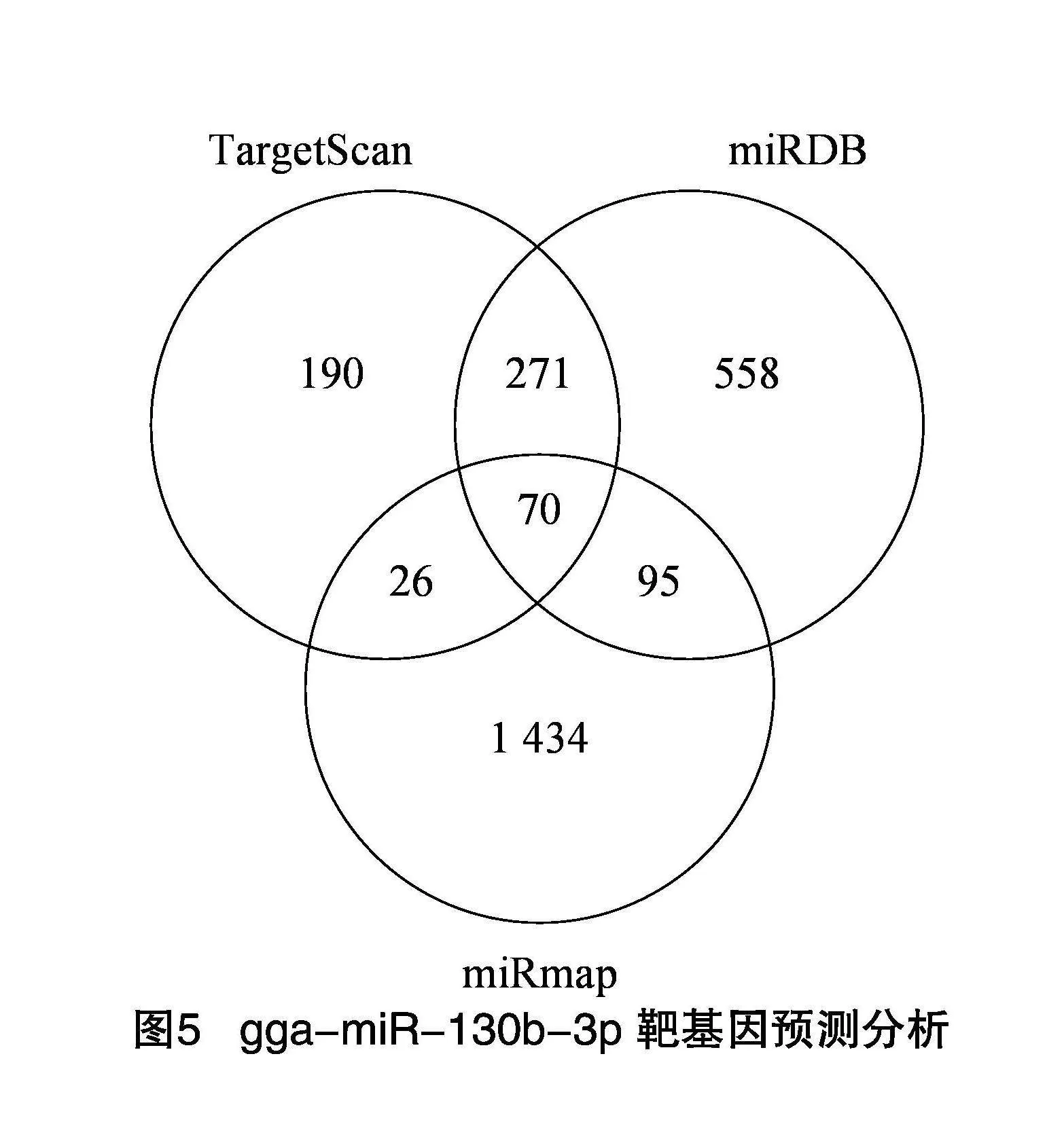
2.5" gga-miR-130b-3p靶基因预测及功能分析
由图5可知,通过不同在线软件预测到的gga-miR-130b-3p靶基因个数,TargetScan为557个,miRDB为994个,miRmap为1 625个,3个软件预测结果的交集靶基因为70个。
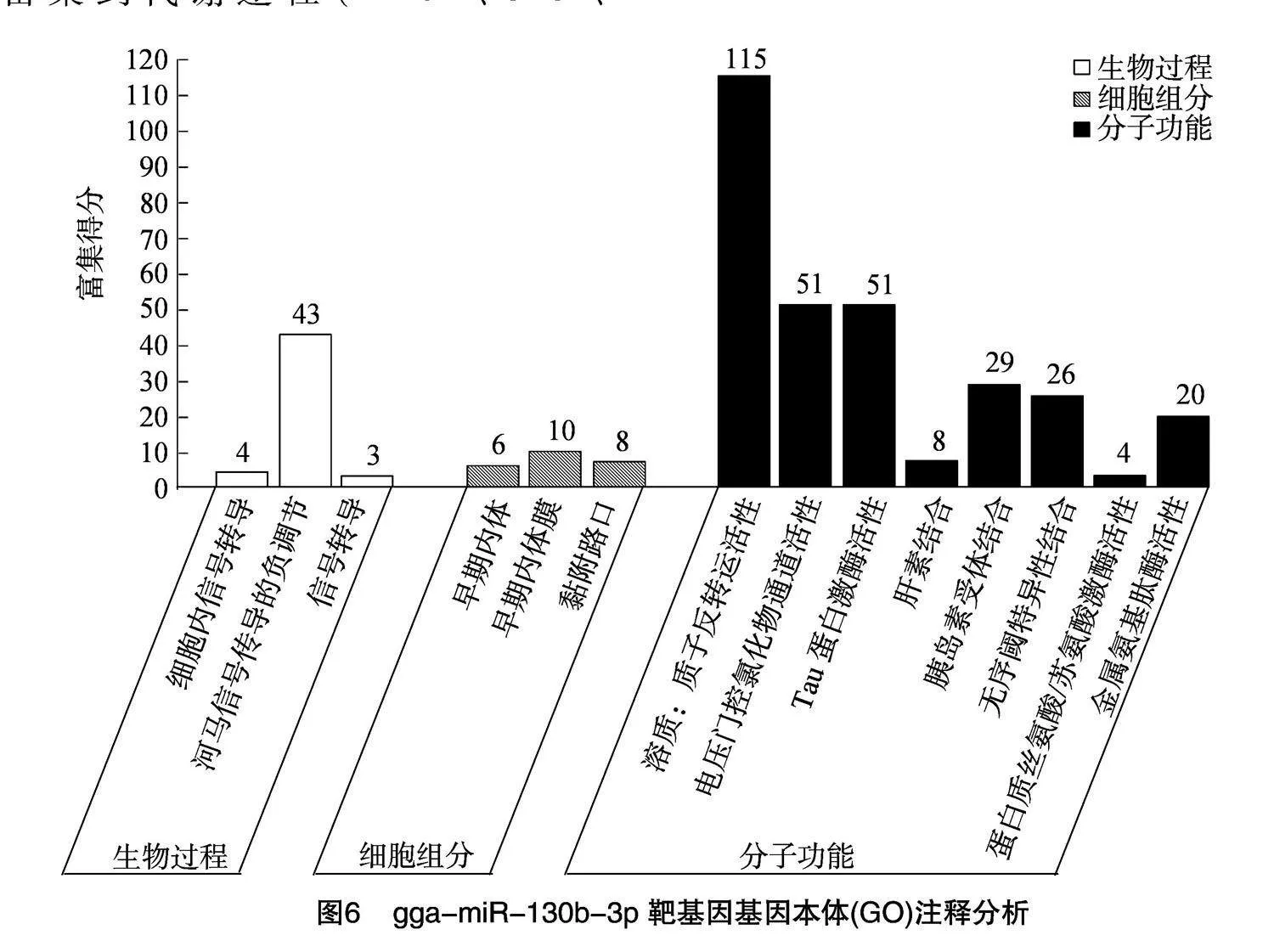
由70个靶基因的GO功能富集分析结果(图6)可知,靶基因主要富集于生物学过程分类中的细胞内信号转导、河马信号的负调控、信号转导、早期内体等过程;细胞组分分类中的早期内吞体膜、粘连结点、溶质:质子逆向转运蛋白活性、电压门控氯通道活动;分子功能分类中的Tau蛋白激酶活性、肝
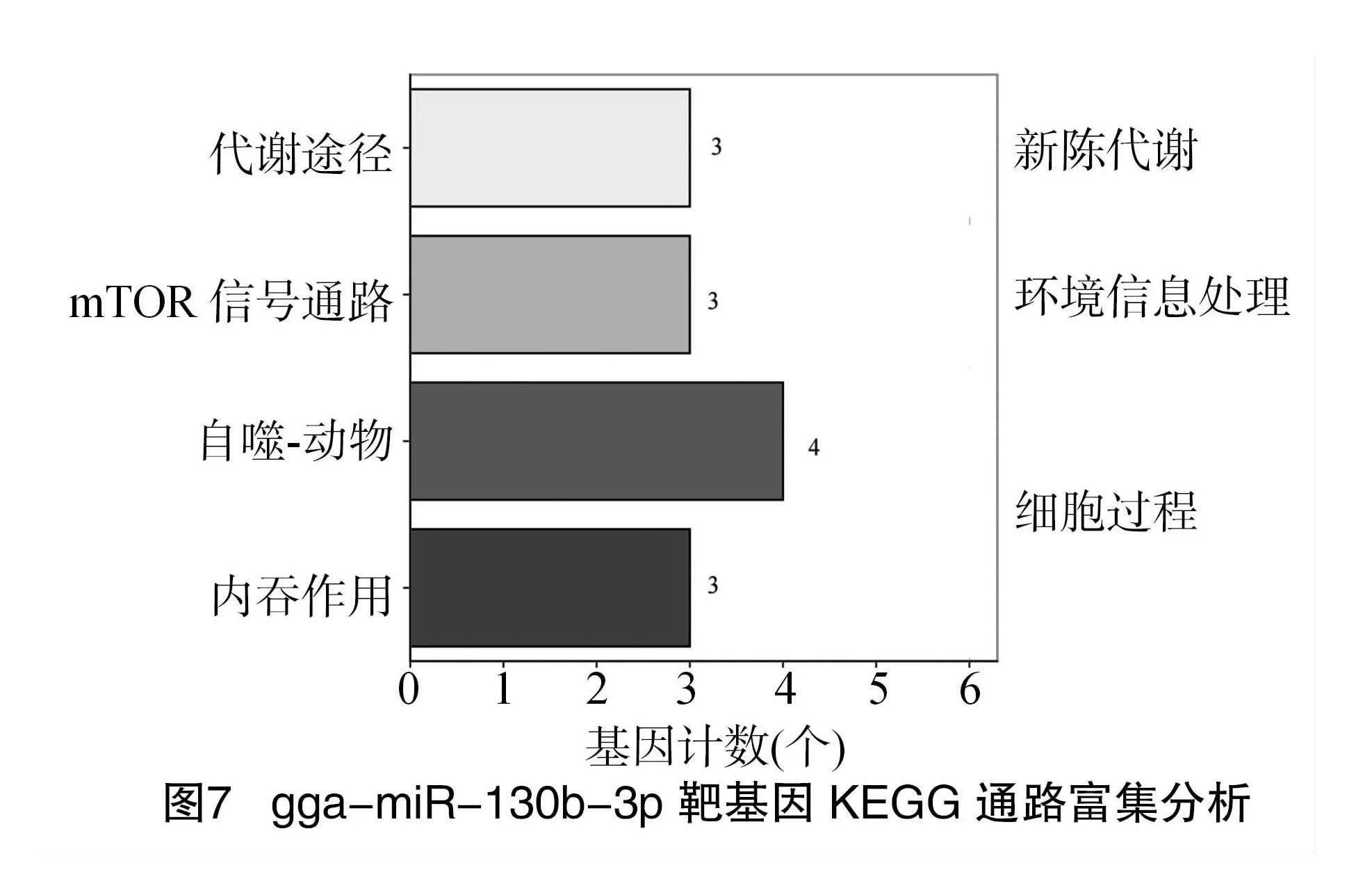
素结合、胰岛素受体结合、无序的结构域特异性结合、蛋白质丝氨酸/苏氨酸激酶活性、金属氨基肽酶活性等。KEGG pathway富集分析结果(图7)表明,靶基因主要富集到代谢途径(HPRT1、UXS1、MAT2B)、mTOR信号通路(ULK2、RRAGD、GRB10)、自噬-动物(ULK2、RRAGD、ATG16L1、PRKACB)、内吞作用(SNX2、STAM、CLTC)等途径中。
3" 讨论
本研究结果表明,在肝脏组织中,gga-miR-130b-3p在S3系鸡和隐性白羽鸡中表达规律有所差异,S3系鸡gga-miR-130b-3p在肝脏中的表达量始终高于隐性白羽鸡,在腹脂组织中,0~2 W隐性白羽鸡gga-miR-130b-3p的表达量高于S3系鸡。在腿肌组织中gga-miR-130b-3p的表达量8 W以前S3系鸡高于隐性白羽鸡,这可能是早期发育中隐性白羽鸡腿肌的脂肪沉积早于S3鸡。综上所述,gga-miR-130b-3p参与了脂肪沉积的过程,且在不同品种中参与脂肪调控的时间及充当的角色均是不同的。gga-miR-130b-3p在体外腹脂和肌内脂肪细胞增殖期均显著低于分化后期,推测gga-miR-130b-3p主要在脂肪细胞分化期起调控作用。有文献研究报道,miR-130b通过靶向PPAR-γ抑制人原代前脂肪细胞和3T3-L1小鼠脂肪细胞中脂肪生成[17],miR-130b-3p能够以胞外囊泡的形式进入到脂肪细胞中,并且能够抑制猪前体脂细胞的脂肪分化[18];miR-130b-3p通过靶向KLF3抑制山羊肌内脂肪细胞分化[19];miR-130b 通过靶向肉牛PPARG和CYP3U2的 1′UTR 直接影响脂肪细胞分化[20];在家兔中miR-130b抑制前体脂肪细胞分化;在鸡肝癌细胞中,INSIG1基因下调导致ACSL1、MTTP-L、ApoB、ApoVLDLII基因表达及甘油三酯及甘油含量显著降低,miR-130b-3p直接靶向INSIG1基因[21]。因此推测,miR-130b-3p可能参与了家禽和哺乳动物的脂肪代谢过程,此外,miR-130b-3p对脂肪细胞分化和脂肪细胞增殖也具有重要作用。
gga-miR-130b-3p通过不同的靶基因在不同物种的相关性状中发挥作用,如何准确预测靶基因是研究miRNA功能的难点和重点问题。本研究采用3种预测软件共筛选到70个预测靶基因,显著富集在代谢途径、mTOR等信号通路,其中富集在mTOR信号通路里的ULK2和Grb10与脂肪代谢密切相关。ULK2调节脂肪细胞的脂质代谢和葡萄糖摄取[22];Grb10通过抑制mTORC1磷酸化依赖反馈促进脂肪分解和产热[23],通过对小鼠模型的研究发现Grb10蛋白可以促进大脑中瘦素(Leptin)的活性,Grb10直接与神经元上的瘦素受体结合,形成复合物,增强瘦素信号,有助于减少食物摄入,增加能量消耗[24]。gga-miR-130b-3p对优质肉鸡腹脂和肌内脂肪沉积的具体作用及其靶向基因的鉴定,在后期的研究中将会进一步通过体外功能试验来证实。
4" 结论
gga-miR-130b-3p在不同发育阶段的肝脏、腹脂和腿肌组织中存在差异表达模式。推测gga-miR-130b-3p对鸡脂肪代谢的调控主要是通过mTOR通路来实现,ULK2和Grb10将是重点关注的靶基因。
参考文献:
[1]Zerehdaran S,Vereijken A L J,van Arendonk J A M,et al. Estimation of genetic parameters for fat deposition and carcass traits in broilers[J]. Poultry Science,2004,83(4):521-525.
[2]Lu J,Shen Y,Wu Q F,et al. The birth and death of microRNA genes in Drosophila[J]. Nature Genetics,2008,40(3):351-355.
[3]Leone V,Langella C,Esposito F,et al. miR-130b-3p upregulation contributes to the development of thyroid adenomas targeting CCDC6 gene[J]. European Thyroid Journal,2015,4(4):213-221.
[4]Zhou D B,Zhang L Y,Sun W W,et al. Cytidine monophosphate kinase is inhibited by the TGF-β signalling pathway through the upregulation of miR-130b-3p in human epithelial ovarian cancer[J]. Cellular Signalling,2017,35:197-207.
[5]Ahn S,Kwon A,Huh Y H,et al. Tumor-derived miR-130b-3p induces cancer-associated fibroblast activation by targeting SPIN90 in luminal A breast cancer[J]. Oncogenesis,2022,11(1):47.
[6]Shui Y F,Yu X J,Duan R,et al. miR-130b-3p inhibits cell invasion and migration by targeting the Notch ligand Delta-like 1 in breast carcinoma[J]. Gene,2017,609:80-87.
[7]Chan C K,Pan Y H,Nyberg K,et al. Tumour-suppressor microRNAs regulate ovarian cancer cell physical properties and invasive behaviour[J]. Open Biology,2016,6(11):160275.
[8]Wang Y C,Yao X H,Ma M,et al. miR-130b inhibits proliferation and promotes differentiation in myocytes via targeting Sp1[J]. Journal of Molecular Cell Biology,2021,13(6):422-432.
[9]Song D,Zhang Q,Zhang H,et al. miR-130b-3p promotes colorectal cancer progression by targeting CHD9[J]. Cell Cycle,2022,21(6):585-601.
[10]Lu Q,Liu T Y,Feng H J,et al. Circular RNA circSLC8A1 acts as a sponge of miR-130b/miR-494 in suppressing bladder cancer progression via regulating PTEN[J]. Molecular Cancer,2019,18(1):111.
[11]Wang Y C,Li Y Y,Wang X Y,et al. Circulating miR-130b mediates metabolic crosstalk between fat and muscle in overweight/obesity[J]. Diabetologia,2013,56(10):2275-2285.
[12]Wagschal A,Najafi-Shoushtari S H,Wang L F,et al. Genome-wide identification of microRNAs regulating cholesterol and triglyceride homeostasis[J]. Nature Medicine,2015,21(11):1290-1297.
[13]Fu M J,Wang B,Chen X,et al. MicroRNA gga-miR-130b suppresses infectious bursal disease virus replication via targeting of the viral genome and cellular suppressors of cytokine signaling 5[J]. Journal of Virology,2017,92(1):e01646-e01617.
[14]Nawaz A H,Lin S D,Wang F J,et al. Investigating the heat tolerance and production performance in local chicken breed having normal and dwarf size[J]. Animal,2023,17(3):100707.
[15]Guillaume J. The dwarfing gene dw:its effects on anatomy,physiology,nutrition,management.its application in poultry industry[J]. Worlds Poultry Science Journal,1976,32(4):285-305.
[16]Burnside J,Liou S S,Zhong C,et al. Abnormal growth hormone receptor gene expression in the sex-linked dwarf chicken[J]. General and Comparative Endocrinology,1992,88(1):20-28.
[17]Lee E K,Lee M J,Abdelmohsen K,et al. miR-130 suppresses adipogenesis by inhibiting peroxisome proliferator-activated receptor γ expression[J]. Molecular and Cellular Biology,2011,31(4):626-638.
[18]何洪炳,蔡明成,梁小虎,等. miR-130b靶向PPARγ抑制家兔前体脂肪细胞分化[J]. 畜牧兽医学报,2017,48(11):2076-2083.
[19]范彩红,杨" 磊,杨" 澜,等. miR-130b-3p靶定AMPK基因抑制糖饥饿诱导的宫颈癌细胞自噬性死亡[J]. 实用医学杂志,2022,8(1):31-37.
[20]Ma X Y,Wei D W,Cheng G,et al. Bta-miR-130a/b regulates preadipocyte differentiation by targeting PPARG and CYP2U1 in beef cattle[J]. Molecular and Cellular Probes,2018,42:10-17.
[21]Yue Y X,Liu Z M,Zhang K,et al. Functional and miRNA regulatory characteristics of INSIG genes highlight the key role of lipid synthesis in the liver of chicken (Gallus gallus)[J]. Poultry Science,2023,102(2):102380.
[22]Ro S H,Jung C H,Hahn W S,et al. Distinct functions of Ulk1 and Ulk2 in the regulation of lipid metabolism in adipocytes[J]. Autophagy,2013,9(12):2103-2114.
[23]Liu M L,Bai J L,He S J,et al. Grb10 promotes lipolysis and thermogenesis by phosphorylation-dependent feedback inhibition of mTORC1[J]. Cell Metabolism,2014,19(6):967-980.
[24]Liu H L,He Y,Bai J L,et al. Hypothalamic Grb10 enhances leptin signalling and promotes weight loss[J]. Nature Metabolism,2023,5(1):147-164.

