二维超声、超声造影联合超声影像组学鉴别诊断肺鳞癌与肺结核的临床价值








摘" " 要" " 目的" " 探讨二维超声、超声造影联合超声影像组学鉴别诊断肺鳞癌与肺结核的临床价值。方法" " 选取我院经超声引导下穿刺活检病理证实的112例肺鳞癌及肺结核患者,共121个病灶,按照7∶3的比例将其随机分为训练集85个(肺鳞癌50个、肺结核35个)和验证集36个(肺鳞癌21个、肺结核15个),比较训练集中肺鳞癌与肺结核二维超声及超声造影图像特征;同时从二维超声及超声造影图像中提取相应的影像组学特征,经过标准化处理及特征筛选降维,建立超声影像组学标签并计算每个病灶的影像组学评分(RS)。采用多因素Logistic回归分析分别构建超声诊断模型、超声影像组学模型及联合模型。绘制受试者工作特征(ROC)曲线分析各模型在训练集和验证集中鉴别肺鳞癌与肺结核的区分度;绘制校准曲线、临床决策曲线评价联合模型的校准度、临床适用性。结果" " 训练集中肺鳞癌与肺结核病灶增强模式、形态、回声、最大径比较差异均有统计学意义(均Plt;0.05)。多因素Logistic回归分析显示,病灶形态、最大径及增强模式均为鉴别诊断肺鳞癌与肺结核的独立影响因素(OR=3.651、5.039、4.467,均Plt;0.05),基于上述3个独立影响因素构建超声诊断模型。基于最小绝对收缩和选择算子(LASSO)算法共筛选出25个非零系数的超声影像组学特征,训练集中肺结核与肺鳞癌的RS分别为(0.79±0.19)分、(0.23±0.12)分,验证集中肺结核与肺鳞癌的RS分别为(0.57±0.22)分、(0.25±0.22)分,二者比较差异均有统计学意义(均Plt;0.05)。ROC曲线分析显示,超声影像组学模型、联合模型在训练集和验证集的曲线下面积分别为0.994和0.848、0.995和0.908,二者比较差异均无统计学意义;且均高于超声诊断模型的曲线下面积(0.814和0.762),差异均有统计学意义(均Plt;0.05)。校准曲线显示,联合模型在训练集和验证集的校准度均较高;临床决策曲线显示,当联合模型概率阈值为16%~89%时净获益更高。结论" " 二维超声、超声造影联合超声影像组学可以较好地鉴别诊断肺鳞癌与肺结核,具有一定的临床应用价值。
关键词" " 超声检查;造影剂;影像组学;肺结核;肺鳞癌;鉴别诊断
[中图法分类号]R445.1;R734.2" " " [文献标识码]A
Clinical value of two-dimensional ultrasound,contrast-enhanced ultrasound combined with radiomics in the differential diagnosis of lung squamous
cell carcinoma and pulmonary tuberculosis
ZHAO Jie,ZHU Lijing,HAO Lei,CHEN Zezheng,WANG Xinghua
College of Medical Imaging,Shanxi Medical University,Taiyuan 030001,China
ABSTRACT" " Objective" " To explore the clinical value of two-dimensional ultrasound,contrast-enhanced ultrasound combined with radiomics in the differential diagnosis of lung squamous cell carcinoma and pulmonary tuberculosis.Methods" " A total of 112 patients form our hospital,with 121 lesions confirmed by ultrasound-guided biopsy to be either lung squamous cell carcinoma or pulmonary tuberculosis were selected.These were randomly divided into a training set of 85 lesions(50 lung squamous cell carcinoma and 35 pulmonary tuberculosis) and a validation set of 36 lesions(21 lung squamous cell carcinoma and 15 pulmonary tuberculosis) at a 7∶3 ratio.The two-dimensional ultrasound and contrast-enhanced ultrasound image features of lung squamous cell carcinoma and pulmonary tuberculosis lesions in the training set were compared.At the same time,the corresponding radiomics features were extracted from two-dimensional ultrasound and contrast-enhanced ultrasound images,and the dimension was reduced by standardized processing feature screening.The radiomics label was established and the radiomics score(RS) of each lesion was calculated.The ultrasonic diagnostic model,ultrasonic radiomics model and combined model were established by multvariate Logistic regression.Receiver operating characteristic(ROC) curve was drawn to analyze the discrimation of each model in differentiating lung squamous cell carcinoma from pulmonary tuberculosis.Calibration curve and clinical decision curve were drawn to evaluate the calibration and clinical practicability of the combined model.Results" " There were significant differences in enhancement pattern,morphology,echogenicity and maximum diameter" between lung squamous cell carcinoma and pulmonary tuberculosis in the training set(all Plt;0.05).Multivariate Logistic regression analysis showed that lesion morphology,maximum diameter and enhancement pattern were independent influencing factors for differentiating lung squamous cell carcinoma from pulmonary tuberculosis(OR=3.651,5.039,4.467,all Plt;0.05).Based on the above 3 independent influencing factors,an ultrasonic diagnosis model was constructed.Based on LASSO regression,a total of 25 non-zero coefficient ultrasonic radiomics features were screened out.The RS of pulmonary tuberculosis and lung squamous cell carcinoma in the training set were 0.79±0.19 and 0.23±0.12,respectively,and in the validation set were 0.57±0.22 and 0.25±0.22,respectively,there were statistically significant(both Plt;0.05).ROC curve analysis showed that the area under the curve of the radiomics model and the combined model in the training and validation sets were 0.994 and 0.848,0.995 and 0.908,respectively,with no significant differences between the two models,which were higher than those of the ultrasonic diagnosis model(0.814 and 0.762),and the differences were statistically significant(all Plt;0.05).Calibration curves showed high calibration in both sets for the combined model,and clinical decision curve showed that when the probability threshold for the combined model was 16%~89%,the clinical net benefit was higher.Conclusion" " Two-dimensional ultrasound,contrast-enhanced ultrasound combined with radiomics can effectively differentiate lung squamous cell carcinoma from pulmonary tuberculosis,which has a certain clinical application value.
KEY WORDS" " Ultrasonography;Contrast agent;Radiomics;Pulmonary tuberculosis;Lung squamous cell carcinoma;Differential diagnosis
肺鳞癌是肺癌发病率最高的亚型之一[1],其易出现坏死区的病理特性,与肺结核进展过程中干酪样坏死表现相似,单纯依靠影像学检查易误诊[2]。既往研究[3-4]显示,肺鳞癌多由支气管动脉供血,而肺结核由于受慢性病程长期侵蚀,导致肺动脉分支被破坏,支气管动脉代偿供血增加,因此二者超声造影表现相似,鉴别诊断困难。影像组学能够高通量从图像中挖掘肉眼难以识别的特征,而这些特征可能与疾病异质性密切相关。研究[5-6]表明,多模态融合的超声影像组学模型可以更深层次地提取病灶中的信息,与单一模态相比具有更好的诊断效能。因此,本研究基于二维超声、超声造影图像特征,并与超声影像组学联合建立分类预测模型,探讨其在鉴别诊断肺鳞癌与肺结核中的临床价值。
资料与方法
一、研究对象
选取2017年10月至2023年10月我院经超声引导下穿刺活检病理证实的112例肺鳞癌及肺结核患者,男77例,女35例,年龄16~91岁,平均(68.15±15.00)岁;共121个病灶,其中肺鳞癌71例(71个病灶),肺结核41例(50个病灶)。按照7∶3的比例将其随机分为训练集和验证集,训练集80例,男55例,女25例,年龄16~91岁,平均(69.11±15.14)岁,共85个病灶,其中肺鳞癌50个,肺结核35个;验证集32例,男22例,女10例,年龄24~88岁,平均(65.75±14.62)岁,共36个病灶,其中肺鳞癌21个,肺结核15个。训练集和验证集中肺鳞癌与肺结核患者年龄、性别比较差异均无统计学意义。纳入标准:①均经病理证实;②临床及超声资料齐全。排除标准:①病理诊断不明确;②无法配合完成相关检查;③有造影剂禁忌证。本研究经我院医学伦理委员会批准(批准号:[2024]YX第010号),为回顾性研究故免除患者知情同意。
二、仪器与方法
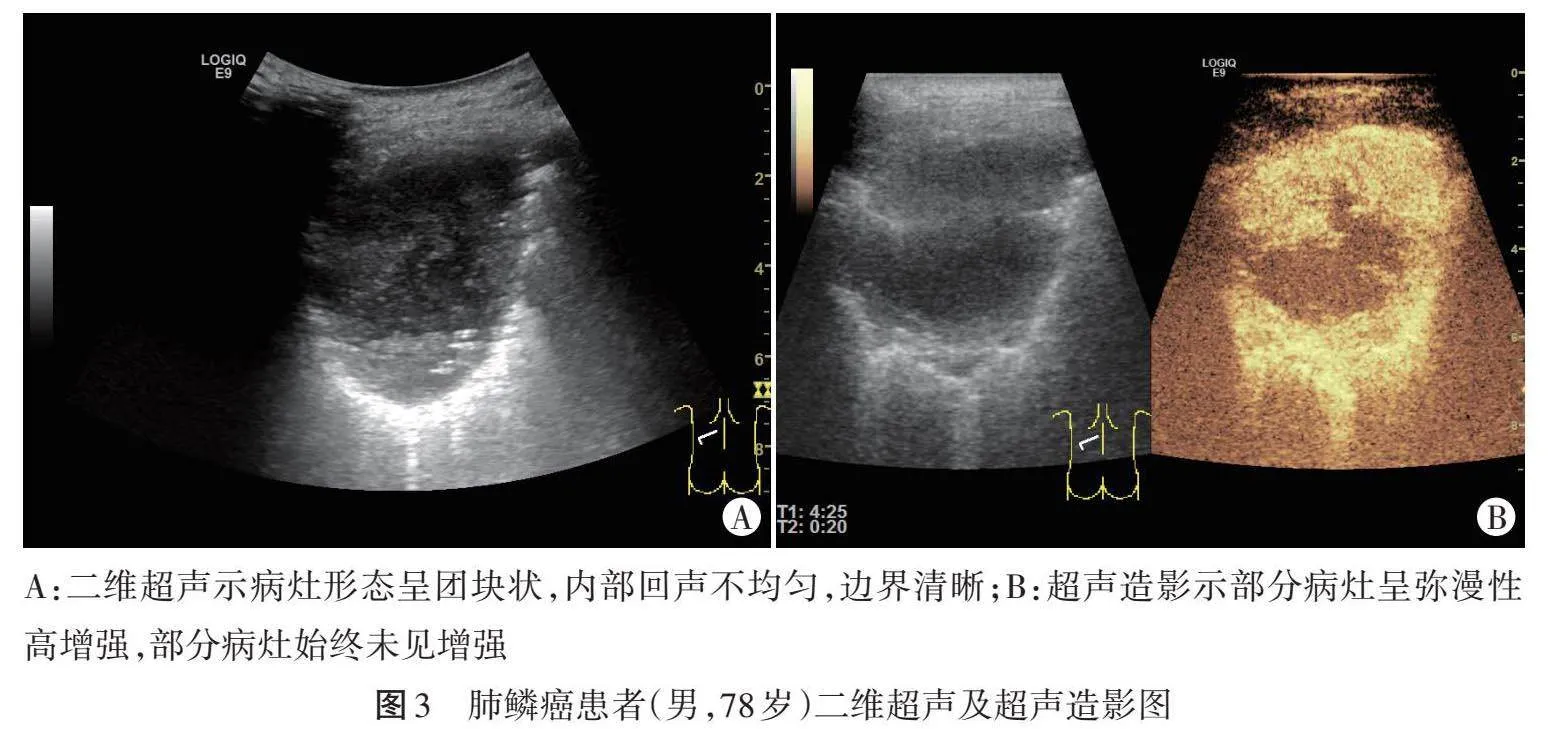
1.多模态超声图像采集:使用GE Logiq E9彩色多普勒超声诊断仪,C1-6凸阵探头、9L线阵探头,频率分别为2.5~6.0 MHz、5~9 MHz;造影剂采用SonoVue(意大利Bracco公司),按说明书配制成混悬液备用。首先行二维超声检查,选择病灶最佳切面,记录病灶内部回声、最大径、形态及边界情况;然后进入超声造影模式,于肘静脉团注配置好的造影剂混悬液2.4 ml,随后迅速推注5.0 ml生理盐水冲管,对病灶进行至少2 min的实时动态监测,记录病灶增强模式(迅速基底树枝样、其他),并计算造影剂到达病灶与邻近正常肺组织时间差(ΔAT)。选取时间-强度曲线中达峰时间范围内增强程度最大的图像作为代表性图像存储。以上操作均由两名具有5年以上工作经验的超声医师完成,如有分歧协商解决。
2.图像分割与特征提取:对选择的二维超声及超声造影图像进行预处理,由另两名具有5年以上肺部超声检查经验的医师使用开源软件ITK-SNAP沿病灶边界手动勾画感兴趣区(ROI)。使用开源软件FAE 0.5.5对原始图像和基于变换和滤波后的图像进行关于形态学、一阶统计学、纹理等影像组学特征提取,包括一阶直方图特征、形态学特征、灰度共生矩阵(GLCM)、灰度大小区域矩阵(GLSZM)、领域灰度差矩阵(NGTDM)、灰度游程矩阵(GLRLM)、灰度依赖矩阵(GLDM)。使用组内及组间相关系数(ICC)评估影像组学特征提取的重复性,ICC均gt;0.75为图像提取可重复性好并纳入后续研究。见图1。
3.预测模型的构建
(1)超声诊断模型:比较训练集中肺鳞癌与肺结核二维超声及超声造影图像特征,将单因素分析中差异有统计学意义的变量纳入多因素Logistic回归分析,筛选鉴别诊断二者的独立影响因素,从而构建超声诊断模型。
(2)超声影像组学模型:为使不同度量之间的特征具有可比性,对提取出的二维超声影像组学特征及超声造影影像组学特征合并后使用Z-score标准化方法对其进行正则化,使之落入一个特定区间。随后利用皮尔逊相关系数(PCC)对各特征间进行相似度比较,若PCCgt;0.990,则移除其中一个特征,以确保每个特征相互独立,提高模型的准确性和泛化能力;采用最小绝对收缩和选择算子(LASSO)算法和10折交叉验证从提取的特征中筛选出非零系数的最优特征集,利用其对应的权重系数计算各病灶的影像组学评分(RS),以此构建超声影像组学模型。
(3)联合模型:将筛选出的超声诊断独立影响因素与RS相结合,基于训练集采用多因素Logistic回归分析构建联合模型,并绘制列线图将分类模型可视化。
三、统计学处理
应用SPSS 25.0、MedCalc 20.1.0统计软件及Python 3.6.13算法、R 4.1.0语言,计量资料若服从正态分布以x±s表示,组间比较采用两独立样本t检验;若不服从正态分布则以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。计数资料以频数或率表示,组间比较采用χ2检验。基于训练集,采用多因素Logistic回归分析分别建立超声诊断模型、超声影像组学模型及联合模型。绘制受试者工作特征(ROC)曲线评估各模型在训练集和验证集中鉴别肺鳞癌与肺结核的区分度;曲线下面积(AUC)比较采用Delong检验。绘制校准曲线评价联合模型在训练集和验证集中的校准度;临床决策曲线评价各模型的临床适用性。Plt;0.05为差异有统计学意义。
结" 果
一、训练集与验证集二维超声及超声造影图像特征比较
训练集与验证集病灶形态、回声、边界、最大径、增强模式、ΔAT比较差异均无统计学意义。见表1。可用于模型的构建与验证。
二、超声诊断模型构建
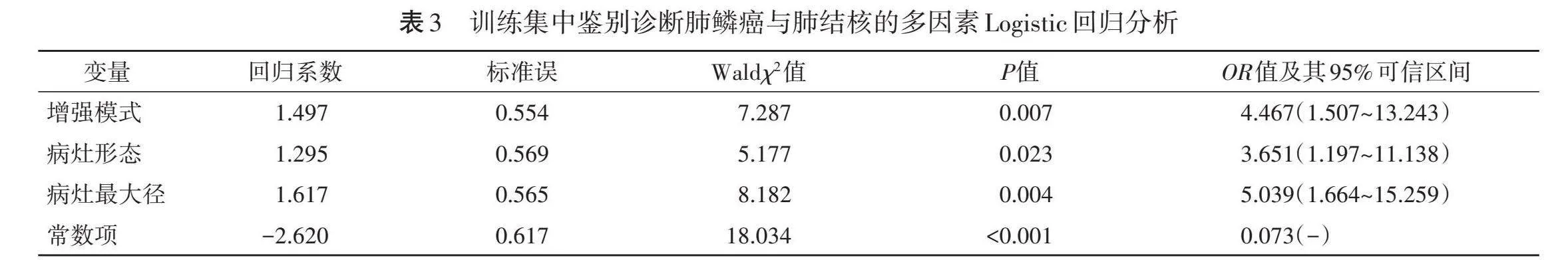
训练集中肺鳞癌与肺结核病灶形态、回声、最大径、增强模式比较差异均有统计学意义(均Plt;0.05)。见表2。将其纳入多因素Logistic回归,结果显示病灶形态、最大径、增强模式均为鉴别诊断肺鳞癌及肺结核的独立影响因素(OR=3.651、5.039、4.467,均Plt;0.05)。见表3和图2,3。构建超声诊断模型:Logit(P)=−2.620+1.497×增强模式+1.295×形态+1.617×最大径。
三、超声影像组学模型构建
利用肺鳞癌及肺结核病灶二维超声及超声造影图像,共提取出2818个特征(包括28个形态学特征,540个一阶统计学特征和2250个纹理特征),经过Z-score标准化和PCC降维后,使用LASSO算法共筛选出25个非零系数的特征。见图4。训练集中肺结核与肺鳞癌的RS分别为(0.79±0.19)分、(0.23±0.12)分,验证集中肺结核与肺鳞癌的RS分别为(0.57±0.22)分、(0.25±0.22)分,二者比较差异均有统计学意义(均Plt;0.05)。
四、联合模型构建
将病理结果作为因变量,病灶形态、最大径、增强模式和RS作为自变量,基于训练集采用Logistic回归分析构建联合模型:Logit(P)=−16.005+4.001×增强模式−2.452×形状−1.187×最大径+32.425×RS,绘制的列线图见图5。
五、各模型鉴别肺鳞癌与肺结核的诊断效能比较及验证
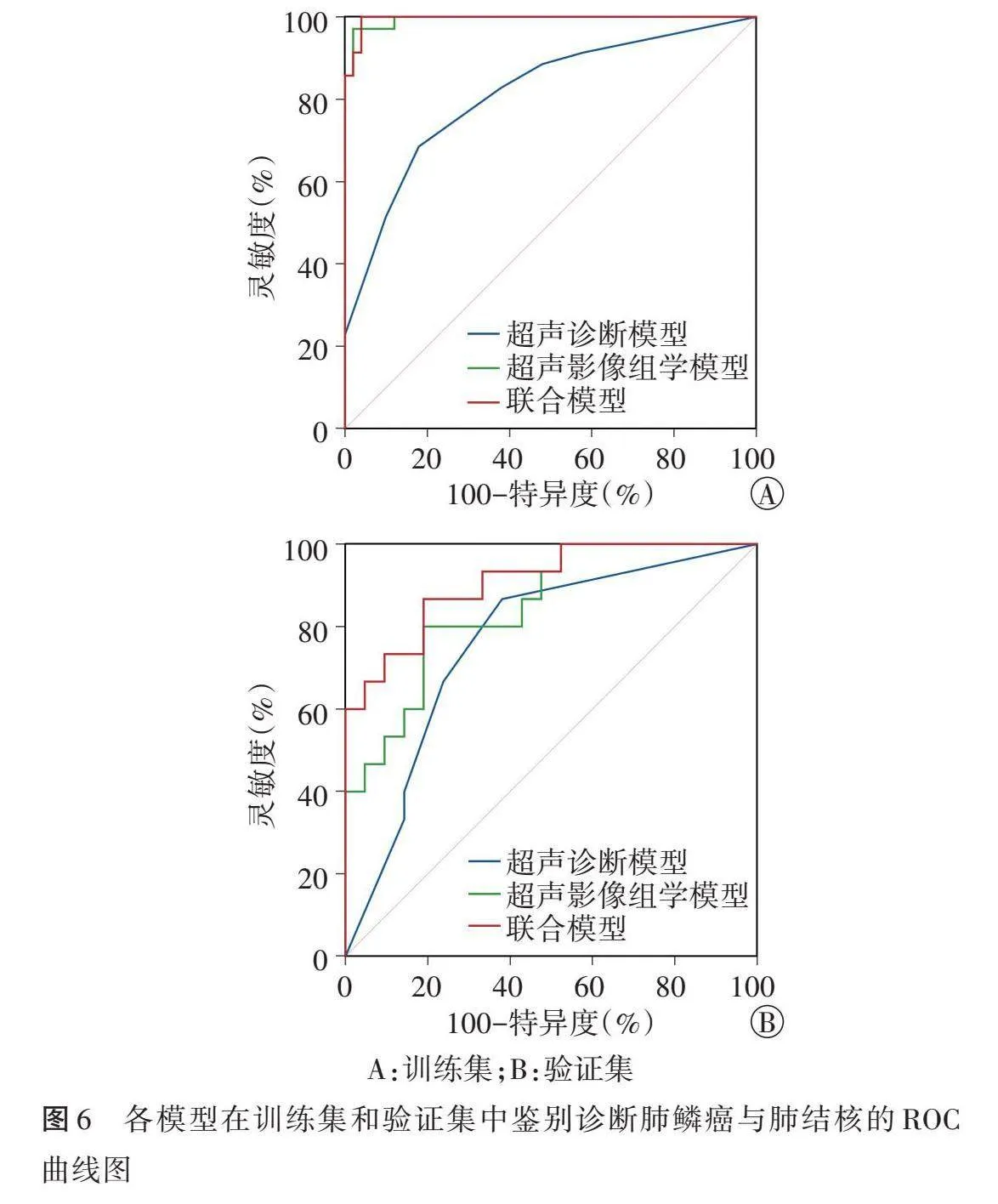
1.区分度:训练集中超声诊断模型、超声影像组学模型、联合模型鉴别诊断肺鳞癌与肺结核的AUC分别为0.814、0.994、0.995,其中联合模型和超声影像组学模型的AUC均高于超声诊断模型,差异均有统计学意义(均Plt;0.001),而联合模型与超声影像组学模型比较差异无统计学意义;验证集中上述模型鉴别诊断肺鳞癌与肺结核的AUC分别为0.762、0.848、0.908,以联合模型的诊断效能最佳,与超声诊断模型比较差异有统计学意义(P=0.036),其余各模型AUC两两比较差异均无统计学意义。见表4和图6。
AUC:曲线下面积
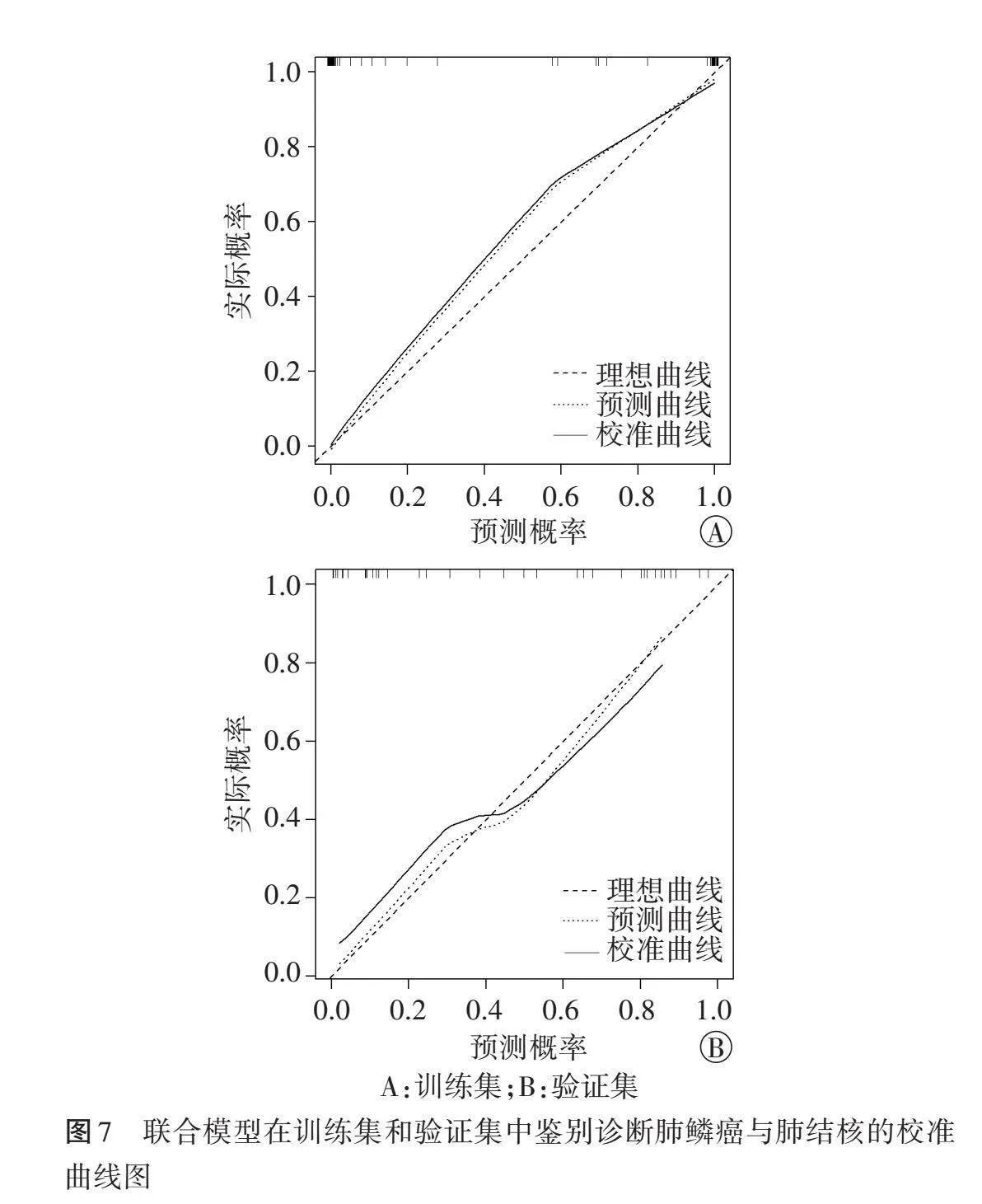
2.校准度:校准曲线显示,联合模型在训练集和验证集中的预测曲线均与标准曲线贴合,在鉴别诊断肺鳞癌与肺结核的校准度较高。见图7。
3.临床适用性:临床决策曲线显示,当联合模型概率阈值为16%~89%时净获益均高于超声诊断模型、超声影像组学模型,具有更高的临床价值。见图8。
讨" 论
目前,肺结核及肺癌的发病率均较高,肺癌以手术、化疗等抗肿瘤治疗为主,其预后与疾病进展阶段密切相关;而肺结核经过规范抗结核药物治疗后预后多较好,故早期准确诊断并尽可能避免不必要的侵入性检查对二者治疗方案的制订及预后至关重要。肺鳞癌作为肺癌最好发的亚型之一,其易坏死的病理特性与肺结核干酪样坏死相似。本研究回顾性分析71个肺鳞癌、50个肺结核二维超声及超声造影图像特征,并通过提取每个病灶的影像组学特征,构建RS联合超声图像特征的分类预测模型,探讨其在鉴别诊断肺鳞癌与肺结核中的临床价值。
超声造影能实时、动态显示病灶内部微血管灌注情况,在鉴别诊断肺局灶性病灶方面具有一定价值,但存在争议,Bai等[7]研究显示,肺部良性病灶超声造影始增时间早于恶性,差异有统计学意义(Plt;0.05),当ΔAT的截断值为2.5 s时鉴别诊断肺部良恶性病灶的准确率可达97.1%;刘丹等[4]研究显示,肺部慢性炎症与恶性肿瘤均于支气管动脉期开始增强,本研究中肺鳞癌与肺结核ΔAT比较差异无统计学意义。分析原因为肺结核病理变化复杂,经过慢性炎症长期侵蚀后,肺动脉分支被破坏、支气管动脉代偿供血增加导致其呈现类似恶性肿瘤的影像学特征[8-10]。本研究通过单因素及多因素Logistic回归分析肺鳞癌与肺结核二维超声及超声造影图像特征,结果显示病灶形态、最大径、增强模式均为鉴别诊断肺鳞癌与肺结核的独立影响因素(OR=3.651、5.039、4.467,均Plt;0.05),分析原因为肺鳞癌其内有大量不成熟的新生肿瘤血管形成,走行较为迂曲且分布不均匀[11],故超声造影增强模式多样;而迅速基底树枝样增强符合肺动脉及其分支的自然走行,肺结核病灶内无肿瘤细胞侵犯,因此较肺鳞癌更易表现为此种增强模式。本研究基于上述独立影响因素建立超声诊断模型,ROC曲线分析显示该模型鉴别诊断训练集和验证集中肺鳞癌与肺结核的AUC分别为0.814、0.762,表明其对鉴别诊断肺鳞癌与肺结核具有一定的临床价值。
影像组学辅助诊断作为近年的研究热点,通过先进的计算机技术,为图像分析与诊断提供了新的观念和方法。目前超声影像组学在疾病诊断[12]、预测预后[13]、评估疗效[14]等方面已有相关进展;在肺结核和肺癌的鉴别诊断方面,现有研究多基于CT图像,如Tan等[15]利用卷积神经网络架构肺癌与肺结核分类模型,并结合迁移学习,最终达到90.4%的准确率;随着研究不断深入,部分学者利用多模态影像技术建立模型取得了较单一模态更好的诊断效果,Hu等[16]基于18F-FDG PET/CT鉴别诊断肺腺癌与肺结核,分别建立临床模型、放射组学模型和联合模型,其中联合模型在训练集和验证集中的AUC均最高,分别为0.884、0.909;然而,目前对于极易误诊为肺结核的肺鳞癌的研究尚无相关报道。因此,本研究基于二维超声和超声造影图像,将影像组学应用于肺鳞癌与肺结核的鉴别诊断中,从图像ROI中共提取了2818个特征,利用LASSO 回归分析从中共筛选出25个(包括18个二维超声特征和7个超声造影特征),其中2个形态学特征和4个一阶统计学特征,其余均为纹理特征;纹理特征揭示了图像中相似现象的视觉属性,通过展示图像内的像素及其周边空间的灰度分布,在评估病变区域内部的差异性方面有较大的潜力,与既往研究[17-18]结论一致。为了探讨RS在鉴别诊断肺鳞癌与肺结核方面的潜力,其计算公式由筛选出的25个超声影像组学特征与相应加权系数相乘后的总和构成。本研究结果显示,训练集和验证集中肺结核的RS均高于肺鳞癌,差异均有统计学意义(均Plt;0.05),表明筛选后的最优特征集可以较好地反映疾病异质性,在鉴别诊断肺鳞癌与肺结核中具有一定价值,基于此构建的超声影像组学模型在训练集和验证集中鉴别诊断肺鳞癌与肺结核的AUC分别为0.994、0.848,训练集中的AUC高于超声诊断模型(0.994 vs. 0.814),差异有统计学意义(Plt;0.001),而验证集中两者比较差异无统计学意义(0.848 vs. 0.762),分析原因可能为样本量较小。为了进一步验证超声影像组学为鉴别诊断肺结核与肺鳞癌提供的增量价值,本研究构建了由二维超声及超声造影图像特征筛选的独立影响因素与RS的联合模型,结果显示联合模型的诊断效能最佳,在训练集和验证集中鉴别诊断肺鳞癌与肺结核的AUC分别为0.995和0.908,与超声诊断模型比较差异均有统计学意义(均Plt;0.05)。且校准曲线显示,联合模型在训练集和验证集中的预测曲线与标准曲线贴合,表明超声诊断与超声影像组学联合鉴别诊断肺结核与肺鳞癌的校准度较高,分析原因可能为肺结核病理进展复杂,由于长期炎症侵蚀导致其二维超声、超声造影表现与肺鳞癌相似,容易导致误诊,而影像组学可以高通量提取肉眼无法识别的特征,从而弥补传统超声诊断方面的不足。此外,本研究构建的联合模型与超声影像组学模型的AUC相近,但临床决策曲线显示联合模型在概率阈值为16%~89%时净获益高于超声影像组学模型,具有更好的临床应用价值。
本研究的局限性:①样本量较小,且为单中心研究,缺乏外部验证;②仅纳入超声可清晰显示的病灶,对大多数中心型病灶无法研究;③为回顾性研究,存在选择性偏倚;④超声造影图像的选择具有一定的主观性,且仅选取单帧增强程度最佳图像纳入研究,未对超声造影的动态过程进行研究。
综上所述,二维超声、超声造影联合超声影像组学可较好地鉴别诊断肺鳞癌与肺结核,具有一定的临床应用价值,可为今后临床制订个体化治疗方案提供新的思路与方法。
参考文献
[1] Ho LJ,Yang HY,Chung CH,et al.Increased risk of secondary lung cancer in patients with tuberculosis:a nationwide,population-based cohort study[J].PloS One,2021,16(5):e0250531-e0250544.
[2] Görg C,Bert T,Kring R,et al.Transcutaneous contrast enhanced sonography of the chest for evaluation of pleural based pulmonary lesions:experience in 137 patients[J].Ultraschall Med,2006,27(5):437-444.
[3] Safai Zadeh E,Görg C,Prosch H,et al.WFUMB technological review:how to perform contrast-enhanced ultrasound of the lung[J].Ultrasound Med Biol,2022,48(4):598-616.
[4] 刘丹,周爱云,张诚,等.超声造影实时判断周围型肺病变初始强化时间点的价值[J].中国医学影像学杂志,2017,25(4):274-277.
[5] Xu Z,Wang Y,Chen M,et al.Multi-region radiomics for artificially intelligent diagnosis of breast cancer using multimodal ultrasound[J].Comput Biol Med,2022,149:105920-105927.
[6] Liang L,Zhi X,Sun Y,et al.A nomogram based on a multiparametric ultrasound radiomics model for discrimination between malignant and benign prostate lesions[J].Front Oncol,2021,11:610785-610797.
[7] Bai J,Yang W,Wang S,et al.Role of arrival time difference between lesions and lung tissue on contrast-enhanced sonography in the differential diagnosis of subpleural pulmonary lesions[J].J Ultrasound Med,2016,35(7):1523-1532.
[8] Eldridge L,Moldobaeva A,Zhong Q,et al.Bronchial artery angiogenesis drives lung tumor growth[J].Cancer Res,2016,76(20):5962-5969.
[9] Eldridge L,Wagner EM.Angiogenesis in the lung[J].J Physiol,2019,597(4):1023-1032.
[10] Safai Zadeh E,Keber CU,Dietrich CF,et al.Perfusion patterns of peripheral pulmonary granulomatous lesions using contrast‐enhanced ultrasound(CEUS) and their correlation with immunohistochemically detected vascularization patterns[J].J Ultrasound Med,2022,41(3):565-574.
[11] 郭西源,郝磊,朱丽静,等.超声造影鉴别诊断周围型肺局灶性病变的临床价值[J].临床超声医学杂志,2020,22(11):866-868.
[12] 张旭,黄品同.基于灰阶超声影像组学的颈部淋巴瘤预测模型研究[J].中华超声影像学杂志,2021,30(6):506-512.
[13] Zhang D,Wei Q,Wu GG,et al.Preoperative prediction of microvascular invasion in patients with hepatocellular carcinoma based on radiomics nomogram using contrast-enhanced ultrasound[J].Front Oncol,2021,11:709339-709351.
[14] Jiang M,Li CL,Luo XM,et al.Ultrasound-based deep learning radiomics in the assessment of pathological complete response to neoadjuvant chemotherapy in locally advanced breast cancer[J].Eur J Cancer,2021,147:95-105.
[15] Tan H,Bates JHT,Matthew Kinsey C.Discriminating TB lung nodules from early lung cancers using deep learning[J].BMC Med Inform Decis Mak,2022,22(1):161-167.
[16] Hu Y,Zhao X,Zhang J,et al.Value of 18F-FDG PET/CT radiomic features to distinguish solitary lung adenocarcinoma from tuberculosis[J].Eur J Nucl Med Mol Imaging,2021,48(1):231-240.
[17] Chen M,Copley SJ,Viola P,et al.Radiomics and artificial intelligence for precision medicine in lung cancer treatment[J].Semin Cancer Biol,2023,93:97-113.
[18] 林莹,冯湛,蒋国平.灰阶超声影像组学鉴别肝细胞肝癌与肿块型肝内胆管细胞癌的价值[J].中国医学影像学杂志,2020,28(4):269-272.
(收稿日期:2024-05-13)

