基于网络Meta分析对比不同钠-葡萄糖协同转运蛋白2抑制剂对慢性心力衰竭患者预后的影响





摘要:目的 运用贝叶斯网状Meta分析对比不同钠-葡萄糖协同转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor, SGLT2i)对慢性心力衰竭患者预后的影响。方法 利用计算机全面检索CNKI、CBM、Wanfang、VIP、Pubmed、Web of Science、Embase、Cochrane Library。检索时间从建库至2022年12月1日。收集SGLT2i治疗心力衰竭的临床随机对照试验。由3名研究者独立进行筛选、提取数据。依据Cochrane系统评价手册进行偏倚风险评价。以RevMan 5.4软件进行异质性检验及直接Meta分析,ADDIS 1.16.6软件进行网状Meta分析。结果 共纳入9项随机对照研究,包含3种不同的SGLT2i,共涉及23 285例患者。与安慰剂相比,3种SGLT2i均能降低心血管死亡/心力衰竭住院复合终点的发生率,从优到劣排序为索格列净>达格列净>恩格列净>安慰剂。与安慰剂相比,3种SGLT2i中仅达格列净能降低心血管死亡或全因死亡发生率。3种SGLT2i与安慰剂在降低低血糖事件发生率方面差异无统计学意义。结论 SGLT2i能降低慢性心力衰竭患者心血管死亡/心力衰竭住院复合终点发生率,且不增加低血糖事件发生率,而在降低心血管死亡和全因死亡方面,达格列净可能优于恩格列净和索格列净。
关键词:心力衰竭;钠-葡萄糖协同转运蛋白2抑制剂;网状Meta分析DOI:10.3969/j.issn.1674490X.2024.05.001
中图分类号:R54"""" 文献标志码:A"""" 文章编号:1674490X(2024)05000110
Effects of different sodium-glucose cotransporter 2 inhibitors on the prognosis of patients with chronic heart failure: a network Meta-analysis
Abstract: Objective" To compare the effects of different sodium-glucose cotransporter 2 inhibitors(SGLT2i) on the prognosis of patients with chronic heart failure by Bayesian network Meta-analysis. Methods" CNKI, CBM, Wanfang, VIP, Pubmed, Web of Science, Embase, and Cochrane Library were comprehensively searched with computer. The retrieval time was from the establishment of the database to December 1, 2022. Clinical randomized controlled trials of SGLT2i in the treatment of heart failure were collected. Three researchers independently screened and extracted the data. Inexpensive risk assessments were determined according to the Cochrane Handbook of Systematic Reviews. Heterogeneity test and direct Meta-analysis were performed with RevMan5.4 software, and Bayesian network Meta-analysis was performed with ADDIS1.16.6 software. Results" A total of 9 RCTs were included, including 3 different SGLT2i types, involving a total of 23 285 patients. Compared with placebo, the three SGLT2i could significantly reduce the incidence of the composite endpoint of cardiovascular death/heart failure hospitalization, order from superior to inferior was: soxagliflozin>dapagliflozin>empagliflozin>placebo. Compared with placebo, dagliazine alone could reduce the incidence of cardiovascular or all-cause death. There was no statistically significant in reducing incidence of hypoglycemic events between the three SGLT2i and placebo. Conclusion" SGLT2i can reduce the incidence of the composite endpoint of cardiovascular death/heart failure hospitalization in patients with chronic heart failure, without increasing the risk of hypoglycemia events, and dapagliflozin may be superior to soxagliflozin and empagliflozin in terms of cardiovascular death and all-cause mortality.
Key words: heart failure; sodium-glucose cotransporter 2 inhibitor; network Meta-analysis
心力衰竭是由于任何心脏结构或功能异常导致心室充盈或射血能力受损的一组复杂临床综合征[1]。虽然,2016年欧洲心力衰竭指南及2017年美国心力衰竭指南相继推荐“金三角”药物用于心力衰竭的防治[2-3],改善心力衰竭的预后,但是相关研究表明,发达国家成年人心力衰竭患病率仍有1%~2%,5年病死率高达50%[4],而中国心力衰竭患者住院病死率亦高达4.1%[5]。为此,积极研制能降低心力衰竭发病率、住院率和病死率的药物迫在眉睫。钠-葡萄糖协同转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitors,SGLT2i)是近年来慢性心力衰竭药物研制中具有划时代的创新,对无论是否有糖尿病的心力衰竭患者,均能改善心功能并降低心血管死亡/心力衰竭住院的风险,且不增加严重低血糖的发生率,被最新欧洲指南[6]推荐用于慢性心力衰竭的治疗。但欧洲指南推荐的SGLT2i仅有恩格列净、达格列净和索格列净,且目前尚无3种药物头对头的临床研究,关于3种药物临床应用的相对有效性及安全性的孰优孰劣尚无定论。本研究采用贝叶斯网状Meta分析比较不同SGLT2i治疗慢性心力衰竭的有效性和安全性,为临床治疗选择SGLT2i提供依据,并为药物治疗慢性心力衰竭提供循证医学证据。
1 资料与方法
1.1 检索策略
中文文献检索CNKI、CBM、Wanfang、VIP。英文文献检索Pubmed、Web of Science、Embase、Cochrane Library。检索策略采取主题词及其款目词相结合的方式,并根据具体数据库进行调整。检索时间从建库至2022年12月1日。中文检索词:钠-葡萄糖协同转运蛋白2抑制剂、达格列净、恩格列净、索格列净、安慰剂、随机、临床试验、慢性心力衰竭及其款目词(充血性心力衰竭、舒张性心力衰竭、收缩性心力衰竭)。英文检索词:sodium-glucose cotransporter2 inhibitors (SGLT2i)、dapagliflozin、empagliflozin、sotagliflozin、Placebo、clinical trails、random、chronic heart failure(Mesh),以及heart failure的款目词(congestive heqrt failure、diastolic heart failure、systolic heart failure)。
1.2 纳入标准
(1)纳入研究均为随机对照试验。(2)研究对象为明确诊断为慢性心力衰竭的患者。(3)对照组和试验组均采用慢性心力衰竭常规治疗,试验组在常规治疗的基础上加用SGLT2i,对照组在常规治疗的基础上加用安慰剂,或试验组和对照组在常规治疗的基础上采用本研究两种不同的SGLT2i。(4)试验的终点分别为有效性(心血管死亡/心力衰竭住院复合终点、全因死亡、心血管死亡)和安全性(低血糖事件)。
1.3 排除标准
(1)研究对象为非心力衰竭患者。(2)研究结果不包含本文所规定的主要终点。(3)施加除本文所研究的其他SGLT2i药物(如利格列净)。(4)数据错误或不完整或不能获取完整数据;(5)综述、病例、会议论文、学位论文、经验总结、Meta分析或重复发表的文献。(6)非中英文文献,Cochrane系统评价手册评分为高风险的文献。
1.4 文献筛选及资料提取
由3名研究人员进行文献筛选和资料提取,然后进行交叉核对,最终由第一作者汇总并核查所有数据。依据制定的检索方案,检索中英文数据库,阅读文献题目与摘要,初步剔除无关文献。下载全文并阅读,进一步排除无关文献并选取符合纳入标准的优质文献。主要提取内容:作者姓名、文献发表年份、入组人数及男女人数、入组患者年龄、试验随机方式、干预措施、疗程、结局指标。
1.5 纳入文献的质量评价
文献质量评价根据Cochrane系统评价手册推荐的研究质量和偏倚风险评估工具进行。包括:随机序列的产生、分配隐藏、盲法、结局数据不完整、选择性发表和其他偏倚。
1.6 统计分析
以RevMan 5.4软件进行异质性检验及直接Meta分析,若各研究间异质性差异无统计学意义(P>0.1且I2≤50%),则采用固定效应模型分析,若各研究间异质性差异有统计学意义(P<0.1 或 I2>50%),判断异质性的来源后,在排除临床异质性后采用随机效应模型。以ADDIS 1.16.6软件进行网状Meta分析,收敛性以潜在的标尺缩减参数PSRF表示,若PSRF接近1表明收敛性良好,采用一致性模型分析,并通过概率排序表给治疗措施排序,否则采用不一致性模型分析。结局指标中,计数资料以相对危险度RR及其95%CI为效应统计量,若可信区间跨越1则差异无统计学意义(P>0.05)。计量资料采取加权均数差或标准化均数差及其95%CI为效应统计量,如果可信区间跨越0则差异无统计学意义(P>0.05)。
2 结果
2.1 文献检索结果
初步检索到文献5 659篇,其中中文文献3 126篇,英文文献2 533篇,基于纳排标准经过重重筛选最终获得9篇文献,均为双臂。具体文献筛选过程见图1。
2.2 文献基本特征
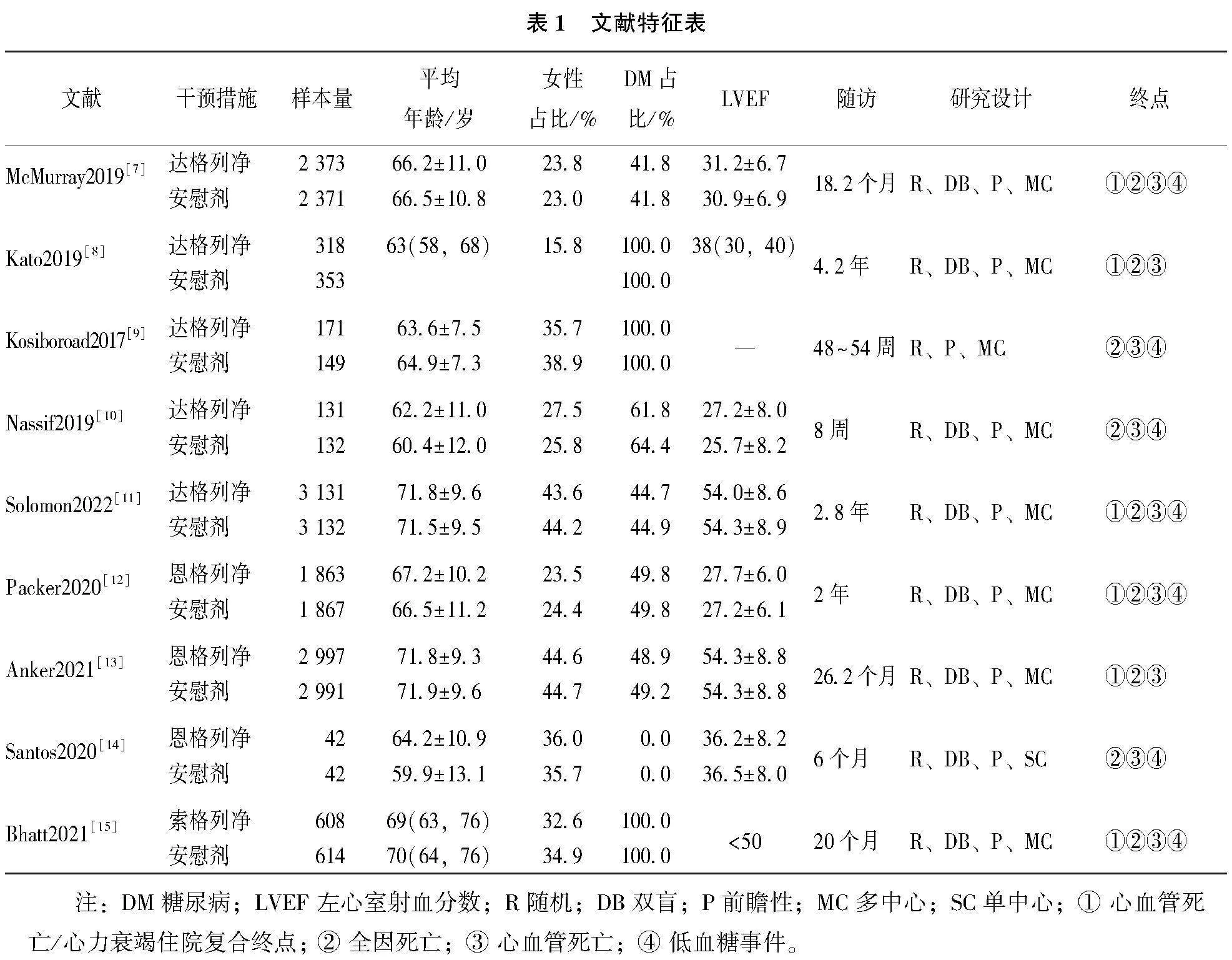
共纳入9篇随机对照试验文献,所有文献均为英文文献,其中达格列净5篇[7-11],恩格列净3篇[12-14],索格列净1篇[15]。涉及患者23 285例,随访时间8周~4.2年。
2.3 文献质量评价
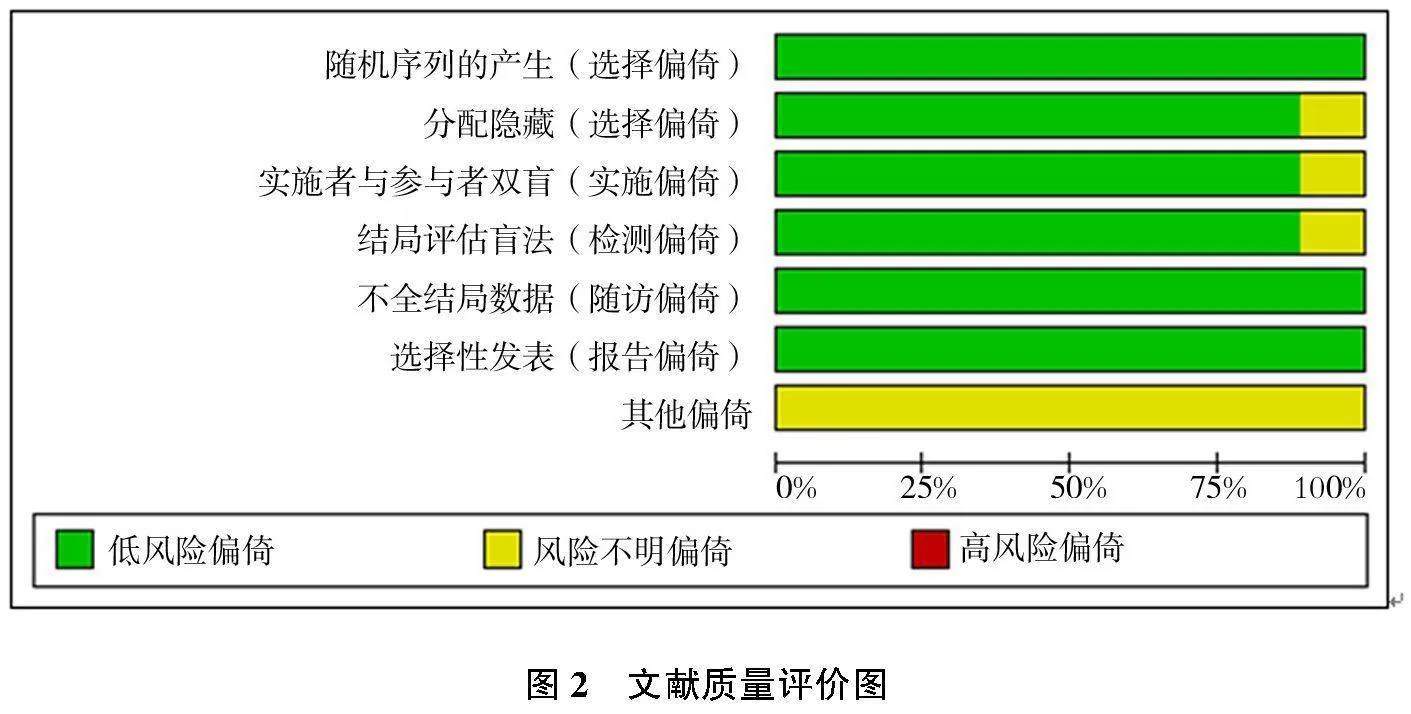
根据Cochrane系统评价手册推荐的研究质量和偏倚风险评估工具进行文献质量评价。9篇文献提及随机法,8篇文献提及双盲法,8篇文献使用分配隐藏,所有文献结果数据完整,无选择性发表,暂时不确定其他偏倚风险。经文献质量评价,所有文献质量高,见图2。
2.4 直接Meta分析
2.4.1 心血管死亡/心力衰竭住院复合终点直接Meta分析
经异质性检验显示结果基本同质(I2<50%且P>0.1),采用固定效应模型分析。直接Meta分析结果提示,达格列净(RR=0.80,95%CI=0.74~0.86,P<0.0001)、恩格列净(RR=0.80,95%CI=0.73~0.87,P<0.0001)和索格列净(RR=0.70,95%CI=0.62~0.78,P<0.0001)对比安慰剂能减少心力衰竭患者的心血管死亡/心力衰竭住院的发生率。见表2。
2.4.2 全因死亡直接Meta分析
经异质性检验显示结果基本同质(I2<50%且P>0.1),采用固定效应模型分析。直接Meta分析结果提示,达格列净相比安慰剂能降低心力衰竭患者的全因死亡率,差异有统计学意义(RR=0.88,95%CI=0.81~0.96,P<0.01)。但安慰剂对比恩格列净(RR=0.97,95%CI=0.88~1.07,P=0.50)和索格列净(RR=0.86,95%CI=0.63~1.18,P=0.36)在减少心力衰竭患者的全因死亡发生率上差异无统计学意义。见表3。
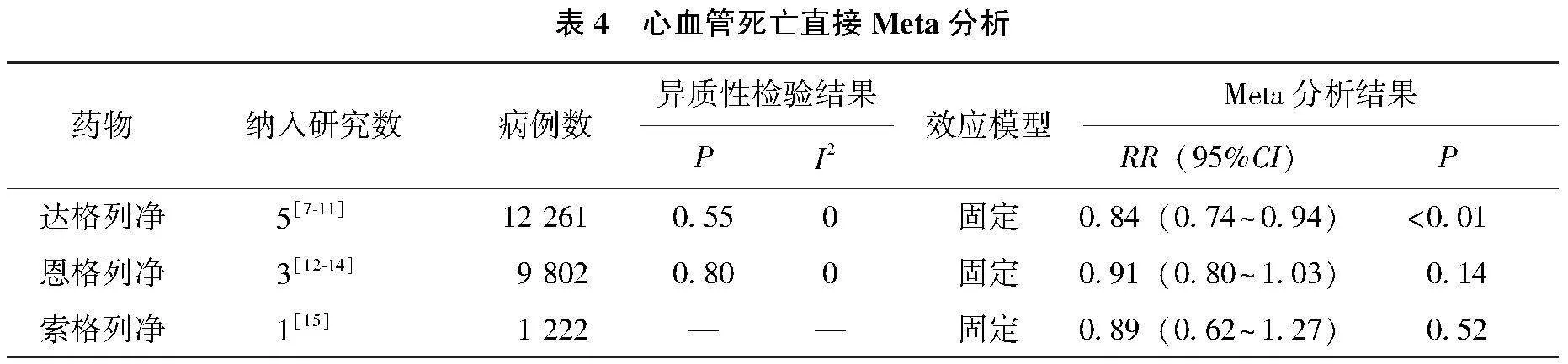
2.4.3 心血管死亡直接Meta分析
经异质性检验显示结果基本同质(I2<50%且P>0.1),采用固定效应模型分析。直接Meta分析结果提示,达格列净相比安慰剂能降低心力衰竭患者的心血管死亡率,差异有统计学意义(RR=0.84,95%CI=0.74~0.94,P<0.01)。但安慰剂对比恩格列净(RR=0.91,95%CI=0.80~1.03,P=0.14)和索格列净(RR=0.89,95%CI=0.62~1.27,P=0.52)在减少心力衰竭患者的心血管死亡发生率上差异无统计学意义。见表4。
2.4.4 低血糖事件直接Meta分析
经异质性检验显示结果基本同质(I2<50%且P>0.1),采用固定效应模型分析。直接Meta分析结果提示达格列净(RR=1.09,95%CI=0.72~1.65,P=0.70)、恩格列净(RR=0.96,95%CI=0.57~1.64,P=0.89)和索格列净(RR=4.60,95%CI=0.99~21.37,P=0.05)对比安慰剂在减少心力衰竭患者的低血糖事件发生率上差异无统计学意义。见表5。
2.5 网状Meta分析
2.5.1 心血管死亡/心力衰竭住院复合终点网状Meta分析
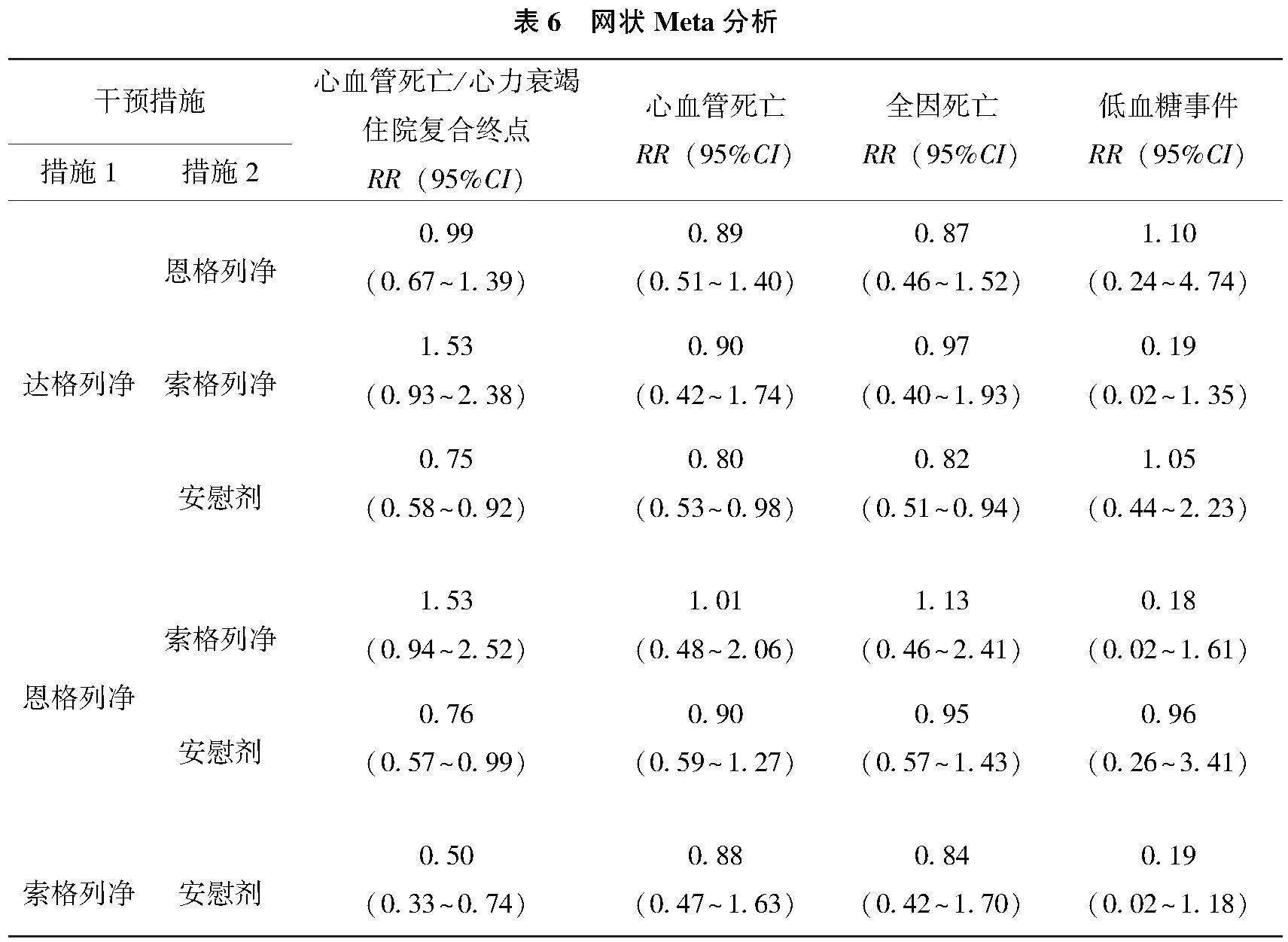
PSRF接近1,说明收敛性良好,采用一致性模型进行网状Meta分析。结果显示,与安慰剂对比,达格列净、索格列净和恩格列净降低心血管死亡/心力衰竭住院复合终点发生率(P<0.05),但药物之间两两比较差异无统计学意义(P>0.05),见表6。概率排序结果显示,索格列净为最优方案,具体排序为索格列净>达格列净>恩格列净>安慰剂,见表7。
2.5.2 全因死亡网状Meta分析
PSRF接近1,说明收敛性良好,采用一致性模型进行网状Meta分析。结果显示,与安慰剂对比,达格列净降低全因死亡发生率(P<0.05),索格列净和恩格列净在降低全因死亡发生率上差异无统计学意义(P>0.05),且药物间两两比较差异无统计学意义(P>0.05),见表6。各药物终点事件概率排序结果显示达格列净为最优方案,具体排序为达格列净>索格列净>恩格列净>安慰剂,见表7。
2.5.3 心血管死亡网状Meta分析
PSRF接近1,说明收敛性良好,采用一致性模型进行网状Meta分析。结果显示,与安慰剂对比,达格列净降低心血管死亡发生率(P<0.05),索格列净和恩格列净在降低心血管死亡发生率上差异无统计学意义(P>0.05),且药物间两两比较差异无统计学意义(P>0.05),见表6。概率排序结果显示达格列净为最优方案,具体排序为达格列净>恩格列净>索格列净>安慰剂,见表7。
2.5.4 低血糖事件网状Meta分析
PSRF接近1,说明收敛性良好,采用一致性模型进行网状Meta分析。结果显示,达格列净、索格列净和恩格列净在低血糖事件发生率上差异无统计学意义(P>0.05),药物间两两比较差异无统计学意义(P>0.05),见表6。各药物终点事件概率排序结果显示达格列净为最优方案,具体排序为达格列净>恩格列净>索格列净>安慰剂,见表7。
3 讨论
SGLT2i本是一种新型口服降糖药,但研究者们发现该药能让2型糖尿病患者心血管结局获益。几项大型临床研究[16-19]结果直接证实这种设想,SGLT2i不仅能降低血糖,且具有多重心血管保护作用,能降低心血管疾病终点事件,对减少心血管疾病具有潜在效益。SGLT2i的药理机制尚无定论。人们普遍认为,SGLT2i在抑制肾小管对葡萄糖的重吸收过程中,也抑制对Na+重吸收,从而达到减轻体液潴留,降低心脏负荷。此外,心肌能量代谢的紊乱可导致心力衰竭发生,这与心肌细胞线粒体氧化代谢功能紊乱、脂肪酸利用率下降、ATP生成持续减少有关[20-21]。酮体则是取代脂肪酸为心肌细胞供应能量的主要能量来源。SGLT2i可直接拮抗这一病理过程,其通过升高血清促红细胞生成素含量,增加肝脏对酮体的合成,提高心肌细胞对酮体的利用率,减少肾脏对酮体的降解,从而改变心力衰竭患者心肌细胞能量代谢方式[22-24]。心室重塑是心力衰竭主要的病理生理机制,这与心肌成纤维细胞转变成活化的成肌纤维细胞并分泌外膜蛋白而重构细胞外基质网络有关[25]。SGLT2i通过抑制成纤维细胞的活化并限制该细胞介导细胞外基质重塑[26],发挥类似于“肾素-血管紧张素-醛固酮系统”制剂逆转心室重构的拮抗作用[27]。
本研究基于欧洲指南所推荐的达格列净、恩格列净和索格列净,借用网状Meta分析模型探讨这3种SGLT2i治疗慢性心力衰竭有效性及安全性的网状Meta分析。传统Meta研究结果显示,恩格列净、达格列净和索格列净均能降低心力衰竭患者心血管死亡/心力衰竭住院复合终点,但经网状Meta分析,笔者发现药物两两比较却没有获得阳性结果,排除研究误差之后,笔者认为以下两方面可能是造成阴性结果的原因。一是不同SGLT2i治疗心力衰竭时在有效性方面本身就没有明显的优劣之分,二是本研究所纳入的文献相对较少,可能影响研究的稳定性,但所纳入的9项研究的患者高达23 285例,其样本量足够大,所以第二种原因的可能性偏低。本研究中的复合终点是心血管死亡和心力衰竭住院的总和,与复合终点一致的是恩格列净、达格列净和索格列净在降低心血管死亡方面,药物两两差异无统计学意义(P>0.05)。但传统Meta分析显示,达格列净能降低心力衰竭患者的心血管死亡率(RR=0.84,95%CI=0.74~0.94,P<0.01),而恩格列净、索格列净均不能降低心力衰竭患者心血管死亡的发生风险。《2021 ESC急性和慢性心力衰竭诊断和治疗指南》明确指出,SGLT2i(达格列净和恩格列净)联合“金三角”可降低心力衰竭患者的心血管死亡风险,无论患者是否合并糖尿病均推荐使用SGLT2i。欧洲指南作出以上推荐可能是基于DAPA-HF、EMPEROR-Reduced的试验结果和Zannad等[28]Meta分析结果。DAPA-HF的试验结果表明,达格列净组共227例患者出现心血管死亡事件(227/2 373,9.6%),安慰剂组共273例患者出现心血管死亡事件(273/2 371,11.5%),接受达格列净治疗的心力衰竭患者心血管死亡率低于安慰剂组(HR=0.82,95%CI=0.69~0.98)。EMPEROR-Reduced试验结果表明,达格列净组共187例患者出现心血管死亡事件(187/1 863,10.0%),安慰剂组共202例患者出现心血管死亡事件(202/1 867,10.8%),接受达格列净治疗的心力衰竭患者心血管死亡率与安慰剂组差异无统计学意义(HR=0.92,95%CI=0.75~1.12)。虽然,EMPEROR-Reduced试验的心血管风险结果呈阴性,但接受恩格列净治疗的心力衰竭患者心血管死亡仍然低于安慰剂组。为何EMPEROR-Reduced试验的心血管死亡风险结果呈阴性,笔者认为以下两点可能是潜在因素:(1)EMPEROR-Reduced的样本量偏低,较DAPA-HF的样本量少了近1 000例,这可能是两个研究出现差异的主要原因。(2)EMPEROR-Reduced试验正值新型冠状病毒感染流行期间,这可能对试验的随访造成一定困难,另外EMPEROR-Reduced的试验结果也表明其试验结束时有将近20例患者的生命状态未知,这可能也给试验带来了不可控偏倚。Zannad等[28]将EMPEROR-Reduced试验和DAPA-HF试验的结果合并做了一项Meta分析,结果表明接受SGLT2i治疗的心力衰竭患者心血管死亡率明显低于安慰剂组(HR=0.86,95%CI=0.76~0.98)。笔者进行的Meta分析仅将同种SGLT2i的文献合并,没有将不同种SGLT2i合并,最终得出的结果与几项大型试验结果基本一致。本研究中,心血管死亡是全因死亡最重要的组成成分,故其结果与心血管死亡是一致的。在全因死亡方面,传统Meta分析提示达格列净较安慰剂组能降低全因死亡率,但恩格列净和索格列净与安慰剂相比却无统计学意义。经过认真梳理文献,笔者发现DAPA-HF试验中达格列净确实不仅能降低心血管死亡风险,还能降低全因死亡风险(HR=0.83,95%CI=0.71~0.97),而恩格列净和索格列净的相关试验均不能降低全因死亡风险。基于此,笔者认为达格列净在降低全因死亡方面可能优于恩格列净和索格列净。安全性方面,传统Meta分析显示恩格列净、达格列净和索格列净在降低低血糖事件上差异无统计学意义,而贝叶斯网状Meta分析显示药物间的两两比较差异无统计学意义。这提示笔者,SGLT2i在临床应用方面安全性较好。
本研究的局限性:(1)缺乏各种SGLT2i间两两直接比较的文献,这可能在一定程度上影响分析结果的稳定性;(2)本研究纳入文献仍相对较少,研究结论仍需SGLT2i头对头大型临床研究试验的证实。
总之,SGLT2i能降低心力衰竭患者心血管死亡/心力衰竭住院复合终点,且不增加低血糖事件发生率,而在降低心血管死亡和全因死亡方面,达格列净可能优于恩格列净和索格列净。
参考文献:
[1]中华医学会心血管病学分会心力衰竭学组,中国医师协会心力衰竭专业委员会,中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2018[J].中华心血管病杂志, 2018, 46(10): 760-789. DOI: 10.3760/cma.j.issn.0253-3758.2018.10.004.
[2]YANCY C W, JESSUP M, BOZKURT B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American college of cardiology/American heart association task force on clinical practice guidelines and the heart failure society of America[J]. J Am Coll Cardiol, 2017, 70(6): 776-803. DOI: 10.1016/j.jacc.2017.04.025.
[3]PONIKOWSKI P, VOORS A A, ANKER S D, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC[J]. Eur J Heart Fail, 2016, 18(8): 891-975. DOI: 10.1002/ejhf.592.
[4]HANSEN M R, HRBJARTSSON A, VIDEBK L, et al. Postponement of death by pharmacological heart failure treatment: a meta-analysis of randomized clinical trials[J]. Am J Med, 2020, 133(6): e280-e289. DOI: 10.1016/j.amjmed.2019.11.015.
[5]ZHANG Y H, ZHANG J, BUTLER J, et al. Contemporary epidemiology, management, and outcomes of patients hospitalized for heart failure in China: results from the China heart failure (China-HF) registry[J]. J Card Fail, 2017, 23(12): 868-875. DOI: 10.1016/j.cardfail.2017.09.014.
[6]MCDONAGH T A, METRA M, ADAMO M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Eur Heart J, 2021, 42(36): 3599-3726. DOI: 10.1093/eurheartj/ehab368.
[7]MCMURRAY J J V, DOCHERTY K F, JHUND P S. Dapagliflozin in patients with heart failure and reduced ejection fraction. reply[J]. N Engl J Med, 2020, 382(10): 973. DOI: 10.1056/nejmc1917241.
[8]KATO E T, SILVERMAN M G, MOSENZON O, et al. Effect of dapagliflozin on heart failure and mortality in type 2 diabetes mellitus[J]. Circulation, 2019, 139(22): 2528-2536. DOI: 10.1161/CIRCULATIONAHA.119.040130.
[9]KOSIBOROD M, GAUSE-NILSSON I, XU J, et al. Efficacy and safety of dapagliflozin in patients with type 2 diabetes and concomitant heart failure[J]. J Diabetes Complications, 2017, 31(7): 1215-1221. DOI: 10.1016/j.jdiacomp.2017.02.001.
[10]NASSIF M E, WINDSOR S L, TANG F M, et al. Dapagliflozin effects on biomarkers, symptoms, and functional status in patients with heart failure with reduced ejection fraction: the DEFINE-HF trial[J]. Circulation, 2019, 140(18): 1463-1476. DOI: 10.1161/CIRCULATIONAHA.119.042929.
[11]SOLOMON S D, MCMURRAY J J V, CLAGGETT B, et al. Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction[J]. N Engl J Med, 2022, 387(12): 1089-1098. DOI: 10.1056/NEJMoa2206286.
[12]PACKER M, ANKER S D, BUTLER J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure[J]. N Engl J Med, 2020, 383(15): 1413-1424. DOI: 10.1056/nejmoa2022190.
[13]ANKER S D, BUTLER J, FILIPPATOS G, et al. Empagliflozin in heart failure with a preserved ejection fraction[J]. N Engl J Med, 2021, 385(16): 1451-1461. DOI: 10.1056/NEJMoa2107038.
[14]SANTOS-GALLEGO C G, VARGAS-DELGADO A P, REQUENA-IBANEZ J A, et al. Randomized trial of empagliflozin in nondiabetic patients with heart failure and reduced ejection fraction[J]. J Am Coll Cardiol, 2021, 77(3): 243-255. DOI: 10.1016/j.jacc.2020.11.008.
[15]BHATT D L, SZAREK M, STEG P G, et al. Sotagliflozin in patients with diabetes and recent worsening heart failure[J]. N Engl J Med, 2021, 384(2): 117-128. DOI: 10.1056/NEJMoa2030183.
[16]ZINMAN B, WANNER C, LACHIN J M, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes[J]. N Engl J Med, 2015, 373(22): 2117-2128. DOI: 10.1056/nejmoa1504720.
[17]NEAL B, PERKOVIC V, MATTHEWS D R. Canagliflozin and cardiovascular and renal events in type 2 diabetes[J]. N Engl J Med, 2017, 377(21): 2099. DOI: 10.1056/NEJMc1712572.
[18]WIVIOTT S D, RAZ I. Dapagliflozin and cardiovascular outcomes in type 2 diabetes[J]. N Engl J Med, 2019, 380(19): 1880-1882. DOI: 10.1056/nejmc1902837.
[19]CANNON C P, PRATLEY R, DAGOGO-JACK S, et al. Cardiovascular outcomes with ertugliflozin in type 2 diabetes[J]. N Engl J Med, 2020, 383(15): 1425-1435. DOI: 10.1056/NEJMoa2004967.
[20]LOPASCHUK G D, VERMA S. Mechanisms of cardiovascular benefits of sodium glucose Co-transporter 2 (SGLT2) inhibitors: a state-of-the-art review[J]. JACC Basic Transl Sci, 2020, 5(6): 632-644. DOI: 10.1016/j.jacbts.2020.02.004.
[21]NAGOSHI T, YOSHIMURA M, ROSANO G M C, et al. Optimization of cardiac metabolism in heart failure[J]. Curr Pharm Des, 2011, 17(35): 3846-3853. DOI: 10.2174/138161211798357773.
[22]JOSHI S S, SINGH T, NEWBY D E, et al. Sodium-glucose co-transporter 2 inhibitor therapy: mechanisms of action in heart failure[J]. Heart, 2021, 107(13): 1032-1038. DOI: 10.1136/heartjnl-2020-318060.
[23]GARCIA-ROPERO A, SANTOS-GALLEGO C G, ZAFAR M U, et al. Metabolism of the failing heart and the impact of SGLT2 inhibitors[J]. Expert Opin Drug Metab Toxicol, 2019, 15(4): 275-285. DOI: 10.1080/17425255.2019.1588886.
[24]DEMDEN M, AMERENA J, DEED G, et al. SGLT2 inhibitors with cardiovascular benefits: transforming clinical care in Type 2 diabetes mellitus[J]. Diabetes Res Clin Pract, 2018, 136: 23-31. DOI: 10.1016/j.diabres.2017.11.023.
[25]TRAVERS J G, KAMAL F A, ROBBINS J, et al. Cardiac fibrosis: the fibroblast awakens[J]. Circ Res, 2016, 118(6): 1021-1040. DOI: 10.1161/CIRCRESAHA.115.306565.
[26]KANG S A, VERMA S, HASSANABAD A F, et al. Direct effects of empagliflozin on extracellular matrix remodelling in human cardiac myofibroblasts: novel translational clues to explain EMPA-REG OUTCOME results[J]. Can J Cardiol, 2020, 36(4): 543-553. DOI: 10.1016/j.cjca.2019.08.033.
[27]VERMA S. Potential mechanisms of sodium-glucose Co-transporter 2 inhibitor-related cardiovascular benefits[J]. Am J Cardiol, 2019, 124(Suppl 1): S36-S44. DOI: 10.1016/j.amjcard.2019.10.028.
[28]ZANNAD F, FERREIRA J P, POCOCK S J, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials[J]. Lancet, 2020, 396(10254): 819-829. DOI: 10.1016/S0140-6736(20)31824-9.

