雷珠单抗联合地塞米松玻璃体内植入剂治疗视网膜分支静脉阻塞继发黄斑水肿的效果



摘要:目的 观察雷珠单抗联合地塞米松玻璃体内植入剂治疗视网膜分支静脉阻塞继发黄斑水肿(macular edema secondary to branch retinal vein occlusion, BRVO-ME)的效果。方法 纳入2020年1月至2022年5月保定市第一中心医院眼科确诊为BRVO-ME且临床资料完整的患者67例67只眼,按照治疗方法的不同将患者分为单药组及联合组,其中单药组37例37只眼,联合组30例30只眼。所有患者行玻璃体腔注射雷珠单抗注射液0.05 mL治疗,联合组于雷珠单抗治疗1周后行地塞米松玻璃体内植入剂0.7 mg玻璃体腔注射;分别于治疗前和治疗后4周检测最佳矫正视力(best corrected visual acuity, BCVA),应用相干光断层扫描成像(optical coherence tomography, OCT)分析黄斑中心凹厚度(central macular thickness, CMT)变化,相干光断层扫描血管成像(optical coherence tomography angiography, OCTA)分析黄斑区浅层视网膜血管灌注密度(vessel perfusion density, VPD)及血管长度密度(vessel length density,VLD)变化。依据患者复诊的情况判断是否需要再次治疗,如果随访复查时OCT的黄斑区域出现视网膜内液或视网膜下液,CMT≥300 μm或BCVA持续下降,需再次接受雷珠单抗注射者则终止观察。结果 初诊时联合组和单药组BCVA、CMT比较差异无统计学意义(Pgt;0.05),治疗后2组BCVA、CMT较治疗前均降低(Plt;0.05)且治疗后联合组BCVA、CMT低于单药组(Plt;0.05)。而2组患者治疗前后黄斑区浅层毛细血管中心、内环、外环及完整的VLD及VPD均无明显变化(Pgt;0.05)。2组治疗前后结果进行组间比较,VLD、VPD结果均无统计学意义(Pgt;0.05)。结论 玻璃体腔内注射雷珠单抗联合地塞米松玻璃体内植入剂治疗BRVO-ME可降低黄斑水肿,改善视力及黄斑区结构和功能,并且疗效可持续。但二者早期疗效相似,协同作用不明显。
关键词:视网膜分支静脉阻塞;黄斑水肿;地塞米松;抗血管内皮生长因子;相干光断层扫描血管成像
DOI:10.3969/j.issn.1674490X.2024.05.003
中图分类号:R77"""" 文献标志码:A"""" 文章编号:1674490X(2024)05001911
Clinical observations of BRVO-ME treated with ranibzumab and ozurdex
Abstract: Objective To observe the effcts of intravitreal of ranibizumab and DEX implant in macular edema secondary to branch retinal vein occlusion (BRVO-ME). Methods 67 cases with BRVO-ME in the Department of Ophthalmology of Baoding No.1 Central Hospital were included from January 2020 to May 2022. According to the different methods of treatment,all patients were divided into ranibizumab group and combined treatment group, 37 cases of 37 eyes in the ranibizumab group and" 30 cases of 30 eyes in the combined treatment group. All patients were treated with intravitreal injection of ranibizumab,and the combined treatment group was treated with ranibizumab and 1 week later with 0.7 mg DEX implant. The best corrected visual acuity (BCVA), the central macular thickness (CMT)and the vessel perfusion density (VPD), vessel length density (VLD) were evaluated detected with optical coherence tomography(OCT and OCTA)before and after treatment. Depending on the patients follow-up, the following situation occurs would stop observing. If intra-retinal/sub-retinal accumulation fluid appeared in the macular area, the BCVA continued to decline, or the CMT≥300 μm, with the increase in CMT. Results There was no significant difference in BCVA and CMT between the combination group and the single drug group at the first diagnosis (Pgt;0.05). After treatment, the BCVA and CMT of the two groups were lower than those before treatment (Plt;0.05), and the BCVA and CMT of the combination group were lower than those of the single drug group after treatment (Plt;0.05).While no significant difference was found in VPD and VLD at the central, inner, otuer, full region in the superficial retinal capillary plexus within 6 mm×6 mm of macular area before and after treatment (Pgt;0.05). Conclusion In eyes with BRVO-ME, treatment with an anti-VEGF agent plus DEX implant could provide a predictable duration of effect, as well as significant improvements in BCVA and CMT. However, the early efficacy of the two is similar, and the synergistic effects are not obvious.
Key words: branch retinal vein occlusion; macular edema; dexamethasone; anti-vascular endothelial growth factor; optical coherence tomography angiography
视网膜静脉阻塞(retinal vein occlusion, RVO)在普通人群中发病率约0.08%,然而在65岁的老年人群中发病率约0.92%[1]。北京眼科研究对国内成年RVO等相关因素研究显示,在RVO眼中视网膜分支静脉阻塞(branch retinal vein occlusion, BRVO)的发生率为30%,黄斑水肿(macular edema,ME)的发生率为37%[2]。ME表现为黄斑区视网膜内液体异常聚集,导致黄斑水肿、增厚,是患者中心视力丧失的最重要原因之一。RVO继发ME可能的主要发病机制为静脉阻塞后造成静脉毛细血管压力升高,破坏血-视网膜内外屏障功能,血管通透性增加,以及血管内皮生长因子(vascular endothelial growth factor, VEGF)、炎症因子等异常表达,血管内血液成分渗透到血管外,最终导致ME。BRVO-ME的治疗主要包括抗VEGF、玻璃体内注射皮质类固醇药物及视网膜激光光凝等。药物治疗被认为是近年来治疗RVO-ME的重要的手段,其中玻璃体腔内注射抗VEGF能够抑制新生血管和缓解水肿,改善患者的视力,但是它作用时间短,需1个月注射1次,加重患者的经济负担及增加手术操作风险。皮质类固醇类药物曲安奈德玻璃体腔内注射在临床广泛应用,在应用过程中,不乏出现一些白内障、继发性青光眼等并发症。近期出现的地塞米松玻璃体植入剂,其半衰期长,药物浓度持续平稳,药效持久,不良反应较少,在治疗BRVO-ME中广泛应用。本研究采用联合用药治疗BRVO-ME,观察联合治疗的疗效,BRVO-ME患者的黄斑区视网膜结构和功能得到有效的改善。
1 资料与方法
1.1 一般资料
纳入2020年1月至2022年5月保定市第一中心医院眼科门诊确诊为BRVO-ME且临床资料完整的患者67例67只眼,按照治疗方法的不同将患者分为单药组及联合组,其中单药组37例37只眼,男性21例(21只眼),女性16例(16只眼),年龄25~79岁,平均(64.81±10.06)岁;联合组30例30只眼,男性17例(17只眼),女性13例(13只眼),年龄22~77岁,平均 (60.50±12.89)岁。2组在年龄、性别、初始最佳矫正视力(best corrected visual acuity,BCVA)、初始黄斑中心凹厚度(central macular thickness, CMT)方面差异无统计学意义。全部参与本研究的患者均签署知情同意书,并由保定市第一中心医院伦理委员会审批通过(快【2021】055号)。
1.2 纳入与排除标准
1.2.1 纳入标准
(1)采用荧光素血管造影和相干光断层扫描成像(optical coherence tomography, OCT)检查确诊为BRVO-ME;(2)CMT≥300 μm;(3)眼压正常。
1.2.2 排除标准
(1)内眼手术、既往接受过抗VEGF治疗、视网膜激光光凝等治疗的患者;(2)对雷珠单抗或激素类药物过敏的患者;(3)视网膜/视盘新生血管及新生血管性青光眼患者;(4)代谢性疾病引起视网膜或者视力疾患;(5)屈光介质不清、固视差的患者。
1.3 研究方法
单药组接受每月1次,连续3次行玻璃体腔注射雷珠单抗注射液。联合组采用雷珠单抗注射液联合地塞米松玻璃体内植入剂治疗,即第一次玻璃体腔注射雷珠单抗 0.05 mL,1周后行塞米松玻璃体内植入剂 0.7 mg玻璃体腔注射,依据患者复诊的情况判断是否需要再次治疗,如果随访复查时OCT的黄斑区域出现视网膜内液或视网膜下液, CMT≥300 μm或BCVA持续下降,需再次接受雷珠单抗注射者则终止观察。
1.4 观察指标
1.4.1 BCVA检查
于治疗前和观察终止(联合组治疗后4周)应用国际标准对数视力表行BCVA检查,检测结果转换为最小分辨角对数(logMAR)视力进行统计学分析。由同一位操作熟练的检查者完成。
1.4.2 OCT、相干光断层扫描血管成像(optical coherence tomography angiography, OCTA)检测
治疗前和观察终止(联合治疗组治疗后4周),所有患者均进行OCT和OCTA检查。所有患者的患眼采用Cirrus HD-OCT 5000型OCTA进行检查。频宽90 nm,A扫描为68 000 次/s,光源波长840 nm,其中的扫描模式包含有HD Radical和Angiography 6 mm×6 mm。采用OCTA追踪的方法在HD Radical模式下识别不同时间点同一个患者同一部位黄斑中心凹点的视网膜厚度,记录CMT值。扫描时开启Fast Trac图像跟踪软件,使用Angio-PlexTM软件对血流进行定量分析。分离生成浅层视网膜毛细血管网(superficial capillary plexus, SCP),并且测量6 mm×6 mm区域内SCP血管长度密度(vessel length density, VLD)和血管灌注密度(vessel perfusion density, VPD)
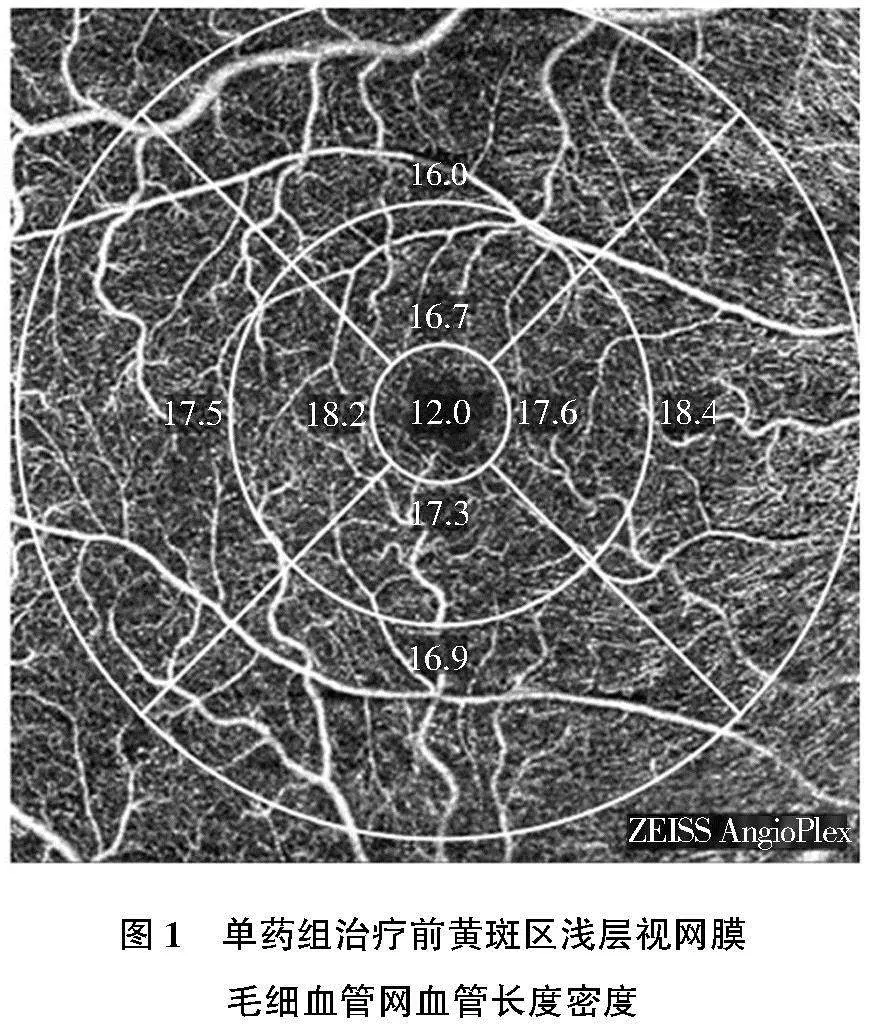
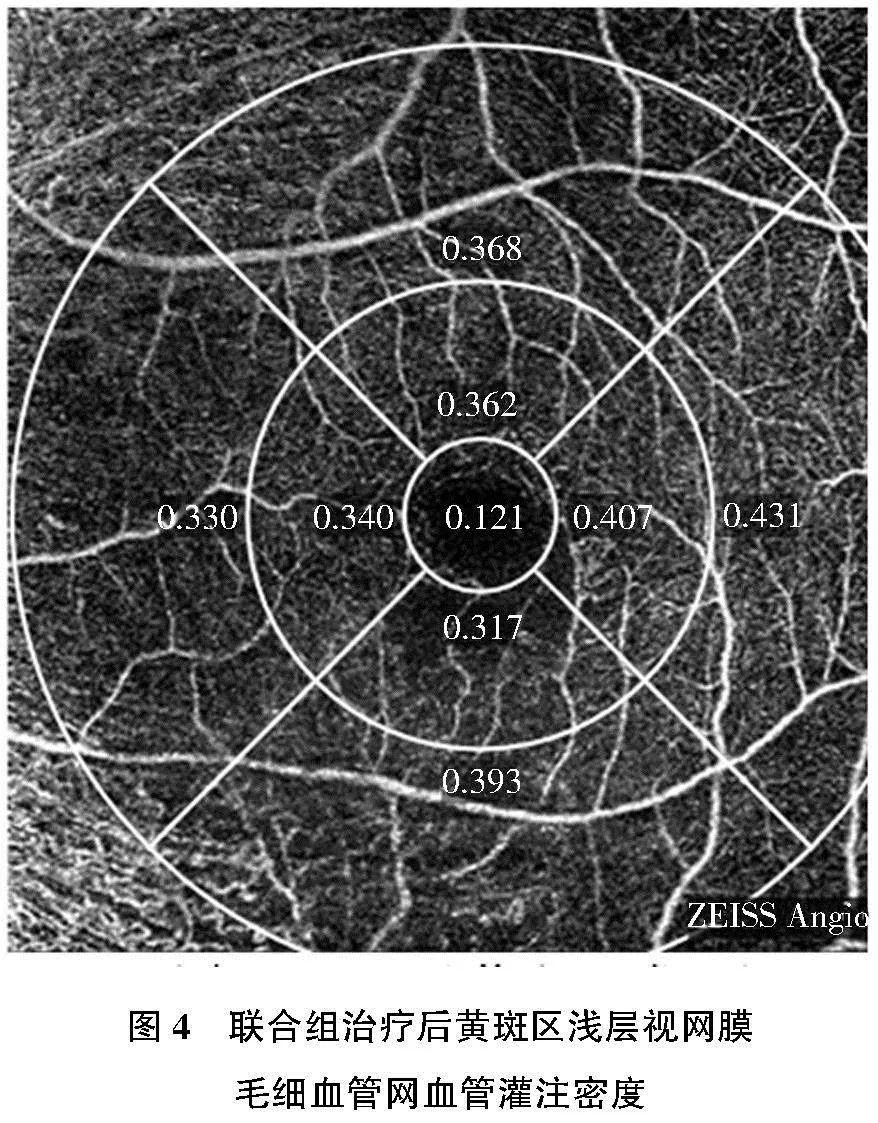
密度,其中VLD为血流信号长度与扫描区域面积的比值,如图1和图2 所示,为单药组患者治疗前后VLD。VPD为血流信号覆盖面积与扫描区域面积的比值,如图3和图4所示,为联合组患者治疗前后VPD。在OCTA的图像计算测量过程中,以黄斑中心凹点作为一个中心点,以1 mm为直径的圆形区域划定为中心凹区,以中心凹为中心1~3 mm的环形区域划定内环,以中心凹为中心>3~6 mm的环形区域划定外环,以中心凹为中心6 mm直径范围内全面积定义为完整。
1.4.3 并发症的发生情况
在患者的预后过程中记录患者的白内障、玻璃体积血、眼压升高等并发症的发生率。
1.5 统计学分析
采用SPSS 22.0进行数据分析,计量资料以x±s表示,2组治疗前后各项观察指标的变化采用配对样本t检验,组间比较采用独立样本t检验。Plt;0.05为差异有统计学意义。
2 结果
2.1 治疗前后BCVA比较
联合组和单药组治疗后BCVA均降低(Plt;0.05),说明两种治疗方法均有效;初诊时2组BCVA比较差异无统计学意义(Pgt;0.05),治疗后联合组低于单药组(Plt;0.05),说明联合组疗效优于单药组。见表1。
2.2 治疗前后CMT比较
联合组和单药组治疗后CMT均降低(Plt;0.05),说明两种治疗均能有效减轻ME;初诊时2组CMT比较差异无统计学意义(Pgt;0.05),治疗后联合组低于单药组(Plt;0.05),说明联合组疗效优于单药组。见表2。
2.3 黄斑区浅层毛细血管VLD分析
联合组和单药组治疗前后患者黄斑区浅层毛细血管中心、内环、外环及完整的VLD相比,差异均无统计学意义(Pgt;0.05);2组间初诊及治疗后黄斑区各环浅层毛细血管VLD相比,差异均无统计学意义(Pgt;0.05)。见表3。
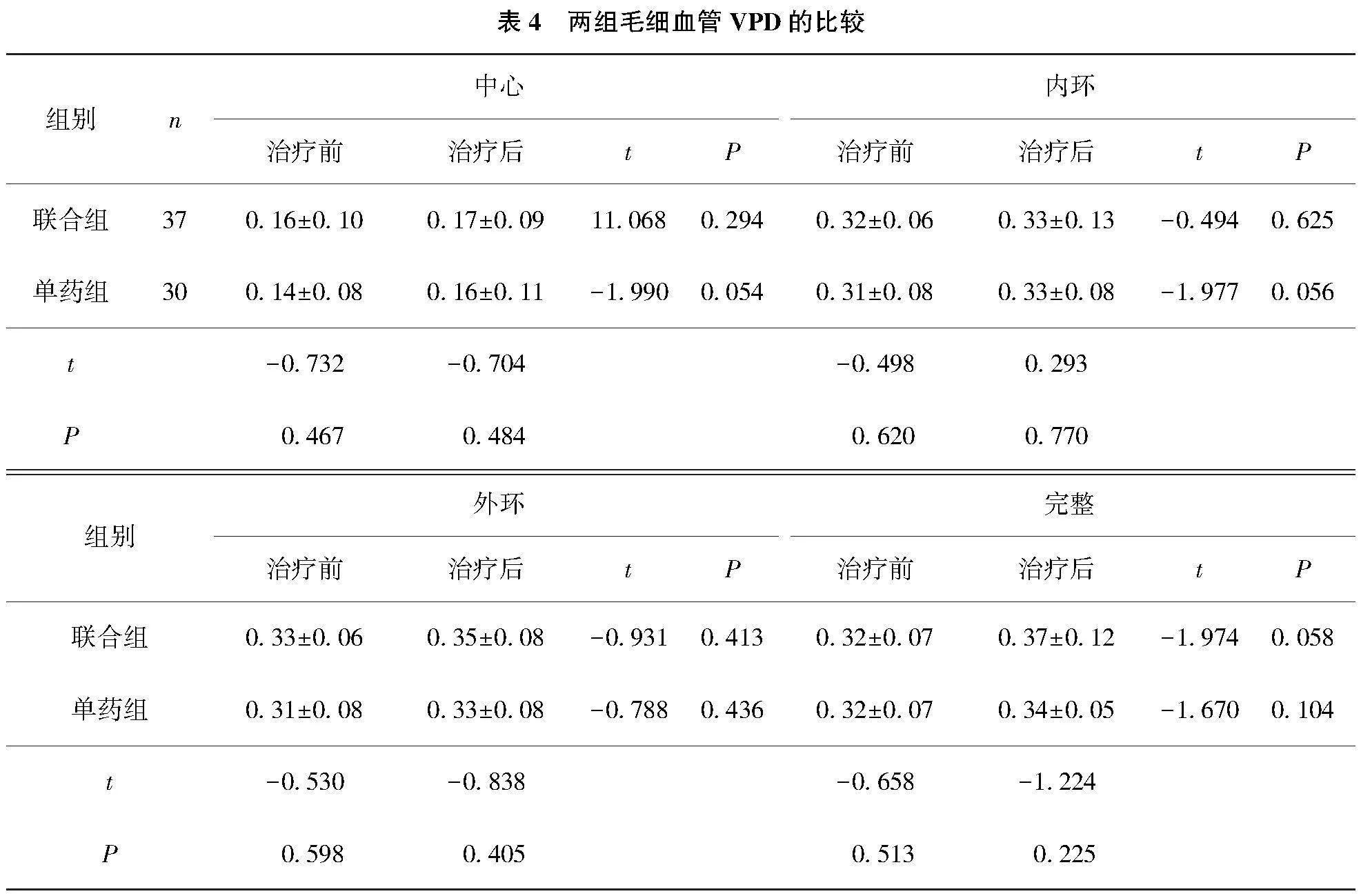
2.4 黄斑区浅层毛细血管VPD的对比分析
联合组和单药组治疗前后患者黄斑区浅层毛细血管中心、内环、外环及完整的VPD相比,差异均无统计学意义(Pgt;0.05);2组间初诊及治疗后黄斑区各环浅层毛细血管VPD相比,差异均无统计学意义(Pgt;0.05)。见表4。
2.5 并发症的发生情况
在治疗过程中,所有患者2只眼使用地塞米松玻璃体内植入剂后发生眼压升高,但是并未出现眼内炎、玻璃体积血、视网膜脱离等一系列并发症。
3 讨论
RVO是发病率仅次于糖尿病视网膜病变的视网膜血管性疾病,因其常继发ME及视网膜新生血管,是导致RVO患者视力丧失的重要原因[3]。蓝山眼科研究显示,RVO的10年累积发生率为1.6%[4]。海狸水坝眼科研究报告视网膜中央静脉阻塞(central retinal vein occlusion,CRVO)和BRVO 15年累计发病率分别为0.5%和1.8%[5]。美国、欧洲、亚洲和澳大利亚11项研究[6-7]的汇总数据显示,RVO患病率为0.52%,BRVO约0.44%,以及CRVO为0.08%,并且BRVO的发病率是CRVO的3~6倍。研究表明,随着年龄增长,RVO患病率增加。
ME是RVO常见的并发症,也是患者视力下降的一个重要原因。RVO继发ME的机制尚不完全明确,研究[8]表明,一方面由于静脉阻塞后视网膜毛细血管回流压力增加导致血管壁的损伤,血-视网膜屏障的破坏,毛细血管渗透性增加,液体积聚在黄斑区导致ME;另一方面是由于静脉阻塞后导致毛细血管无灌注及组织缺血缺氧,从而引起一些内源性细胞因子以及炎症因子释放增加,造成血管的通透性增加,导致黄斑区视网膜水肿增厚。ME导致视网膜外界膜和光感受器内节或外节损伤、视网膜缺血引起的神经节细胞坏死,进一步出现视网膜透明的降低、光散射增加等,导致视力不可逆的损伤[9-11]。
目前针对RVO-ME的治疗方法有玻璃体腔内注射抗VEGF药物、皮质类固醇药物及视网膜激光光凝治疗。
Noma等[12]研究表明,VEGF的异常高表达在RVO-ME的发生发展中起重要作用。VEGF有保持正常血管活性作用,在正常人体中浓度较低,而RVO患者因视网膜缺血缺氧造成VEGF过度表达,破坏血-视网膜屏障,血管通透性增加,加重血管壁渗漏[13]。VEGF促进新生血管形成,而新生血管又加重了视网膜渗漏。并且VEGF能诱导细胞间细胞黏附分子-1和巨噬细胞炎症蛋白-1等一系列炎症因子表达,这可能进一步加重RVO患者炎症反应,导致血管渗漏增加[14]。抗VEGF药物通过结合VEGF受体,抑制新生血管形成,减轻ME,保护患者视功能。目前抗VEGF治疗已成为RVO-ME的一线治疗方法[15-16],包括雷珠单抗、康柏西普、阿柏西普以及贝伐单抗注射液。中国视网膜静脉阻塞临床诊疗路径专家共识[17]指出,于RVO的治疗,推荐采用抗VEGF药物治疗作为主要手段,遵循“3+PRN”的模式,即首诊开始每个月注射1次,连续注射3次,直到视力稳定。因抗VEGF药物半衰期短,在有效浓度降低后ME复发需要多次进行注射,因此增加了玻璃体内注射并发症的概率,且药物的作用比较单一,加重患者经济负担及心理负担。
皮质类固醇药物通过其抗炎作用降低血管的渗透性,抑制上皮细胞增生和新生血管形成,并且可以非特异性地抑制花生四烯酸代谢通路,减轻血-视网膜屏障破坏,减轻ME。目前常用眼内皮质类固醇药物包括曲安奈德和地塞米松玻璃体内植入剂。皮质类固醇药物是治疗RVO-ME的重要方案,但多作为二线用药,适用于抗VEGF治疗效果不佳或近期发生了重大心血管事件的患者,以及不愿每月接受玻璃体注射药物或随访的患者可将其作为一线治疗方案[18]。激素在RVO-ME治疗方面应用广泛,然而在激素治疗的过程中会产生眼压升高、白内障等并发症亦不容忽视。曲安奈德目前为超适应证用药,地塞米松玻璃体内植入剂是世界上第一个生物降解型眼内缓释装置,药效长达6个月[19],因而它可以减少眼内注射频率与相关的并发症。研究[20]表明,地塞米松玻璃体内植入剂在使用过程中有良好的安全性,是伴有严重心脑血管疾病的RVO-ME患者确切替代疗法[17],且其作为糖皮质激素新的用药模式,与玻璃体腔注射曲安奈德相比具有一定的优点,其并发症的发生率低等,但仍有眼压升高、白内障、角膜毒性及植入物异位等并发症的发生,需要关注和警惕[21]。地塞米松玻璃体内植入剂在复发性RVO-ME的治疗上更具优势,单次或多次重复眼内注射可显著提高RVO患眼视力[22]。虽然地塞米松玻璃体内植入剂在国内已广泛应用,但缺乏大样本、长期、多中心的研究结果。
视网膜激光光凝应用于RVO的治疗已有40多年的历史,曾是RVO的标准治疗,其机制是破坏视网膜无灌注区,降低耗氧,改善视网膜缺血缺氧状态,减少VEGF的产生,抑制新生血管的发生、封闭血管壁渗漏,以减轻ME。但Tan等[23]研究表明,激光光凝无法明显提高患者的中心视力,且对周边视野及视敏度造成一定损害。基于抗VEGF治疗的有效性,目前视网膜激光光凝仅作为二线治疗。
玻璃体切割术联合内界膜剥除治疗RVO-ME尚存在争议,需进一步大规模临床试验进行验证。Shirakata等[24]采用玻璃体切除术联合内界膜剥除治疗反复发作的BRVO-ME,结果显示,合并视网膜前膜的眼视力改善幅度更大。但手术会增加玻璃体腔内药物的清除速度,缩短药物作用时间,降低再次玻璃体腔内注药的效果[25]。
目前,抗VEGF治疗和地塞米松玻璃体内植入剂已被欧盟、美国等多个国家指南推荐为RVO-ME主要治疗方案[17,26]。新治疗观念联合治疗理念被临床应用,目的在提高患者视力的同时减轻患者的经济负担,但联合治疗的策略尚无标准。临床上关于抗VEGF联合抗炎治疗的方案不一,从早期的玻璃体腔注射抗VEGF药物2周后联合地塞米松玻璃体内植入剂,抗VEGF治疗3次后再加入地塞米松玻璃体内植入剂,到现在的1周联合、起始联合,治疗目的均是在有效提高患者视力的前提下减轻患者注射负担,使RVO-ME获得长期的治疗效果。本研究采取序贯疗法(即雷珠单抗注射1针,1周后地塞米松玻璃体内植入剂1针)治疗BRVO-ME。在抗VEGF治疗起效的基础上及时加入地塞米松可以进一步减少ME的复发,避免了同时注射药的手术风险及眼压升高的风险。
本研究最重要的发现是联合用药对BRVO-ME治疗无论从视力和微结构都产生了实质性的改善,并且在观察期能够维持。本研究中30例眼中只有2例在观察期内再次出现ME而被排出。本论文的研究结果与Singer等[27]应用抗VEGF与地塞米松玻璃体内植入剂联合干预BRVO或CRVO继发ME患者结论一致。他们的患者平均注射间隔时间为 (135.5±36.4)d,虽然本研究没有观察到3个月,但结果显示联合用药在治疗BRVO-ME过程中疗效良好,并且延长注射时间间隔。Iu等[28]应用雷珠单抗联合地塞米松玻璃体内植入剂治疗BRVO-ME,发现对视力改善效果远优于单一的干预方法。本研究过程中不仅观察BRVO-ME的ME消退效果,进一步对黄斑区VLD和VPD进行定量分析,并且分析患者的视力变化。本研究中BRVO-ME患者在联合治疗后VLD、VPD在6 mm×6 mm区域内差异无统计学意义,同时结果提示,抗VEGF和地塞米松玻璃体内植入剂对黄斑区内缺血状态并没有得到改善,这表明在抗VEGF治疗的基础上加用地塞米松玻璃体内植入剂治疗BRVO-ME的早期疗效可能与抗VEGF单药治疗效果相似,协同作用不明显。本研究显示患者CMT降低,ME和视力得到一定的改善,这些研究结果与前期的研究结果一致。Singer等[27]探讨VEGF联合地塞米松玻璃体内植入剂治疗BRVO或CRVO继发ME共62眼的疗效,认为联合治疗RVO-ME具有很好可预见性,同时BCVA和CMT有显著的改善。有试验显示,地塞米松玻璃体内植入剂对BCVA和CMT的影响在2个月后最为显著,此后逐渐减弱[29-30]。许多学者[31-32]认为,为了防止BCVA的波动和稳定增益,3~4个月后需要再次进行植入治疗。地塞米松玻璃体内植入剂植入玻璃体后存在一系列的不良反应,其中包括植入剂迁移、白内障、眼压升高、感染等,其中并发性白内障和高眼压症状最为常见[33],研究[34]报道,在术后6个月其发生率可高达29.8%,但是本研究中仅有2只眼在注射地塞米松玻璃体内植入剂后出现眼压升高,经用药后眼压升高状态得到改善,同时并未观察到眼内炎、玻璃体积血、视网膜脱离等一系列眼部不良反应,且未发现与用药物相关的全身不良反应。
本研究存在样本量较小、术后观察时间短、观察指标较少的不足,此后需要大样本、长期随访及多因素的研究进一步验证本研究结果,对RVO了解更深入。
4 结论
综上所述,玻璃体腔内注射雷珠单抗联合地塞米松玻璃体内植入剂治疗BRVO-ME可显著降低ME,改善视力及黄斑区结构和功能,并且疗效可持续。目前抗VEGF与地塞米松玻璃体内植入剂联合治疗RVO-ME的报道越来越多,联合用药与单一用药比较其具有一定的优势和缺点,但抗VEGF与地塞米松玻璃体内植入剂联合转换时机和用药过程中的时间间隔及联合用药疗程仍需要大量临床研究,优化治疗方案。
参考文献:
[1]URIAS E A, URIAS G A, MONICKARAJ F, et al. Novel therapeutic targets in diabetic macular edema: beyond VEGF[J]. Vision Res, 2017, 139: 221-227. DOI: 10.1016/j.visres.2017.06.015.
[2]ZHOU J Q, XU L, WANG S, et al. The 10-year incidence and risk factors of retinal vein occlusion: the Beijing eye study[J]. Ophthalmology, 2013, 120(4): 803-808. DOI: 10.1016/j.ophtha.2012.09.033.
[3]LI J, PAULUS Y M, SHUAI Y L, et al. New developments in the classification, pathogenesis, risk factors, natural history, and treatment of branch retinal vein occlusion[J]. J Ophthalmol, 2017, 2017: 4936924. DOI: 10.1155/2017/4936924.
[4]CUGATI S, WANG J J, ROCHTCHINA E, et al. Ten-year incidence of retinal vein occlusion in an older population: the Blue Mountains Eye Study[J]. Arch Ophthalmol, 2006, 124(5): 726-732. DOI: 10.1001/archopht.124.5.726.
[5]KLEIN R, MOSS S E, MEUER S M, et al. The 15-year cumulative incidence of retinal vein occlusion: the Beaver Dam Eye Study[J]. Arch Ophthalmol, 2008, 126(4): 513-518. DOI: 10.1001/archopht.126.4.513.
[6]BERGER A R, CRUESS A F, ALTOMARE F, et al. Optimal treatment of retinal vein occlusion: Canadian expert consensus[J]. Ophthalmologica, 2015, 234(1): 6-25. DOI: 10.1159/000381357.
[7]ROGERS S, MCINTOSH R L, CHEUNG N, et al. The prevalence of retinal vein occlusion: pooled data from population studies from the United States, Europe, Asia, and Australia[J]. Ophthalmology, 2010, 117(2): 313-319. DOI: 10.1016/j.ophtha.2009.07.017.
[8]雍红芳,戚卉,吴瑛洁,等.视网膜静脉阻塞继发黄斑水肿发病机制及黄斑水肿影响视功能的研究进展[J].国际眼科杂志, 2019, 19(11): 1888-1891. DOI: 10.3980/j.issn.1672-5123.2019.11.17.
[9]CHATZIRALLI I, THEODOSSIADIS G, PARIKAKIS E, et al. Long-term anatomical and functional outcomes in patients with ischemic central retinal vein occlusion treated with anti-vascular endothelial growth factor agents[J]. Ophthalmic Res, 2017, 58(4): 203-208. DOI: 10.1159/000462976.
[10]CELIK E, DOG" ˇAN E, TURKOGLU E B, et al. Serous retinal detachment in patients with macular edema secondary to branch retinal vein occlusion[J]. Arq Bras Oftalmol, 2016, 79(1): 9-11. DOI: 10.5935/0004-2749.20160004.
[11]IIJIMA H. Mechanisms of vision loss in eyes with macular edema associated with retinal vein occlusion[J]. Jpn J Ophthalmol, 2018, 62(3): 265-273. DOI: "10.1007/s10384-018-0586-5.
[12]NOMA H, MINAMOTO A, FUNATSU H, et al. Intravitreal levels of vascular endothelial growth factor and interleukin-6 are correlated with macular edema in branch retinal vein occlusion[J]. Graefes Arch Clin Exp Ophthalmo, 2006, 244(3): 309-315. DOI: 10.1007/s00417-004-1087-4.
[13]TARALLO V, FALCO S D. The vascular endothelial growth factors and receptors family: up to now the only target for anti-angiogenesis therapy[J]. Int J Biochem Cell Biol, 2015, 64: 185-189. DOI: 10.1016/j.biocel.2015.04.008.
[14]XIA J P, WANG S, ZHANG J S. The anti-inflammatory and anti-oxidative effects of conbercept in treatment of macular edema secondary to retinal vein occlusion[J]. Biochem Biophys Res Commun, 2019, 508(4): 1264-1270. DOI: 10.1016/j.bbrc.2018.12.049.
[15]SIVAPRASAD S, AMOAKU W M, HYKIN P, et al. The Royal College of Ophthalmologists Guidelines on retinal vein occlusions: executive summary[J]. Eye, 2015, 29(12): 1633-1638. DOI: 10.1038/eye.2015.164.
[16]PULIDO J S, FLAXEL C J, ADELMAN R A, et al. Retinal vein occlusions preferred practice pattern() guidelines[J]. Ophthalmology, 2016, 123(1): 182-208. DOI: 10.1016/j.ophtha.2015.10.045.
[17]中华医学会眼科学分会眼底病学组,中国医师协会眼科医师分会眼底病专业委员会.中国视网膜静脉阻塞临床诊疗路径专家共识[J].中华眼底病杂志, 2024, 40(3): 175-185. DOI: 10.3760/cma.j.cn511434-20240201-00056.
[18]陈露璐,陈有信.2019年《EURETINA视网膜静脉阻塞诊疗指南》解读[J].中华实验眼科杂志, 2020, 38(1): 60-63. DOI: 10.3760/cma.j.issn.2095-0160.2020.01.012.
[19]MYUNG J S, AAKER G D, KISS S. Treatment of noninfectious posterior uveitis with dexamethasone intravitreal implant[J]. Clin Ophthalmol, 2010, 4: 1423-1426. DOI: 10.2147/OPTH.S15696.
[20]BOYER D S, YOON Y H, BELFORT R, et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema[J]. Ophthalmology, 2014, 121(10): 1904-1914. DOI: 10.1016/j.ophtha.2014.04.024.
[21]MISHRA S K, GUPTA A, PATYAL S, et al. Intravitreal dexamethasone implant versus triamcinolone acetonide for macular oedema of central retinal vein occlusion: quantifying efficacy and safety[J]. Int J Retina Vitreous, 2018, 4: 13. DOI: 10.1186/s40942-018-0114-2.
[22]BUDZINSKAYA M V, SHELANKOVA A V, PLUKHOVA A, et al. The role of steroids in the management of macular edema from retinal vein occlusion[J]. Ophthalmol Russ, 2019, 16(1): 95-101. DOI: 10.18008/1816-5095-2019-1-95-101.
[23]TAN M H, MCALLISTER I L, GILLIES M E, et al. Randomized controlled trial of intravitreal ranibizumab versus standard grid laser for macular edema following branch retinal vein occlusion[J]. Am J Ophthalmol, 2014, 157(1): 237-247. DOI: 10.1016/j.ajo.2013.08.013.
[24]SHIRAKATA Y, FUKUDA K, FUJITA T, et al. Pars plana vitrectomy combined with internal limiting membrane peeling for recurrent macular edema due to branch retinal vein occlusion after antivascular endothelial growth factor treatments[J]. Clin Ophthalmol, 2016, 10: 277-283. DOI: 10.2147/OPTH.S85751.
[25]HAHN P. Successful treatment of neovascular age-related macular degeneration following single bevacizumab failure using aflibercept in a vitrectomized eye[J]. Clin Ophthalmol, 2014, 8: 2129-2131. DOI: 10.2147/OPTH.S73265.
[26]FLAXEL C J, ADELMAN R A, BAILEY S T, et al. Retinal vein occlusions preferred practice pattern()[J]. Ophthalmology, 2020, 127(2): 288-320. DOI: 10.1016/j.ophtha.2019.09.029.
[27]SINGER M A, JANSEN M E, TYLER L, et al. Long-term results of combination therapy using anti-VEGF agents and dexamethasone intravitreal implant for retinal vein occlusion: an investigational case series[J]. Clin Ophthalmol, 2017, 11: 31-38. DOI: 10.2147/OPTH.S119373.
[28]IU L P, ZHAO P, YEUNG I Y, et al. Sequential therapy with ranibizumab and dexamethasone intravitreal implant is better than dexamethasone monotherapy for macular oedema due to retinal vein occlusion[J]. Br J Ophthalmol, 2015, 99(2): 210-214. DOI: 10.1136/bjophthalmol-2014-305661.
[29]AL-KHERSAN H, HARIPRASAD S M, SALEHI-HAD H. Dexamethasone and anti-VEGF combination therapy for the treatment of diabetic macular edema[J]. Ophthalmic Surg Lasers Imaging Retina, 2019, 50(1): 4-7. DOI: 10.3928/23258160-20181212-01.
[30]QIAN T, ZHAO M, XU X. Comparison between anti-VEGF therapy and corticosteroid or laser therapy for macular oedema secondary to retinal vein occlusion: a meta-analysis[J]. J Clin Pharm Ther, 2017, 42(5): 519-529. DOI: 10.1111/jcpt.12551.
[31]MANOUSARIDIS K, PETER S, MENNEL S. Outcome of intravitreal dexamethasone implant for the treatment of ranibizumab-resistant macular edema secondary to retinal vein occlusion[J]. Int Ophthalmol, 2017, 37(1): 47-53. DOI: 10.1007/s10792-016-0226-3.
[32]COSCAS G, AUGUSTIN A, BANDELLO F, et al. Retreatment with Ozurdex for macular edema secondary to retinal vein occlusion[J]. Eur J Ophthalmol, 2014, 24(1): 1-9. DOI: 10.5301/ejo.5000376.
[33]FASSBENDER ADENIRAN J M, JUSUFBEGOVIC D, SCHAAL S. Common and rare ocular side-effects of the dexamethasone implant[J]. Ocul Immunol Inflamm, 2017, 25(6): 834-840. DOI: 10.1080/09273948.2016.1184284.
[34]ZHAO L Q, CHENG J W. A systematic review and meta-analysis of clinical outcomes of intravitreal anti-VEGF agent treatment immediately after cataract surgery for patients with diabetic retinopathy[J]. J Ophthalmol, 2019, 2019: 2648267. DOI: 10.1155/2019/2648267.

