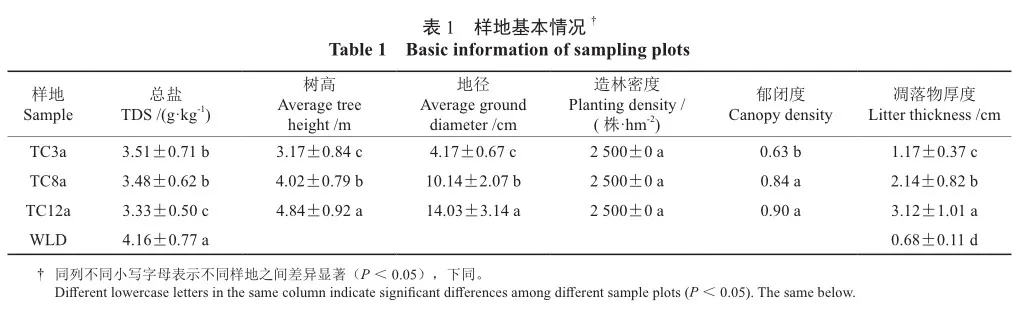
黄河三角洲柽柳人工林土壤微生物群落结构及多样性分析
摘 要:【目的】探究黄河三角洲不同林龄柽柳人工林对土壤微生物群落结构特征及多样性的影响,对评价人工林土壤质量动态变化和后期栽培管理具有重要意义。【方法】以无林地(WLD)和3种不同林龄(TC3a、TC8a、TC12a)的柽柳人工林为研究对象,采用高通量测序技术,对土壤细菌和真菌群落结构及多样性变化进行分析。【结果】3种林龄及无林地土壤微生物数量均表现为细菌>真菌,随着林龄的增加,优势菌群未发生改变。林龄对土壤细菌和真菌群落α多样性的影响有限,其中细菌Chao1index、ACE index和Shannon指数表现为TC8a>TC3a>TC12a,而真菌Shannon指数和Simpson指数则表现为TC3a>TC8a>TC12a。细菌的群落组成数量在门、纲、目、科、属水平上与真菌存在显著差异,其中细菌的群落组成在各个分类水平上均表现为TC12a>TC8a>TC3a>WLD,而真菌则表现不规律,但均以TC3a数量最多。土壤微生物优势群落和主要群落组成基本一致,但在相对丰度上存在一定差异。其中细菌群落中变形菌门Proteobacteria和unidentified Bacteria相对丰度均超过10%,是优势菌门,而真菌群落中,子囊菌门Ascomycota的相对丰度均超过45%,是绝对优势菌门。林龄变化对土壤理化性质和微生物群落结构特征均存在一定影响,其中土壤有机碳、全氮、全磷、全钾、铵态氮、有效磷及速效钾含量随着林龄的增长而增加,且均高于WLD,而土壤含盐量则表现出相反的变化规律。冗余分析表明,不同林龄的微生物群落受养分影响明显,细菌群落中土壤全氮、铵态氮和真菌群落中盐分、有机碳、全氮、全磷,分别是影响细菌和真菌群落变化的主要环境因子。【结论】柽柳人工林调控了滨海盐碱地土壤微生物群落结构,提高了土壤微生物多样性,改善了土壤理化性质,但对林龄的响应变化不规律。
关键词:黄河三角洲;柽柳人工林;土壤微生物;群落结构;土壤质量
中图分类号:S718.52 文献标志码:A 文章编号:1673-923X(2024)09-0080-14
基金项目:山东省重点实验室开放基金项目(2022KFJJ02);国家重点研发计划项目(2021YFD2201205);山东省重点研发计划项目(重大科技创新工程)(2021SFGC0205)。
Soil microbial community structure and diversity in Tamarix chinensis plantations in the Yellow River Delta
LI Yongtao1,2, WANG Zhenmeng2, YANG Qingshan2, ZHANG Zilong2, DONG Aixin2, ZHOU Jian2, CAO Qiqi1, ZHANG Jun1
(1. Shandong Provincial Key Laboratory of Eco-Environmental Science for Yellow River Delta, Shandong University of Aeronautics, Binzhou 256603, Shandong, China; 2. Yellow River Delta Farmland Shelterbelt Ecosystem National Observation and Research Station, Shandong Academy of Forestry Sciences, Jinan 250014, Shandong, China)
Abstract:【Objective】The aim of this study was to explore the effects of soil microbial composition and diversity of Tamarix chinensis plantations with different stand ages, it is of great significance for evaluating the dynamic changes in soil quality and later cultivation management of artificial forests.【Method】The high-throughput sequencing technology was used to analysis the changes of bacterial and fungi community structure and diversity on no-forest land (WLD) and the plantations of different stand ages (TC3a, TC8a, TC12a) in the Yellow River Delta.【Result】The number of bacteria was more than that of fungi in three kinds of forest age and non-forest land and the dominant species did not change with the increase of forest age. Forest age had limited influence on the alpha diversity soil bacterial and fungal communities. Among them, the sequence of bacterial Chao1index, ACE index and Shannon index from high to low was TC8a, TC3a and TC12a, while the sequence of Shannon index and Simpson index of fungi from high to low was TC3a, TC 8a and TC12a. The community composition of bacteria was significantly different from that of fungi at the levels of phylum, class, order, family and genus(P<0.05). The order of community composition of bacteria was TC12a, TC8a, TC3a and WLD at all taxonomic levels, while that of fungi was irregular, but the number of TC3a was the largest. The composition of soil microbial dominant communities and major communities was basically the same, but there were some differences in relative abundance. The relative abundance of Proteobacteria and unidentified Bacteria in the bacterial community was more than 10%, which was the absolute dominant phylum. In the fungal community, the relative abundance of Ascomycota is more than 45%, which was the dominant phylum. The change of forest age had a influence on soil physical and chemical properties and microbial community structure characteristics. The contents of soil organic carbon, total nitrogen, total phosphorus, total potassium, ammonium nitrogen, available phosphorus and available potassium increased with the increase of forest age, and were higher than WLD, while the soil salt content showed the opposite change rule. The results of redundancy analysis showed that the microbial communities of different forest age were significantly affected by nutrients, and soil total nitrogen and ammonium nitrogen in bacterial communities and total salt, organic carbon, total nitrogen and total phosphorus in fungal communities were the main environmental factors which affected the changes of bacterial and fungal communities, respectively.【Conclusion】The establishment of T. chinensis plantations effectively regulated the structure of soil microbial communities, enhanced soil microbial diversity, and improved physical and chemical properties in coastal saline-alkali lands. However, the response to forest age exhibited irregular patterns.
Keywords: Yellow River Delta; Tamarix chinensis plantations; soil microorganism; community structure; soil quality
黄河三角洲地处滨海湿润半湿润海水浸渍盐渍区,受暖温带大陆性季风气候和人为活动等因素的多重影响,区域内土壤盐渍化及荒漠化严重,区内有大片未利用的盐碱化土地,生态环境极为脆弱[1]。由于该区天然林资源匮乏,目前营造人工林是黄河三角洲地区植被恢复和生态体系构建的重要措施[2]。柽柳Tamarix chinensis为柽柳科Tamaricaceae柽柳属Tamarix落叶小乔木或灌木,具有耐干旱瘠薄、耐盐碱、抗逆性强的特点,在滨海湿地和内陆盐碱地均广泛分布,现已成为盐碱地区主要的生态修复树种[3],在盐碱化治理和生态系统恢复过程中发挥了重要作用[4-6]。
土壤微生物是森林生态系统的重要组成部分,它在调节土壤碳、氮循环和推动土壤养分转化过程中发挥了重要的作用,并通过调控土壤养分变化来直接或间接影响植物生长和群落结构变化[7-8]。人工林生态系统作为我国森林生态系统的重要类型,目前发展迅速,保存面积不断增大,对我国的社会发展和生态环境建设发挥了举足轻重的作用[9]。但由于人工林生物多样性低、结构简单及稳定性差,研究原生境土壤微生物群落结构特征,是揭示人工林、土壤、微生物相互关系,探寻土壤中优势菌群及影响因素的重要依据。林龄能够改变物种组成、植物群落结构和林内小气候环境[10],而由林龄引起的林分和土壤环境变化也可间接影响土壤微生物群落结构特征和生态功能[11-12]。有研究表明,同一种植物土壤微生物的群落组成会因植物生长年限以及发育阶段而发生明显变化[13-14]。牛小云等[15]的研究发现,日本落叶松Larix kaempferi土壤微生物群落随着林龄的增加呈现降低趋势;而彭辉等[16]的研究发现,随着林龄的增长,红豆树Ormosia hosiei土壤真菌多样性增加;蔡锰柯等[17]的研究发现,林龄对华北落叶松林Larix principis-rupprechtii土壤理化性质和微生物群落结构特征存在显著影响。目前,滨海盐碱地区有关柽柳的研究多以野生单株或群落为主,而有关人工林的研究相对较少,且主要集中在土壤水分的物理性质[18]、土壤养分[19]、土壤微生物与土壤呼吸特征[20]等方面,而对柽柳人工林土壤微生物群落结构及多样性的研究鲜有报道。黄河三角洲是我国滨海盐碱地的集中分布区之一,是我国重要的后备耕地资源,研究如何利用耐盐植物,并对盐碱地进行改良是重要的研究方向。本研究基于高通量测序技术,对黄河三角洲不同林龄柽柳人工林土壤微生物群落结构和多样性特征进行分析,探讨了土壤微生物群落结构及多样性随林龄的变化规律,分析土壤主要养分性质对其微生物的影响,以期为该区柽柳人工林土壤质量动态变化研究和后期栽培管理提供科学依据。
1 研究区概况
研究区位于黄河三角洲的核心区域东营市,地理坐标为118°40′53″E?37°24′12″N。试验地土壤类型为盐化潮土,盐分以NaCl为主。根据黄河三角洲农田防护林站地面标准气象场数据,2023年试验区平均气温为14.2 ℃,年降水量为433 mm,且集中于夏季,年蒸发量为2 106.4 mm,是降水量的4.8倍。试验区植被以人工林为主,树种主要有柽柳、白蜡Fraxinus velutina和榆树Ulmus pumila等。
2 材料与方法
2.1 样地设置与样品采集
在试验地选取立地条件基本一致的3个不同林龄(TC3a、TC8a和TC12a)柽柳人工林和无林地(WLD)作为研究对象,并对样地内林木进行每木检尺(表1)。柽柳林下植被稀少,主要有灰绿藜Oxybasis glauca、藜Chenopodium album、鹅绒藤Cynanchum chinense、旋覆花Inula japonica等。无林地植被盖度相对较高,以盐地碱蓬Suaeda salsa、白茅lmperata cylindrica、芦苇Phragmites australis、鹅绒藤Cynanchum chinense等为主。
2023年9月在3个林龄和1个无林地内随机设置3个10 m×10 m的标准样地,每个样地再分别设置3个1 m×1 m的样方,在每个样方内按对角线五点法采集凋落物层下方0~10 cm的土壤样品,36个样方共180个采样点。样品采集后分成两份,一份采用冰盒立即带回实验室-80 ℃冰箱保存,用于土壤微生物的测定;另一份室温下自然风干,用于土壤理化指标的测定。
2.2 土壤微生物群落的测定
利用高通量基因组测序技术对土壤微生物多样性进行分析,土壤基因组DNA的提取、PCR的扩增、文库的构建及测试工作由北京诺禾致源科技股份有限公司完成,其中细菌多样性采用16S rDNA扩增子测序测定[21],以16S V3~V4区引物(341F和806R)鉴定细菌多样性,扩增引物名称及序列分别为341F(CCTAYGGGRBGCASCAG)和806R(GGACTACNNGGGTATCTAAT)[22]。真菌的分类鉴定采用核苷酸序列内转录区进行,以ITS1区作为测序区域,扩增引物名称及序列分别为1737F(GGAAGTAAAAGTCGTAACAAGG)和2043R(GCTGCGTTCTTCATCGATGC)[23]。
2.3 土壤养分指标的测定
土壤有机碳(OC)的测定采用K2Cr2O7容量―外加热法[24];全氮(TN)的测定采用硫酸-过氧化氢消煮,用凯氏定氮法[24];全磷(TP)的测定采用硫酸-过氧化氢消煮,用分光光度法[24];全钾(TK)的测定采用硫酸-过氧化氢消煮,用原子吸收火焰光度计法[24]。
2.4 数据处理
采用Microsoft Excel 2013软件对数据进行初步统计和处理;采用FLASH软件(V1.2.7)[25]对每个测序样本进行拼接、过滤等多重处理,得到有效数据;利用Uparse软件(v7.0.1001)[26]对所有样品的全部有效数据在97%相似度水平下进行聚类,获得频数最高的OTUs序列;采用Qiime软件(Version 1.9.1)中的blast方法[27]与Unite(v8.2)数据库[28],在门(phylum)、纲(class)、目(order)、科(family)、属(genus)水平上,对OTUs序列进行物种注释分析;采用Qiime软件(Version 1.9.1)计算Chao1、Shannon、Simpson、ACE指数;采用R软件(Version 2.15.3)绘制PCA图。
3 结果与分析
3.1 不同林龄柽柳林土壤微生物OTU分析
通过对4个样地土壤进行高通量测序得出,36份土壤样品共获得细菌有效序列238 435条,总碱基数99 363 012 bp,平均碱基长度416.918 bp;共获得真菌有效序列316 607条,总碱基数78 771 554 bp,平均碱基长度248.165 bp。以97%的一致性进行OTUs聚类,细菌和真菌分别获得9 115个和2 895个OTUs,然后对OTUs序列进行物种注释。细菌和真菌各样本的文库分别在0.982和0.997以上,测序结果能够很好地反映土壤中微生物群落的真实情况。
由维恩图(图1)可看出,不同样地中共有细菌OTUs为1 907个,而特有OTUs数中WLD样地为627个,TC3a样地为687个,TC8a样地为843个,TC12a样地为1 263个,分别占各自样本总OTUs的16.31%、12.82%、14.75%和23.03%;不同样地土壤中共有真菌OTUs为321个,而4个样地特有OTUs数分别为283、525、310和418个,分别占各自样本总OTUs的22.99%、33.76%、25.64%和33.20%。土壤细菌数量明显高于真菌数量,而细菌和真菌特有OTUs数中,分别以TC12a样地和TC3a样地最多。

3.2 不同林龄柽柳林土壤微生物群落多样性指数分析
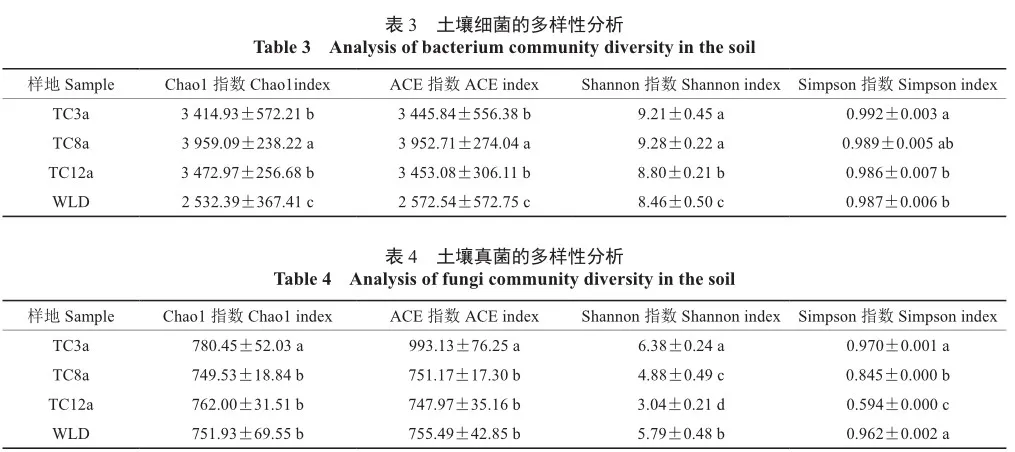
由表3可知,不同林龄柽柳土壤中细菌丰富度指数(Chao1指数和ACE指数)和多样性指数(Shannon指数)变化一致,均表现为TC8a>TC3a>TC12a。其中,TC8a林地细菌丰富度指数与其他林地均差异显著(P<0.05)。与WLD相比,3种林龄林地土壤细菌Chao1指数、ACE指数和Shannon指数均显著高于WLD(P<0.05)。细菌Simpson指数则以TC3a林地最高,TC12a林地最低。
土壤真菌群落中,Chao1指数和ACE指数表现为TC3a>TC12a>TC8 a,而Shannon指数和Simpson指数则表现为TC3a>TC8a>TC12a,其中TC3a林地显著高于其他林地(P<0.05)(表4)。与WLD相比,TC3a林地的Chao1指数、ACE指数和Shannon指数均显著高于无林地(P<0.05),而TC8a和TC12a林地的Chao1指数和ACE指数与无林地无显著差异,但多样性指数间则差异显著(P<0.05)。
3.3 不同林龄柽柳林土壤微生物群落结构组成分析
3.3.1 土壤微生物群落结构组成分析
在各分类水平上检测WLD和3种不同林龄土壤的微生物群落组成,共检测出细菌80门166纲359目534科882属,检测出真菌15门59纲155目338科618属,细菌的群落组成数量在各分类水平上均显著高于真菌的群落组成数量(表5)。其中,细菌的群落组成在各个分类水平上均表现为TC12a>TC8a>TC3a>WLD,且3种林龄在纲、目、科、属水平上均与WLD差异显著(P<0.05);而真菌的群落组成在各个分类水平上表现不规律,但均以TC3a数量最多。
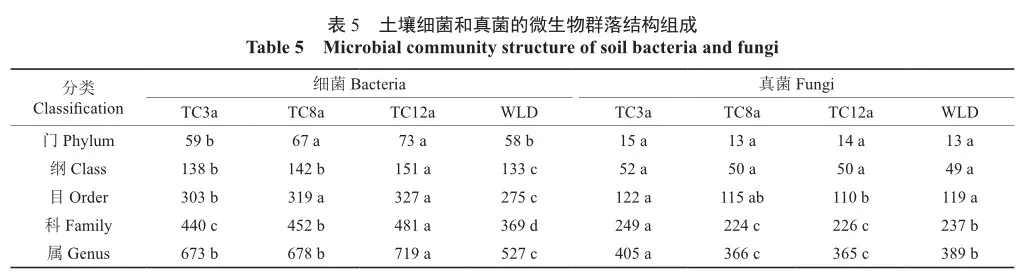
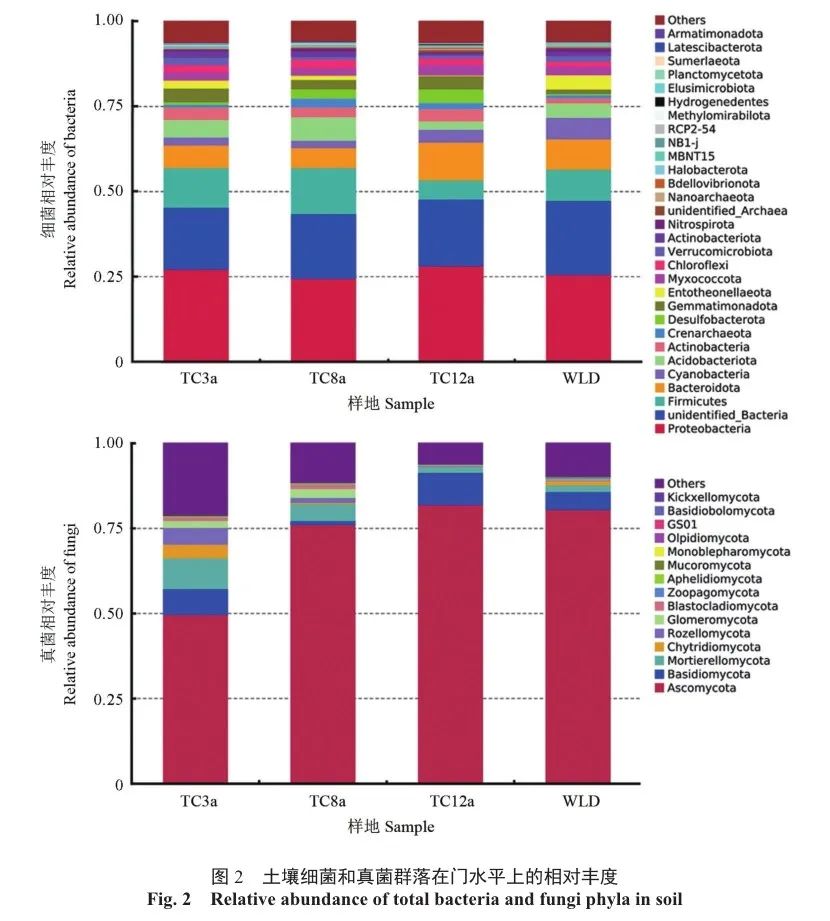
在门水平上,土壤细菌群落中4个样地土壤中变形菌门Proteobacteria、unidentified_Bacteria及TC3a、TC8a土壤中的厚壁菌门Firmicutes和TC12a人工林土壤中的拟杆菌门Bacteroidota相对丰度均超过10%,是土壤中的优势群落(图2)。此外,蓝藻菌门Cyanobacteria、酸杆菌门Acidobacteriota、放线菌门Actinobacteria的相对丰度超过1%,是土壤中的主要群落。其中,排名前8的细菌优势群落和主要群落占土壤细菌总OTU数的70%以上。3种林龄中变形菌门相对丰度最高,均高于WLD的相对丰度。而WLD土壤中unidentified_Bacteria和蓝藻菌门相对丰度分别达到了21.77%和6.40%,显著高于3种林龄(P<0.05);而土壤真菌群落中,检测到的门类相对较少,4个样地子囊菌门Ascomycota相对丰度均超过45%,是土壤中的优势群落,而其他各门相对丰度均不超过10%。其中,子囊菌门在TC12a人工林土壤中丰度达到最高,为82.02%,而在TC3a土壤中相对丰度最低,为49.71%,与WLD和TC8a、TC12a差异显著(P<0.05)。此外,4个样地的担子菌门Basidiomycota、被孢霉门Mortierellomycota以及TC3a、TC8a人工林的壶菌门Chytridiomycota、罗兹菌门Rozellomycota、球囊菌门Glomeromycota、芽枝霉门Blastocladiomycota的真菌相对丰度均超过1%,是土壤中的主要真菌群落。其中,在主要真菌群落中,TC12a土壤中担子菌门相对丰度最高,为9.39%,显著高于其他林龄和WLD样地(P<0.05)。而被孢霉门则以TC3a最高,为9.01%,显著高于其他林龄和WLD样地(P<0.05)。同时发现,GS01是TC3a人工林中的特有菌门。
从属水平看,4个样地土壤中前10位细菌属的相对丰度占比为15.18%~22.22%,前30位占比为25.74%~34.81%(图3)。其中,unidentified_Chloropla、大肠杆菌志贺菌属Escherichia-Shigella、unidentified_Actinomarinales 3个属是4个样地共有的优势属,相对丰度为1.51%~6.36%。此外,WLD样地中Candidatus_ Entotheonella、Subdoligranulum 2个菌属,TC3a土壤中Candidatus_Entotheonella、链霉菌属Streptomyces、巨单胞菌属Megamonas、Subdoligranulum 4个菌属,TC8a土壤中Candidatus_Entotheonella、Subdoligranulum、Candidatus_Nitrocosmicus 3个菌属以及TC12a土壤中海洋杆菌属Pontibacter 1个菌属的相对丰度占比较高,均超过1%,也是土壤细菌群落的优势菌属。而土壤真菌群落中,4个样地土壤中前10位真菌属群落的相对丰度占比差异较大,WLD样地中相对丰度为52.56%,TC3a为33.21%,TC8a为62.59%,TC12a为77.19%,各样地间差异显著(P<0.05)。其中,TC8a和TC12a样地相对丰度均显著高于WLD(P<0.05),而TC3a相对丰度则显著低于WLD(P<0.05)。此外,TC3a土壤中镰刀菌属Fusarium丰度占比为10.81%,被孢霉菌属Mortierella占比为8.91%,Brachyphoris占比为8.06%,这3种菌属是优势菌属;而TC8a土壤中蓝状菌属Talaromyces为优势菌属,占比为39.13%;TC12a土壤中木霉菌属Trichoderma为优势菌属,占比为66.37%;WLD土壤中木霉菌属和镰刀菌属2种菌属为优势菌属,占比分别为19.98%和13.22%。
3.3.2 土壤微生物Beta多样性分析
从属水平对各样品进行PCA分析发现,4个样地土壤样品间距离相对较远,且细菌和真菌群落组成具有明显差异(图4)。细菌PC1和PC2对样品差异的贡献值分别为23.73%和15.16%,真菌PC1和PC2对样品差异的贡献值分别为20.03%和15.91%。从样品分布位置来看,细菌群落中TC3a主要聚集在PC1正端、PC2负端,TC8a主要聚集在PC1负端、PC2正端,TC12a主要聚集在PC1负端、PC2负端,而WLD主要聚集在PC1负端、PC2正端;而在真菌群落中,TC3a主要聚集在PC1正端、PC2正端,TC8a主要聚集在PC1负端、PC2负端,TC12a和WLD主要聚集在PC1负端、PC2负端。

3.4 不同林龄柽柳林土壤养分的变化
由表6可知,不同林龄柽柳人工林土壤养分含量变化存在差异,OC和TK是土壤中主要的养分组成部分,含量分别为4.90~11.03 g·kg-1和14.69~22.65 g·kg-1,而TN和全TP含量相对较低,各龄级土壤化学性质均表现为TC12a>TC8a>TC3a>WLD。其中,OC、AN、AP和AK含量在不同样地间均差异显著(P<0.05),TN、TP含量在TC12a、TC8a与WLD间差异显著(P<0.05),TK含量在3种林龄与WLD间差异显著(P<0.05)。C/N以TC12a柽柳林地最高,C/P、N/P则以TC8a样地最高,其中3种林龄的C/N、C/P与WLD差异显著(P<0.05)。
3.5 环境因子对不同林龄柽柳林土壤微生物群落结构的影响
通过RAD分析(图5)得出,不同林龄间土壤微生物群落明显分开,林龄增长导致林地土壤微生物群落结构出现明显变化。细菌群落中第1轴(RDA1)和第2轴(RDA2)特征值分别为33.54%和21.71%,而真菌群落中第1轴和第2轴特征值分别为44.43%和22.39%,共同解释了土壤细菌和真菌群落总变异的55.25%和66.82%。其中,细菌群落中TN(r=0.501 6、P=0.047 0)、AN(r=0.568 8、0.026 0)和真菌群落中TDS(r=0.523 3、P=0.026 0)、OC(r=0.530 4、P=0.028 0)、TN(r=0.537 9、P=0.023 5)、TP(r=0.512 9、P=0.033 0)分别为影响细菌和真菌群落变化的主要环境因子。

细菌群落属水平丰度前35位的Spearman相关性分析(图6)表明,土壤TDS与Skermanella呈显著负相关,与Subgroup_10呈极显著负相关,与Adhaeribacte呈极显著正相关;OC、TN、TP、TK、AN、AP和AK均与Subgroup_10呈极显著正相关,与Adhaeribacte呈极显著负相关。此外OC与RB41呈极显著正相关,OC、TN与Skermanella呈显著正相关,与假单胞菌属Pseudomonas、unidentified_Chloroplast呈显著负相关;TP与 Skermanella、RB41呈显著正相关,与unidentified_ Actinomarinales呈显著负相关;TK与unidentified_ Actinomarinales呈极显著负相关。
真菌群落属水平丰度前35位的Spearman相关性分析(图6)得出,TDS与f_Diversisporaceae.g_ unidentified、Boubovia、unidentified_Rozellomycota_ sp、Emericellopsis、被孢霉菌属Mortierella呈显著负相关,与Pseudocosmospora呈极显著负相关,与赤霉菌属Gibberella和木霉菌属Trichoderma呈显著正相关,与布氏白粉菌属Blumeria呈极显著正相关;OC、TN与f_Diversisporaceae.g_unidentified、Pseudocosmospora呈极显著正相关,与Boubovia、unidentified_Rozellomycota_sp、Emericellopsis呈显著正相关,与布氏白粉菌属呈极显著负相关,与木霉菌属呈显著负相关;土壤TP、TK与Emericellopsis呈极显著正相关,与Pseudocosmospora呈显著正相关,与布氏白粉菌属呈极显著负相关,与木霉菌属呈显著负相关;AN、AP与Pseudocosmospora呈极显著正相关,AP、AK与f_ Diversisporaceae.g_unidentified呈极显著正相关,而AN、AP和AK与布氏白粉菌属均呈极显著负相关;AN、AP和AK与unidentified_Rozellomycota_ sp和被孢霉菌属均呈显著正相关。

4 讨论与结论
4.1 讨 论
土壤微生物是土壤生态系统的关键组成部分之一,微生物的数量和多样性对整个土壤生态系统的功能和稳定性都具有极其重要的指示作用[29]。本研究中,柽柳人工林土壤细菌群落组成种类在各分类水平上均显著高于真菌的群落组成。而韦恩图也表明,不同样地土壤中共有细菌OTUs为1 907个,而共有真菌OTUs为321个,各龄级之间土壤微生物数量均表现为细菌高于真菌,且细菌具有绝对优势,这可能是黄河三角洲地区土壤多为盐碱地,同时林木生长所分泌的糖和淀粉为细菌提供了充足的食物来源[30],该环境条件下更有利于细菌的生长繁殖,从而导致细菌的组成和数量显著高于真菌,这与河西走廊盐碱土[31]、西北荒漠盐碱土[32]及环渤海地区盐碱地[33]土壤微生物的分布规律一致。同时,本研究中3个柽柳林地土壤表层总盐含量相对较高,达到了3.33~3.51g·kg-1。这一方面可能与土样采集的时间有关,本研究土样采于9月中旬,降水相对减少,而地表水分蒸发强烈,从而一定程度上造成了土壤返盐。另一方面与柽柳作为泌盐植物有关,通过根系吸收土壤中的盐分并富集在叶片,再以凋落物的形式完成盐分的归还,从而增加了土壤表层的盐分含量[34]。这种盐分的再分配在一定程度上导致了土壤盐分的异质性,这可能也是造成本研究中不同林龄土壤微生物变化不规律的原因之一。
森林生态系统中土壤微生物的多样性和群落组成受林龄、土壤环境和林下植被多样性等多种因素影响[35-36]。本研究中,林龄对土壤细菌和真菌群落α多样性的影响有限,其中细菌Chao1指数、ACE指数和Shannon指数表现为8 a>3 a>12 a,而真菌Shannon指数和Simpson指数则表现为3 a>8 a>12 a,造成这一结果的原因可能与林分郁闭度有关。通常在人工林生态系统中,幼龄或中龄阶段林分尚未郁闭,林下灌木层和草本层物种多样性总体上呈现上升趋势,林下物种多样性相对较高。而随着林龄的增加,林分逐渐郁闭,从而导致林下物种多样性下降[37]。因此,不同柽柳人工林演变中林下植物群落结构和多样性的差异可能是影响林下土壤微生物群落多样性发生差异的主要因素之一。此外,土壤理化性质的差异可能也是导致不同林龄土壤微生物多样性变化的重要原因[11]。通常情况下,每种土壤微生物都有最适合自身生存的土壤环境,因此土壤温湿度、含盐量及养分的微小差异都可能影响微生物的生长和死亡,从而影响菌群的丰富度和多样性。
在门水平上,黄河三角洲柽柳人工林及无林地共检测出细菌58~80门、真菌13~15门,表明细菌在该地区柽柳人工林土壤微生物群落中占据支配地位,且林龄的增加总体上提高了土壤微生物菌群的丰度。在细菌群落中,优势菌门为变形菌门、unidentified_Bacteria、厚壁菌门和拟杆菌门,这4类细菌优势菌门占细菌总丰度的60%以上,此外,蓝藻菌门、酸杆菌门、放线菌门的相对丰度均超过1%,是土壤中的主要细菌群落,这与该区域其他树种主要优势细菌群落组成基本一致[38-39]。有研究表明,变形菌门、拟杆菌门、放线菌门等细菌是不同研究区普遍存在的类群,这应该与此类细菌类型的生态幅较宽、其分布受环境和植被类型的影响较小有关[40]。此外,酸杆菌门在自然环境中同样十分常见,但多难以培养,可降解植物纤维素等大分子聚合物[41]。本研究中酸杆菌门作为主要优势群落,可能与柽柳凋落物中木质素和纤维素含量较高、分解慢有重要关系。有研究表明,盐生环境下720 d柽柳凋落物木质素呈逐渐释放过程,残留率为52.24%,而纤维素则表现出先累积后释放的过程,残留率达到了177.87%[42]。此外,其他细菌群落组成上的差异应该是受到不同生境的环境因素(土壤含盐量、含水量等)等差异所造成的[43]。而真菌群落中主要菌门为子囊菌门、担子菌门和被孢霉菌门,这可能与柽柳人工林林下存在大量凋落物需要分解有关。有研究表明,真菌是生态系统中重要的分解者,其中子囊菌门大多为腐生菌,是土壤中重要的分解者,而担子菌门在降解土壤中高木质素含量的植物凋落物方面起着重要作用[43-44]。在属水平上,细菌群落中的海洋杆菌在12年生柽柳土壤中丰度较高,该菌属是氯化合物去除的主要贡献者,是低盐区土壤中的优势菌属[45],说明随着林龄的增加林地盐分得到了改善。链霉菌属在3年生柽柳土壤中丰度较高,它是参与土壤磷循环的重要细菌,有显著分解难溶性无机磷矿物质的功能[46]。而真菌群落中的木霉菌属,可加速对土壤中纤维素和半纤维素等较难分解的固态底物的分解[46],此外篮状菌属也是自然界中重要的分解者,这3种菌属分别在3种林龄土壤中丰度较高,说明不同时期参与枯落物的分解菌属存在差异,这可能原因是随着林龄的增加林下植被以及枯落物层逐渐增多,引起土壤微生物菌属生存的微生境发生了改变,从而导致了林龄间优势菌属的差异。PCA分析结果证实,林龄是影响土壤微生物物种组成的重要因素。本研究中4个样地土壤样品间距离相对较远,林龄增长导致林地土壤微生物群落结构出现明显变化,且细菌和真菌群落组成具有明显差异。
林龄的增长会对土壤性质和养分状况产生一定的影响,从而也会造成土壤微生物组成也随之变化[47]。在以盐碱土壤为主的黄河三角洲3种林龄类型中表现更为明显,本研究中,除全钾含量外,林龄的增长显著提高了土壤中其他养分含量,同时土壤性质也解释了土壤细菌55.25%和真菌66.82%的变化,这表明土壤微生物群落的组成变化与土壤性质有密切的相关性。RAD分析表明,土壤全氮、铵态氮含量是细菌群落最主要的影响因素,土壤盐分、有机碳、全氮和全磷含量是影响真菌群落最主要因素。Yuan等[48]也发现土壤铵态氮是影响表层土壤细菌群落的主要环境因子,说明土壤氮组分在细菌群落结构形成中起着重要作用。此外,细菌群落全氮、铵态氮与Skermanella呈显著正相关,而Skermanella属典型的生物固氮菌,在盐渍化土壤中,生物固氮极其重要,固氮微生物的增加可使得土壤氮素养分含量提高[32]。土壤真菌群落主要受有机碳、全氮和全磷的影响,这一结果与赵盈涵等[49]的研究结果基本一致。真菌在土壤中具有腐生性,是土壤氮、碳循环中的主要动力,其代谢产物在生态系统碳汇、土壤质地和土壤肥力提升方面均发挥了重要作用。
需要指出的是,本研究中3种林龄柽柳人工林正处于中、幼龄阶段,未涵盖整个龄组,对土壤质量和土壤微生物群落结构及多样性的影响在时间尺度上具有一定的局限性。其次,本研究采样时间集中在秋季,受外界环境影响,土壤中微生物群落可能也存在一定差异。今后有必要对不同龄组间土壤微生物群落结构和多样性的演变进行跟踪研究,并分析不同季节土壤微生物群落结构变化特征和影响因子,为充分了解盐碱区柽柳人工林土壤质量的动态变化提供科学参考。
4.2 结 论
柽柳人工林促进了土壤微生物的富集,改善了盐碱地土壤理化性质,但随着林龄的增加,土壤微生物多样性及群落结构群落的变化存在不规律性。其中,林龄对土壤细菌和真菌群落多样性的影响
有限,细菌Chao1指数、ACE指数和Shannon指数以8年生柽柳最高,12年生柽柳最小,而真菌Shannon指数和Simpson指数则以3年生柽柳最高。细菌的群落组成数量在门、纲、目、科、属水平上与真菌均差异显著(P<0.05),细菌在各个分类水平上均表现为TC12a>TC8a>TC3a>WLD,而真菌则表现不规律。不同林龄柽柳土壤微生物优势群落和主要群落组成基本一致,但在相对丰度上存在一定差异。林龄的增长提高了土壤养分含量,同时土壤性质也解释了土壤细菌和真菌群落总变异的55.25%和66.82%。此外,细菌群落中土壤全氮、铵态氮和真菌群落中盐分、有机碳、全氮、全磷分别是影响细菌和真菌群落变化的主要环境因子。
参考文献:
[1] 刘桂民,陈苗苗,李存华,等.黄河三角洲盐碱地人工林土壤肥力质量的综合评价[J].东北林业大学学报,2017,45(10):6-9. LIU G M, CHEN M M, LI C H, et al. Soil fertility quality for different plantations in the coastal saline land of the Yellow River Delta[J]. Journal of Northeast Forestry University,2017,45(10): 6-9.
[2] 杜振宇,邢尚军,马海林,等.黄河三角洲刺槐人工林生态服务价值动态分析[J].山东林业科技,2013(4):22-27,46. DU Z Y, XING S J, MA H L, et al. Dynamic analysis of ecosystem service value for long-term plantations of black locust in the Yellow River Delta[J]. Shandong Forestry Science and Technology,2013(4):22-27,46.
[3] 郑万钧.中国树木志:第2卷[M].北京:中国林业出版社, 1985. ZHENG W J. Flora of China: Volume 2[M]. Beijing: China Forestry Publishing House,1985.
[4] HAO X M, CHEN Y N, LI W H. Indicating appropriate groundwater tables for desert river-bank forest at the Tarim River, Xinjiang, China[J]. Environmental Monitoring and Assessment, 2009,152:167-177.
[5] 单奇华,张建锋,阮伟建,等.滨海盐碱地土壤质量指标对生态改良的响应[J].生态学报,2011,31(20):6072-6079. SHAN Q H, ZHANG J F, RUAN W J, et al. Response of soil quality indicators to comprehensive amelioration measures in coastal salt-affected land[J]. Acta Ecologica Sinica,2011,31(20): 6072-6079.
[6] 封晓辉,张秀梅,刘小京,等.滨海重盐碱地人工栽植柽柳生长动态及生态效应[J].中国生态农业学报,2013,21(10):1233-1240. FENG X H, ZHANG X M, LIU X J, et al. Growth dynamics of Tamarix chinensis plantations in heavy-saline coastal lands and related ecological effects[J]. Chinese Journal of Eco-Agriculture, 2013,21(10):1233-1240.
[7] 卫雨西,陈丽娟,冯起,等.干旱区盐碱土微生物特征及其影响因素研究进展[J].中国沙漠,2024,44(3):18-30. WEI Y X, CHEN L J, FENG Q, et al. Progress on microbial characteristics in arid salt-affected soils and related factors[J]. Journal of Desert Research,2024,44(3):18-30.
[8] 戴雅婷,闫志坚,解继红,等.基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究[J].土壤学报,2017,54(3): 735-748. DAI Y T, YAN Z J, JIE J H, et al. Soil bacteria diversity in rhizophere under two types of vegetation restoration based on high throughput sequencing[J]. Acta Pedologica Sinica,2017,54(3): 735-748.
[9] 黄从德,张国庆.人工林碳储量影响因素[J].世界林业研究, 2009,22(2):34-38. HUANG C D, ZHANG G Q. Impact factors of carbon sequestration in artificial forest carbon stock and its impact factors[J]. World Forestry Research,2009,22(2):34-38.
[10] ZHONG Z K, ZHANG X Y, WANG X, et al. Soil bacteria and fungi respond differently to plant diversity and plant family composition during the secondary succession of abandoned farmland on the Loess Plateau, China[J]. Plant and Soil,2020,448(1): 183-200.
[11] 张胜男,闫德仁,黄海广,等.不同林龄沙地樟子松人工林土壤微生物群落结构[J].中南林业科技大学学报,2023,43(1): 123-131,143. ZHANG S N, YAN D R, HUANG H G, et al. The soil microbial community structure in the Pinus sylvestris var. mongolica plantations of different ages[J]. Journal of Central South University of Forestry & Technology,2023,43(1):123-131,143.
[12] 马义淑,曹亚鑫,牛敏,等.太岳山不同林龄人工油松林土壤微生物特征[J].环境科学,2024,45(4):2406-2416. MA Y S, CAO Y X, NIU M, et al. Investigation of soil microbial characteristics during stand development in Pinus tabuliformis forest in Taiyue Mountain[J/OL]. Environmental Science, 2024,45(4):2406-2416.
[13] SHILLAM L, HOPKINS D W, BADALUCCO L, et al. Structural diversity and enzyme activity of volcanic soils at different stages of development and response to experimental disturbance[J]. Soil Biology and Biochemistry,2008,40:2182-2185.
[14] ADAIR K L, WRATTEN S, LEAR G. Soil phosphorus depletion and shifts in plant communities change bacterial community structure in a long-term grassland management trial[J]. Environmental Microbiology Reports,2013,5:404-413.
[15] 牛小云,孙晓梅,陈东升,等.辽东山区不同林龄日本落叶松人工林土壤微生物?养分及酶活性[J].应用生态学报, 2015,26(9):2663-2672. NIU X Y, SUN X M, CHEN D S, et al. Soil microorganisms, nutrients and enzyme activity of Larix kaempferi plantation under different ages in mountainous region of eastern Liaoning province, China[J]. Chinese Journal of Applied Ecology,2015,26(9): 2663-2672.
[16] 彭辉,周红敏,张弓乔,等.不同林龄红豆树土壤真菌群落组成和多样性[J].中南林业科技大学学报,2021,41(11):129-135. PENG H, ZHOU H M, ZHANG G Q, et al. Composition structure and diversity of soil fungi community in Ormosia hosiei plantations at different ages[J]. Journal of Central South University of Forestry & Technology,2021,41(11):129-135.
[17] 蔡锰柯,韩海荣,程小琴,等.山西太岳山不同林龄华北落叶松林土壤微生物群落结构特征[J].北京林业大学学报, 2022,44(5):86-93. CAI M K, HAN H R, CHENG X Q, et al. Characteristics of soil microbial community structure with different plantation ages in larch forest in Taiyue Mountain of Shanxi province, northern China[J]. Journal of Beijing Forestry University,2022,44(5): 86-93.
[18] 李永涛,李宗泰,王振猛,等.滨海盐碱区不同林龄柽柳人工林土壤水分物理性质差异性[J].东北林业大学学报, 2018,46(9):75-79. LI Y T, LI Z T, WANG Z M, et al. Soil water-physical properties of Tamarix chinensis plantations with different ages in the coastal saline-alkali region[J]. Journal of Northeast Forestry University,2018,46(9):75-79.
[19] 陈萍,夏江宝,王善龙,等.黄河三角洲滨海滩涂不同密度柽柳林的土壤盐碱与养分特征[J].生态学报,2022,42(24):10180-10190. CHEN P, XIA J B, WANG S L, et al. Variations in soil salinity and nutrient contents of Tamarix chinensis with different densities on the beach of the Yellow River Delta[J]. Acta Ecologica Sinica, 2022,42(24):10180-10190.
[20] 李永涛,王霞,王振猛,等.黄河三角洲不同林龄人工柽柳林生长季土壤微生物与土壤呼吸特征研究[J].中南林业科技大学学报,2019,39(2):86-92. LI Y T, WANG X, WANG Z M, et al. Soil microorganism and soil respiration characteristics of Tamarix chinensis plantations of different ages in the Yellow River Delta during the growing season[J]. Journal of Central South University of Forestry & Technology, 2019,39(2):86-92.
[21] CAPORASO J G, LAUBER C L, WALTERS W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(Suppl.1): 4516-4522.
[22] BERG J, BRANDT K K, AL-SOUD W A, et al. Selection for Cu-tolerant bacterial communities with altered composition, but unaltered richness, via long-term Cu exposure[J]. Applied and Environmental Microbiology,2012,78(20):7438-7446.
[23] ZHAO S, LIU D Y, LING N, et al. Bio-organic fertilizer application significantly reduces the Fusarium oxysporum population and alters the composition of fungi communities of watermelon Fusarium wilt rhizosphere soil[J]. Biology and Fertility of Soils,2014,50(5):765-774.
[24] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2008: 213-218. BAO S D. Soil agricultural chemistry analysis[M]. Beijing: China Agriculture Press,2008:213-218.
[25] MAGO? T, SALZBERG S L. Flash: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011,27(21):2957-2963.
[26] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods,2013,10(10): 996-998.
[27] ALTSCHUL S F, GISH W, MILLER W, et al. Basic local alignment search tool[J]. Journal of Molecular Biology,1990, 215(3):403-410.
[28] K?LJALG U, NILSSON R H, ABARENKOV K, et al. Towards a unified paradigm for sequence-based identification of fungi[J]. Molecular Ecology,2013,22(21):5271-5277.
[29] CAO Y S, FU S L, ZOU X M, et al. Soil microbial community composition under Eucalyptus plantations of different age in subtropical China[J]. European Journal of Soil Biology, 2010,46(2):128-135.
[30] KRAJICK K. Living the high life: the mountain top environment of the Andes harbors a Noah’s ark of previously undocumented species[J]. Natural History,2006,115(7):44-55.
[31] 牛世全,龙洋,李海云,等.应用Illumina MiSeq高通量测序技术分析河西走廊地区盐碱土壤微生物多样性[J].微生物学通报,2017,44(9):2067-2078. NIU S Q, LONG Y, LI H Y, et al. Microbial diversity in saline alkali soil from Hexi Corridor analyzed by Illumina MiSeq high-throughput sequencing system[J]. Microbiology China, 2017,44(9):2067-2078.
[32] 杨惠婷,冷小云,石春芳.盐碱化土壤细菌群落研究进展[J].环境科学与技术,2021,44(6):230-236. YANG H T, LENG X Y, SHI C F. Research progress on bacterial communities in saline-alkali soil[J]. Environmental Science & Technology,2021,44(6):230-236.
[33] 张婷,周成,石爱丽,等.环渤海地区盐碱地土壤微生物多样性研究[J].北方园艺,2022(23):83-89. ZHANG T, ZHOU C, SHI A L, et al. Study on soil microbial diversity in saline-alkali land around the Bohai sea[J]. Northern Horticulture,2022(23):83-89.
[34] 许婕,陈永金,刘加珍.盐生植物灌丛对土壤养分和盐分空间分布的影响及其机制研究进展[J].安徽农业科学,2020,48(1): 19-23,69. XU J, CHEN Y J, LIU J Z. Research progress of the effects of halophyte shrubs on spatial distribution of soil nutrients and salts and their mechanisms[J]. Journal of Anhui Agricultural Sciences, 2020,48(1):19-23,69.
[35] 张诗雨,张润,牛喜妹,等.长白山森林不同演替阶段土壤微生物群落结构[J].环境生态学,2024,6(1):89-93,102. ZHANG S Y, ZHANG R, NIU X M, et al. Structure of soil microbial community at different succession stages of forest in Changbai Mountains[J]. Environmental Ecology,2024,6(1): 89-93,102.
[36] ZHU W Z, CAI X H, LIU X L, et al. Soil microbial population dynamics along a chronosequence of moist evergreen broadleaved forest succession in southwestern China[J]. Journal of Mountain Science,2010,7(4):327-338.
[37] 胡方伟.退化马尾松森林恢复过程中群落结构与土壤微生物多样性研究[D].合肥:安徽农业大学,2020. HU F W. Research on community structure and soil microbial diversity during recovery process of degraded masson pine (Pinus massoniana) forest[D]. Hefei: Anhui Agricultural University, 2020.
[38] 丁新景,黄雅丽,敬如岩,等.基于高通量测序的黄河三角洲4种人工林土壤细菌结构及多样性研究[J].生态学报,2018, 38(16):5857-5864. DING X J, HUANG Y L, JING R Y, et al. Bacterial structure and diversity of four plantations in the Yellow River Delta by highthroughput sequencing[J]. Acta Ecologica Sinica,2018,38(16): 5857-5864.
[39] 龚远博.杜梨人工林土壤微生物群落结构与菌根化杜梨苗耐盐碱胁迫机制研究[D].泰安:山东农业大学,2022. GONG Y B. Study on soil microbial community structure of Pyrus betulifolia plantation and the mechanism of salt and alkali tolerance of arbuscular mycorrhizal Pyrus betulifolia seedlings[D]. Taian: Shandong Agricultural University,2022.
[40] 滕嘉玲,贾荣亮,赵芸.沙埋对干旱沙区真藓结皮层细菌群落结构和多样性的影响[J].生态学报,2017,37(7):2179-2187. TENG J L, JIA R L, ZHAO Y. Impact of sand burial on bacterial community structure and diversity within biocrusts dominated by Bryum argenteum[J]. Acta Ecologica Sinica,2017,37(7):2179-2187
[41] 魏志文,李韵雅,江威,等.无锡地区常见树木根际土壤酸杆菌多样性[J].生态学杂志,2018,37(9):2649-2656. WEI Z W, LI Y Y, JIANG W, et al. Diversity of Acidobacteria in rhizosphere soils of common trees in Wuxi[J]. Chinese Journal of Ecology,2018,37(9):2649-2656.
[42] 杨晶晶,吕瑞恒,梁继业,等.塔里木盆地盐生和干旱生境柽柳(Tamarix)凋落物分解特征[J].中国沙漠,2020,40(1): 215-222. YANG J J, Lü R H, LIANG J Y, et al. Decomposition characteristics of Tamarix litter in different habitats of Tarim Basin[J]. Journal of Desert Research,2020,40(1):215-222.
[43] GE Z, LI S, BOL R, et al. Differential long-term fertilization alters residue-derived labile organic carbon fractions and the microbial community during straw residue decomposition[J]. Soil and Tillage Research,2021.DOI:10.1016/j.still.2021.105120.
[44] 周玉杰,李建华,张广宇,等.基于高通量测序的橡胶林土壤真菌多样性及群落组成分析[J].南方农业学报,2018,49(9): 1729-1735. ZHOU Y J, LI J H, ZHNG G F, et al. Analysis of soil fungal diversity and community composition of rubber plantations based on high-throughput sequencing[J]. Journal of Southern Agriculture, 2018,49(9):1729-1735.
[45] 王焓屹,王瑞菲,钟玮,等.黄河三角洲湿地土壤中功能微生物群落的结构特征和影响因素研究进展[J].湿地科学, 2022,20(1):111-118. WANG H Y, WANG R F, ZHONG W, et al. Advance in structural characteristics and influence factors of functional microbial communities in the soils of the wetlands in the Yellow River Delta[J]. Wetland Science,2022,20(1):111-118.
[46] 颜培,杜远达,姜爱霞,等.黄河三角洲土壤真菌群落结构及互作网络对盐度的响应[J].分子植物育种,2021,19(11):3818-3828. YAN P, DU Y D, JIANG A X, et al. Response of soil fungal community structures and interaction networks to salinity in the Yellow River Delta[J]. Molecular Plant Breeding,2021,19(11): 3818-3828.
[47] LIU Y, FANG Y, AN S S. How C:N:P stoichiometry in soils and plants responds to succession in Robinia pseudoacacia forests on the Loess Plateau, China[J/OL]. Forest Ecology and Management,2020,475:118394. https://doi.org/10.1016/j.foreco.
[48] YUAN Y L, SI G C, WANG J, et al. Bacterial community in alpine grasslands along an altitudinal gradient on the Tibetan Plateau[J]. Fems Microbiology Ecology,2014,87(1):121-132.
[49] 赵盈涵,李田,邵鹏帅,等.黄河三角洲不同类型盐生植物土壤真菌群落结构特征[J].西北植物学报,2022,42(5):854-864. ZHAO Y H, LI T, SHAO P S, et al. Structural characteristics of fungi communities in soil of different halophytes in the Yellow River Delta[J]. Acta Botanica Boreali-Occidentalia Sinica, 2022,42(5):854-864.
[本文编校:谢荣秀]

