R∶FR值对盐胁迫下银杏幼苗生长及光合生理的影响
摘 要:【目的】设置不同比例红光与远红光环境,研究其对盐胁迫下银杏幼苗生长及光合特性的影响,为深入探究通过光质调节提高银杏抗盐性的机制提供理论依据。【方法】以当年生银杏实生苗为研究对象,设置4个处理,分别为对照CK(0 NaCl,红光与远红光之比为7,即R∶FR=7)、T1(0.3% NaCl,R∶FR=7)、T2(0.3% NaCl,R∶FR=1.2)、T3(0.3% NaCl,R∶FR=0.8),测定处理14、28、42 d的光合色素含量及相对电导率,于42 d试验结束时测定生长指标、叶片形态和光合指标,分析R∶FR值对盐胁迫下银杏幼苗生长发育及光合能力的影响。【结果】与CK相比,T1、T2处理下银杏幼苗各生长指标均显著下降,T3处理下银杏幼苗叶片鲜、干质量相较T1处理有显著提升。叶片形态参数中,各盐处理相较CK叶面积、叶片周长、叶宽及叶长均出现下降,T1处理下降幅度最大;随着R∶FR值的降低,盐胁迫对银杏幼苗叶片生长抑制减轻。随着胁迫时间的延长,各盐处理的叶片相对电导率均呈上升趋势,T3处理上升幅度最小。不同处理下银杏幼苗叶片叶绿素a(Chla)、类胡萝卜素(Car)和叶绿素a/b(Chla/b)随时间变化总体呈现先降后升的趋势,而叶绿素b(Chlb)和总叶绿素(Chla+b)则呈现相反的变化趋势;各处理组Chla+b含量整体表现为CK>T3>T2>T1,处理42 d后,不同处理间Chla/b表现为CK>T3>T1>T2。光合气体交换参数及光响应曲线特征参数中,T3处理下叶片净光合速率(Pn)、最大净光合速率(Pn,max)及内禀量子效率(φ0)相较CK无显著差异,相较T1处理显著升高;随着光环境中R∶FR值的降低,盐胁迫下银杏幼苗暗呼吸速率(Rd)、光补偿点(Ic)显著提升。【结论】随着光环境中R∶FR值的降低,盐胁迫对银杏幼苗的生长、膜系统的损伤、呼吸及光合特性的抑制作用得到了有效缓解;且当R∶FR为0.8时,光合性能得到显著提升,缓解效果最佳。
关键词:银杏;盐胁迫;红光与远红光;光合作用;光响应曲线
中图分类号:S792.95;S718.43 文献标志码:A 文章编号:1673-923X(2024)09-0071-09
基金项目:江苏省科技计划(资金)项目(BE2021367)。
Effect of R∶FR ratio on the growth and photosynthetic physiology of Ginkgo biloba seedlings under salt stress
ZHAO Huiqin1, MA Wuzhen1, WANG Gaiping1, ZHAI Jinting2, ZHAO Qun1, WANG Zheng1
(1. Co-Innovation Center for the Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, Jiangsu, China; 2. Jiangsu Yancheng Forest Farm, Yancheng 224057, Jiangsu, China)
Abstract:【Objective】Establishing varied ratios of red light to far-red light environments to investigate their impact on the growth and photosynthetic characteristics of Ginkgo biloba seedlings under salt stress. This study aims to provide a theoretical basis for a deeper understanding of the mechanisms underlying improved salt tolerance in G. biloba through light quality regulation.【Method】The experiment used one-year-old Ginkgo seedlings as the research subjects and had four treatments: CK (0 NaCl, R∶FR=7), T1 (0.3% NaCl, R∶FR=7), T2 (0.3% NaCl, R∶FR=1.2), and T3 (0.3% NaCl, R∶FR=0.8). Measurements of chlorophyll content and relative conductivity were taken at 14, 28, and 42 days of treatment. Measure growth indicators, leaf morphology, and photosynthetic parameters at the end of the 42-day experiment. Analyzing the effects of R∶FR ratio on the growth, development, and photosynthetic capacity of Ginkgo seedlings under salt stress.【Result】Compared with CK, various growth indicators of Ginkgo seedlings under T1 and T2 treatments significantly decreased. However, under the T3 treatment, the fresh and dry mass of Ginkgo seedling leaves increased significantly compared to T1. In terms of leaf morphology parameters, all salt-treated groups showed a decrease in leaf area, leaf perimeter, leaf width, and leaf length compared to CK, with T1 showing the greatest decrease. As the R∶FR ratio decreased, the inhibitory effect of salt stress on leaf growth in Ginkgo seedlings decreased. With increasing stress duration, the relative conductivity of leaves in all salt-treated groups showed an upward trend, with the smallest increase observed in the T3 treatment group. Regarding the changes in chlorophyll a (Chla), carotenoids (Car), chlorophyll a/b (Chla/b), chlorophyll b (Chlb), and total chlorophyll (Chla+b) content in Ginkgo seedling leaves under different treatments over time, they generally exhibited a trend of initially decreasing and then increasing, while Chlb and Chla+b showed the opposite trend. The overall trend in Chla+b content among different treatments was CK>T3>T2>T1. At 42-day, the Chla/b ratio among treatments was CK>T3>T1>T2. In terms of photosynthetic gas exchange parameters and characteristics of the light response curve, under the T3 treatment, the net photosynthetic rate (Pn), maximum net photosynthetic rate (Pn,max), and intrinsic quantum efficiency (φ0) of leaves showed no significant difference compared to CK but were significantly higher than T1. As the R∶FR ratio decreased in the light environment, the dark respiration rate (Rd) and light compensation point (Ic) of Ginkgo seedlings under salt stress significantly increased.【Conclusion】The inhibitory effect of salt stress on the growth, membrane system damage, respiration, and photosynthetic characteristics of Ginkgo seedlings was effectively alleviated as the R∶FR ratio decreased in the light environment. Furthermore, when the R∶FR ratio was 0.8, there was a significant improvement in photosynthetic performance, indicating the most effective alleviation effect.
Keywords: Ginkgo biloba; NaCl stress; red light and far-red light; photosynthesis; light response curve
银杏Ginkgo biloba是我国特有的多用途生态经济树种,其叶提取物广泛应用于预防及治疗心脑血管疾病、抗肿瘤等药用领域[1]。随着银杏叶提取物的深入研究与开发,国内外市场对银杏叶产量及质量的要求也不断提升。山东、江苏等地区的叶用银杏种植产业较为发达且集中[2],但滨海地区大面积的盐渍化土壤在很大程度上制约着叶用银杏产业的发展。盐渍化的土壤影响植物的形态建成和生长发育,导致作物产量和质量下降[3]。银杏对盐害具有一定的抗性,其幼树生长耐盐阈值约为0.4%NaCl[4];随着盐质量分数及胁迫时间的增加,渗透胁迫及离子过剩效应逐渐影响银杏碳同化进程,干扰其代谢,进而抑制生长,使树势衰弱[5]。传统的抗盐品种选育或喷施生长调节剂等方法对缓解银杏盐害具有一定效果,但仍存在培育周期长、成本高等问题,短时间难以实现大规模应用。因此,亟须寻找能够提高银杏抗盐能力的新型措施。
光除了驱动植物进行光合作用外,也是植物生长发育过程中重要的调节因子[6]。目前,人工光源补光等光质调控技术因其具有安全可靠、精准调控、无污染、易与光伏技术结合等优点,广泛应用于植物设施栽培[7]。近年来,有研究发现,给予植物适当比例的红光(R)与远红光(FR)处理,不仅能实现调控植株形态、光合产物分配等目的,还能够提高植物在生物及非生物胁迫中的抗逆性[8]。在番茄Solanum lycopersicum[9]、黄瓜Cucumis sativus[10]的研究中发现,低比例R∶FR能够有效提高盐胁迫下植物叶片PSⅡ反应中心活性、光合电子传递速率及光合色素含量,改善其光合气体交换能力,促进植物生长。孟力力等[11]发现在一定范围内降低光环境中的R∶FR值可以缓解光系统受到的损伤。Wang等[12]的研究则进一步揭示了R∶FR为0.8时的光质调控盐胁迫下提高番茄光合性能的分子机制。前人对银杏光质的研究多集中在生长及次生代谢物合成等方面,谢宝东等[13]通过研究发现,随着光质从自然光向着红光、黄光、绿光、蓝光逐渐变化时,黄酮含量逐渐增加;Wang等[14]发现蓝光可显著提高银杏幼苗生物量和黄酮醇的积累;而关于光质调控银杏抗逆性方面的研究报道较少。改变光环境中R∶FR的比例能否提高银杏的抗盐性以及不同R∶FR比例对盐胁迫下银杏生长生理有何影响尚不清楚。采取措施减轻植物的盐害作用,提高植物耐盐能力,其效果通常在植物光合性能中有所体现。为此,本研究拟通过设置不同比例红光与远红光环境,探究其对盐胁迫下银杏幼苗生长及光合特性的影响,以期为通过光质调节来提高银杏抗盐性的应用技术提供理论支持。
1 材料与方法
1.1 试验材料
供试材料为当年生半同胞银杏实生苗,2021年9月采种自南京林业大学下蜀实习林场(119°12′E,32°07′N),同年11月沙藏。翌年3月,银杏种子经浸种、催芽后,栽种于内径7.9 cm、高7.5 cm的塑料容器中,移至人工气候室培养,栽培基质为草炭、蛭石、珍珠岩(V∶V∶V=1∶1∶1)。基质中有机质含量为183.31 g/kg,全氮为5.99 g/kg,pH值为5.84。气候室白天光照12 h,冠层高度光照强度约250 μmol·m2·s-1,温度为(25±0.5)℃;夜间温度为(20±0.5)℃,全天相对湿度为85%。至7月,待其长出3~5片成熟叶时,筛选长势较好、生长状况相对一致的银杏幼苗进行试验处理(苗高,10.6 cm±1.5 cm;地径,3.3 mm±0.2 mm)。
1.2 试验设计
试验以NaCl溶液模拟次生盐渍化环境,分为4个处理组:T1,0.3% NaCl(占土壤干质量百分含量),R∶FR=7,即幼苗生长光环境下红光(R∶655~665 nm)与远红光(FR∶725~735 nm)辐射强度之比为7;T2,0.3% NaCl,R∶FR=1.2;T3,0.3% NaCl,R∶FR=0.8;CK,浇灌等体积清水代替NaCl溶液,R∶FR=7。每处理36株银杏幼苗,3次重复,同处理各单株幼苗受光一致,互不遮挡。光源选择以白光LED为对照,在此基础上,通过添加不同数量远红光LED灯管以实现对银杏幼苗生长光环境中R∶FR值的调节。利用植物光谱分析仪(HR-350,Hipoint,中国台湾)对冠层高度光照强度及光谱进行测定。不同光质处理与盐处理同时进行,基质与育苗时期一致,试验全程在人工气候室中开展,处理周期为42 d,培养至第14、28、42天时,进行光合色素、相对电导率的测定,在试验结束时测定形态指标及光合指标。
1.3 试验方法
1.3.1 生长指标
处理42 d后,每处理随机选取未经采样破坏的10株银杏幼苗作为10个生物学重复,用卷尺及游标卡尺测定其苗高、地径。之后将其分成根、茎、叶三部分,洗净后吸干表面水分,用电子天平分别称其鲜质量,105 ℃杀青5 min后,80 ℃烘至恒质量,再分别称其干质量。
1.3.2 叶片形态
处理42 d后,每处理随机选取未经采样破坏的银杏幼苗3株,每株选取3片成熟叶片,用叶面积测量仪(YMJ-D,托普云农,中国)对叶面积、叶片周长、叶宽、叶长、叶片长宽比进行测定。
1.3.3 相对电导率
分别处理14、28、42 d后,每处理随机选取9株银杏幼苗,将叶片采下洗净后擦干,用打孔器打取叶圆片,每10片为一组,设3次重复,进行相对电导率的测定。
1.3.4 光合色素含量
各处理于第14、28、42天分批取样,称取新鲜叶片0.1 g,加入95%乙醇提取液10 mL,浸提48 h至叶片完全变白后,测定其在665、649和470 nm下的吸光值,并计算叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chla+b)及类胡萝卜素(Car)的含量。
1.3.5 光合气体交换参数
处理42 d后,于9:00—12:00,每处理随机选取3株银杏幼苗,采用LI-6400(LI-COR,Lincoln,US)光合仪,测定幼苗中成熟叶片的光合气体交换参数,即叶片净光合速率(Pn)、胞间二氧化碳浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)。仪器测定时设置光强为250 μmol·m2·s-1,气体流速为300 μmol·s-1,叶温为25 ℃,CO2浓度为400 μmol·mol-1。
1.3.6 光响应曲线的测定
在光合气体交换参数测定结束后,利用LI-6400光合仪进行光响应曲线的测定,光强梯度设置为1 500、1 200、1 000、800、600、400、200、100、50、20、10和0 μmol·m2·s-1,其他系统参数与气体交换参数测定时一致。测定前,将幼苗放置在1 500 μmol·m2·s-1光强下适应20 min,待Pn值稳定后开始测定。利用直角双曲线修正模型[15]对试验结果进行拟合,并根据拟合结果得到最大净光合速率(Pn,max)、暗呼吸速率(Rd)、光补偿点(Ic)、光饱和点(Isat)、表观量子效率(φc0)、内禀量子效率(φ0)及光补偿点处的量子效率(φc)等特征参数。
1.4 数据处理与分析
采用SPSS 22.0统计软件进行单因素方差分析,采用新复极差法(Duncan)进行显著性检验,使用Origin绘图软件进行图表绘制。
2 结果与分析
2.1 不同R∶FR值对盐胁迫下银杏生长的影响
如表1所示,处理42 d后,与CK相比,T1处理下银杏幼苗的苗高、地径、总鲜质量与总干质量均显著下降(P<0.05),分别降低了14.81%、12.44%、21.62%、26.71%,表明盐胁迫显著抑制了银杏幼苗的生长;相比T1、T2处理,银杏幼苗各项生长指标均无显著差异(P>0.05),说明R∶FR为1.2的光质条件对盐胁迫下银杏生长的缓解效果不明显。T3处理下,银杏幼苗的苗高、总鲜质量及总干质量相比T1处理显著升高(P<0.05),分别提高了17.30%、25.06%、23.08%,其中,叶片鲜质量、干质量相比T1处理提高了35.92%、31.03%。与CK相比,T3处理下银杏幼苗的苗高、地径、总干质量差异均不显著(P>0.05),说明R∶FR为0.8的光质条件一定程度上缓解了盐胁迫对银杏幼苗生长的抑制作用。
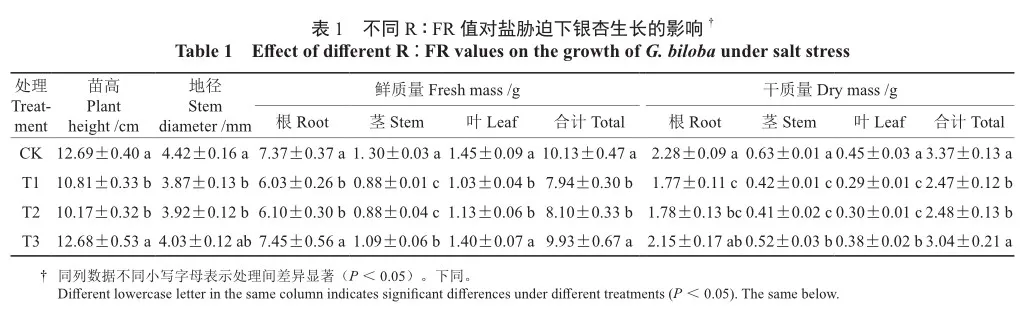
2.2 不同R∶FR值对盐胁迫下银杏叶片形态的影响
如表2所示,处理42 d后,与CK相比,T1处理下银杏幼苗的叶面积、叶片周长、叶宽、叶长及长宽比均存在不同程度下降,且除叶片长宽比外,下降均达到显著水平(P<0.05),分别降低了57.28%、42.09%、31.37%、41.38%、14.06%,这表明盐胁迫显著抑制了银杏幼苗叶片的发育(P<0.05)。在较低R∶FR值的光环境(T2和T3)下,相较于T1处理叶片各形态参数均有所提升,其中,T3处理相比于T1处理分别升高了73.38%、72.27%、25.33%、56.99%、25.45%。T3处理下,叶面积、叶片周长、叶长及长宽比相较CK均无显著差异(P>0.05)。综上,在一定程度上降低光环境中R∶FR值,能够有效减轻盐胁迫对银杏幼苗叶片发育造成的影响,并提高叶片长宽比,使叶片趋于细长。
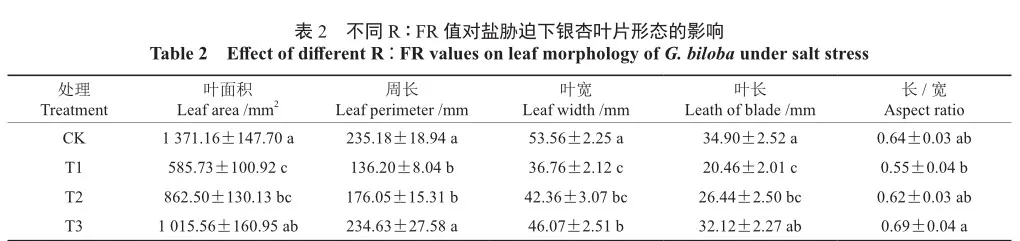
2.3 不同R∶FR值对盐胁迫下银杏相对电导率的影响
如图1所示,随着处理时间的延长,各盐处理组银杏幼苗叶片的相对电导率均呈现持续上升的趋势,其中T1处理的上升幅度最为明显,在处理后14、28、42 d的上升幅度均达到显著水平(P<0.05),而T2、T3处理的相对电导率与T1处理相比升高幅度较小。在处理42 d后,与CK对比,T1处理下的相对电导率升高了425.25%;与T1处理相比,T2、T3处理下的相对电导率均有显著下降(P<0.05),分别降低了42.21%、60.62%。综上,低R∶FR值处理能够降低盐胁迫下银杏幼苗叶片中的相对电导率。
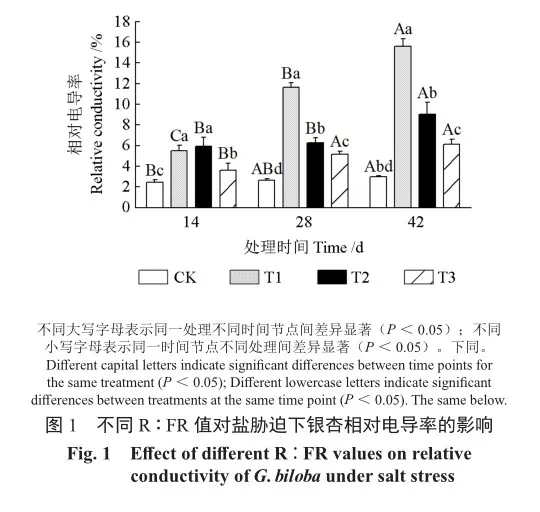
2.4 不同R∶FR值对盐胁迫下银杏光合色素的影响
如图2所示,随着处理时间的延长,不同处理间银杏幼苗叶片Chla、Chlb、Car、Chla+b含量和Chla/b均出现显著差异(P<0.05)。不同处理下银杏幼苗叶片Chla、Car和Chla/b总体呈现出先降后升的趋势,而Chlb和Chla+b则呈现出先小幅上升后下降的趋势。在盐胁迫处理42 d后,与CK相比,盐处理组银杏叶片的Chla、Chlb、Car、Chla+b含量均有显著下降(P<0.05),其中T1处理下降最为明显,分别降低了34.54%、25.71%、14.79%、30.34%,与T1处理对比,T3处理银杏叶片光合色素含量显著增加(P<0.05),其中Chla、Chlb和Chla+b分别升高了22.22%、19.23%、20.97%。处理42 d,不同处理间Chla/b呈现CK>T3>T1>T2的规律。

2.5 不同R∶FR值对盐胁迫下银杏叶片光合性能的影响
如表3所示,在处理42 d后,相较CK,T1处理下银杏幼苗叶片净光合速率(Pn)下降了37.97%;与T1处理相比,T3处理下Pn显著升高(P<0.05),升高了45.69%。不同处理银杏幼苗叶片蒸腾速率(Tr)与Pn的变化相似,相较于CK,T1、T2处理下降较为明显,分别降低了33.33%、18.06%;相比T1处理,T3处理下银杏幼苗叶片Tr显著升高(P<0.05)。T3处理下银杏幼苗叶片的气孔导度(Gs)最高,T2处理最低。不同处理下银杏幼苗叶片蒸汽压亏缺(VpdL)的规律与Tr相似,与CK相比,各盐处理组VpdL均显著下降,其中T1处理下降最为明显,降低了26.91%。
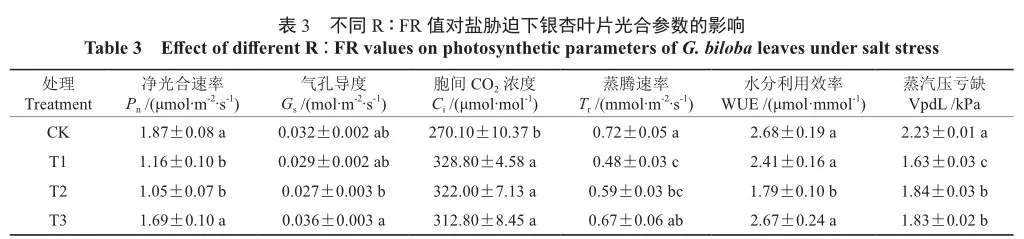
光合-光响应曲线能够反映植物叶片表观光合速率随光合有效辐射强度变化而变化的规律,不同处理下银杏幼苗光合-光响应拟合曲线变化趋势大体相同。如图3所示,当PAR<100 μmol·m2·s-1时,各处理Pn随PAR的增加近似线性变化,随着光强的继续增加,曲线上升趋势趋缓,至Isat时,Pn不再随光强的增加而上升。当PAR为100~600 μmol·m2·s-1时,不同处理间Pn差异逐渐增大,且在同一光强下,CK、T3处理的Pn值均明显高于T1、T2处理;当PAR超过400 μmol·m2·s-1后,各处理Pn的增幅明显减小,达到Isat后趋于稳定。比较不同处理在Isat下的Pn值,由大到小依次为CK>T3>T1>T2,其中CK、T3处理均显著高于T1、T2处理。
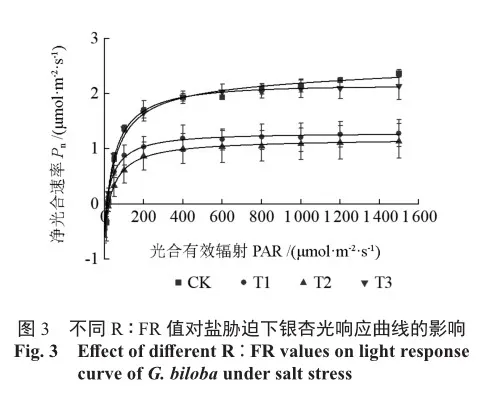
通过对不同处理下银杏幼苗光响应曲线的拟合,可以得到最大净光合速率(Pn,max)、饱和光强(Isat)、光补偿点(Ic)和暗呼吸速率(Rd)等光合特征参数。由表4可知,在盐胁迫条件下,各处理银杏幼苗叶片Pn,max值均呈现出不同程度的下降,其中T1、T2处理下降最为明显,与CK相比,分别降低了46.86%、51.46%;T3处理与CK相比差异不显著(P>0.05)。植物Isat可以反映叶片对强光的适应能力。与CK对比,各盐处理组Isat均显著下降(P<0.05),而T3处理下降幅度相对较小。不同处理下银杏幼苗叶片Ic和Rd的变化大体一致,在持续的盐胁迫影响下,Rd受到明显抑制,Ic随之表现出一定程度的下降,其中T1处理下降了44.04%,T2、T3处理相比T1处理显著升高(P<0.05)。
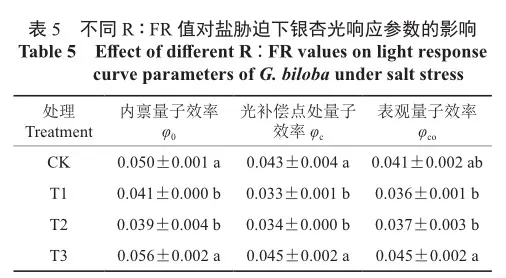
表观量子效率可以反映植物对光能的利用效率,但采用低光范围(PAR≤200 μmol·m2·s-1)内Pn-PAR的关系来反映表观量子效率时,由于人为对PAR的选择范围不同,得到的表观量子效率不同,且不同光合能力的植物在低光强范围内PnPAR线性对应关系差异较大[16],因此,用光响应曲线上I=0和I=Ic两点连线的斜率作为植物的表观量子效率,记为φc0;φ0为植物叶片在暗呼吸处的量子效率,即内禀量子效率,其可以表征植物潜在的最大光能利用能力;φc为植物叶片在光补偿点处的量子效率,用来反映植物将吸收到的光能转换为净能量的能力。如表5所示,与CK相比,T1处理下银杏幼苗叶片φc0、φ0、φc均有下降,分别降低了12.20%、18.00%、23.26%,其中φ0、φc下降幅度达到显著水平(P<0.05)。与T1处理相比,T3处理下φc0、φ0、φc显著升高(P<0.05),分别升高了25.00%、36.59%、36.36%。T3处理与CK相比差异不显著。

3 讨 论
植物在盐胁迫下相关形态指标发生的变化能直观反映其受盐害的程度,也是代谢过程在形态上的综合体现[17]。本试验中,0.3% NaCl的盐胁迫对银杏幼苗苗高、地径、鲜质量和干质量均存在显著的抑制作用,降低R∶FR比值有利于茎、叶生物量的积累,这与Sin[18]对杨树Populus的研究结果一致。处于R∶FR为0.8的光环境中时,盐胁迫对各形态指标的抑制作用明显减轻,说明R∶FR为0.8的光环境能够有效缓解盐胁迫对银杏幼苗生长的抑制程度,这与高登国等[19]对番茄幼苗的研究结果一致,与之不同的是,R∶FR为1.2的光环境对银杏幼苗生长的促进作用不明显。这可能是由于不同植物对光质的响应存在一定差异。
叶片是植物维持光合作用及同化功能的重要器官,对外界环境变化较为敏感,植物受到的外界环境压力大小通常能够直观地反映在叶片形态变化上[20]。在盐胁迫环境中,植物受渗透胁迫和离子过剩效应的影响,叶面积扩展速率下降,叶片生长受到限制[21]。本试验中,0.3% NaCl浓度的盐胁迫对银杏幼苗叶长、叶宽和叶面积均存在明显的抑制作用。随着光环境中R∶FR值的降低,银杏幼苗叶面积、叶长均有所增加,这可能是为了叶片进行更有效的光收集,增加对光能的截获面积,这在Sharew等[22]关于东非圆柏Juniperus procera及Ito等[23]关于沙梨Pyrus pyrifolia中也有相似的表现。当R∶FR值为0.8时,各叶形指标与非盐处理组无显著差异,这与冰草Mesembryanthemum crystallinum[11]、番茄[24]及黄瓜[10]的研究结果一致。
在盐胁迫下,叶片细胞质及质外体中快速积累的盐离子引起活性氧清除机制失衡和离子失调,生物膜结构破坏,选择透性丧失,膜内电解质及小分子物质外渗[25-26]。通过测定叶片相对电导率能够反映出膜的受损程度。有研究表明,植物光敏色素能够通过调节基因表达、细胞膜的离子渗透性和膜电位等途径来影响细胞的代谢发育[27-28];在对黄瓜[10]、番茄[9]的研究中发现,在一定范围内降低植物生长光环境中的R∶FR值能够减缓盐胁迫所引起的活性氧物质积累,减轻膜脂受到的氧化伤害。本试验中,随着处理时间的延长,银杏幼苗叶片相对电导率显著升高;当光环境中R∶FR值为1.2和0.8时,叶片中相对电导率则显著降低,且R∶FR为0.8时最为明显,说明膜系统损伤得到了有效缓解。
随着处理时间的延长,银杏叶片中光合色素含量明显降低。有研究发现,随着光环境中R∶FR值发生变化,植物叶片中光合色素含量及不同组分比例也会随之发生改变[9];低比例R∶FR能够通过促进叶绿素合成从而缓解植物受到的盐胁迫[29]。在本试验中,R∶FR为0.8的处理下银杏叶片中Chla、Chlb、Car和Chla+b含量均明显提高。R∶FR为1.2的处理下对光合色素含量下降的缓解效果不明显,这可能是由于不同植物的光合色素合成代谢对光质的适应性有差异。研究发现,叶绿素a/b能够反映盐胁迫对类囊体垛叠程度的影响[30],银杏在盐胁迫环境中Chla/b显著下降,说明银杏叶片类囊体膜结构受到了破坏,但不同处理间的差异随时间的变化幅度较小,可能是由于Chla/b降低能够提高植物对远红光的吸收,从而适应环境的改变。
光合作用过程中气孔承担吸入二氧化碳、释放水汽的作用,证明植物的光合作用与净光合速率和气孔导度关系密切[31]。本试验中,在处理42 d后,银杏幼苗净光合速率显著下降,而胞间二氧化碳浓度显著上升,气孔导度则变化不明显,说明此时银杏幼苗净光合速率下降主要受非气孔因素限制[32]。蒸腾速率和蒸汽压亏缺的下降说明银杏幼苗根系可能受到损伤,水分吸收受阻。有研究发现,当植物处在红光环境下并适当地补充远红光时,能够促进PSI与PSⅡ的平衡,并使量子产额大幅增加[33]。本试验中,在R∶FR为0.8时盐胁迫对银杏幼苗净光合速率抑制作用明显减小,结合胞间二氧化碳浓度的降低,蒸腾速率、蒸汽压亏缺上升等变化,表明此光环境下有效缓解了盐胁迫对银杏光合系统的抑制作用。
光响应曲线及其特征参数可以较好地反映植物对光的利用和适应能力[34]。最大净光合速率是饱和光强下的净光合速率,在一定的温度和CO2浓度下能够反映出盐胁迫对叶片光合能力造成的影响[35]。在盐处理下银杏幼苗叶片最大净光合速率显著降低,在R∶FR为0.8的处理下其下降幅度明显减小,且与内禀量子效率的变化规律一致,这进一步说明R∶FR为0.8的光环境能够缓解盐胁迫对银杏幼苗光合结构的损伤,从而提高光能的利用能力。在盐胁迫下,由于线粒体膜脂受到氧化损伤,三羧酸循环和氧化磷酸化等活动可能受到影响,糖类代谢进程减慢,生命活动减弱,呼吸速率下降[36]。本试验中盐胁迫下银杏幼苗暗呼吸速率、光补偿点均明显下降,随着光环境中R∶FR值的降低,暗呼吸速率、光补偿点则显著提升,说明低比例R∶FR能够减轻盐胁迫对银杏呼吸的抑制作用。光饱和点、光补偿点处量子效率、表观量子效率的提高也说明低比例R∶FR值对银杏幼苗叶片在强光下的适应能力、将吸收到的光能转换为净能量的能力和对光能的利用效率均存在一定的提升作用。
本研究仅在气候室条件下对盐胁迫下不同比例R∶FR对银杏幼苗生长及光合特性进行了研究,植株生长环境相对稳定,且光照试验周期较短,具有一定的时间局限性。由于室内环境不能准确模拟银杏在自然生境中的应激反应,未来有必要在滨海盐碱地区开展实地田间试验。随着银杏的生长发育,低比例R∶FR的光环境是否能够持续缓解盐胁迫对银杏生长的盐害作用,有待进一步深入探讨。
4 结 论盐胁迫显著抑制了银杏幼苗的正常生长发育,而降低光环境中R∶FR比值在一定程度上可以缓解盐胁迫对银杏幼苗生长及光合作用的不利影响。R∶FR值为1.2的光环境能够缓解盐胁迫对膜系统的损伤,减轻细胞呼吸的受抑制程度;R∶FR值为0.8的光环境能够有效缓解盐胁迫对银杏幼苗叶片发育的抑制,提高光能截获面积,并减轻膜系统的损伤程度,降低叶片光合色素含量的下降程度,使银杏幼苗光能利用率得到提高,呼吸受抑制程度减轻,同化能力提高,进而缓解盐胁迫对银杏幼苗生长的抑制。当R∶FR为0.8时,光合性能得到显著提升,缓解效果最佳。
参考文献:
[1] 杜金法,李萍,陆续.银杏内酯生物合成与代谢调控研究进展[J].中国中药杂志,2021,46(13):3288-3297. DU J F, LI P, LU X. Advance in biosynthesis and metabolic regulation of ginkgolides[J]. China Journal of Chinese Materia Medica, 2021,46(13):3288-3297.
[2] 辜夕容,江亚男,倪亚兰,等.叶用银杏的良种选育与定向培育研究进展[J].中草药,2017,48(15):3218-3227. GU X R, JIANG Y N, NI Y L, et al. Research progress on breeding and cultivation of Ginkgo biloba for leaf use in China[J]. Chinese Traditional and Herbal Drugs,2017,48(15):3218-3227.
[3] 白世践,户金鸽,郑明,等.5个葡萄砧木品种对混合盐碱胁迫的生理响应分析[J].经济林研究,2022,40(2):112-124. BAI S J, HU J G, ZHENG M, et al. Physiological responses analysis of five grape rootstocks to complex salt-alkali stress[J]. Non-wood Forest Research,2022,40(2):112-124.
[4] 孙聪聪,赵海燕,郑彩霞.NaCl胁迫对银杏幼树渗透调节物质及脯氨酸代谢的影响[J].植物生理学报,2017,53(3):470-476. SUN C C, ZHAO H Y, ZHENG C X. Effects of NaCl stress on osmolyte and proline metabolism in Ginkgo biloba seedling[J]. Plant Physiology Journal,2017,53(3):470-476.
[5] 赵海燕,魏宁,孙聪聪,等.NaCl胁迫对银杏幼树组织解剖结构和光合作用的影响[J].北京林业大学学报,2018,40(11): 28-41. ZHAO H Y, WEI N, SUN C C, et al. Effects of salt stress on anatomic structure of tissue and photosynthesis in Ginkgo biloba seedlings[J]. Journal of Beijing Forestry University,2018,40(11): 28-41.
[6] 许大全,高伟,阮军.光质对植物生长发育的影响[J].植物生理学报,2015,51(8):1217-1234. XU D Q, GAO W, RUAN J. Effects of light quality on plant growth and development[J]. Plant Physiology Journal,2015,51(8): 1217-1234.
[7] 刘再亮,马承伟,杨其长.设施环境中红光与远红光比值调控的研究进展[J].农业工程学报,2004,20(1):270-273. LIU Z L, MA C W, YANG Q C. Review on controlling the ratio of red light to far-red light in protected environment[J]. Transactions of the Chinese Society of Agricultural Engineering,2004,20(1): 270-273.
[8] CARVALHO R F, CAMPOS M L, AZEVEDO R A. The role of phytochrome in stress tolerance[J]. Journal of Integrative Plant Biology,2011,53(12):920-929.
[9] CAO K, YU J, XU D W, et al. Exposure to lower red to far-red light ratios improve tomato tolerance to salt stress[J]. BMC Plant Biology,2018,18:92.
[10] 高星星,李若婵,温祥珍,等.红光和远红光比例对盐胁迫下黄瓜幼苗生长和光合特性的影响[J].山东农业科学,2021, 53(10):36-41. GAO X X, LI R C, WEN X Z, et al. Effect of red light to farred light ratio on growth and photosynthetic characteristics of cucumber seedlings under salt stress[J]. Shandong Agricultural Sciences,2021,53(10):36-41.
[11] 孟力力,曹凯,孙倩,等.不同红光远红光配比对冰草生长发育、光合特性及品质的影响[J].核农学报,2022,36(1):226-235. MENG L L, CAO K, SUN Q, et al. Effects of different ratios of red light and far red light on growth, photosynthetic characteristics and quality of Mesembryanthemum crystallinum L.[J]. Journal of Nuclear Agricultural Sciences,2022,36(1): 226-235.
[12] WANG Y L, BIAN Z H, PAN T H, et al. Improvement of tomato salt tolerance by the regulation of photosynthetic performance and antioxidant enzyme capacity under a low red to far-red light ratio[J]. Plant Physiology and Biochemistry,2021,167:806-815.
[13] 谢宝东,王华田.光质和光照时间对银杏叶片黄酮、内酯含量的影响[J].南京林业大学学报(自然科学版),2006,30(2): 51-54. XIE B D, WANG H T. Effects of light spectrum and photoperiod on contents of flavonoid and terpene in leaves of Ginkgo biloba L.[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2006,30(2):51-54.
[14] WANG G P, ZHANG L, WANG G B, et al. Growth and flavonol accumulation of Ginkgo biloba leaves affected by red and blue light[J]. Industrial Crops and Products,2022,187:115488.
[15] 叶子飘,于强.一个光合作用光响应新模型与传统模型的比较[J].沈阳农业大学学报,2007,38(6):771-775. YE Z P, YU Q. Comparison of a new model of light response of photosynthesis with traditional models[J]. Journal of Shenyang Agricultural University,2007,38(6):771-775.
[16] 王海珍,韩路,徐雅丽,等.胡杨异形叶光合作用对光强与CO2浓度的响应[J].植物生态学报,2014,38(10):1099-1109. WANG H Z, HAN L, XU Y L, et al. Photosynthetic responses of the heteromorphic leaves in Populus euphratica to light intensity and CO2 concentration[J]. Chinese Journal of Plant Ecology, 2014,38(10):1099-1109.
[17] 钱玥,饶良懿.盐碱胁迫对枸杞幼苗生长与叶绿素荧光特性的影响[J].森林与环境学报,2022,42(3):271-278. QIAN Y, RAO L Y. Effects of saline-alkali stress on the growth and chlorophyll fluorescence characteristics of Lycium barbarum seedlings[J]. Journal of Forest and Environment, 2022,42(3):271-278.
[18] SIN S. Tree spacings and red: far-red light effects on juvenile Populus growth and morphology[M]. Ames: Iowa State University, 2000.
[19] 高登国,于捷,邹志荣,等.不同红光与远红光比值对盐胁迫下番茄光合能力的影响[J].安徽农业大学学报,2021,48(4): 578-583. GAO D G, YU J, ZOU Z R, et al. Effects of different red to far-red light ratios on tomato photosynthesis ability under salt stress[J]. Journal of Anhui Agricultural University,2021,48(4): 578-583.
[20] 李东胜,史作民,冯秋红,等.中国东部南北样带暖温带区栎属树种叶片形态性状对气候条件的响应[J].植物生态学报, 2013,37(9):793-802. LI D S, SHI Z M, FENG Q H, et al. Response of leaf morphometric traits of Quercus species to climate in the temperate zone of the north-south transect of eastern China[J]. Chinese Journal of Plant Ecology,2013,37(9):793-802.
[21] 齐琪,马书荣,徐维东.盐胁迫对植物生长的影响及耐盐生理机制研究进展[J].分子植物育种,2020,18(8):2741-2746. QI Q, MA S R, XU W D. Advances in the effects of salt stress on plant growth and physiological mechanisms of salt tolerance[J]. Molecular Plant Breeding,2020,18(8):2741-2746.
[22] SHAREW H, GRACE J, LEGG C J. Response of two Afromontane coniferous tree species to light and nutrient supply[J]. Tree Physiology,1996,16(7):617-626.
[23] ITO A, SAITO T, NISHIJIMA T, et al. Effect of extending the photoperiod with low-intensity red or far-red light on the timing of shoot elongation and flower-bud formation of 1-year-old Japanese pear (Pyrus pyrifolia)[J]. Tree Physiology,2014,34(5): 534-546.
[24] ZHANG Y T, ZHANG Y Q, YANG Q C, et al. Overhead supplemental far-red light stimulates tomato growth under intracanopy lighting with LEDs[J]. Journal of Integrative Agriculture, 2019,18(1):62-69.
[25] 王宝山,赵可夫,邹琦.作物耐盐机理研究进展及提高作物抗盐性的对策[J].植物学通报,1997,14(增1):25-30. WANG B S, ZHAO K F, ZOU Q. Advances in mechanism of crop salt tolerance and strategies for raising crop salt tolerance[J]. Chinese Bulletin of Botany,1997,14(Suppl.1):25-30.
[26] 束胜,郭世荣,孙锦,等.盐胁迫下植物光合作用的研究进展[J].中国蔬菜,2012(18):53-61. SHU S, GUO S R, SUN J, et al. Research progress on photosynthesis under salt stress[J]. China Vegetables,2012(18): 53-61.
[27] ZHAO K H, RAN Y, LI M, et al. Photochromic biliproteins from the cyanobacterium Anabaena spp. PCC 7120: Lyase activities, chromophore exchange, and photochromism in phytochrome AphA[J]. Biochemistry,2004,43(36):11576-11588.
[28] 王春台,刘学群,涂文忠.不同光质间断暗期对农垦58s叶片细胞膜透性及外渗液主要成分含量的影响[J].华中农业大学学报,1998,17(2):105-110. WANG C T, LIU X Q, TU W Z. Effects of red far-red light on cell membrane permeability and contents of main components in leaf cell exudate of nongken 58s[J]. Journal of Huazhong Agricultural University,1998,17(2):105-110.
[29] 艾楷棋,苏华,周海将,等.不同红光与远红光对盐胁迫下番茄叶绿素合成的影响[J].北方园艺,2019(1):14-22. AI K Q, SU H, ZHOU H J, et al. Effects of different R:FR ratio on chlorophyll biosynthesis in tomato leaves under salt stress[J]. Northern Horticulture,2019(1):14-22.
[30] 史典义,刘忠香,金危危.植物叶绿素合成?分解代谢及信号调控[J].遗传,2009,31(7):698-704. SHI D Y, LIU Z X, JIN W W. Biosynthesis, catabolism and related signal regulations of plant chlorophyll[J]. Hereditas,2009,31(7): 698-704.
[31] 汪星星,陈钢,孟芳芳,等.光质对杉木幼苗光合生理及色素的影响[J].中南林业科技大学学报,2022,42(12):82-90,111. WANG X X, CHEN G, MENG F F, et al. Effects of light quality on photosynthetic physiology and pigment accumulation of Chinese fir seedlings[J]. Journal of Central South University of Forestry & Technology,2022,42(12):82-90,111.
[32] 许大全.光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997,33(4):241-244. XU D Q. Some problems in stomatal limitation analysis of photosynthesis[J]. Plant Physiology Communications,1997,33(4): 241-244.
[33] EMERSON R, LEWIS C M. The dependence of the quantum yield of chlorella photosynthesis on wave length of light[J]. American Journal of Botany,1943,30(3):165-178.
[34] 宝音满达,李兆佳,刘晓东,等.不同种源光皮树叶绿素荧光特性及其光合响应能力[J].经济林研究,2023,41(2):205-213. BAOYINMANDA, LI Z J, LIU X D, et al. Chlorophyll fluorescence characteristics and their photosynthetic capacity in response to different provenance sources of Swida wilsoniana[J]. Non-wood Forest Research,2023,41(2):205-213.
[35] 赵秀婷,王延双,段劼,等.盐胁迫对红花玉兰嫁接苗生长和光合特性的影响[J].林业科学,2021,57(4):43-53. ZHAO X T, WANG Y S, DUAN J, et al. Effects of salt stress on growth and photosynthetic characteristics of Magnolia wufengensis grafted seedlings[J]. Scientia Silvae Sinicae,2021,57(4): 43-53.
[36] 钱琼秋,宰文姗,何勇,等.外源硅和辅酶Q10对盐胁迫下黄瓜根系线粒体的保护作用[J].中国农业科学,2006,39(6):1208-1214. QIAN Q Q, ZAI W S, HE Y, et al. Protection of exogenous silicon and CoQ10 on mitochondria in Cucumber (Cucumis sativus L.) roots under salt stress[J]. Scientia Agricultura Sinica,2006,39(6): 1208-1214.
[本文编校:谢荣秀]

