茶树接种AM真菌在干旱胁迫下的生理响应


摘要:为探究干旱胁迫下丛枝菌根(Arbuscular mycorrhizal,AM)真菌对茶树生长及生理的作用机理,以福鼎大白茶(Camellia sinensis cv. ‘Fuding Dabaicha’)茶树实生苗为试验材料,采用温室盆栽法,在正常水分和干旱胁迫下分别接种或不接种AM真菌幼套近明球囊霉(Claroideoglomus etunicatum),探究AM真菌在不同干旱胁迫时长(4周、6周、8周)下对茶树实生苗生长、光合、渗透调节及气孔开度等的生理响应。结果显示,在两种不同的水分条件下,接种AM真菌处理均显著促进了茶树生长,增加了地上部和地下部生物量,改善了根系构型,与不接种AM真菌相比,茶树根系总长度、二级侧根和三级侧根的数量、叶片渗透势分别增加了20.00%~38.77%、48.90%~163.33%、60.00%~442.86%、29.77%~41.24%,降低了干旱胁迫下茶树叶片气孔密度和相对电导率,与不接种AM真菌相比分别降低了16.00%~42.37%、2.21%~6.67%,且在干旱胁迫下的效果更为显著。干旱胁迫显著抑制了AM真菌对茶树根系的侵染和茶树的生长,表现为抑制了茶树根系构型的建立,降低了叶片叶绿素含量、最大光量子效应(QY_max)、叶片相对含水量(RWC)、气孔开度及渗透势等。接种AM真菌能显著缓解这种抑制效应,改善茶树对干旱胁迫的生理响应,从而促进茶树生长。研究表明,AM真菌可通过优化茶苗根系构型,提高茶苗叶片的保水和光合能力,调节气孔及渗透平衡,从而促进植株对水分和养分的吸收,缓解干旱对茶树的损伤,提高茶树实生苗的抗旱能力,且随着干旱时间的延长AM真菌的促进效果更为显著。
关键词:茶树生长;生理特性;丛枝菌根真菌;干旱胁迫
中图分类号:S571.1;S326 文献标识码:A 文章编号:1000-369X(2024)05-718-17
Physiological Response of Tea Plants Inoculated with Arbuscular Mycorrhizal Fungi under Drought Stress
LU Wei1, WU Xiaolong1, HU Xianchun1, HAO Yong2*, LIU Chunyan1*
1. College of Horticulture and Gardening, Yangtze University, Jingzhou 434025, China;
2. College of Urban Construction, Yangtze University, Jingzhou, 434023, China
Abstract: To explore the mechanism of arbuscular mycorrhizal (AM) fungi on the growth and physiological characteristics of tea plants under drought stress, tea cultivar ‘Fuding Dabaicha’ was used as experimental material to inoculate with or without (Claroideoglomus etunicatum) under well-watered and drought stress. Plant growth performance, photosynthesis, osmotic regulation and stomatal aperture were determined to investigate the effect of AMF on tea seedlings under different duration of DS (4 weeks, 6 weeks and 8 weeks). The results show that under well-watered and drought stress conditions, AMF inoculation significantly promoted plant growth performance, increased the shoot and root biomass, improved the root system architecture, in particularly increased total root length, secondary and tertiary lateral root numbers, and leaf osmotic potential by 20.00%-38.77%, 48.90%-163.33%, 60.00%-442.86%, 29.77%-41.24%, decreased the stomatal density and relative conductance under drought stress by 16.00%-42.37% and 2.21%-6.67% respectively. The effects were more significant under drought stress. Whereas, drought stress significantly inhibited the root AMF colonization and plant growth, as evidenced by impaired establishment of root system architecture, reduced leaf chlorophyll content, maximum light quantum effect (QY_max), leaf relative water content, stomatal aperture and osmotic potential, etc. AMF inoculation could significantly alleviate this inhibitory effect, improve the physiological response of tea plants under drought stress and thus promote tea plant growth. The results indicate that AMF could promote the absorption of water and nutrients, alleviate the damage of drought stress and improve the drought resistance of tea seedlings by improving root morphology, promoting the water retention and photosynthetic capacity, adjusting the stomatal and osmotic balance, and the promotion effect of AMF became more significant with the extension of drought time.
Keywords: tea plant growth, physiological character, AMF, drought stress
茶树[Camellia sinensis (L.) O. Kuntze]是山茶科山茶属的多年生常绿木本植物,是我国重要的园艺及经济作物。茶树起源于我国西南部,具有喜湿怕涝的特性,对土壤水分含量十分敏感,土壤缺水或渍水都会影响茶树的生长、代谢、产量和品质[1]。近年来,高温干旱等极端天气频发,严重影响着茶树生长和茶产业的发展。
干旱是影响全球农业可持续发展的限制性因素之一,严重影响植物的生长发育。我国多数茶产区气候条件为四季分明,降雨量周年分布不均,夏季高温少雨、日照强烈,许多茶区都会出现不同程度的干旱。一旦遭受干旱,茶树叶片便会逐渐变黄卷曲、出现褐斑、老嫩叶焦枯脱落,严重干旱时会使茶树整体缺水,枝条枯死甚至整株死亡。不仅如此,干旱还会使茶树体内活性氧增加,叶绿素含量和相对含水量降低,气孔关闭,从而限制茶树光合速率[2]。此外,在干旱胁迫下,茶叶中总蛋白、淀粉和双糖含量降低,可溶性糖、可溶性蛋白和纤维素含量增加[3],嫩叶中茶多酚含量减少,儿茶素含量下降,从而影响茶叶的产量和品质[1]。因此,探索茶树耐旱性机制,提高茶树的抗逆栽培,对茶产业的可持续发展具有重要的意义。
丛枝菌根(Arbuscular mycorrhizal,AM)真菌是土壤中的一类有益微生物,它能侵染植物根系并与超过80%的陆生植物建立共生关系。研究证实,AM真菌强大的根外菌丝能够帮助植物根系吸收根系以外区域的水分和养分,从而改善宿主的营养状况,促进植株的生长发育[4]。AM真菌还能够通过提高宿主植物体内叶绿素含量、光合酶活性提高植物的光合性能,进而提高植物固碳能力、改善其源库关系[5]。大量研究表明,AM真菌在提高植物抗逆性方面具有广阔的应用前景,可通过调控渗透调节物质的含量[6]、提高抗氧化酶活性[7]、调节植物激素水平[8]、调控植物胁迫相关基因表达水平[9]等来提高宿主植物的抗逆性。在逆境胁迫下,AM真菌还可以通过改善宿主植物的根系构型、保护光系统、增强抗氧化系统,改善植株的生理生化特性,提高宿主植物对干旱的适应性,进而提高产量和品质[10]。
与大多数陆生植物一样,茶树根际具有极为丰富的AM真菌资源。前人研究发现,在野生茶树和栽培茶树的根际中存在多种丛枝菌根物种,在自然栽培条件下无梗囊霉属(Acaulospora)、巨孢囊霉属(Gigaspora)、球囊霉属(Glomus)、近明球囊霉属(Claroideoglomus)和盾巨孢囊霉属(Scutellospora)的AM真菌均能与茶树根系形成良好共生体[11]。我国茶园土壤中的AM真菌资源也十分丰富,目前,已报道鉴定的AM真菌达36种,占世界已知AM真菌种类数的17.4%[12]。茶树为少根毛植物,AM真菌能在茶树根际形成大量外生菌丝,从而扩展根系吸收面积,促进茶树对水分和营养元素的吸收利用。王玉娟等[13]研究发现,接种幼套球囊霉(Glomus etunicatum)后,茶树叶片数量和各部分(叶片、茎、根系)生物量显著增加,茶树叶片蔗糖、葡萄糖、果糖、儿茶素、氨基酸和茶多酚的含量提高,表明AM真菌在茶树生长和改善茶叶品质方面有一定的促进作用。此外,研究发现AM真菌能促进水分胁迫下茶树的生长,增强水分胁迫下茶树叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及抗坏血酸过氧化物酶(APX)的活性,缓解茶树叶片受氧化程度[14]。这表明AM真菌在缓解逆境胁迫,提高茶树抗逆性方面也有重要作用。
虽然关于AMF调控茶树生长的一系列研究已经开展,但是对不同时长干旱胁迫下AM真菌对茶树生长及抗性方面的研究较少,相关机理解析还不够深入。鉴于此,本研究以福鼎大白茶(Camellia sinensis cv. ‘Fuding Dabaicha’)为试验材料,在正常水分和干旱胁迫下接种AM真菌,分析其对不同时长干旱胁迫下茶树实生苗生长及生理特性的影响,为探究AM真菌增强茶树抗旱性机理及茶树高效栽培提供理论依据。
1 材料与方法
1.1 试验材料
以福鼎大白茶实生苗为试验材料,茶种由贵州省农科院茶叶研究所提供。茶种经75%酒精消毒10 min后置于预先经过高压灭菌(121 ℃,0.1 MPa,2 h)的河沙中,于昼/夜温度28 ℃/20 ℃,相对湿度为70%的培养箱中催芽。供试AM真菌为幼套近明球囊霉(Claroideoglomus etunicatum),菌种购于中国丛枝菌根真菌种质资源库(BGC),经白三叶草(Trifolium repens L.)扩繁3个月(每克孢子数约达43个)后用于本研究。选取长势一致的2叶龄无菌茶苗移栽至塑料盆(盆口内径×盆底内径×盆高=15 cm×10 cm×13 cm)中,盆中装有预先经过高压蒸汽灭菌消除基质中土著真菌孢子的栽培基质(V土︰V河沙=1︰1),每盆移栽2株茶树实生苗。
1.2 试验设计
本研究采用双因素完全随机试验设计。因素一为水分处理,分别为正常水分(田间最大持水量的75%,WW)和干旱胁迫(田间最大持水量的55%,DS)。因素二为AM真菌接种,即在每个水分梯度下分别设置接种C. etunicatum(+AMF)与不接种(-AMF)处理。接种AM真菌的处理在移栽时采用“分层接种法”(即分别在盆土1/2和1/3高度处加入AM真菌菌种,并与盆栽基质混匀)进行接种处理,每盆接种80 g菌剂(包括侵染的根段、AM真菌菌丝的孢子和河沙等),活孢子数量约为3 440个。不接种AM真菌的处理在移栽时加入相同质量经高压灭菌后的菌种作为对照。试验共4个处理,每个处理重复6次,共24盆,随机排列。
于AM真菌接种8周后进行干旱处理,随机选取一半接种AM真菌(+AMF)和不接种(-AMF)处理茶苗进行干旱处理,另一半则继续维持正常水分条件。干旱处理于每天18:00通过称重法[13]计算基质中的水分含量,并补充相应水分,维持稳定的含水量。所有试验材料均于水分处理4周、6周、8周后分批收获。
1.3 测定方法
每次植株收获前测定株高、茎粗、叶片数。同时,自上而下选取第4片完全展开的功能叶,采用FluorCam封闭式荧光成像仪(RAP-FLUO高通量植物荧光表型检测平台,武汉谷丰光电科技有限公司)测定叶绿素荧光参数,获得最大光量子效应(QY_max)、稳态光量子效应(QY_Lss)、稳态非光化学荧光淬灭(NPQ_Lss)等参数。随后参照王学奎[15]的方法测定叶绿素含量。
植株收获时将茶树实生苗从试验盆中完整取出,分成地上部和地下部,同时收集根际土。小心将根系清洗干净,吸干表面水分后立即称取地上部鲜重和地下部鲜重。随后将完整的根系置于根盘中,采用Epson Perfection V700 Photo Dual Lens System(J221A,Indonesia)对茶树根系进行扫描,采用WinRHIZO(2007)分析根系构型参数。随后将根系平铺在实验台上,人工统计各级侧根数。随机选取各级侧根根系,去掉根尖,剪成1~2 cm长根段置于FAA固定液中,经曲利苯蓝染色后参考Phillips等[16]的方法测定菌根侵染率。土壤菌丝长度参考Bethlenfalvay等[17]的方法,在生物显微镜下镜检,记录土壤菌丝长度。
叶片相对含水量参照Bajji等[18]的方法测定。相对电导率、渗透势以及气孔密度的测量参考孙琪璐[19]的方法:相对电导率采用电解质外渗法测定;取植物组织液10 μL用露点渗透压仪测定其渗透势;气孔密度测定,自顶部向下选取第3片完全成熟的功能叶,切成体积为1 mm3的小块,放于预冷的5%戊二醛固定液中,4 ℃过夜,随后在叶片下表皮涂抹指甲油,自然风干后将指甲油剥离,置于载玻片上于显微镜下观察气孔形态,在光学显微镜40×物镜下统计每个视野中的气孔数目,并测量视野中的气孔器长度、宽度。参照杨妮等[20]的方法计算气孔开度。
1.4 统计分析
运用SAS10.1.3v软件(SAS Institute Inc.,Cary,NC,USA)进行双因素差异分析(Two way ANOVA),并用Duncan多重比较法进行多重比较分析(P<0.05)。
2 结果与分析
2.1 水分处理前茶树实生苗生长状况
水分处理前,接种AM真菌(+AMF)显
著促进了茶树实生苗生长,株高、茎粗、叶片数及各部分生物量分别增加了19.95%、6.17%、54.76%、68.29%、75.00%和139.06%(表1)。
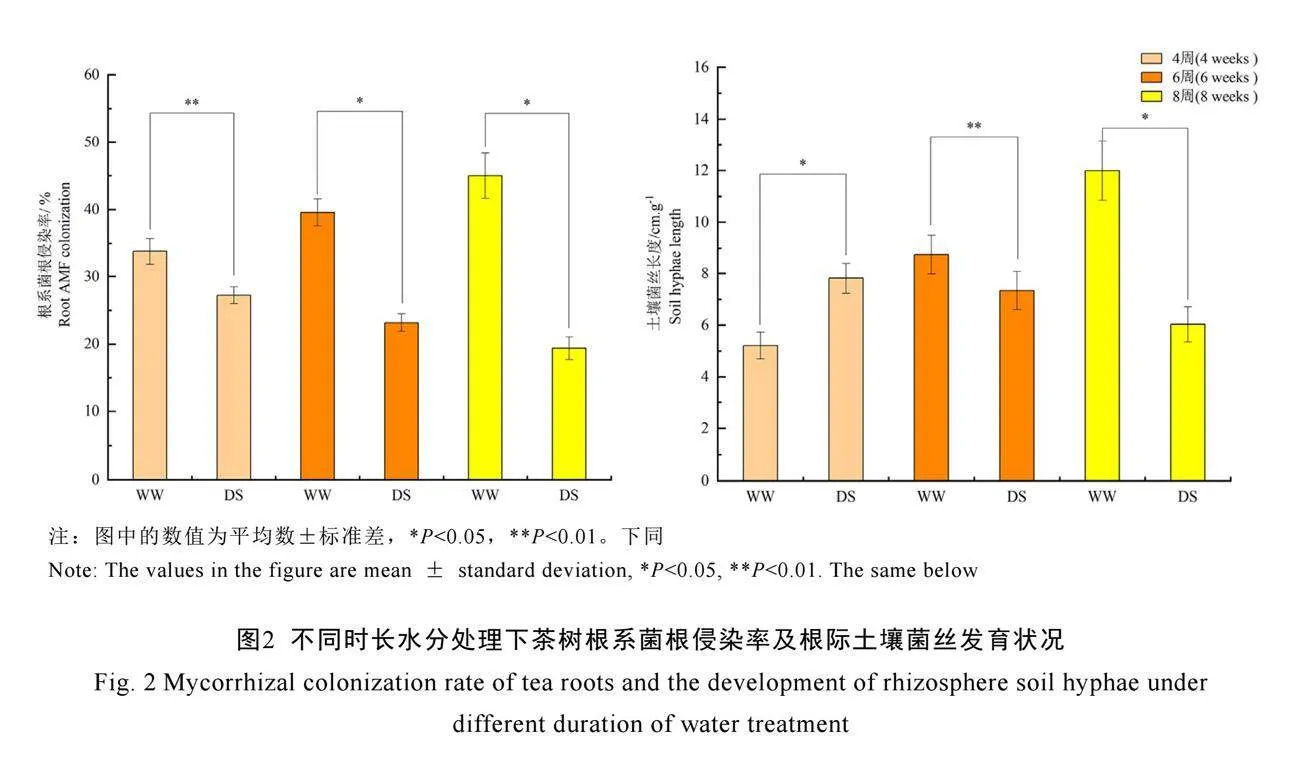
2.2 不同水分处理下茶树菌根发育状况
不论在正常水分还是在干旱胁迫下,C. etunicatum均能侵染茶树根系(图1),侵染率为19.4%~45.0%(图2)。在正常水分下,茶树根系菌根侵染率和根际土壤菌丝长度均随着处理时间的延长而不断增加,在8周时,分别达到45.01%和11.99 cm·g-1。然而,干旱胁迫下茶树根系菌根侵染率和土壤菌丝长度会随着处理时间的延长而不断降低,并在8周时显著降低(P<0.05),与同时期正常水分组相比,分别降低了57.78%和50.00%。表明干旱胁迫会抑制AM真菌对茶树根系的侵染,限制菌丝在土壤中的扩繁,进而影响AM真菌促生功能的发挥。
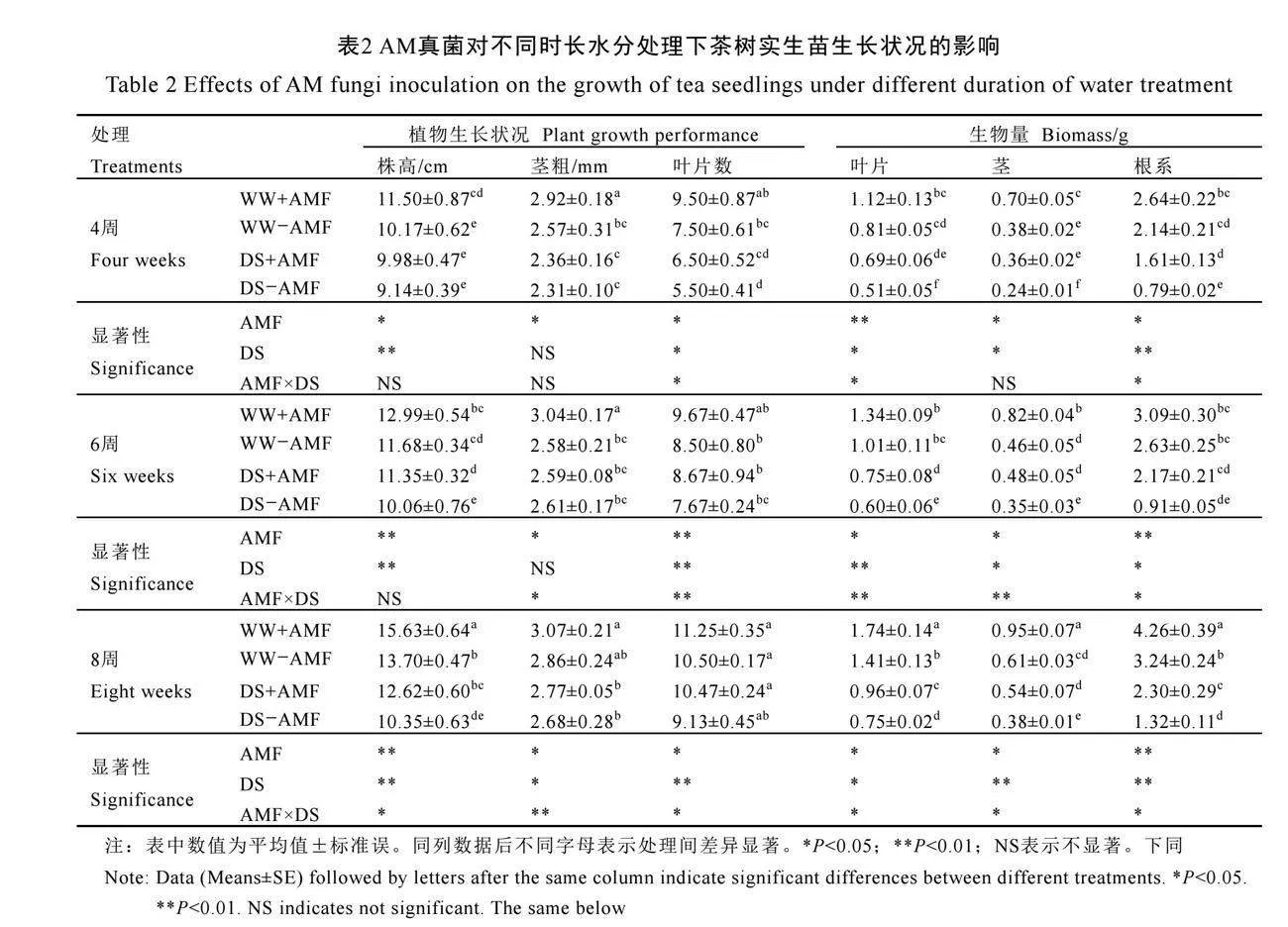
2.3 AM真菌对不同时长水分处理下茶树实生苗生长的影响
由表2可知,在不接种AM真菌(–AMF)处理下,干旱胁迫仅在6周和8周时显著降低了株高,在4周和8周时显著降低了叶片数(P<0.05),对茎粗无显著影响。但不同干旱胁迫时长均显著降低了茶树叶片、茎和根系的生物量。与不接种AM真菌相比,接种AM真菌显著增加了正常水分下4周、8周时茶树的株高,以及4周和6周时的茎粗;增加干旱胁迫下6周、8周时茶树的株高以及8周时的叶片数。此外,接种AM真菌还显著增加了正常水分和
干旱胁迫下茶树茎干鲜重以及8周时根系和叶片鲜重,且对干旱胁迫下各时长叶片、茎和根系的生物量增加尤为显著(P<0.05),在4周时分别增加35.29%、50.00%和103.79%;在6周时分别增加25.00%、37.14%和138.46%;在8周时分别增加28.00%、42.11%和74.24%(表2)。
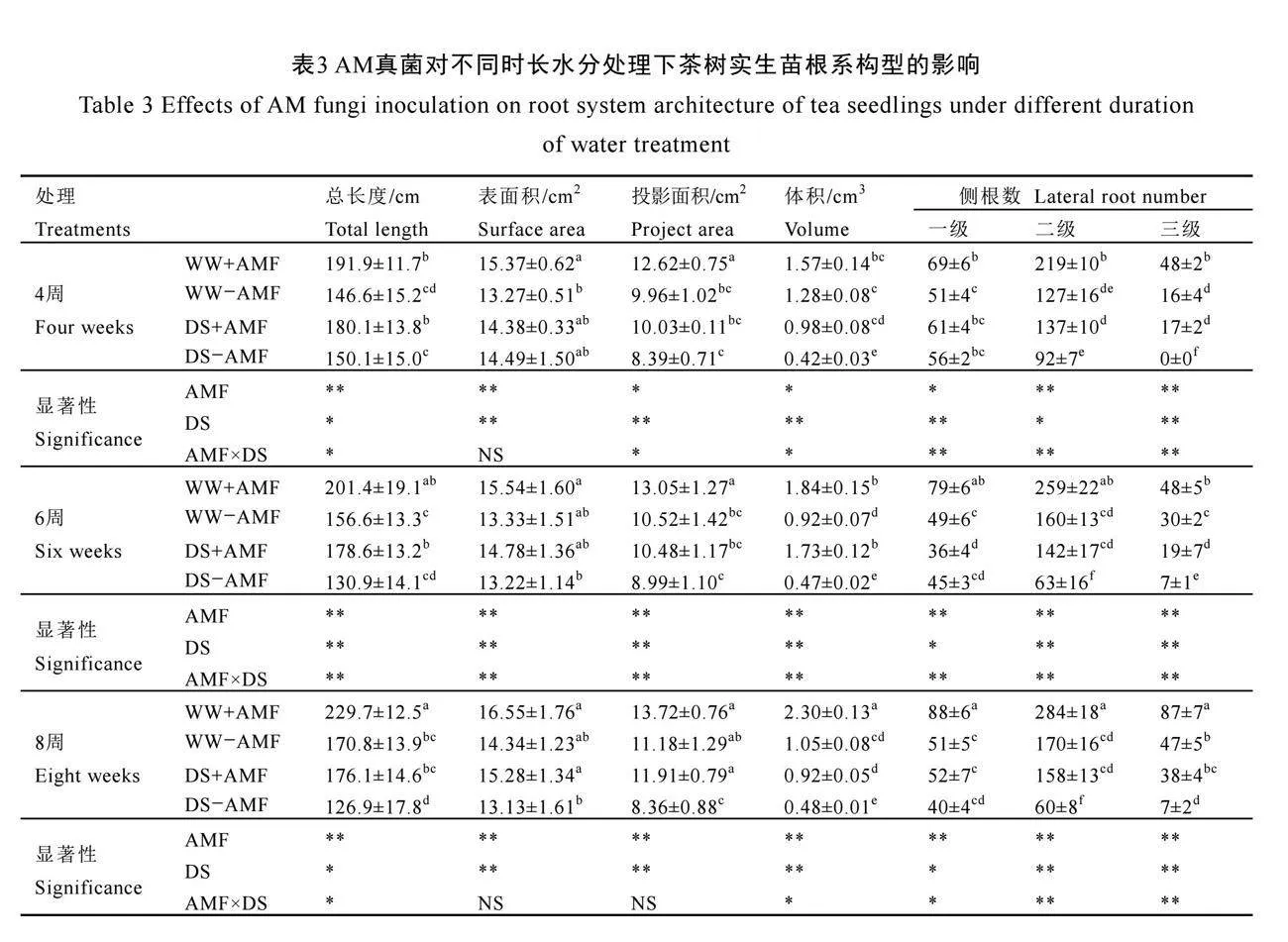
2.4 AM真菌对不同时长水分处理下茶树实生苗根系构型的影响
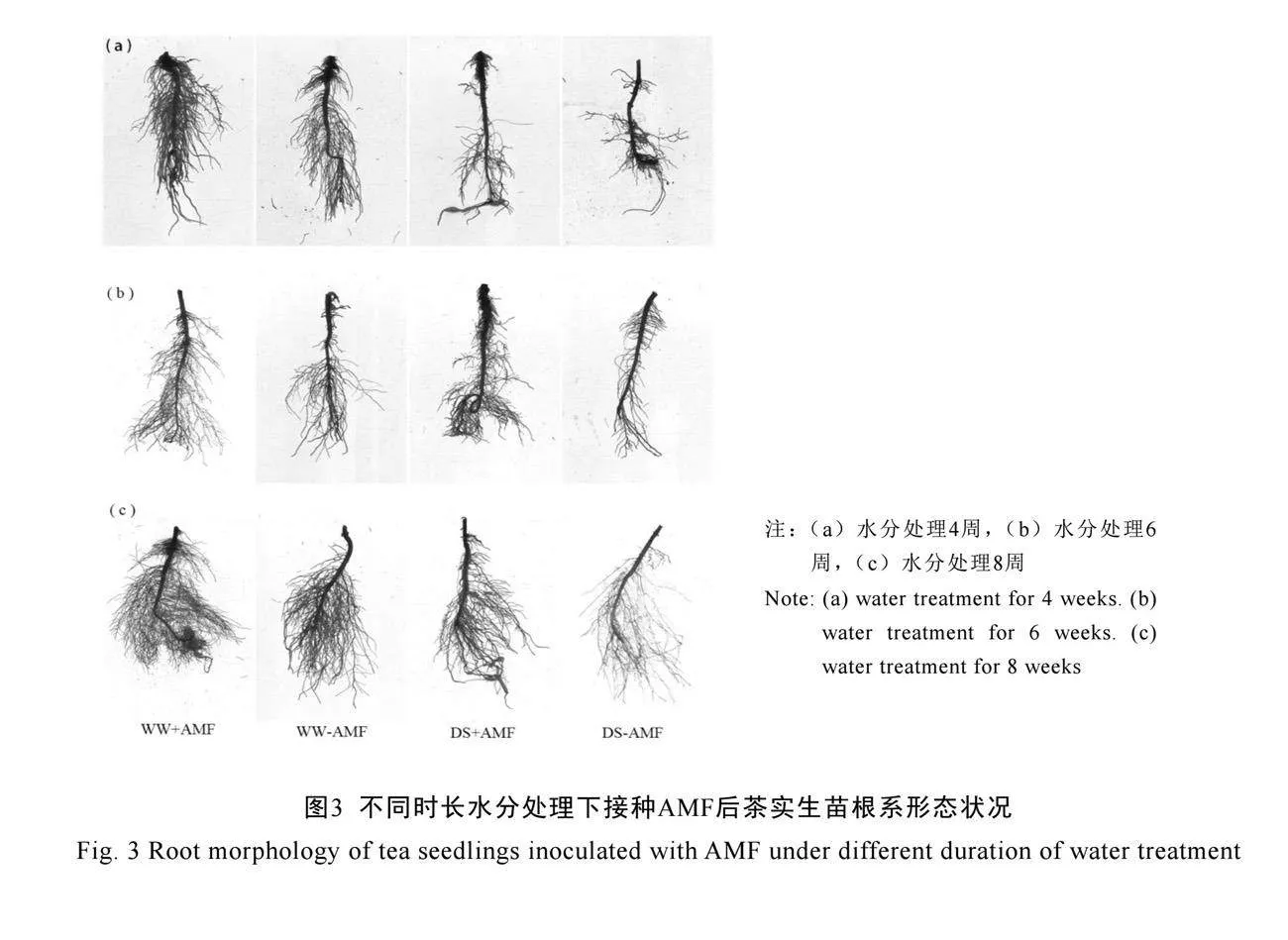
不同水分处理下AM真菌对茶树实生苗根系构型的影响如图3所示。不接种AM真菌(-AMF)处理的茶苗,在干旱胁迫下仅在第4周、6周时的根系体积、三级侧根数量以及6周时二
级侧根数量(P<0.05)显著降低;根系的发育在第8周时才被显著抑制,根系总长度降低、根系体积及各级侧根数量减少(表3)。与未接种AM真菌(-AMF)相比,接种AM真菌(+AMF)后显著促进了茶树根系发育。在正常水分下,接种AM真菌(+AMF)显著增加了根系总长度及一级、二级和三级侧根数量,在4周时分别增加了30.9%、35.3%、72.4%和200.0%,6周时分别增加了28.7%、61.2%、61.9%和60.0%,在8周时分别增加了34.5%、72.5%、57.1%和85.1%;在干旱胁迫下,接种AM真菌(+AMF)显著增加了茶树根系总长度、根系体积、二级侧根和三级侧根的数量(P<0.05),在4周时分别增加了20.0%、133.3%、48.9%和170.0%,在6周时分别增加了36.4%、268.1%、125.4%和171.43%,在8周时分别增加了38.8%、91.7%、163.3%和442.9%。由此可见,AM真菌对干旱胁迫下根系构型的促进作用更为显著,能有效缓解干旱胁迫对根系发育的抑制作用。
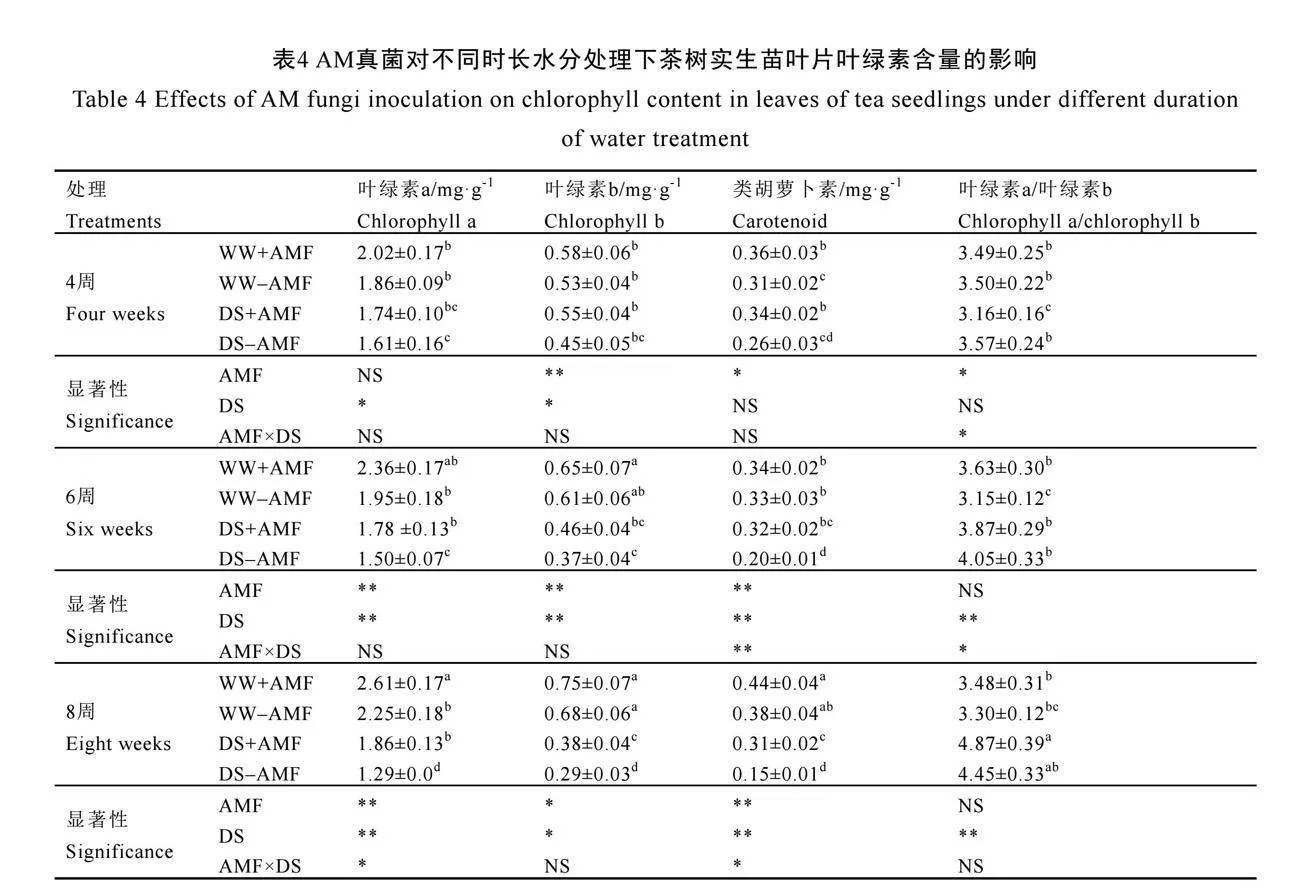
2.5 AM真菌对不同时长水分处理下茶树叶片叶绿素含量的影响
由表4可知,在未接种AM真菌(-AMF)下,干旱胁迫4周时仅显著降低了茶树叶片叶绿素a的含量,在6周和8周时显著降低了叶绿素a、叶绿素b和类胡萝卜素的含量,却显著提高了叶绿素a/叶绿素b的值(P<0.05)。与不接种AM真菌相比,在4周时,接种AM真菌(+AMF)显著增加了茶树叶片类胡萝卜素的含量,在正常水分和干旱胁迫下分别增加了16.13%和30.77%;与此同时,显著增加了干旱胁迫下叶绿素a/叶绿素b的值(P<0.05)。在6周时,接种AM真菌(+AMF)显著提高了干旱胁迫下茶树叶片叶绿素a和类胡萝卜素的含量,以及正常水分下叶绿素a/叶绿素b的值,对正常水分下色素含量和干旱胁迫下叶绿素a/叶绿素b的值无显著影响。在8周时,接种AM真菌仅显著增加了正常水分下叶绿素a的含量以及干旱胁迫下叶绿素a、叶绿素b和类胡萝卜素的含量,与不接种AM真菌相比,分别增加了16.00%、44.19%、31.03%和106.7%(P<0.05)。
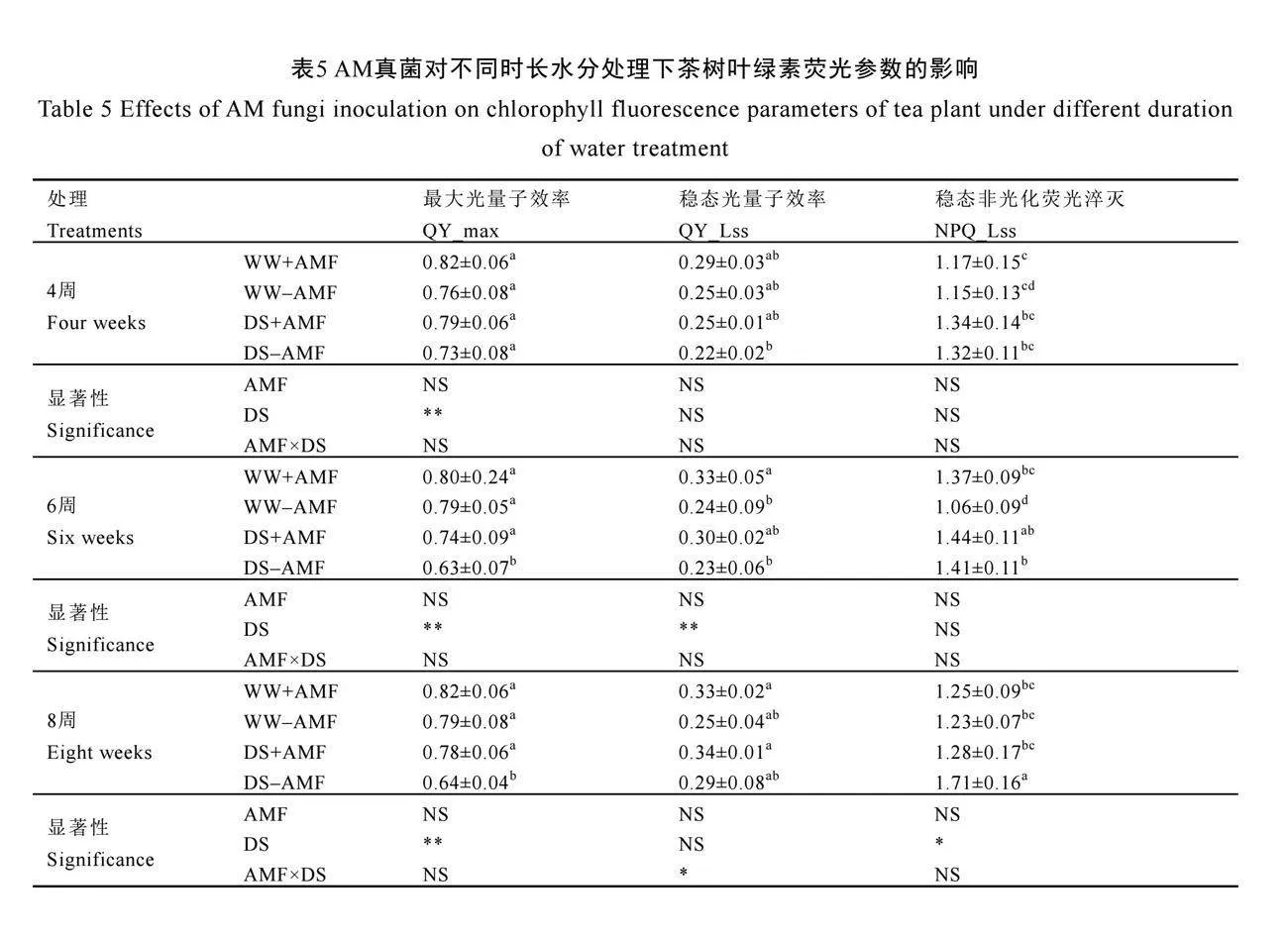
2.6 AM真菌对不同时长水分处理下茶树叶绿素荧光参数的影响
在未接种AM真菌(-AMF)下,干旱胁迫(DS)显著降低6周和8周时茶树叶片QY_max,与正常水分组相比分别降低了20.25%、18.99%,但是却显著增加了NPQ_Lss,分别增加了33.02%和39.02%(P<0.05,表5)。与不接种AM真菌相比,接种AM真菌(+AMF)显著增加了干旱胁迫(DS)下6周和8周时茶树叶片QY_max(P<0.05),分别增加了17.46%和21.88%,同时降低了在8周时茶树叶片NPQ_Lss,降低了25.15%;但是在正常水分下,接种AM真菌显著增加了6周时茶树叶片QY_Lss和NPQ_Lss(P<0.05),对其他荧光参数无显著影响(表5)。
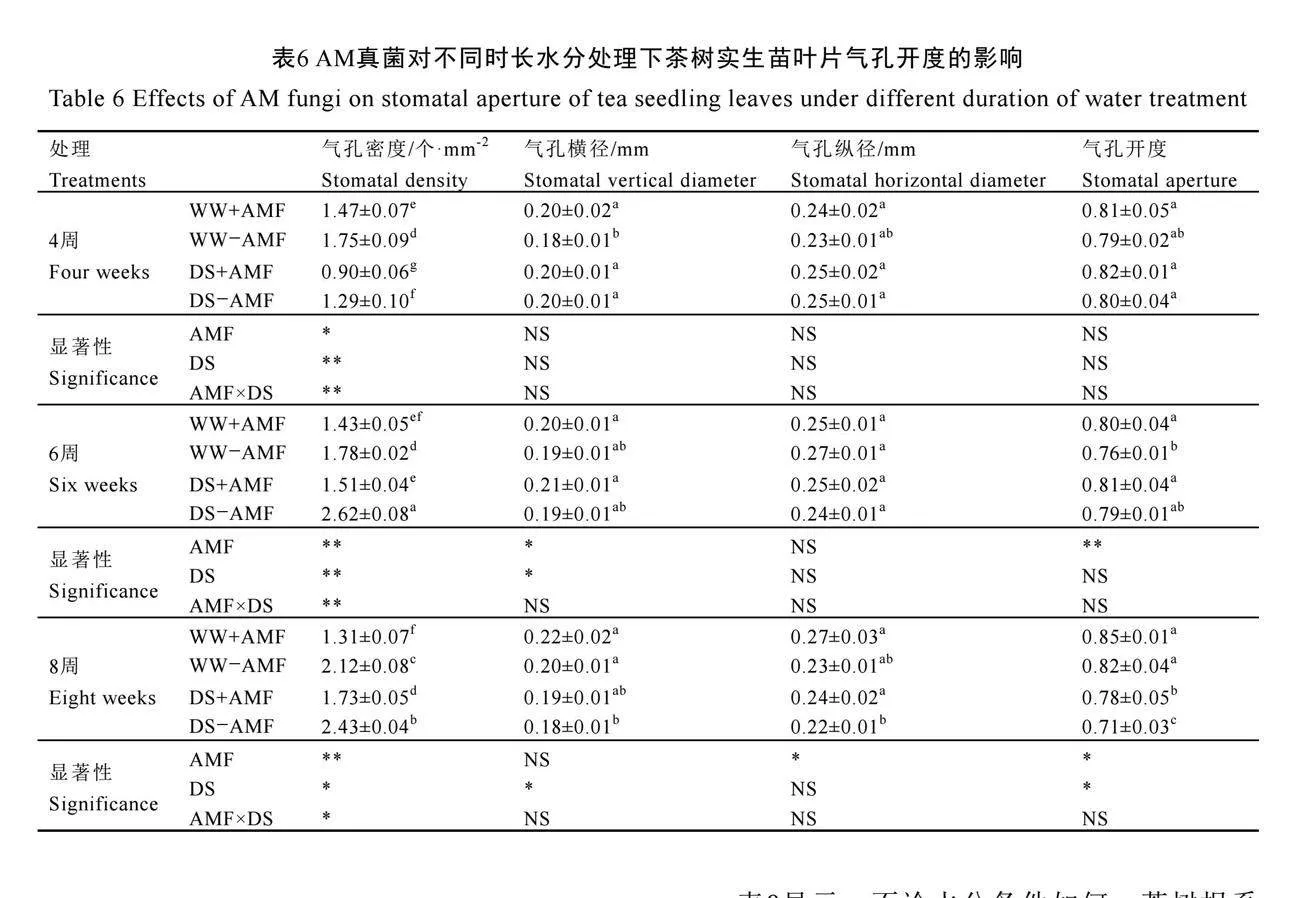
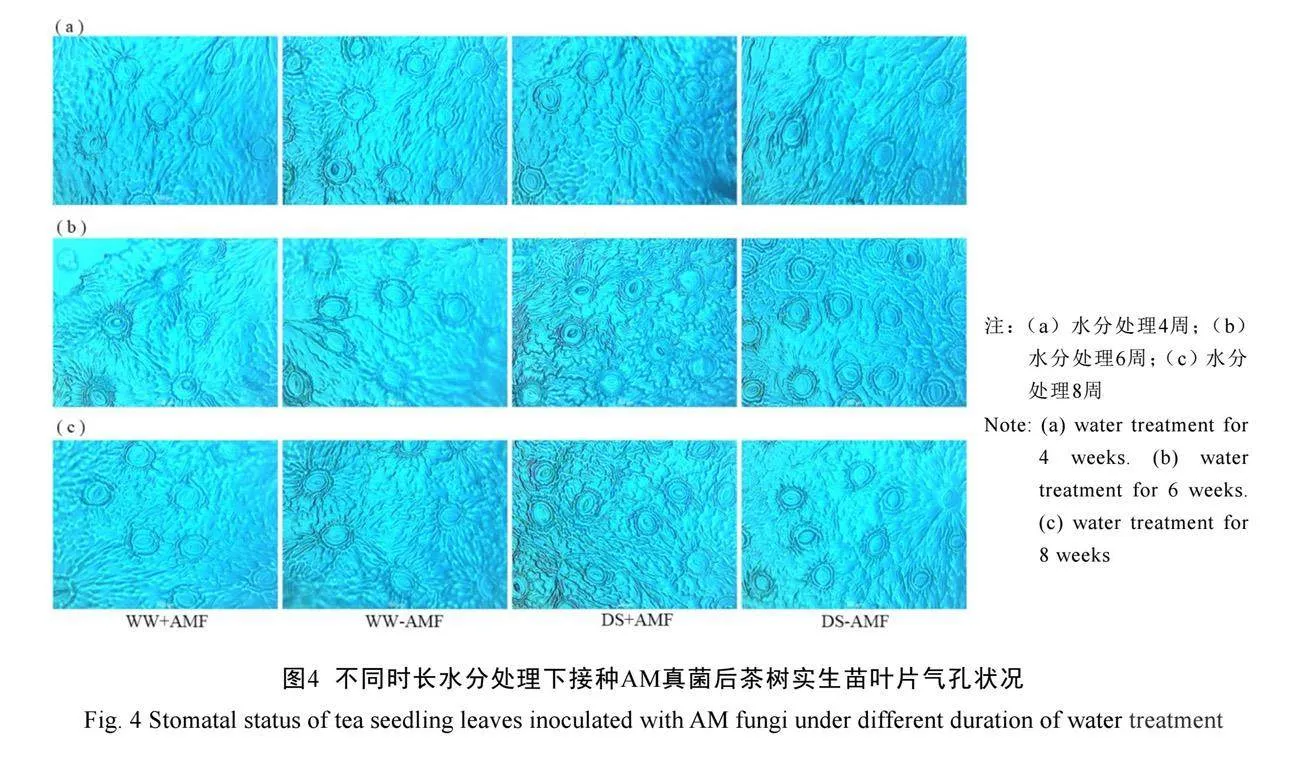
2.7 AM真菌对不同时长水分处理下茶树实生苗叶片气孔开度的影响
不同时长水分处理下,茶树实生苗叶片气孔状况如图4所示。在未接种AM真菌(-AMF)下,干旱胁迫4周时叶片气孔密度显著降低,气孔横径显著增加;6周时,仅显著增加了气孔密度;8周时,气孔密度显著增加,气孔横径和开度显著降低(P<0.05),且干旱胁迫处理对气孔纵径无显著影响(表6)。与不接种AM真菌相比,接种AM真菌(+AMF)显著降低了正常水分和干旱胁迫下茶树叶片气孔密度(P<0.05),在4周、6周、8周时分别降低了16.00%、19.66%、38.21%和30.23%、42.37%、28.81%。此外,接种AM真菌还显著增加了4周时正常水分下的气孔横径和8周时干旱胁迫下的气孔纵径,以及6周时正常水分处理下和8周时干旱胁迫下的气孔开度(表6)。
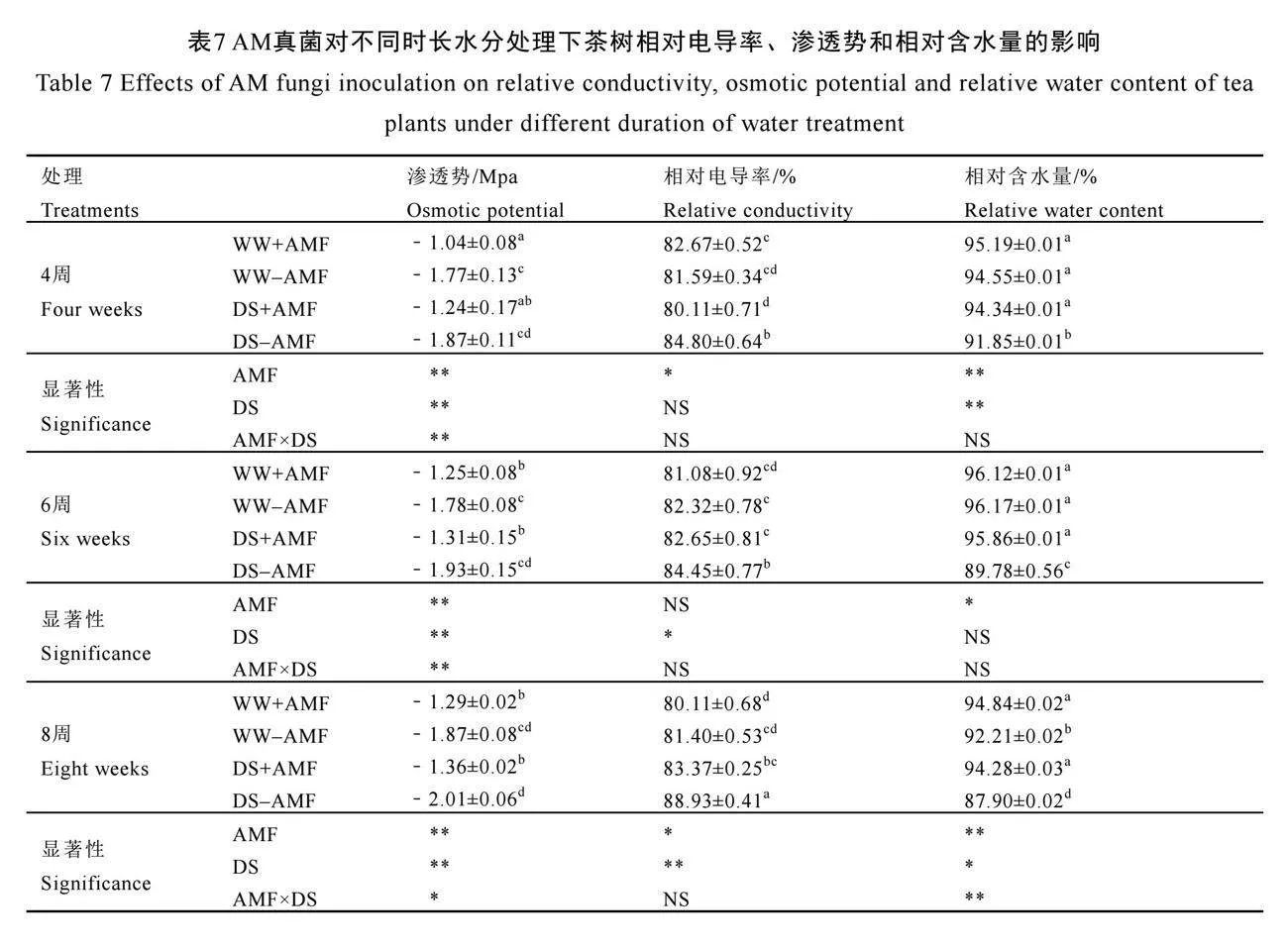
2.8 AM真菌对不同时长水分处理下茶树相对电导率、渗透势和相对含水量的影响
由表7可知,在未接种AM真菌(-AMF)的茶苗中,干旱胁迫显著增加了茶树相对电导率,但是却显著降低了茶树叶片相对含水量(P<0.05),对渗透势无显著影响。与未接种AM真菌相比,接种AM真菌(+AMF)显著增加了正常水分(WW)和干旱胁迫下渗透势,在4周、6周、8周时分别增加了41.24%、29.78%、31.02%和33.69%、32.12%、32.34%,表明AM真菌能够改善植物的水分状态,增强植株在胁迫环境下的抵抗能力。与此同时,接种AM真菌还显著降低了干旱胁迫(DS)下4周、6周、8周时茶叶电导率,但是却显著增加了叶片相对含水量,表明AM真菌的接种能减少细胞物质渗出,保护细胞膜的完整性,从而改善叶片水分状况。
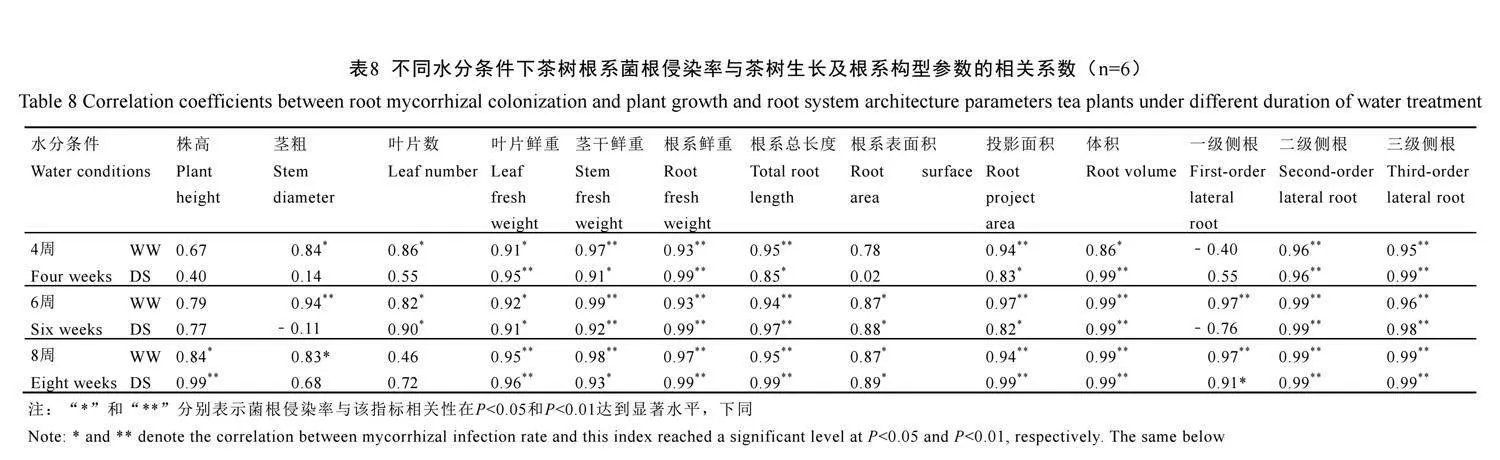
2.9 茶树根系菌根侵染率与茶树生长及根系构型参数相关关系
表8显示,不论水分条件如何,茶树根系菌根侵染率在4周、6周、8周时均与生物量(叶片、茎干、根系鲜重)、根系总长度、投影面积、体积、二级侧根和三级侧根的数量呈显著或极显著正相关(P<0.05或P<0.01);在6周、8周时均与根系表面积呈显著正相关(P<0.05)。除此之外,水分处理4周时,在正常水分下菌根侵染率与茎粗、叶片数呈显著正相关(P<0.05)。6周时,在正常水分下,菌根侵染率与茎粗、叶片数和一级侧根数量呈显著正相关,在干旱胁迫下与叶片数呈显著正相关(P<0.05)。8周时,在正常水分下,茶树根系菌根侵染率与株高,茎粗、一级侧根呈显著正相关,在干旱胁下与株高和一级侧根数量呈极显著负相关(P<0.01)。表明水分条件和处理时间均对茶树根系侵染率与生长和根系构型建立之间产生了显著的影响,尤其是在生物量、根系总长度和侧根发育方面效果极为显著,表明AM真菌侵染能显著促进茶树生长,即使在干旱胁迫下,也能促进茶树生长。
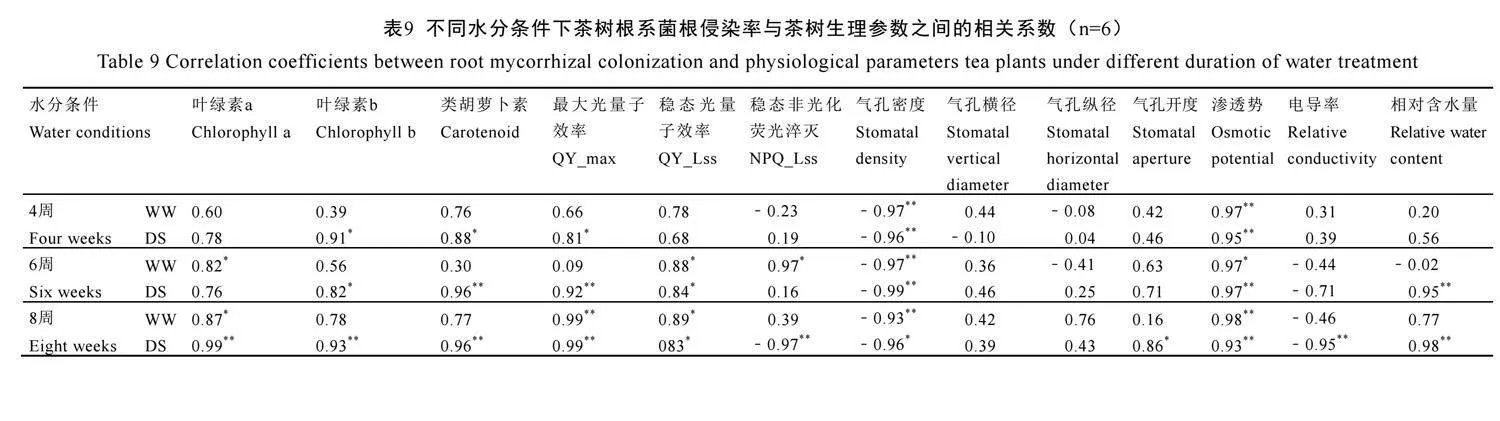
2.10 茶树根系菌根侵染率与茶树生理参数之间相关关系
由表9可见,不论水分条件如何,茶树根系菌根侵染率在4周、6周、8周时均与气孔密度呈极显著负相关(P<0.01)。此外,水分处理4周时,在正常水分下菌根侵染率仅与渗透式呈极显著正相关(P<0.01),在干旱胁迫下与叶绿素b、类胡萝卜素、QY_max(P<0.05)、渗透式(P<0.01)呈显著或极显著正相关。6周时,在正常水分下菌根侵染率与叶绿素a、QY_Lss、NPQ_Lss、渗透式呈显著正相关(P<0.05),在干旱胁迫下与叶绿素b、QY_Lss(P<0.05)、类胡萝卜素、QY_max、渗透式、相对含水量(P<0.01)呈显著或极显著正相关。8周时,在正常水分下菌根侵染率与叶绿素a、QY_Lss(P<0.05)、QY_max、渗透式(P<0.01)呈显著或极显著正相关,在干旱胁迫下与QY_Lss、气孔开度(P<0.05)、叶绿素a、叶绿素b、类胡萝卜素、QY_max、渗透式、相对含水量(P<0.01)呈显著或极显著正相关,但是却与NPQ_Lss和相对电导率呈极显著负相关(P<0.01)。表明水分条件和处理时间影响了AM真菌侵染与茶树生理参数间的相关性,干旱胁迫下AM真菌与这些生理参数之间相关性更强,表明AM真菌侵染有利于改善茶树对干旱胁迫的生理响应。
3 讨论
干旱胁迫是限制茶树生长发育的主要因素之一,极端气候变化导致干旱频繁发生,直接影响着茶叶的产量和品质[1]。AM真菌与植物共生产生的大量根外菌丝能够促进宿主植物对水分和养分的吸收,从而提高植物对干旱胁迫的抵御能力,增强宿主植物对干旱胁迫的适应性[10]。本研究发现AM真菌能与福鼎大白茶根系建立良好的共生关系,且在正常水分下
侵染率和土壤菌丝长度随处理时间的延长而提高。在干旱胁迫下,茶树根系菌根侵染率显著降低,且随着干旱胁迫时间的延长而逐渐下降,根际土壤菌丝长度也显著降低。这与王玉娟等[13]和Liu等[21]在茶树上的研究结果一致。虽然短时间的干旱处理也会抑制AM真菌的侵染,但宿主植物根系菌根侵染率仍然呈现增长缓慢的趋势,这主要归因于宿主植物体内保存的水分以及积累的碳水化合物还能继续促进菌丝的发育[22],然而长期的水分亏缺抑制了孢子的萌发和菌丝的扩展,以及碳水化合物的积累[23],同时使得宿主植物生长代谢变缓,AM真菌无法从宿主中获取充足的营养。因此在本研究中持续的干旱处理导致根系菌根侵染率和土壤菌丝长度下降,这与Ortas等[24]的研究结果一致。
干旱胁迫是抑制植物生长,影响产量和品质的限制性因子。在本研究中我们也得到了相似的结果,发现干旱胁迫处理显著抑制了茶树实生苗的生长,降低了茶树地上部和地下部生物量。然而接种AMF后显著改善了不同水分处理下茶苗的生长表型,显著增加了茶树植株生物量,且在干旱胁迫下的促进效果更为显著。这与前人在柑橘[25]上的研究结果一致。相关关系分析也显示,不论水分状况为何,茶树根系菌根侵染率与不同时长水分处理下茶树生物量呈极显著正相关,表明干旱胁迫虽然抑制AM真菌与茶树根系共生关系的建立,但是AM真菌的侵染仍然促进了茶苗的生长,这主要归因于AM真菌庞大的根外菌丝网络增强了水分和养分的吸收,改善了宿主植物养分状况,提高了植株的抗旱能力[26]。此外,根外菌丝还会向土壤中分泌球囊霉素蛋白,不仅能够促进土壤团聚体的形成从而提高土壤的保水能力,还可为土壤提供充足的有机碳、氮等大量元素,为宿主植物有机物质的积累提供保障[27]。
根系可塑性高,能对周围环境变化做出快速响应。然而在众多环境因素中,土壤水分状况和养分含量对根系的生长起决定性作用[28]。在本研究中,干旱胁迫显著抑制了茶树根系构型的建立,在侧根发育方面的抑制作用尤为显著,这与Liu等[21]在茶树上的研究结果一致。然而,AM真菌作为土壤中的一类有益微生物,对根系构型的影响不言而喻。先前的研究发现AM真菌可通过调控宿主植物根系构型促进植物生长[21]。本研究发现,接种AM真菌处理显著改善茶树根系构型,无论是在正常水分还是干旱胁迫下,都显著增加了根系总长度以及各级侧根的数量。这与前人在柑橘[27]上的研究结果一致。这可能是因为AM真菌提高了根系对水分和养分的吸收,增强了根系活力,从而促进了根系发育[29]。此外,AM真菌可能通过影响植物生理和代谢过程,主要表现为改变宿主植物内源激素的水平,促进根系发育[30]。相关关系分析显示,不论水分状况为何,水分处理4周、6周、8周时茶树根系菌根侵染率与茶树根系总长度、根系投影面积、二级侧根以及三级侧根的数量呈显著正相关,在6周和8周时与根系表面积呈显著正相关,与6周时正常水分下的一级侧根以及8周时的一级侧根数量呈显著正相关,这进一步说明AM真菌侵染在改善茶树根系构型方面具有积极地作用。良好根系构型是地上部分形态建成的基础,这也为本研究中干旱胁迫下AM真菌仍然促进茶树生长提供了证据。
叶绿素含量和叶绿素荧光参数是反映植物光合能力的主要指标,同时也反映着植物在逆境胁迫下的抵抗能力。在干旱胁迫下,植物体内活性氧的积累会致使膜结构发生变化,从而抑制叶绿素的合成与积累。本研究结果显示,干旱胁迫处理4周时茶树叶片叶绿素a含量显著降低,6周和8周时叶绿素a、叶绿素b及类胡萝卜素含量显著降低,表明干旱胁迫会使得叶片细胞器受到损伤,从而影响叶绿素的合成。在4周时,干旱胁迫并未显著影响叶绿素b和类胡萝卜素的含量,这可能是因为短时间的干旱胁迫下,茶树一方面通过抑制叶绿素类物质的消耗,另一方面通过强化胞质抗氧化系统,增强了叶绿素的稳定性。此外,在本研究中,接种AM真菌显著促进了干旱胁迫下4周时类胡萝卜素、6周时叶绿素a和类胡萝卜素以及8周时茶树叶片色素的积累,但在正常水分下仅显著增加了4周时类胡萝卜素和8周时叶绿素a的含量,这与Dai等[2]在茶树上的研究结果一致。相关关系分析结果显示,茶根系菌根侵染率与4周、6周、8周时叶绿素b和类胡萝卜素的含量呈显著正相关,与6周和8周时的叶绿素a呈显著正相关,表明AM真菌能够有效缓解干旱胁迫对茶树叶片光合器官的损伤以及叶绿素的破坏作用,保护细胞器免受损伤,从而通过促进宿主植物叶绿素的合成与积累,增强光合作用,促进茶树地上部分的形态建成与植株的发育。
叶绿素荧光参数反映着植物在不同环境下的光合反应器的化学性能。先前在茶树上的研究结果显示,干旱胁迫会导致叶片的最大光化学效率、实际光化学量子产率和光化学猝灭系数呈现降低,然而接种AM真菌能显著改善这些荧光参数值[2]。本研究结果显示干旱胁迫处理6周时显著降低了茶树叶片QY_max,增加了NPQ_Lss,这与方必君等[31]在野牡丹上的研究结果一致,表明干旱胁迫会降低光合器官活性以及光能转换效率。与此同时,接种AM真菌仅显著增加了干旱胁迫处理6周和8周时QY_max以及6周时NPQ_Lss,这与马坤等[32]的研究结果一致。相关关系分析显示,茶树根系菌根侵染率与干旱胁迫处理4周时的QY_max、6周时和8周时QY_max、QY_Lss呈显著正相关,表明接种AM真菌能够增强宿主植物光合器官活性,促进光能转换,从而减轻干旱胁迫对茶树幼苗光系统的损失,以此增强植物的光合性能,促进宿主植物生长。
气孔是植物与外界气体交换和水汽运输的通道,同时也调控着植物蒸腾速率的快慢和光合作用的强弱。在干旱胁迫下,植物可通过调节气孔的开度和密度从而降低蒸腾作用,减少植物体内水分的散失。本研究结果显示,干旱胁迫处理4周时,茶苗叶片气孔密度降低,在6周和8周时气孔密度增加,且在8周时气孔开度显著降低,这与吴学蕤等[33]的研究结果一致。在干旱处理前期气孔密度降低可能是植物对逆境环境的适应策略,在干旱胁迫下通过减少叶片气孔开度来减少水分的蒸腾,同时为保证植物通过叶片能吸收更多的水分而增加气孔数量。在6周以后,可能是因为干旱胁迫抑制了叶片的生长,使得叶面积变小,从而造成单位面积内密度变大。此外,本研究结果还显示,接种AM真菌处理显著增加了6周时正常水分下以及8周时干旱胁迫下茶苗叶片气孔开度,显著降低了4周、6周和8周时的气孔密度,这与刘婷等[34]的研究结果一致。表明AM真菌可通过增加茶苗叶片气孔开度以获取更大的气体交换空间。而气孔密度的降低可能是由于AM真菌使植物体内水分增加,叶面积增大,从而使茶苗叶片气孔密度减少。相关分析显示,不论是在正常水分还是在干旱胁迫下,茶树根系菌根侵染率与气孔密度呈显著负相关,与8周时干旱胁迫下气孔开度呈显著正相关,进一步证明AM真菌侵染参与了茶树叶片气孔的变化,扩大气体交换空间,从而促进植物生长,增强植物抗性。
相对电导率和渗透势反映着植物在逆境胁迫下的伤害程度。在非生物胁迫下,植株细胞膜可能会受到不同程度的损伤,膜透性增大,细胞内电解质外渗使细胞相对电导率增大,渗透势降低[35]。本研究结果显示,干旱胁迫显著增加了茶树的相对电导率,随着干旱胁迫时间的延长,相对电导率逐渐增大,这与李津津等[36]在核桃上的研究结果一致,说明干旱胁迫处理对茶树叶片细胞膜造成了一定的损伤。然而,AM真菌侵染后,干旱胁迫下的茶树叶片相对电导率显著降低,但无论是在正常水分还是在干旱胁迫下,AM真菌侵染均显著提高了茶树叶片渗透势,这与前人[6]的研究结果一致。相关关系分析显示,不论水分状况如何,茶树根系菌根侵染率均与4周、6周和8周时的渗透式呈显著正相关,与8周时干旱胁迫下相对电导率呈显著负相关,表明AM真菌具有缓解植株细胞膜过氧化,维持细胞膜稳定性的作用,在一定程度上增强植株的抗旱能力,在逆境胁迫下维持宿主植物健壮生长。
相对含水量是衡量植物体内水分状况的重要指标,反映了植株体内水分亏缺程度和体内代谢活性。AM真菌与宿主植物共生后,其庞大的菌丝网络能够帮助植株吸收更多的水分,同时还能改善根系构型以增加宿主植物根系吸收面积,使植株保持良好的水分状况[26]。本研究中,干旱胁迫显著降低了茶树叶片相对含水量,但是接种AM真菌显著提高了茶树叶片相对含水量,这与前人在枳[37]上的研究结果一致。相关关系分析结果显示,在6周和8周时,茶根系菌根侵染率与干旱胁迫下茶叶片相对含水量呈极显著的正相关关系,表明AM真菌在促进水分吸收,改善植物体内水分的转运与分布方面具有重要作用。水分条件的改善不仅为宿主植物的生长提供了非常有利的环境条件,同时在逆境胁迫下还能增强植株对不良环境的适应能力。
综上所述,AM真菌能通过促进干旱胁迫下福鼎大白茶根系形态的建立、促进侧根的发生,改善植株体内水分的运输与分布,从而促进茶树生长。此外,AM真菌还能通过改善茶树叶片色素的合成与积累、气孔的数量与开度来改善气体交换空间、增强最大光量子效应改善光合,同时通过调节水势缓解活性氧伤害,从而提高植物的生产性能,提高茶树对干旱胁迫的抵御能力。
参考文献
[1] Zhang S Y, Liu J J, Zhong G X, et al. Genome-wide identification and expression patterns of the C2H2-Zinc finger gene family related to stress responses and catechins accumulation in Camellia sinensis (L.) O. Kuntze [J]. International Journal of Molecular Sciences, 2021, 22(8): 4197-4214.
[2] Dai F J, Rong Z Y, Wu Q S, et al. Mycorrhiza improves plant growth and photosynthetic characteristics of tea plants in response to drought stress [J]. Biocell, 2022, 46(5): 1339-1346.
[3] Shen J Z, Wang S S, Sun L T, et al. Dynamic changes in metabolic and lipidomic profiles of tea plants during drought stress and re-watering [J]. Frontiers in Plant Science, 2022, 13: 978531. doi: 10.3389/fpls.2022.978531.
[4] 黄文镜, 杨树华, 葛红, 等. AMF对观赏植物生长发育影响的研究进展[J]. 中国农学通报, 2023, 39(7): 55-63.
Huang W J, Yang S H, Ge H, et al. Research of AMF on the growth and development of ornamental plants [J]. Chinese Agricultural Science Bulletin, 2023, 39(7): 55-63.
[5] Bagheri V, Shamshiri M H, Alaei H, et al. The role of inoculum identity for growth, photosynthesis, and chlorophyll fluorescence of zinnia [J]. Bhotosynthetica, 2019, 57(2): 409-419.
[6] Ye Q H, Wang H, Li H. Arbuscular mycorrhizal fungi enhance drought stress tolerance by regulating osmotic balance [J]. Australian Journal of Grape and Wine Research, 2023, 2023: 1-13.
[7] Abdurrahim Y, Ertan Y, Hilal Y, et al. Use of arbuscular mycorrhizal fungi for boosting antioxidant enzyme metabolism and mitigating saline stress in sweet basil (Ocimum basilicum L.) [J]. Sustainability, 2023, 15(7): 5982-5996.
[8] Bahadur A L I, Batool A S F A, Nasir F A H A D, et al. Mechanistic insights into arbuscular mycorrhizal fungi-mediated drought stress tolerance in plants [J]. International Journal of Molecular Sciences, 2019, 20(17): 4199-4217.
[9] Liang S M, Li Q S, Liu M Y, et al. Mycorrhizal effects on growth and expressions of stress-responsive genes (aquaporins and SOSs) of tomato under salt stress [J]. Journal of Fungi, 2022, 8(12): 1305-1315.
[10] Yan Q X, Li X Y, Xiao X F, et al. Arbuscular mycorrhizal fungi improve the growth and drought tolerance of Cinnamomum migao by enhancing physio-biochemical responses [J]. Ecology and Evolution, 2022, 12(7): e9091. doi: 10.1002/ece3.9091.
[11] Singh S, Pandey A, Chaurasia B, et al. Diversity of arbuscular mycorrhizal fungi associated with the rhizosphere of tea growing in ‘natural’ and ‘cultivated’ ecosites [J]. Biology and Fertility of Soils, 2008, 44: 491-500.
[12] 卢东升, 吴小芹. 豫南茶园VA菌根真菌种类研究[J]. 南京林业大学学报(自然科学版), 2005, 29(3): 33-36.
Lu D S, Wu X Q. Species of VAM fungi around tea roots in the southern area of Henan province [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2005, 29(3): 33-36.
[13] 王玉娟, 高秀兵, 吴强盛, 等. 不同水分条件下AM真菌对福鼎大白茶生长和茶叶品质的影响[J]. 茶叶科学, 2020, 40(5): 588-596.
Wang Y J, Gao X B, Wu Q S, et al. Influences of arbuscular mycorrhizal fungi on plant growth and tea quality of Fuding Dabaicha seedlings under different water conditions [J]. Journal of Tea Science, 2020, 40(5): 588-596.
[14] 许平辉, 王飞权, 齐玉岗, 等. 丛枝菌根真菌对茶树抗旱性的影响[J]. 西北农业学报,2017, 26(7): 1033-1040.
Xu P H, Wang F Q, Qi Y G, et al. Effect of arbuscular mycorrhiza fungi on drought resistance in tea plant (Camellia sinensis) [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2017, 26(7): 1033-1040.
[15] 王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京: 高等教育出版社, 2006.
Wang X K. Experimental principles and techniques of plant physiology and biochemistry [M]. 2nd ed. Beijing: Higher Education Press, 2006.
[16] Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection [J]. Transactions of the British Mycological Society, 1970, 55: 158-161.
[17] Bethlenfalvay G J, Ames R N. Comparison of two methods for quantifying extraradical mycelium of vesicular-arbuscular mycorrhizal fungi [J]. Soil Science Society of America Journal, 1987, 51: 834-837.
[18] Bajji M, Lutts S, Kinet J M. Water deficit effects on solute contribution to osmotic adjustment as a function of leaf ageing in three durum wheat (Triticum durum Desf.) cultivars performing differently in arid conditions [J]. Plant Science, 2001, 160(4): 669-681.
[19] 孙琪璐. 复水方式对干旱胁迫下茶树的影响及CsSnRK2基因家族的克隆与表达[D]. 合肥: 安徽农业大学, 2019.
Sun Q L. Effect of rehydration method on tea plant under drought stress and cloning and expression of CsSnRK2 gene family [D]. Hefei: Anhui Agricultural University, 2019.
[20] 杨妮, 万绮雯, 李逸民, 等. 外源亚精胺对盐胁迫下茶树光合特性及关键酶基因表达的影响[J]. 园艺学报, 2022, 49(2): 378-394.
Yang N, Wan Q W, Li Y M, et al. Effects of exogenous spermidine on photosynthetic characteristics and gene expression of key enzymes under salt stress in tea plant [J]. Acta Horticulturae Sinica, 2022, 49(2): 378-394.
[21] Liu C Y, Hao Y, Wu X L, et al. Arbuscular mycorrhizal fungi improve drought tolerance of tea plants via modulating root architecture and hormones [J]. Plant Growth Regulation, 2024, 102(1): 13-22.
[22] Zou Y N, Zhang F, Srivastava A K, et al. Arbuscular mycorrhizal fungi regulate polyamine homeostasis in roots of trifoliate orange for improved adaptation to soil moisture deficit stress [J]. Frontiers Plant Science, 2021, 11: 600792. doi: 10.3389/fpls.2020.600792.
[23] Liu C Y, Wang Y J, Wu Q S, et al. Arbuscular mycorrhizal fungi improve the antioxidant capacity of tea (Camellia sinensis) seedlings under drought stress [J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2020, 48(4): 1993-2005.
[24] Ortas I, Rafique M, Çekiç F Ö. Do mycorrhizal fungi enable plants to cope with abiotic stresses by overcoming the detrimental effects of salinity and improving drought tolerance? [J]. Symbiotic Soil Microorganisms: Biology and Applications, 2021: 391-428.
[25] 李雪. 丛枝菌根真菌对干旱胁迫下柑橘幼苗生长及抗旱性的影响[D]. 重庆: 西南大学, 2022.
Li X. Effects of arbuscular mycorrhizal fungi on growth and drought resistance of citrus seedlings under water stress [D]. Chongqing: Southwest University, 2022.
[26] 蒲子天, 张林, 张弛, 等. 丛枝菌根真菌与植物共生影响植物水分状态的研究进展[J]. 土壤, 2022, 54(5): 882-889.
Pu Z T, Zhang L, Zhang C, et al. Research progress of arbuscular mycorrhizal fungi and plant symbiosis affecting plant water regime [J]. Soils, 2022, 54(5): 882-889.
[27] Guo X N, Hao Y, Wu X L, et al. Exogenous easily extractable glomalin-related soil protein stimulates plant growth by regulating tonoplast intrinsic protein expression in lemon [J]. Plants, 2023, 12(16): 2955-2967.
[28] Liu C Y, Guo X N, Dai F J, et al. Mycorrhizal symbiosis enhances P uptake and indole-3-acetic acid accumulation to improve root morphology in different citrus genotypes [J]. Horticulture, 2024, 10(4): 339-415.
[29] Liu C Y, Zhang F, Zhang D J, et al. Mycorrhiza stimulates root-hair growth and IAA synthesis and transport in trifoliate orange under drought stress [J]. Scientific Reports, 2018, 8(1): 1978-1987.
[30] 王浩, 孙丽英. 植物激素调控丛枝菌根发育的作用机制研究进展[J]. 微生物学通报, 2022, 49(10): 4448-4466.
Wang H, Sun L Y. Mechanisms of phytohormones in regulating arbuscular mycorrhiza development [J]. Microbiology China, 2022, 49(10): 4448-4466.
[31] 方必君, 卓定龙, 刘晓洲, 等. 干旱胁迫及复水对野牡丹光合和叶绿素荧光参数的影响[J]. 热带农业科学, 2023, 43(2): 44-49.
Fang B J, Zhuo D L, Liu X Z, et al. Effects of drought stress and rehydration on photosynthetic and chlorophyll fluorescence parameters of Melastoma candidum D. Don [J]. Chinese Journal of Tropical Agriculture, 2023, 43(2): 44-49.
[32] 马坤, 王彦淇, 杨建军, 等. 不同干旱胁迫条件下丛枝菌根真菌对木棉叶绿素荧光参数的影响[J]. 植物资源与环境学报, 2017, 26(3): 35-43.
Ma K, Wang Y Q, Yang J J, et al. Effect of arbuscular mycorrhizal fungi on chlorophyll fluorescence parameters of Bombax ceiba under different drought stress conditions [J]. Journal of Plant Resources and Environment, 2017, 26(3): 35-43.
[33] 吴学蕤, 赵庆霞, 蔡银美, 等. 干旱-复水对构树叶片水势和气孔开闭的影响[J]. 草地学报, 2023, 31(3): 769-776.
Wu X R, Zhao Q X, Cai Y M, et al. Effects of drought-rewatering on leaf water potential and stomatal opening and closing of Broussonetia papyrifera [J]. Acta Agrestia Sinica, 2023, 31(3): 769-776.
[34] 刘婷, 唐明. 丛枝菌根真菌对杨树生长、气孔和木质部微观结构的影响[J]. 植物生态学报, 2014, 38(9): 1001-1007.
Liu T, Tang M. Effects of arbuscular mycorrhizal fungi on growth and anatomical properties of stomata and xylem in poplars [J]. Chinese Journal of Plant Ecology, 2014, 38(9): 1001-1007.
[35] 杨海莉. 小花碱茅对渗透胁迫与等渗透势盐胁迫的生理响应[D]. 兰州: 兰州大学, 2019.
Yang H L. Physiological response of Puccinellia tenuiflora to osmotic and isotonic salt stress [D]. Lanzhou: Lanzhou University, 2019.
[36] 李津津, 赵书岗, 安秀红, 等. 干旱胁迫下核桃生理适应性及抗性指标筛选[J]. 中国果树, 2023, 84(3): 72-78.
Li J J, Zhao S G, An X H, et al. Physiological adaptation of walnut under drought stress and screening of its resistance indexes [J]. China Fruits, 2023, 84(3): 72-78.
[37] 张菲, 邹英宁, 吴强盛. AM真菌摩西管柄囊霉对干旱胁迫下枳抗氧化酶基因表达的影响[J]. 菌物学报, 2019, 38(11): 2043-2050.
Zhang F, Zou Y N, Wu Q S. Effects of Funneliformis mosseae on the expression of antioxidant enzyme genes in trifoliate orange exposed to drought stress [J]. Mycosystema, 2019, 38(11): 2043-2050.

