心房和肺静脉机械牵张在慢性心力衰竭合并心房颤动中的作用与相关治疗的研究进展
【摘要】心房颤动是心力衰竭患者最常见的心律失常之一。心力衰竭引发心房颤动的机制主要涉及炎症反应、血流动力学引起的机械牵张及离子通道的变化导致的电生理重塑等,其中机械牵张被认为是诱发心房颤动的关键因素之一。目前研究已证明,心力衰竭合并心房颤动的治疗往往存在复发率高和预后不佳等问题,因此,深入探究病因并寻找新的防治策略尤为重要。现主要综述心房和肺静脉机械牵张在慢性心力衰竭合并心房颤动患者病情发生、发展过程中的病理生理机制,探讨减少心房和肺静脉机械牵张在治疗及预后判断中的潜在作用。
【关键词】心力衰竭;心房颤动;心房;肺静脉;机械牵张
【DOI】10.16806/j.cnki.issn.1004-3934.2024.10.007
The Role and Related Treatment of Atrial and Pulmonary Vein Mechanical Stretch in Chronic Heart Failure Complicated with Atrial Fibrillation
ZHANG Chenyue,LU Yanmei,TANG Baopeng
(Department of Pacing and Electronphysiology/Department of Cardiac Electrophysiology and Cardiac Remodeling,The First Affiliated Hospital of Xinjiang Medical University,Urumqi 830054,Xinjiang,China)
【Abstract】Atrial fibrillation is one of the most prevalent arrhythmias in patients with heart failure.The mechanism of atrial fibrillation induced by heart failure mainly involves inflammatory reaction,hemodynamically induced mechanical stretch and electrophysiological remodeling caused by ion channel changes,among which mechanical stretch is considered to be one of the key factors inducing atrial fibrillation.Current studies have proved that the treatment of heart failure combined with atrial fibrillation often has high recurrence rate and poor prognosis,so it is particularly important to explore the etiology and find new prevention and treatment strategies.This article mainly reviews the pathophysiological mechanism of atrial and pulmonary vein mechanical stretch in the occurrence and development of heart failure patients with atrial fibrillation,and discusses the potential role of reducing atrial and pulmonary vein mechanical stretch in treatment and prognosis.
【Keywords】Heart failure;Atrial fibrillation;Atrial;Pulmonary vein;Mechanical stretch
心力衰竭(heart failure,HF)是由众多因素导致心脏结构或功能异常,引起心室充盈或射血功能障碍,进而引起肺、体循环淤血等症状的临床综合征。长期以来,HF与心律失常的发生密切相关,心房颤动(atrial fibrillation,AF)是HF患者中最常见的心律失常之一,对患者的生活质量和预后造成严重的影响,超过1/3的慢性HF患者在病程中出现AF[1]。AF不仅加剧HF症状,还显著增加卒中和死亡风险,为治疗带来严峻的挑战[2]。而机械牵张是引起心律失常的重要因素之一,追溯到1982年,Lab[3]首次提出心脏的机械-电反馈机制,认为心脏主动或被动的机械活动对其电活动具有反馈作用,可引起AF等心律失常的发生发展。在HF状态下,心脏负荷的改变,会影响心房的血流动力学,进而诱发心房和肺静脉机械牵张,随之心脏机械牵张敏感离子通道激活,造成心肌电传导与有效不应期的改变,为AF的发生和维持提供生理基础。
因此,通过减轻心脏负荷、抑制心房结构重塑从而减少心房和肺静脉机械牵张引起的电生理改变,是预防慢性HF患者AF的发生及改善预后的关键策略。现综述此治疗方向,探讨这一潜在的治疗方向。
1 HF合并AF的流行病学
HF是一种以高患病率和死亡率为特征的缓进性心血管疾病。据统计,全球HF患者约2 600万,占成年人口约2%[4],尤其以老年人与男性为主要患病人群。在中国,HF患病人群更为庞大,25岁以上人群中HF患者约1 205万,且每年约有297万新发HF患者[5],患者出院后半年病死率为5.5%,这加重了社会负担。
HF促进了AF的发生,Framingham心脏中心研究[1]表明,超过1/3的新发AF患者伴有慢性HF,HF显著增加了AF的患病风险[6],特别是在射血分数正常的HF患者中更为明显,并且随着美国纽约心脏病协会心功能分级的升高,AF的发病率也随之增高[7]。HF相关AF不仅加剧心功能的恶化,还显著增加了卒中和死亡风险。研究[8]表明,相较于仅有HF的人群,HF合并AF患者的卒中风险增加了2~3倍。
2 机械牵张
心肌机械活动、血流动力学变化、心脏负荷改变、心包限制以及胸腔压力波动等均会引起心肌的机械牵张。某些病症,例如睡眠呼吸暂停综合征、心脏瓣膜疾病、肺动脉高压,可能会直接或间接地增加心房和肺静脉机械牵张,常与AF合并发生。其中,HF导致心脏收缩或舒张功能障碍,引起心房和肺静脉机械牵张,是直接导致电生理特征改变进而引发AF的重要因素。机械牵张分为急性机械牵张和慢性机械牵张,急性机械牵张减缓肺静脉与左心房之间的电信号传导,促成心房内折返环路,在AF的发生和维持中起着重要作用[9];慢性机械牵张则引起神经内分泌激素变化和心房结构重塑,导致电重塑,进而促发AF。
2.1 机械牵张导致心房结构重塑
长期慢性机械牵张使心房肌纤维承受的压力增大,导致心肌纤维伸长,造成心房肌细胞凋亡、肌原纤维降解、间质纤维化,以及缝隙连接下调,最终导致心肌电传导改变,诱发AF。一项前瞻性队列研究[10],对3 147例患者随访发现,右心房最大和最小容积指数的升高是AF复发的独立危险因素(HR=1.13,P=0.041;HR=1.12,P<0.001)。心房腔大小与房性心律失常的发生密切相关,反映了由机械牵张引起的心房结构重塑程度。此外,随着斑点超声心动图在临床上的应用,心肌应变通过描述一个心动周期内心肌纤维长度的变化,更加直观地反映心肌形变程度,尤其是左心房储器期应变,目前已成为评价心房重塑与功能、卒中分层、识别隐匿的阵发性AF、评估AF复律治疗后复发的敏感性指标[11]。心房大小与左心房应变作为衡量心房结构重塑的重要指标,与评估HF患者AF的发生、进展密切相关。心房结构重塑,包括缝隙连接紊乱和间质纤维化,是心房电重塑的基础。
2.1.1 缝隙连接的改变
心脏心肌细胞与间质细胞间的缝隙连接对心脏电活动、兴奋和传导至关重要。这些缝隙连接主要由间隙连接蛋白(connexin,Cx)亚单位组成,心房缝隙连接以Cx43和Cx40为主。Cx表达的变化会引起电活动传导不均和局部传导阻滞,是心律失常的关键因素。Rucker-Martin等[12]的研究显示,长期压力负荷增加导致心房结构重塑,并伴有Cx表达和缝隙连接分布改变。反之,大鼠心房重塑恢复时,Cx表达和缝隙连接分布也逐渐恢复正常,说明机械牵张能引起Cx表达变化和缝隙连接分布改变。Shi等[13]对人脐血管内皮细胞施加长期机械牵张,发现Cx43和转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达上调。TGF-β1抑制剂或特异性抗体及肌动蛋白和微管细胞骨架抑制剂能抑制Cx43上调,证实机械牵张状态下细胞骨架网络、TGF-β1分泌与Cx43上调、细胞间缝隙连接增加密切相关,促进了AF的发生。
2.1.2 纤维化
心脏机械牵张是引起心肌纤维化的关键因素,特别是心房肌较心室肌更易受其影响并发生纤维化[14]。心房纤维化常导致电传导异常,进而引发AF,使其成为常见心律失常。研究显示,心房机械牵张促进成纤维细胞分化和肾素-血管紧张素-醛固酮系统(renin aniotension aldosterone system,RAAS)激活,引发心房纤维化。一方面,纤维化破坏了心房内正常的电传导通路,导致传导减慢或受阻,促进心房折返环路形成,为AF的发生与维持提供基质[15]。另一方面,心房成纤维细胞中存在机械牵张敏感的离子通道。Jakob等[16]发现离体人心房成纤维细胞含有Piezo1非选择性阳离子通道和钙离子依赖的选择性钾通道。AF患者的心房成纤维细胞Piezo1活性和表达水平高于窦性心律患者,推测心房成纤维细胞中机械牵张敏感离子通道活性增加与AF相关。同时,长期机械牵张心肌细胞导致反复损伤修复、炎症刺激,及细胞外基质生长因子、细胞因子分泌,抑制肌成纤维细胞凋亡,推进纤维化过程,影响心肌细胞电活动[17]。
此外,心脏收缩和舒张功能障碍引起心腔内压增高,进一步引起心房机械牵张,导致RAAS过度激活,血管紧张素Ⅱ分泌增加,促进心房成纤维细胞增殖、胶原蛋白合成和细胞外基质纤维化,最终引发心律失常。
2.2 机械牵张导致电重塑
AF的发生与异位电活动密切相关,其中由肺静脉机械牵张引发的肺静脉起源的异位电活动,是触发该疾病的关键因素。除触发AF外,机械牵张还常常促进心房内折返性电活动的形成,从而维持AF的状态。尽管目前针对机械牵张引起AF的触发与维持的分子机制尚没有确切结论,但目前认为,机械牵张敏感离子通道的激活以及心肌细胞内钙离子的变化可能是心房、肺静脉机械牵张引起局部或整体电重塑的主要因素。
2.2.1 机械牵张敏感离子通道的激活
肺静脉机械牵张引起的异位电活动与机械牵张敏感离子通道激活紧密相关[18-19]。这些通道的激活可增强早期后除极和延迟后除极,从而促进心律失常的发生[20-21]。其中,TWIK相关钾离子通道-1(TWIK related K+ channel-1,TREK-1)是心房中常见的机械牵张敏感离子通道,参与机械牵张相关心律失常。HF合并AF患者的心房TREK-1 mRNA及蛋白水平下调,与动作电位持续时间和有效不应期延长相符。Lugenbiel等[22]在HF合并AF的猪模型中观察到TREK-1下调,而过表达TREK-1缩短了有效不应期,AF随之转为窦性心律。
此外,Egorov等[23]发现血流动力学超负荷时,小窝蛋白表达下调促进氯离子通道激活,增加肺静脉对拉伸的敏感性,诱发AF。这些研究均证实机械牵张引起心房和肺静脉异位电活动,触发AF,揭示了分子水平的机制,为HF合并AF的防治提供了干预靶点。
2.2.2 钙离子调控
钙离子参与了调控机械牵张诱发AF的过程。心肌细胞机械牵张通过引起细胞内钙离子浓度升高,造成钙超载,进而诱发异位电活动,引起AF发生。Yan等[24]在离体兔心脏机械牵张实验中发现,钙离子依赖的钾离子通道抑制剂通过减轻急性机械牵张导致的心房有效不应期缩短,降低AF易感性,证实钙离子在机械牵张诱发AF中扮演关键角色。Zhang等[25]在长期机械牵张心房的小鼠模型研究中,发现使用丹曲林抑制肌质网钙渗漏,能有效降低AF复发,并指出机械牵张相关钙离子调控或可作为AF防治的潜在治疗靶点。
2.2.3 心电生理的调控作用
心房机械牵张通过引起肺静脉、心房传导阻滞及有效不应期的缩短或延长,增加了肺静脉、心房电传导的不均一性,进一步触发AF并促进折返环路形成。除了机械牵张引起的心房纤维化,机械牵张本身同样能促进传导阻滞的形成、缩短心房有效不应期[26],使心房、肺静脉组织间形成折返环路,为AF触发及维持提供条件。此外,机械牵张引起有效不应期的改变与离子通道的活化密切相关,有效不应期的缩短或者延长能进一步诱发心房早期去极化、延迟去极化[20-21],触发AF。其引起的不应期变化的差异性或与机械牵张持续时间、频率、强度及心房壁厚度有密切关联。
2.3 机械牵张引起局部内分泌改变
心房机械牵张会引起心腔内分泌变化,特别是心房利尿钠肽(atrial natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP)的生成增多[27]。HF时心房充盈压升高,心房肌细胞发生改变,促进了ANP和BNP基因的表达上调,其中BNP、N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)常作为HF诊断及疗效评估的关键血清学标志物。近年来一些研究显示高水平BNP或NT-proBNP能够进一步预测消融后AF复发,用于评估AF疗效。Younes等[28]研究显示,在非HF患者中,消融前BNP水平可以预测AF射频消融术后的心律失常复发。然而,在合并HF患者中,BNP水平会受到AF的影响,因此,在HF合并AF的患者中BNP水平升高很难作为AF射频消融术后复发的预测因素。此外,肾功能衰竭等其他一些疾病会进一步升高合并AF患者的BNP水平。因此BNP是衡量机械牵张程度、检测AF以及评估疗效的敏感但非特异性标志物。
3 减少心房和肺静脉机械牵张的临床治疗手段
3.1 药物治疗
3.1.1 减容治疗
HF导致心房和肺静脉机械牵张,可能引起AF发生。因此,减轻容量负荷的药物,如利尿剂,对优化充血性HF患者血流动力学、改善左心房应变和功能至关重要。Deferm等[29]对31例急性失代偿性HF患者进行利尿减容治疗研究。通过血流动力学检测、超声心动图评估及HF再入院和全因死亡率的统计分析,结果证实利尿减容治疗能改善左心房储器期应变,降低HF患者再入院和死亡风险。
3.1.2 抗纤维化治疗
传统HF治疗药物,如:血管紧张素转化酶抑制剂(angiotension converting enzyme inhibitor,ACEI)、血管紧张素Ⅱ受体阻滞剂(angiotonin receptor blocker,ARB)等通过调节细胞外基质沉积和代谢,已被证实可减轻心肌纤维化和心房结构重塑,改善心肌舒张功能障碍和心房电重塑。这些药物在射血分数降低的HF(heart failure with reduced ejection fraction,HFrEF)患者中,能有效减少AF事件。近年来,包括PARADIGM-HF在内的多项研究[30]也显示,在症状性HFrEF合并AF患者中,沙库巴曲缬沙坦相较于ACEI、ARB效果更佳,作为首选治疗药物。然而,一项涵盖16项随机对照试验、共计22 563例患者的荟萃分析[31]显示,在HFrEF患者中,沙库巴曲缬沙坦治疗组发生心律失常的人数显著低于ARB/ACEI组,但在射血分数保留的HF(heart failure with preserved ejection fraction,HFpEF)患者中疗效不明显,沙库巴曲缬沙坦的机制可能包括减轻心房结构重塑和扩张的心腔,减少心房血流反流,从而减轻血流动力学改变及心房和肺静脉机械牵张,有效降低多数HFrEF患者的心律失常风险。
3.2 手术及器械治疗
3.2.1 导管消融术
HF合并AF患者,早期采用节律控制策略可降低心血管死亡率和卒中风险。仅依赖药物复律并不能有效降低全因死亡率,反而增加心律失常风险[32]。CASTLE-AF临床试验[33]显示导管消融术可改善这类患者的生存预后。该试验纳入363例患者,随机分至射频消融组和药物治疗组,5年随访发现消融组射血分数改善,全因死亡率和心血管住院率明显低于药物组。
亦有研究[34]指出,结合沙库巴曲缬沙坦等药物可降低持续性AF患者消融术后6个月的复发率,并改善左心功能,这主要归因于药物对左心房机械基质的影响。消融术通过阻断折返并形成瘢痕,有效减少和均匀化心房机械牵张,是改善药物治疗耐药AF患者预后的有效方法。然而,HF患者常伴心房纤维化,消融成功率随纤维化程度加重而降低。因此,消融术围手术期药物治疗对预防AF复发至关重要。
3.2.2 器械治疗
近年来,左心室辅助装置(left ventricular assist device,LVAD)的发展不仅改善了终末期HF患者的临床症状和阻止HF恶化,还可能减少AF的发生。Ishikawa等[35]发现,LVAD能减轻血流动力学对左心房的机械牵张,降低亚急性心肌梗死后HF患者发生房性心律失常风险。但对HF合并AF患者的长期益处,目前尚缺乏长期随访的临床证据。
除LVAD外,心房分流术也逐渐运用于临床,该治疗通过在房间隔制造人工缺口,利用右心系统容量代偿特性缓解左心房压力负荷,分流减压。Lu等[36]指出,在HFpEF伴肺动脉高压患者中,心房分流术能降低左心房压力,改善HF肺水肿症状,或成为预防慢性HF患者新发AF的潜在方法。然而,对于HFpEF患者,一项多中心、双盲、随机对照试验[37]在626例患者中发现,心房分流术组与假手术组新发AF发病率无显著差异,说明该术式无法显著减少HFpEF患者新发AF风险,也未改善总体健康状况。因此,心房分流术的效果和安全性仍存在争议,需更多研究以验证其有效性。
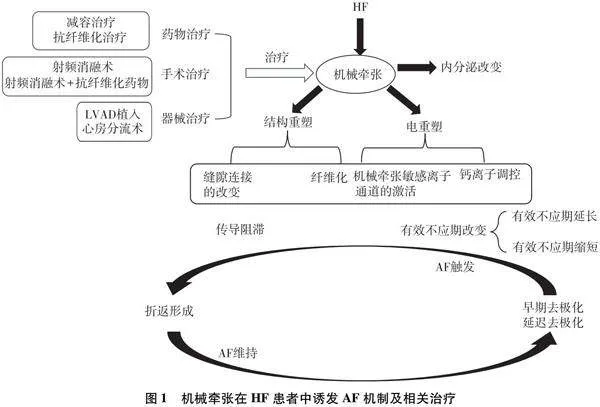
综上所述,减容治疗,尤其是利尿剂的使用,通过降低心脏负荷、减少心房和肺静脉机械牵张,为HF合并AF患者提供了一种有效的治疗策略。该方法能够有效降低左心房压力,从而减轻心房和肺静脉机械牵张,延缓AF的发展。然而,长期使用利尿剂可能导致电解质失衡和肾功能受损。抗纤维化治疗,包括使用ACEI和ARB,通过抑制心房结构重塑,有助于减少心房纤维化,改善心脏电生理稳定性。手术及器械治疗,如导管消融和LVAD的应用,提供了针对难治性HF合并AF的新选择,通过直接或间接减少心房机械牵张,展现了良好的疗效。见图1。
4 结论
本综述详细描述了心房和肺静脉机械牵张在慢性HF合并AF病理生理过程中的关键作用,通过减轻心房和肺静脉机械牵张,可能显著降低AF的发生率,改善患者的临床预后。往后可深入研究心房和肺静脉机械牵张对心房电生理影响的分子机制,有助于发现新的药物靶点,从而开发出更有效的治疗方法,为患者提供更加个体化和有效的治疗方案。
参考文献
[1]Lee DS,Gona P,Albano I,et al.A systematic assessment of causes of death after heart failure onset in the community:impact of age at death,time period,and left ventricular systolic dysfunction[J].Circ Heart Fail,2011,4(1):36-43.
[2]Bjrck S,Palaszewski B,Friberg L,et al.Atrial fibrillation,stroke risk,and warfarin therapy revisited:a population-based study[J].Stroke,2013,44(11):3103-3108.
[3]Lab MJ.Contraction-excitation feedback in myocardium.Physiological basis and clinical relevance[J].Circ Res,1982,50(6):757-766.
[4]Ponikowski P,Anker SD,Alhabib KF,et al.Heart failure:preventing disease and death worldwide[J].ESC Heart Fail,2014,1(1):4-25.
[5]Wang H,Chai K,Du M,et al.Prevalence and incidence of heart failure among urban patients in China:a national population-based analysis[J].Circ Heart Fail,2021,14(10):e008406.
[6]Farmakis D,Chrysohoou C,Giamouzis G,et al.The management of atrial fibrillation in heart failure:an expert panel consensus[J].Heart Fail Rev,2021,26(6):1345-1358.
[7]Anker SD,Butler J,Filippatos G,et al.Empagliflozin in heart failure with a preserved ejection fraction[J].N Engl J Med,2021,385(16):1451-1461.
[8]邹书斌,朱柏祥,张春洋,等.无心衰房颤与房颤合并心衰病人脑卒中发生率的对比研究[J].航空航天医学杂志,2016,27(3):286-287.
[9]Walters TE,Lee G,Spence S,et al.Acute atrial stretch results in conduction slowing and complex signals at the pulmonary vein to left atrial junction:insights into the mechanism of pulmonary vein arrhythmogenesis[J].Circ Arrhythm Electrophysiol,2014,7(6):1189-1197.
[10]Xie E,Yu R,Ambale-Venkatesh B,et al.Association of right atrial structure with incident atrial fibrillation:a longitudinal cohort cardiovascular magnetic resonance study from the Multi-Ethnic Study of Atherosclerosis (MESA)[J].J Cardiovasc Magn Reson,2020,22(1):36.
[11]包丽莲,程蕾,黄国倩,等.斑点追踪超声心动图评价左房功能及其在房颤中临床价值的研究进展[J].复旦学报(医学版),2022,49(4):606-613.
[12]Rucker-Martin C,Milliez P,Tan S,et al.Chronic hemodynamic overload of the atria is an important factor for gap junction remodeling in human and rat hearts[J].Cardiovasc Res,2006,72(1):69-79.
[13]Shi Y,Li X,Yang J.Cx43 upregulation in HUVECs under stretch via TGF-β1 and cytoskeletal network[J].Open Med (Wars),2022,17(1):463-474.
[14]Wang J,Chen H,Seth A,et al.Mechanical force regulation of myofibroblast differentiation in cardiac fibroblasts[J].Am J Physiol Heart Circ Physiol,2003,285(5):H1871-H1881.
[15]Sohns C,Marrouche NF.Atrial fibrillation and cardiac fibrosis[J].Eur Heart J,2020,41(10):1123-1131.
[16]Jakob D,Klesen A,Allegrini B,et al.Piezo1 and BKCa channels in human atrial fibroblasts:interplay and remodelling in atrial fibrillation[J].J Mol Cell Cardiol,2021,158:49-62.
[17]Kis K,Liu X,Hagood JS.Myofibroblast differentiation and survival in fibrotic disease[J].Expert Rev Mol Med,2011,13:e27.
[18]Chang SL,Chen YC,Chen YJ,et al.Mechanoelectrical feedback regulates the arrhythmogenic activity of pulmonary veins[J].Heart,2007,93(1):82-88.
[19]Hamaguchi S,Hikita K,Tanaka Y,et al.Enhancement of automaticity by mechanical stretch of the isolated guinea pig pulmonary vein myocardium[J].Biol Pharm Bull,2016,39(7):1216-1219.
[20]Wang Y,Joyner RW,Wagner MB,et al.Stretch-activated channel activation promotes early afterdepolarizations in rat ventricular myocytes under oxidative stress[J].Am J Physiol Heart Circ Physiol,2009,296(5):H1227-H1235.
[21]Kamkin A,Kiseleva I,Wagner KD,et al.Characterization of stretch-activated ion currents in isolated atrial myocytes from human hearts[J].Pflugers Arch,2003,446(3):339-346.
[22]Lugenbiel P,Wenz F,Syren P,et al.TREK-1 (K2P2.1) K+ channels are suppressed in patients with atrial fibrillation and heart failure and provide therapeutic targets for rhythm control[J].Basic Res Cardiol,2017,112(1):8.
[23]Egorov YV,Lang D,Tyan L,et al.Caveolae-mediated activation of mechanosensitive chloride channels in pulmonary veins triggers atrial arrhythmogenesis[J].J Am Heart Assoc,2019,8(20):e012748.
[24]Yan Y,Skarsfeldt MA,Diness JG,et al.Small conductance calcium activated K+ channel inhibitor decreases stretch induced vulnerability to atrial fibrillation[J].Int J Cardiol Heart Vasc,2021,37:100898.
[25]Zhang Y,Qi Y,Li JJ,et al.Stretch-induced sarcoplasmic reticulum calcium leak is causatively associated with atrial fibrillation in pressure-overloaded hearts[J].Cardiovasc Res,2021,117(4):1091-1102.
[26]Ravelli F,Masè M,del Greco M,et al.Acute atrial dilatation slows conduction and increases AF vulnerability in the human atrium[J].J Cardiovasc Electrophysiol,2011,22(4):394-401.
[27]Alcidi G,Goffredo G,Correale M,et al.Brain natriuretic peptide biomarkers in current clinical and therapeutic scenarios of heart failure[J].J Clin Med,2022,11(11):3192.
[28]Younes H,Mekhael M,Feng H,et al.Baseline natriuretic peptides as a predictor of atrial fibrillation recurrence after radiofrequency-based pulmonary vein isolation in a non-heart failure population:a subanalysis from DECAAFⅡ[J].Pacing Clin Electrophysiol,2023,46(8):848-854.
[29]Deferm S,Martens P,Verbrugge FH,et al.LA mechanics in decompensated heart failure:insights from strain echocardiography with invasive hemodynamics[J].JACC Cardiovasc Imaging,2020,13(5):1107-1115.
[30]Desai AS,McMurray JJ,Packer M,et al.Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients[J].Eur Heart J,2015,36(30):1990-1997.
[31]Wang R,Ye H,Ma L,et al.Effect of sacubitril/valsartan on reducing the risk of arrhythmia:a systematic review and meta-analysis of randomized controlled trials[J].Front Cardiovasc Med,2022,9:890481.
[32]Yang E,Tang O,Metkus T,et al.The role of timing in treatment of atrial fibrillation:an AFFIRM substudy[J].Heart Rhythm,2021,18(5):674-681.
[33]Sohns C,Zintl K,Zhao Y,et al.Impact of left ventricular function and heart failure symptoms on outcomes post ablation of atrial fibrillation in heart failure:CASTLE-AF trial[J].Circ Arrhythm Electrophysiol,2020,13(10):e008461.
[34]梁晓芳,李文华,宋艳斌,等.沙库巴曲缬沙坦对持续性心房颤动导管消融术后临床疗效的影响:基于倾向性评分的单中心队列研究[J].临床心血管病杂志,2023,39(9):699-706.
[35]Ishikawa K,Watanabe S,Lee P,et al.Acute left ventricular unloading reduces atrial stretch and inhibits atrial arrhythmias[J].J Am Coll Cardiol,2018,72(7):738-750.
[36]Lu D,Zhu J,Liao B.Efficacy and safety of inter-atrial shunt devices for heart failure with reduced or preserved ejection fraction:early experiences[J].Heart Lung Circ,2018,27(3):359-364.
[37]Shah SJ,Borlaug BA,Chung ES,et al.Atrial shunt device for heart failure with preserved and mildly reduced ejection fraction (REDUCE LAP-HFⅡ):a randomised,multicentre,blinded,sham-controlled trial[J].Lancet,2022,399(10330):1130-1140.
基金项目:新疆维吾尔自治区重点专项(2022B03023)
通信作者:汤宝鹏,E-mail:Tangbaopeng1111@xjmu.edu.cn