淹水胁迫及恢复对文冠果幼苗形态及生理特性的影响


关键词:文冠果;淹水胁迫;恢复;形态;生理
中图分类号:S608 文献标志码:A 文章编号:1003—8981(2024)03—0077—09
文冠果Xanthoceras sorbifolia Bunge 是无患子科的一种落叶乔木或灌木,主要分布在陕西、山西、河北、内蒙古等北方地区,是我国特有的木本油料树种,同时具有较强的适应性和抗逆性[1],但由于文冠果是肉质根,不耐水淹,这成为文冠果在南方地区栽培的最主要限制因素,因此对文冠果进行淹水与淹水后的恢复能力的科学研究意义重大。自20 世纪90 年代以来,洪涝灾害的频率在全球范围内显著增加,这主要是由于全球气候变暖和人类活动的双重影响所致。洪涝灾害的范围逐年扩大,频率不断上升,严重影响了动植物的生存和发展。因此,洪涝灾害已成为全人类必须面对和迫切解决的重大自然灾害之一[2]。一般来说,涝害指的是土壤水分过多对植物造成的伤害。从广义角度来看,它通常包括两种情况:渍水和水淹。渍水是指植物生长环境中的土壤水分含量超过了田间最大持水量,即土壤水分处于完全饱和状态;而水淹则指植物的局部或整株被淹没,从而阻碍了植物的生长[3]。植物根系是受淹水胁迫影响最直接也是受害最严重的部位。有研究报道,5个不同品种的生姜Zingiber officinale Roscoe 在遭受淹水胁迫后,其根系活力与各自对照相比均显著降低[4],此外也有研究表明鸭茅Dactylis glomerata L.幼苗在遭受淹水胁迫后会出现根系变短和变黑腐烂的现象[5]。除根系外,叶片也能直接体现出淹水胁迫对植物造成的伤害。有研究表明,淹水胁迫加速叶片光合色素的降解,影响光合作用的正常进行,最终导致叶片发黄萎蔫;与此同时,持续胁迫使得活性氧大量积累,引起细胞膜脂质过氧化,导致丙二醛的大量产生,并进一步加剧细胞膜损伤。然而,植物体内也存在一定含量的渗透调节物质和特定的抗氧化保护酶系统,二者共同作用清除胁迫中产生的过量活性氧物质,以维持正常的生理活动[6]。
目前对于文冠果的研究主要集中在栽培管理[7-8]、种实性状[9-10]、新品种选育[11-12]、抗逆性等方面,且在抗逆性方面的研究主要集中在抗寒[13-14]、抗旱[15-17] 以及抗盐碱[18-19] 等方面,而关于文冠果抗涝性及涝后恢复能力的研究未见报道。本研究以文冠果实生苗为试验材料,对其进行淹水处理,并在处理结束后恢复正常水分管理,观察其经过淹水胁迫后的恢复能力,研究其在生理方面的变化,探讨其在淹水胁迫下的适应性,以期为提高文冠果在南方地区的造林成活率和苗期的水分管理提供参考。
1 材料与方法
1.1 试验材料
试验所需文冠果种子采自盐城林场,采集时间为2022 年8 月,同年12 月进行低温沙藏。2023 年2 月,取沙藏后的种子,播种于统一规格的塑料花盆中(花盆的规格:17.9 cm×14.7 cm×18.8 cm),栽培所用基质为营养土,基质高度15 cm 左右。试验地位于南京林业大学室外大棚内。2023 年7月,选择长势一致且无病虫害的苗木作为试验材料,并在淹水处理之前进行正常的水肥管理。
1.2 试验方法
采用双套盆法模拟淹水环境(套盆为塑料营养钵,规格为:25 cm×20 cm),前期预实验表明,淹水7 d 后,植株表现出明显的受害症状(叶片皱缩、枯萎掉落,甚至出现部分植株死亡现象),因此,本试验共设置5 个处理,分别为正常水分管理(CK)、淹水1 d(W1)、淹水3 d(W3)、淹水5 d(W5)和淹水7 d(W7),并在解除淹水胁迫后分别恢复7 d,记为RCK、RW1、RW3、RW5和RW7。试验期间,每天控制水面高于基质表面2 cm 左右,且每天及时对蒸发失水进行补充。每个处理各20 盆,共计100 盆。在各处理组结束淹水后和恢复正常水分管理7 d 后分别采样,选取每株苗木上生长部位相同且生长良好的成熟叶片,先用自来水清洗叶片表面污物,再用蒸馏水冲洗2 ~ 3次,擦净表面水分,混合采集叶片后放于-80 ℃冰箱中保存,分别用于各项生理指标的测定。
1.3 指标测定
参照王学奎[20] 的方法测定叶片生理指标,其中丙二醛(MDA)含量采用硫代巴比妥酸法测定,可溶性糖(SS)含量采用蒽酮比色法测定,可溶性蛋白(SP)采用考马斯亮蓝法测定,脯氨酸(Pro)含量采用酸性茚三酮染色法,超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定,过氧化物酶(POD)活性采用愈创木酚法测定,叶绿素(Chl)和类胡萝卜素(Car)含量采用乙醇浸泡法测定,根系活力测定采用TTC 染色法,每个指标测定重复3 次。
1.4 数据处理及分析
使用Excel 2019软件整理数据, 使用SPSSStatistics 27 软件进行单因素方差分析和相关性分析,采用Duncan 方法进行多重比较及差异显著性检验(P < 0.05)。
2 结果与分析
2.1 淹水胁迫及恢复后幼苗叶片形态的变化
随着淹水时间的延长,文冠果幼苗叶片逐渐变黄皱缩,甚至出现枯萎凋落等涝害症状。由图1可知,W1 处理组叶片未发生明显变化,W3 处理组少数苗木叶片开始萎蔫变黄,W5 处理组部分苗木叶片出现枯萎凋落等现象,而W7 处理组则发现有少数苗木死亡的情况;恢复正常水分管理7 d后,RW3、RW5 和RW7 3 个处理组苗木叶片均未恢复到正常状态。
2.2 淹水胁迫及恢复后幼苗根系活力的变化
由表1 可知,随着淹水时间的延长,文冠果幼苗根系活力呈逐渐下降的趋势。淹水处理之后各处理组文冠果幼苗根系活力均显著低于对照组,其大小依次为:CK > W1 > W3 > W5 > W7,较CK 下降幅度依次为22.8%、37.5%、50.5% 和79.0%。其中,W7 处理组较对照组下降幅度最大并与对照差异显著(P < 0.05);W1 处理组较对照组下降幅度最小,但仍与对照组有显著差异。恢复正常水分管理7 d 后,各处理组文冠果幼苗根系活力均较淹水处理后有所提高。其中,RW1处理组恢复至对照组水平,与对照组无显著差异(P > 0.05); 而RW3、RW5 和RW7 三个处理组仍与对照差异显著,其降低幅度依次为25.7%、36.9% 和64.6%。
2.3 淹水胁迫及恢复后幼苗叶片MDA 含量的变化
由表1可知,随着淹水时间的延长,文冠果幼苗叶片MDA 含量呈大幅度升高的趋势。淹水处理之后各处理组文冠果幼苗叶片MDA 含量均显著高于对照组,其大小依次为:W7 > W5 > W3 >W1 > CK, 较CK 增加幅度依次为112.8%、84.4%、73.0% 和31.3%。其中,W7 处理组较对照组升高幅度最大并与对照组差异显著;W1 处理组较对照组增加幅度最小,但仍与对照组差异显著。恢复正常水分管理7 d 后,各处理组文冠果幼苗叶片MDA含量均较淹水处理后有所降低。其中,RW1 和RW3 处理组均恢复至对照组水平,与对照组无显著差异;而RW5 和RW7 处理组仍与对照组差异显著,其增加幅度依次为16.2% 和28.3%。
2.4 淹水胁迫及恢复后幼苗叶片抗氧化酶活性的变化
由表2 可知,随着淹水时间的延长,文冠果幼苗叶片SOD 和POD 活性均表现为先升高后降低的趋势。淹水处理之后各处理组文冠果幼苗叶片SOD 和POD 活性均显著高于对照组,并均在W3 处理组达到最大值,较CK 分别提高了83.4%和55.6%;W1、W5 和W7 处理组文冠果幼苗叶片SOD 和POD 活性较CK 分别提高了70.8%、65.3%、37.6% 和46.7%、35.8%、29.5%。恢复正常水分管理7 d 后,各处理组文冠果幼苗叶片SOD和POD 活性均较淹水处理后有所降低。其中,RW1 处理组文冠果幼苗叶片SOD 和POD 活性均恢复至对照组水平,与对照组无显著差异;而RW3、RW5 和RW7 处理组文冠果幼苗叶片SOD和POD 活性仍与对照组差异显著,其增加幅度依次为69.2%、51.1%、25.6% 和20.2%、17.4%、8.5%。
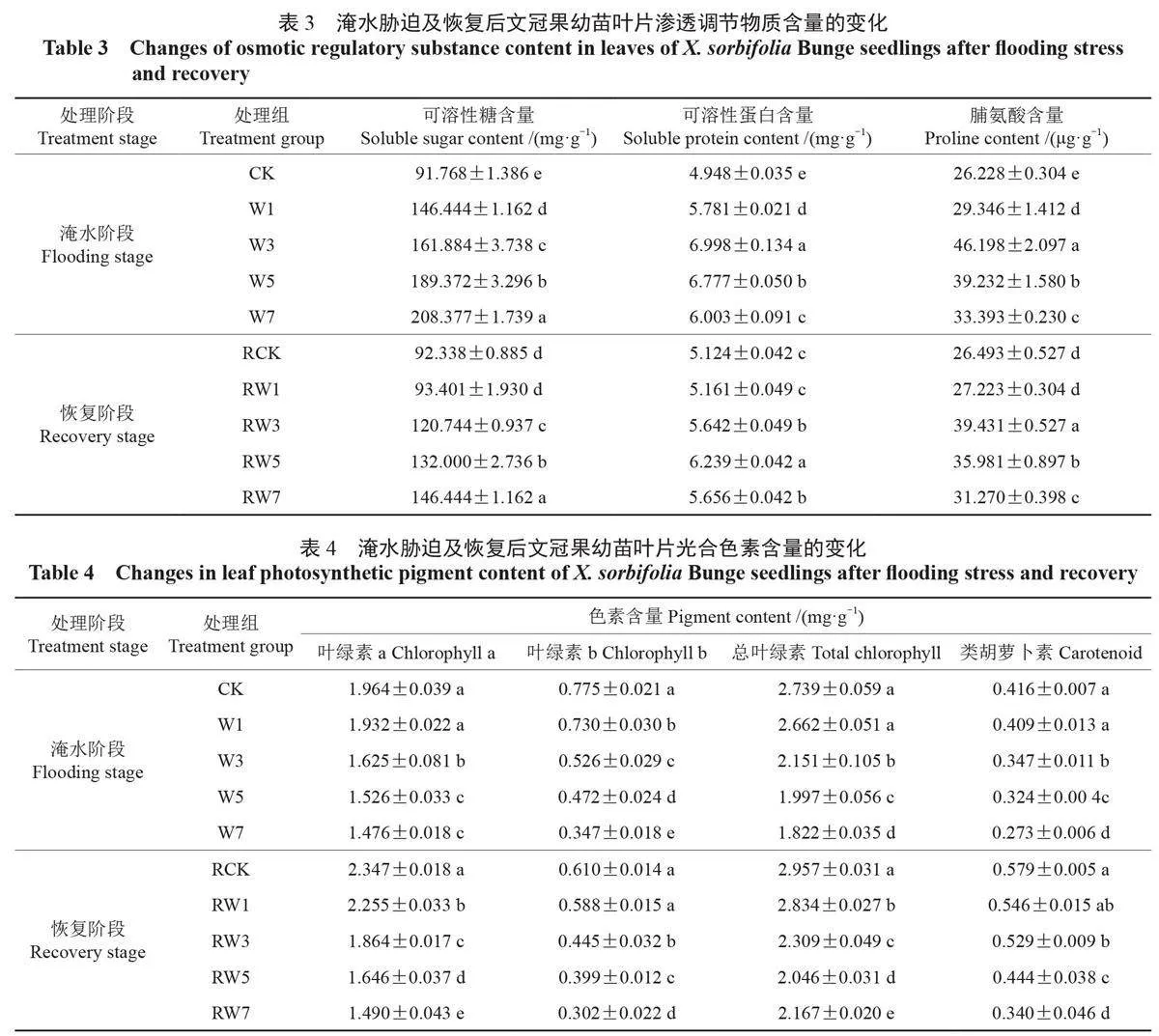
2.5 淹水胁迫及恢复后幼苗叶片渗透调节物质含量的变化
由表3 可知,随着淹水时间的延长,文冠果幼苗叶片SS 含量表现呈逐渐升高的趋势。淹水处理之后各处理组文冠果幼苗叶片SS 含量均显著高于对照组,其大小依次为:W7 > W5 > W3 >W1 > CK, 较CK 增加幅度依次为127.1%、106.4%、76.4% 和59.6%。其中,W7 处理组较对照组升高幅度最大并与对照组差异显著;W1 处理组较对照组增加幅度最小,但仍与对照组差异显著。恢复正常水分管理7 d 后,各处理组文冠果幼苗叶片SS 含量均较淹水处理后有所降低。其中,RW1 处理组恢复至对照水平,与对照组无显著差异;而RW3、RW5 和RW7 处理组仍与对照组差异显著,其增加幅度依次为30.8%、43.0% 和58.6%。
由表3 可知,随着淹水时间的延长,文冠果幼苗叶片SP 和Pro 含量均表现为先升高后降低的趋势。淹水处理之后各处理组文冠果幼苗叶片SP和Pro 含量均显著高于对照组,并均在W3 处理组达到最大值,较CK 分别提高了41.4% 和76.1%;W1、W5 和W7 处理组文冠果幼苗叶片SP 和Pro含量较CK 分别提高了16.8%、37.0%、21.3% 和11.9%、49.6%、27.3%。恢复正常水分管理7 d后,各处理组文冠果幼苗叶片SP 和Pro 含量均较淹水处理后有所降低。其中,RW1 处理组文冠果幼苗叶片SP 和Pro 含量均恢复至对照组水平,与对照组无显著差异;而RW3、RW5 和RW7 处理组文冠果幼苗叶片SP 和Pro 含量仍与对照差异显著,其增加幅度依次为10.1%、21.8%、10.4% 和48.8%、35.8%、18.0%。
2.6 淹水胁迫及恢复后幼苗叶片光合色素含量的变化
由表4 可知,随着淹水时间的延长,文冠果幼苗叶片Chla、Chlb、ChlT 和Car 含量均呈逐渐下降的趋势。淹水处理之后各处理组文冠果幼苗叶片光合色素含量均低于对照组,其大小顺序均表现为CK > W1 > W3 > W5 > W7。其中,W3、W5 和W7 三个处理组均显著低于对照组,而W1 处理组与对照组无显著差异(Chlb 含量除外)。W1、W3、W5 和W7 处理组幼苗叶片Chla含量较CK 下降幅度依次为1.6%、17.3%、22.3%和24.9%,Chlb 含量较CK 下降幅度依次为5.8%、32.1%、39.2% 和55.3%,ChlT 含量较CK 下降幅度依次为2.8%、21.5%、27.1% 和33.5%,Car 含量较CK 下降幅度依次为1.8%、16.6%、22.1% 和34.5%。
恢复正常水分管理7 d 后,各处理组文冠果幼苗Chla、Chlb、ChlT 和Car 含量较淹水处理后总体表现呈增加趋势。其中,RW1 处理组与对照组差异不大;而RW3、RW5 和RW7 三个处理组仍与对照差异显著,Chla 含量的降低幅度依次为20.6%、29.9% 和36.5%,Chlb 含量的降低幅度依次为27.0%、34.5% 和50.4%,ChlT 含量的降低幅度依次为21.9%、30.8% 和26.7%,Car 含量的降低幅度依次为8.6%、23.3% 和41.2%。
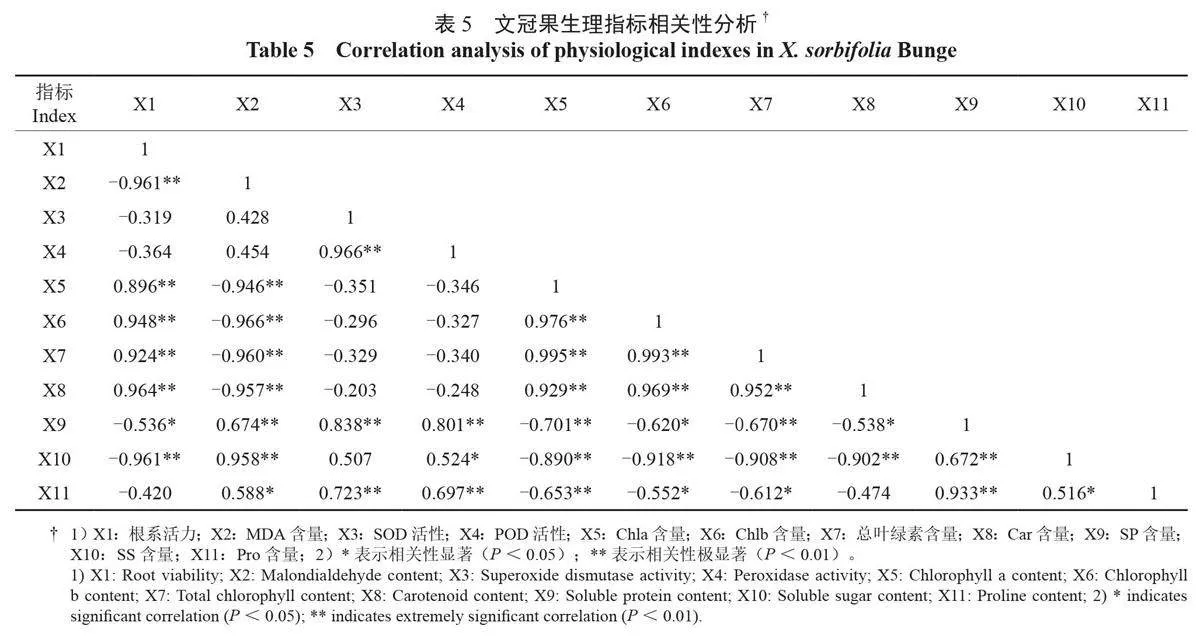
2.7 文冠果幼苗各项生理指标相关性分析
通过对11个生理生化指标的相关性进行分析,由表5 可知,各指标间存在不同程度的相关性,根系活力与光合色素含量呈极显著正相关关系(P < 0.01),而与MDA 含量、SS 含量呈极显著负相关关系,与SP 含量呈显著负相关关系(P<0.05), 与SOD活性、POD 活性、Pro 含量相关关系不显著(P > 0.05);MDA 含量与光合色素含量呈极显著负相关关系,与渗透调节物质含量呈显著正相关关系;抗氧化保护酶活性与渗透调节物质含量呈显著正相关关系;光合色素含量与渗透调节物质含量呈显著负相关关系。可见在文冠果幼苗受到淹水胁迫时,叶片细胞产生有害物质逐渐增多、细胞膜膜脂过氧化程度加重,与此同时,细胞内可溶性糖和可溶性蛋白等渗透调节物质以及SOD 和POD 等抗氧化保护酶协同作用,共同调节植物细胞使其能够适应外界淹水环境。
3 结论与讨论
3.1 讨论
当植物受到淹水胁迫时,其丙酮酸脱氢酶和乙醇脱氢酶的活性会提高,加快乙醇发酵进程,这会导致植物根系周围积聚大量乙醇,进而影响根系的正常生理活动,甚至可能引发根系死亡[21]。本试验中,文冠果幼苗随着淹水处理天数的增加,其根系活力呈逐渐降低的趋势,这与前人对虎尾草Chloris virgata[22]、樱桃番茄Solanum lycopersicumMill.[23] 的研究结果一致;恢复正常水分管理7 d后,各淹水处理组幼苗根系活力均较淹水处理后有所升高,但仅W1 处理幼苗根系活力恢复至对照水平,其余3 个处理仍与对照差异显著,这与胡燕莉等[24] 的研究结果一致。
丙二醛对植物细胞有着显著的毒害作用,它能够严重损害细胞膜中的生物功能分子,从而对生物膜的结构和功能造成不良影响,丙二醛含量的高低揭示了逆境胁迫对植物细胞膜脂质过氧化作用的强度以及其对细胞膜造成的损害程度[25]。本试验中,随着淹水处理天数的增加,文冠果幼苗叶片丙二醛含量逐渐增加,W7 处理中,幼苗叶片丙二醛含量比同期对照增加了112.8%,可能是此时SOD、POD 活性下降不足以抵抗活性氧带来的伤害,使膜脂过氧化程度加重,导致细胞膜结构被破坏,造成MDA 含量激增,这与前人对丁香Syringa[26]、竹子Bambusoideae[27]、玉兰YulaniaSpach[28] 的研究结果一致;恢复正常水分管理7 d后,各淹水处理组幼苗叶片丙二醛含量均较淹水处理后有所降低,其中,W5 和W7 两个处理组仍与对照组差异显著,这表明长时间的淹水处理后会使细胞膜膜脂过氧化程度加深,并对植物产生不可逆的伤害。
当植物处于淹水等逆境条件时,其体内会产生大量的活性氧,从而导致细胞膜膜脂过氧化加剧、细胞结构受损,进而影响植物的正常生长。为了维持代谢平衡,植物会启动体内的抗氧化酶系统,以清除过量的活性氧[29]。抗氧化酶系统包括SOD、POD 等抗氧化酶,其中,SOD 是超氧阴离子自由基的主要清除剂,能将其转化成HO 和O,POD 则能催化HO 生成O[30]。本试验中,随着淹水处理天数的增加,文冠果幼苗叶片SOD活性呈先升高后降低的趋势,这与Chen 等[31] 的研究结果一致;恢复正常水分管理7 d 后,各淹水处理组幼苗叶片SOD 活性均较淹水处理后有所降低,其中,W1 处理组恢复至对照水平,而其余3个处理组仍与对照组差异显著。同样,随着淹水处理天数的增加,文冠果幼苗叶片POD 活性也呈先升高后降低的趋势,这与胡衍平等[32]、陈菲等[33]的研究结果一致;恢复正常水分管理7 d 后,各淹水处理组幼苗叶片POD 活性均较淹水处理后有所降低,其中,W5 和W7 两个处理组仍与对照组差异显著。在本试验中,SOD 活性和POD 活性均在W3 处理中达到最高值,可能是由于此时细胞膜脂质过氧化作用过强,使二者活性提高;随后二者活性上升幅度减小,这可能是由于随着淹水时间的延长,超过植物一定耐受能力范围,植物叶片细胞膜组织和功能逐渐受损。
渗透调节是植物应对水分胁迫的另一重要机制,其中,可溶性糖、可溶性蛋白和游离脯氨酸是植物体内参Lx+4Go5Ed3CvTgwMFD8BTg==与渗透调节的重要物质[34]。本试验中,随着淹水处理天数的增加,文冠果幼苗叶片可溶性糖含量呈逐渐升高的趋势,这与赵雪瑶等[35]的研究结果一致,而可溶性蛋白和游离脯氨酸含量则随着淹水处理天数的增加表现为先升后降,这与陈兰[36] 的研究结果一致;恢复正常水分管理7 d 后,各淹水处理组幼苗叶片溶性糖、可溶性蛋白和游离脯氨酸含量均较淹水处理后有所降低,但仅W1 处理幼苗3 种渗透调节物质含量恢复至对照水平,其余3 个处理仍显著高于同期对照。这表明文冠果幼苗在遭受淹水胁迫时,其叶片中的可溶性糖在渗透调节中发挥重要作用。
淹水胁迫会引起植物光合色素含量和比例的变化和调整,从而影响光合系统的运作,进而影响植物的生长和发育[37]。叶绿素含量是反映植物叶片光合作用强弱的重要指标,它在光能的吸收、传递和转换中扮演着关键角色。类胡萝卜素则作为光吸收的辅助色素,主要负责吸收和传递电子,并能够吸收过剩的光能,具备保护叶绿素免受伤害的光保护功能[38]。本试验中,随着淹水处理天数的增加,文冠果幼苗叶片叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均呈逐渐降低的趋势,这与前人对辣椒Capsicum annuum L.[39]、大豆Glycine max (L.) Merr.[40] 的研究结果一致;恢复正常水分管理7 d 后,各淹水处理组幼苗叶片光合色素含量均较淹水处理后有所升高,但仅W1 处理与对照相差不大,其余3 个处理仍显著低于同期对照。这表明文冠果幼苗在经历短期淹水后恢复正常水分管理,其光合作用能力仍能恢复到正常水平,进而使得植株能够正常生长。
3.2 结论
文冠果幼苗在遭受淹水胁迫后,随着胁迫时间的延长,其根系活力与光合色素含量逐渐降低,丙二醛呈递增趋势,表明胁迫对其造成了严重影响,但其会通过提高抗氧化酶活性和增加渗透调节物质含量来减轻胁迫带来的伤害。经过短期淹水(W1)后恢复正常水分管理7 d(RW1),文冠果幼苗的各项指标均能恢复正常水平,而经过较长时间的淹水(W3、W5、W7)后恢复正常水分管理7 d(RW3、RW5、RW7),植株的各项指标均未能恢复正常水平。因此,当文冠果幼苗遭受淹水胁迫时应及时做好排水管理工作,以减轻胁迫带来的损伤,使植株能够正常生长发育,从而提高文冠果在南方地区的造林成活率。本试验只对一些形态和生理指标进行了观测,并未深入探究其内部机理,因此,可在此试验的基础上进行深入研究,使淹水胁迫及恢复正常水分管理对文冠果幼苗的影响研究更具全面性和科学性。

