高州油茶与小果油茶种仁蛋白质组差异比较
关键词:高州油茶;小果油茶;种仁;蛋白质组;非标记技术
中图分类号:S601;S794.4 文献标志码:A 文章编号:1003—8981(2024)03—0010—15
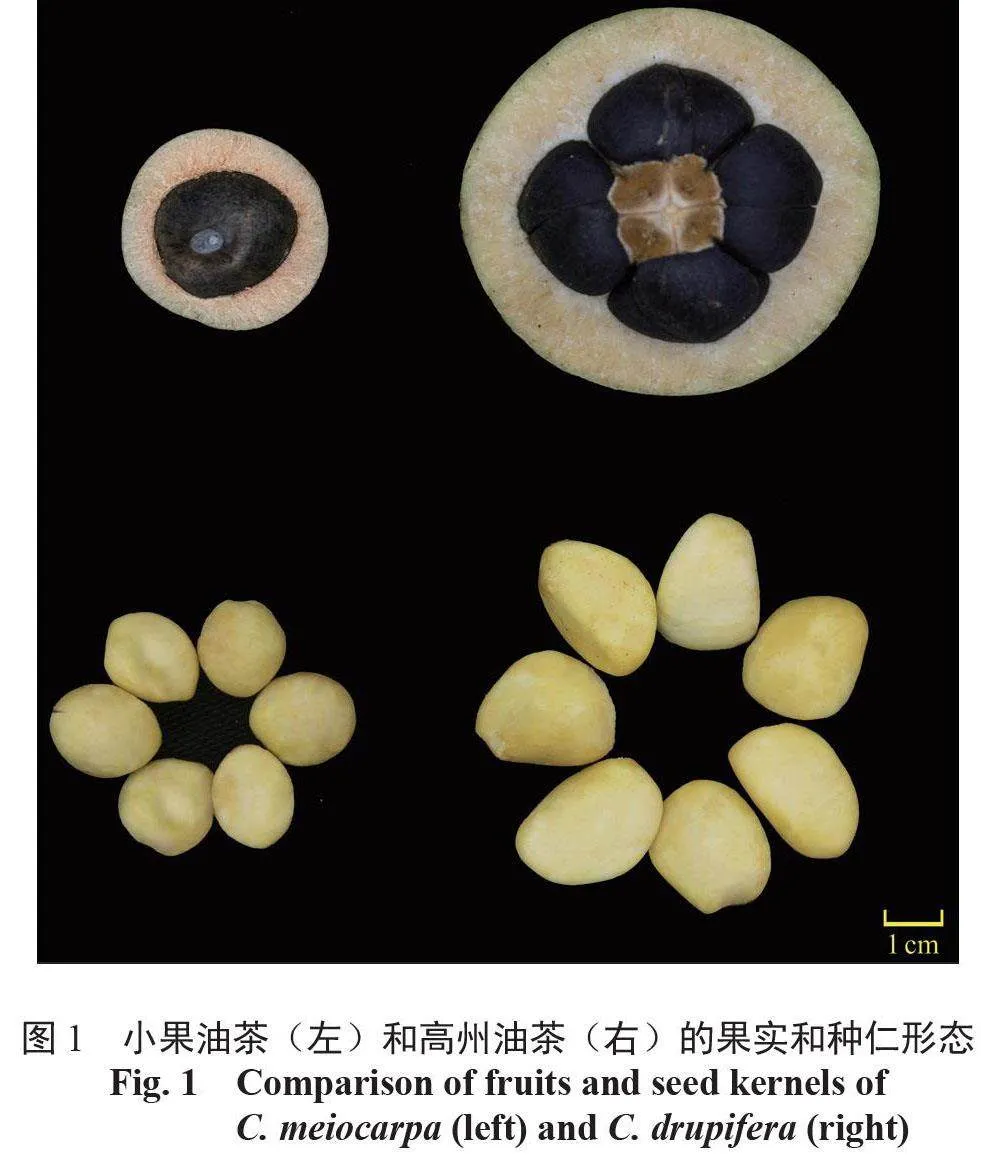
油茶属于山茶科Theaceae 山茶属Camellia 小乔木或灌木,是我国南方地区重要的木本油料树种[1-2]。油茶种质资源丰富,小果油茶Camelliameiocarpa 和高州油茶Camellia drupifera 是其中具有代表性的2 种。小果油茶的特点是适应性较强,抗炭疽病能力较强,产量稳定,单果出籽率和含油率优于普通油茶,栽培面积和年产量仅次于普通油茶,主要分布在江西、福建、湖南、广西、贵州和广东北部等地区[3]。高州油茶,又名华南油茶、大果油茶,具有果实大且树体较高的特点,是培育果大皮薄、高产优质油茶的重要种质资源,主要分布在广东、广西、海南和香港等地,栽植面积和产量均排在全国第3 位[4]。
油茶具有广泛的应用前景,不但可用于园林观赏,而且非产油部位的果皮可用于堆沤作为肥料,果皮提取物质还可用于制作护肤产品和水果保鲜等,种仁是油茶产油的主要部位,其中富含脂质、蛋白质、淀粉、黄酮类、酚酸类、有机酸类、萜类、木脂素类等物质[5-6]。从油茶种仁中提取的油脂含有丰富的油酸、亚油酸、亚麻酸等不饱和脂肪酸及棕榈酸、硬脂酸等饱和脂肪酸,还有生育酚、角鲨烯、多酚类化合物等主要成分,以及胡萝卜素、维生素、矿物质、皂苷、三萜醇、鞣质和芝麻素等物质[7-11]。小果油茶油脂中包含约80% 的油酸,含有较多的棕榈酸和亚油酸,少量硬脂酸、亚麻酸、棕榈油酸和花生烯酸等,还含有多酚、角鲨烯、植物甾醇和维生素E 等生物活性物质,营养价值极高[12-15]。高州油茶油脂中,油酸含量同样最高,其次为棕榈酸、亚油酸、硬脂酸和亚麻酸,不饱和脂肪酸含量可达90%。高州油茶的油脂中,具有与小果油茶类似的活性物质,还富含黄酮类和酚酸类物质。研究结果表明,高州油茶油脂具有普通油茶油脂约3 倍的角鲨烯含量和更高的β- 谷甾醇含量,说明高州油茶种仁在抗氧化活性方面具有极高价值[6,16-18]。
油茶是以产油为主要种植目的的经济林树种,茶油的产量和品质决定了其价值。茶油产量受种仁大小、发育进程以及油脂积累过程等诸多因素影响,茶油品质则与抗氧化活性、脂肪酸组成及其生物合成水平等紧密相关。赵松子等[19]对普通油茶转录组的数据进行了分析,用油茶SPATULA/ALCATRAZ 基因的mRNA 序列搜索,发现了CoALC、CoSPT1、CoSPT2 等与油茶果实发育、大小相关的基因;赵松子[20] 通过对普通油茶CYP78A10同源基因的mRNA 序列搜索,发现CoCYP78A10a、CoCYP78A10b、CYP78A10、GmCYP78A10 等基因可能参与种子大小的调控;Ji等[21] 采用加权基因共表达网络分析法研究了普通油茶种子大小相关基因,筛选到21 个枢纽基因,其中SPL4、ABI4、YAB1、KLU 等基因在不同时期的表达水平发生显著改变,参与调控种子大小的过程;吴波等[22] 研究了油脂合成源基因(GPD1)和汇基因(DGAT1 和DGAT2)在高产油量与低产油量的油茶种子中的表达差异及其对油脂合成积累的影响,发现GPD1 基因为油脂合成积累了更多初始底物,从而促进种子油脂合成,DGAT1 和DGAT2基因在种子发育期间的高表达促进了油脂积累;Wu 等[23] 对高产和低产普通油茶进行转录组测序和qRT-PCR 分析,发现上游基因HAD、EAR 和KASI的协同高表达为油酸生物合成提供了前体资源,SAD 基因的持续高表达加速了油酸的合成和积累,而下游基因FAD2、FAD3 等的协同低表达降低了油酸转化的消耗;郭钰柬[24] 利用qRT-PCR 技术对越南油茶的4 个关键酶基因进行测定,发现了SAD、FAD2、FAD3 等基因参与脂肪酸合成的作用机制。这些研究结果揭示了影响油茶种仁大小、发育过程、油脂合成和油脂积累水平的相关基因及其表达情况,但仍未能完整地反映调控种仁性状的作用机制。蛋白质能直接或间接地控制生理性状的表达,通过比较2 种油茶种仁的蛋白质组差异,可以初步探索调控油茶油脂合成和积累的蛋白质组学机制。基于此,本研究中采用非标记(label-free)蛋白质组学技术,对小果油茶和高州油茶种仁的蛋白质组进行比较分析,挖掘2 种油茶种仁中与种仁大小、发育、油脂合成积累及其成分等相关的关键蛋白,分析差异蛋白的生物学功能,以期为油茶分子育种提供理论参考。
1 材料与方法
1.1 供试材料
用于试验的高州油茶和小果油茶的成熟果实及其种仁如图1 所示,高州油茶于2020 年10 月中旬(成熟期)采自中国广东省惠州市博罗林场(114°34′E,23°23′N), 小果油茶于2020 年11月中旬(成熟期)采自中国广东省韶关市曲江小坑林场(113°35′E,24°15′N)。2 个品种均随机选择3 棵盛果期单株,采集树冠中上部成熟果实,取其种仁放入冻存管,高州油茶种仁样品标记为GZ255-2-1、GZ255-2-2、GZ255-2-3,小果油茶种仁样品标记为YPZZ13-1、YPZZ13-2、YPZZ13-3,随后置于液氮中快速冷冻,保存于-80 ℃超低温冰箱中备用。
1.2 试验方法
1.2.1 蛋白质提取和酶解
取1g种仁样品置于预冷的研钵中,加入液氮充分研磨至粉末状。参照文献[25-26] 中的方法,进行蛋白质的提取。蛋白质浓度参照Bradford 法[27]测定。随后,对蛋白质进行酶解,样品的消化肽段在SPE Cartridges C18(标准密度)滤芯(Sigma-Aldrich公司)上进行脱盐,管床内径7 mm,体积3 mL。真空离心浓缩后用40 μL 体积比0.1% 的甲酸重构。
1.2.2 液相色谱串联质谱(LC-MS/MS)分析
LC-MS/MS 分析在Q-Exactive 质谱仪上进行,该质谱仪与Easy nLC 联用。根据定量后的酶解产物浓度,从各组酶解的样品中分别取2 μg 上样分析。
1.2.3 蛋白质鉴定和定量
使用MaxQuant(1.5.3.17)软件对每个样品的LC-MS/MS 原始数据进行数据搜索,对各组的原始数据进行鉴定和定量分析。使用公共蛋白数据库UniProt(https://www.uniprot.org/)对蛋白质进行定性分析。
1.2.4 差异表达蛋白质筛选
使用公共蛋白数据库UniProt 筛选出差异表达的蛋白质,包括显著差异表达蛋白质和部分差异表达蛋白质。显著差异表达蛋白质,是指组间比较中差异倍数(fold change,FC)大于2.0 或小于0.5 的差异蛋白质;部分差异表达蛋白质,指组间比较中一组样品具有2 个及以上的非空值,而另一组样品具有空值的差异蛋白质。
1.2.5 生物信息学分析
分别使用CELLO(http://cello.life.nctu.edu.tw/)软件和在线网站NCBI Conserved Domain(https://www.ncbi.nlm.nih.gov/cdd/)的CDD 数据库进行亚细胞定位分析和蛋白结构域分析。
小果油茶和高州油茶种仁中差异表达的蛋白质使用Cluster 3.0 软件采用层次聚类法进行聚类,并将结果显示在热图中。
采用GO 数据库(http://www.geneo-ntology.org/) 和KEGG 通路数据库(http://www.genome.ad.jp/kegg/)对差异蛋白进行GO 功能注释和所参与代谢通路分析,获得差异蛋白质的生物功能、所参与生物过程以及细胞定位等信息。
通过Fisher 精确检验进行富集分析,应用多重测试的Benjamini- Hochberg 校正来调整得到的P 值,P 值小于0.05 的功能类别和通路被认为是显著的。
使用String 数据库(https://string-db.org/)进行蛋白质互作网络(protein-protein interaction networks,PPI)分析,通过Cytoscape软件(http://www.cytoscape.org/)进行可视化和编辑。
2 结果与分析
2.1 种仁蛋白质的识别与鉴定
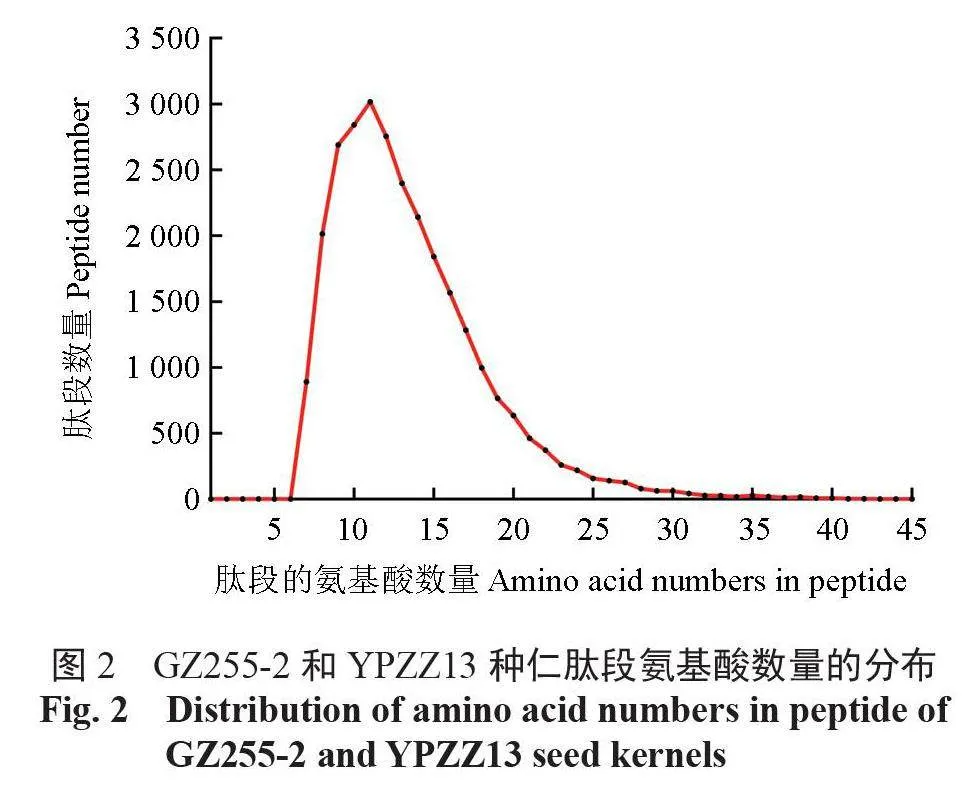
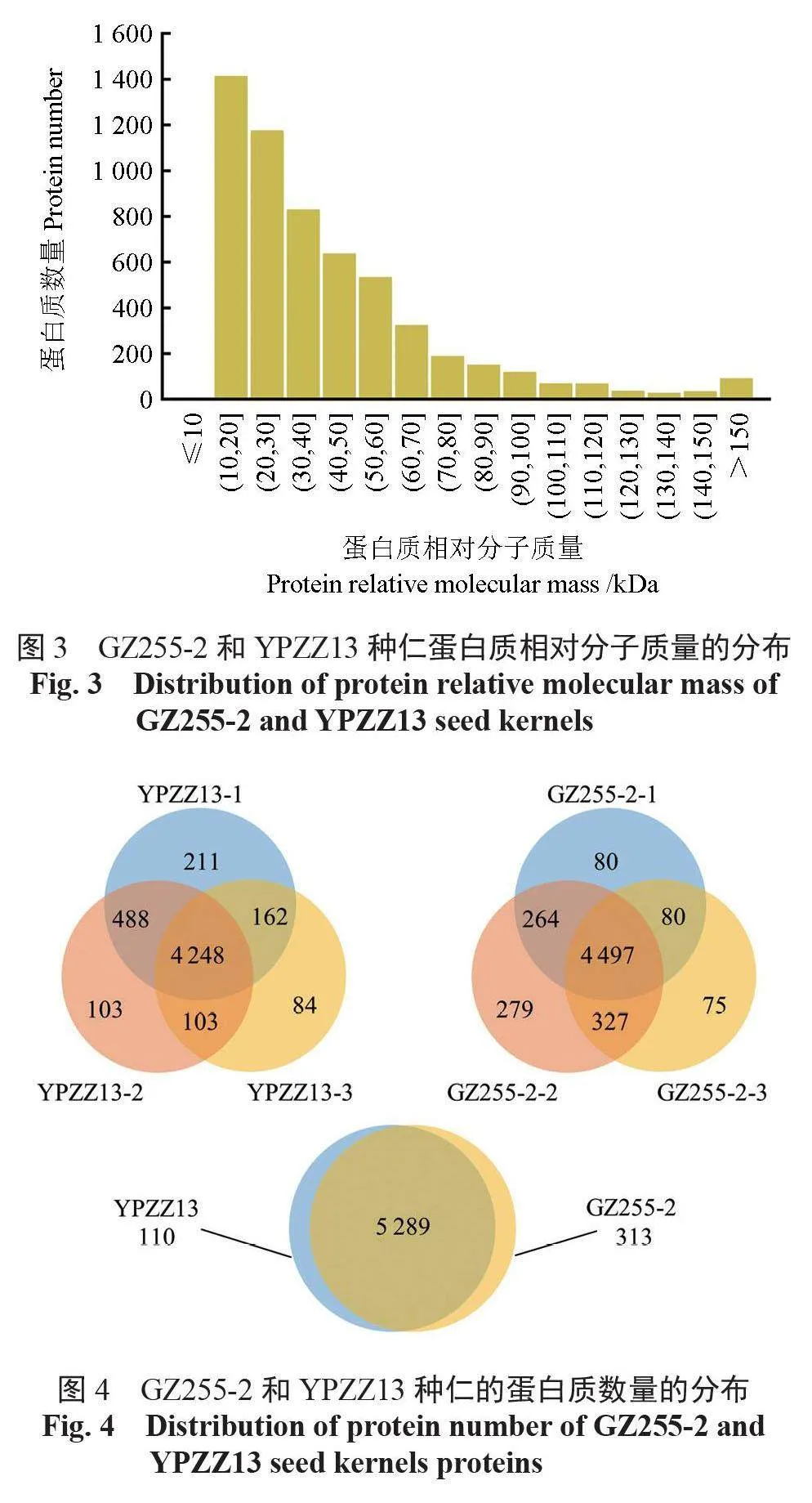
酶解后总蛋白的质谱鉴定结果显示,共有27 983 个肽段被鉴定,肽段的氨基酸组成数量集中分布在7~22,占总数量的95.31%(图2)。所有肽段对应5712个蛋白质,其相对分子质量主要为10 ~ 100 kDa,占总数量的94.15%(图3)。
如图4所示, 在YPZZ13中共鉴定出5399个蛋白质, 其中有4248个共有的蛋白质,在GZ255-2中共鉴定出5602个蛋白质, 其中有4497个共有的蛋白质。通过组间比较发现,GZ255-2和YPZZ13中共鉴定出5712个蛋白质,其中有5289个共有的蛋白质,差异蛋白质有110个属于YPZZ13,313个属于GZ255-2。
2.2 种仁蛋白质的亚细胞定位及结构域注释
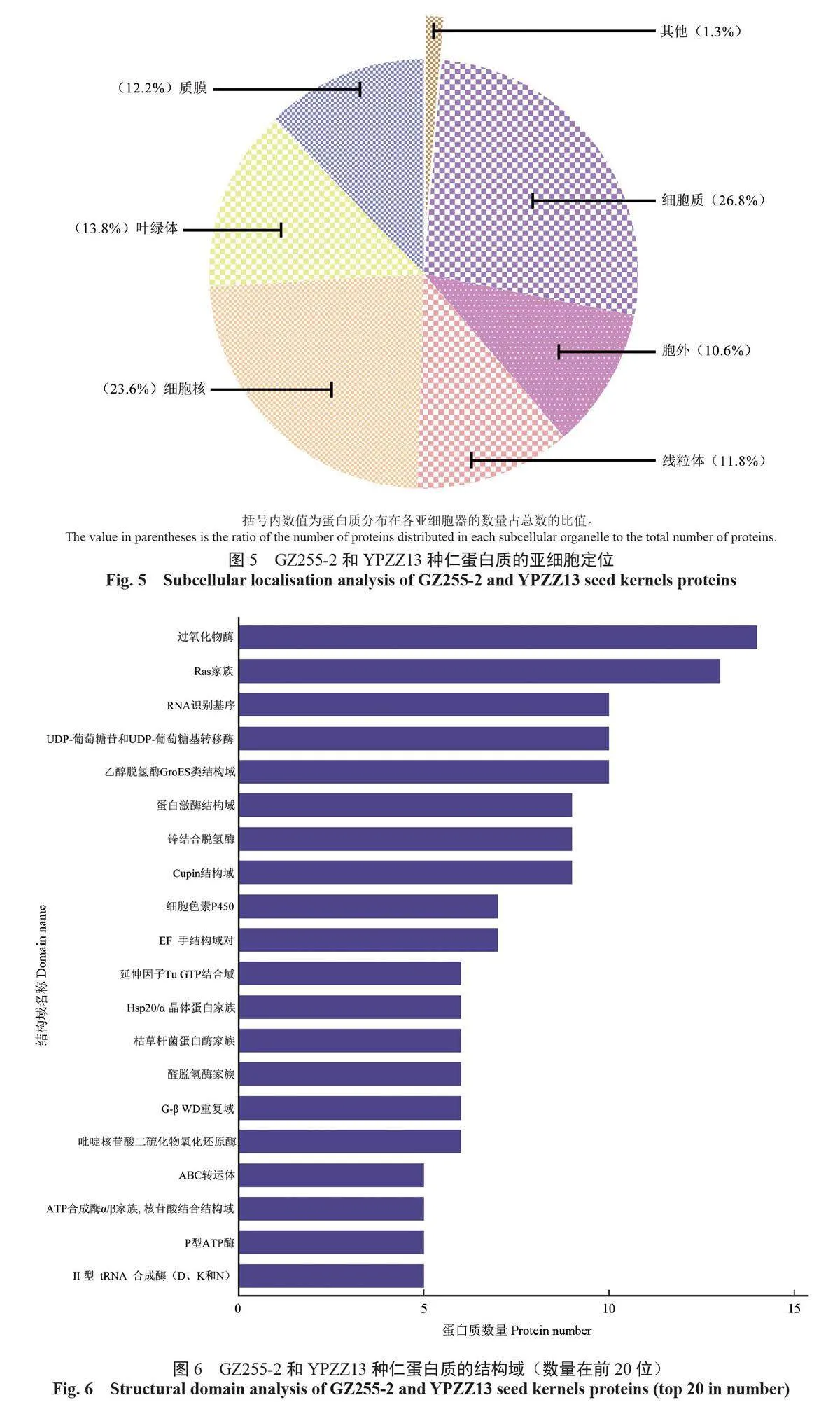
蛋白质的亚细胞定位可揭示其在细胞中发挥的功能,GZ255-2和YPZZ13中的蛋白质分布在细胞内的大部分亚细胞器中,体现功能的主要亚细胞器依次分别是细胞质、细胞核、叶绿体、质膜、线粒体和胞外,在溶酶体、过氧化物酶体、高尔基体、细胞骨架等其他亚细胞器中体现了部分功能(图5)。
结构域是蛋白质中能独立折叠和发挥功能的基本单位,GZ255-2和YPZZ13的蛋白质结构域分析结果显示,蛋白质数量排名靠前的结构域主要为过氧化物酶、Ras家族、RNA 识别基序、UDP-葡萄糖苷和UDP-葡萄糖基转移酶、乙醇脱氢酶GroES类结构域等(图6)。
2.3 种仁差异表达蛋白的筛选
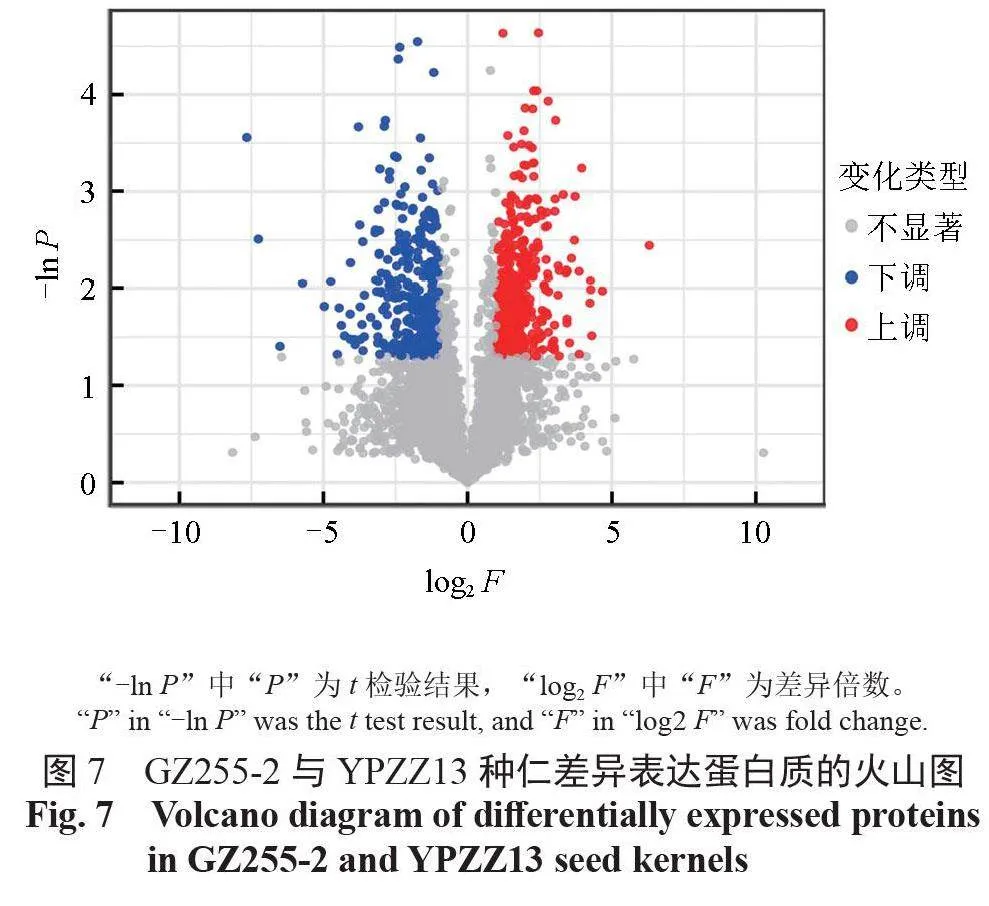
对在GZ255-2 和YPZZ13 种仁中鉴定出的5712个蛋白质进行差异表达蛋白(differentiallyexpressed proteins,DEPs)的筛选,将折叠变化的蛋白质进行t 检验得到P 值,筛选出显著差异表达的蛋白质。与YPZZ13 种仁蛋白质相比,GZ255-2种仁中有403个上调的显著差异表达蛋白质,有337 个下调的显著差异表达蛋白质,有178 个上调的部分差异表达蛋白质,有68 个下调的部分差异表达蛋白质。GZ255-2 与YPZZ13 种仁中蛋白质表达的差异情况如图7 所示。
2.4 种仁差异表达蛋白质的聚类
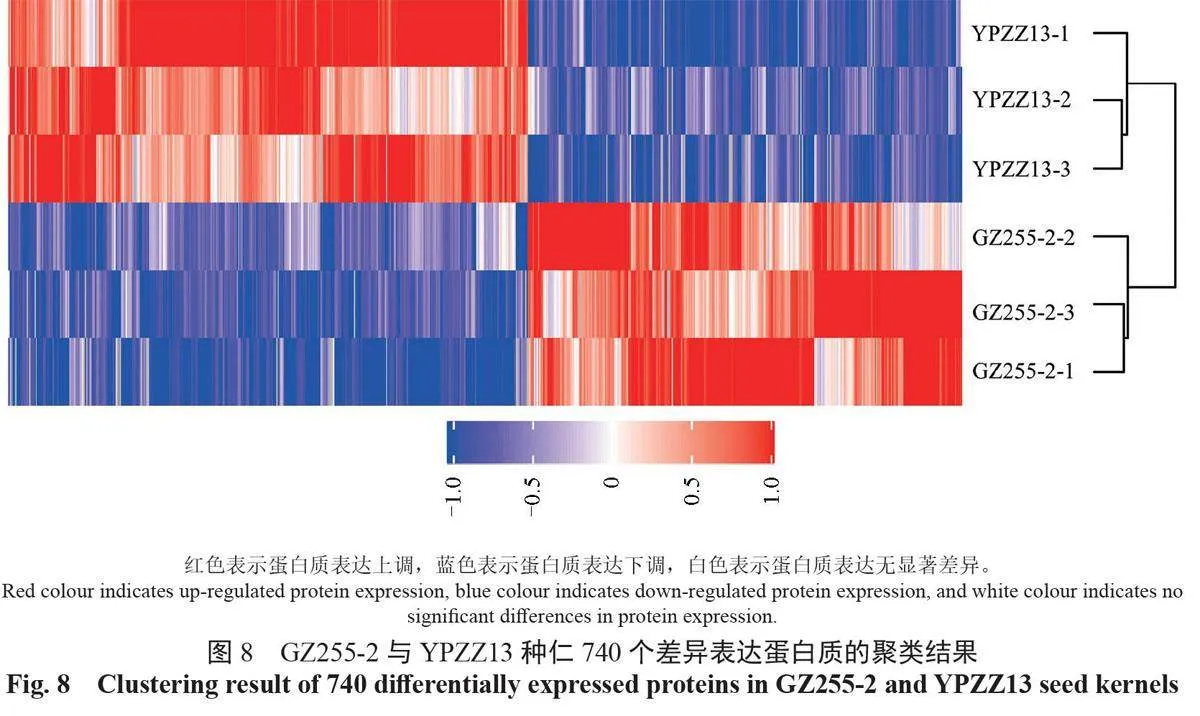
将GZ255-2和YPZZ13种仁中差异表达的740 个蛋白质采用层次聚类法进行聚类,结果如图8所示。具有相似积累模式的蛋白质被聚在一起,展示了蛋白质的差异表达与生理功能、性状的相关性。有403 个差异表达蛋白质在YPZZ13中上调,在GZ255-2 中下调;有337个差异表达蛋白质在YPZZ13 中下调,在GZ255-2中上调。高州油茶和小果油茶种仁中蛋白质聚类的结果表明,二者生理性状的差异来源于蛋白质的积累模式差异。
2.5 种仁差异表达蛋白质的GO分析
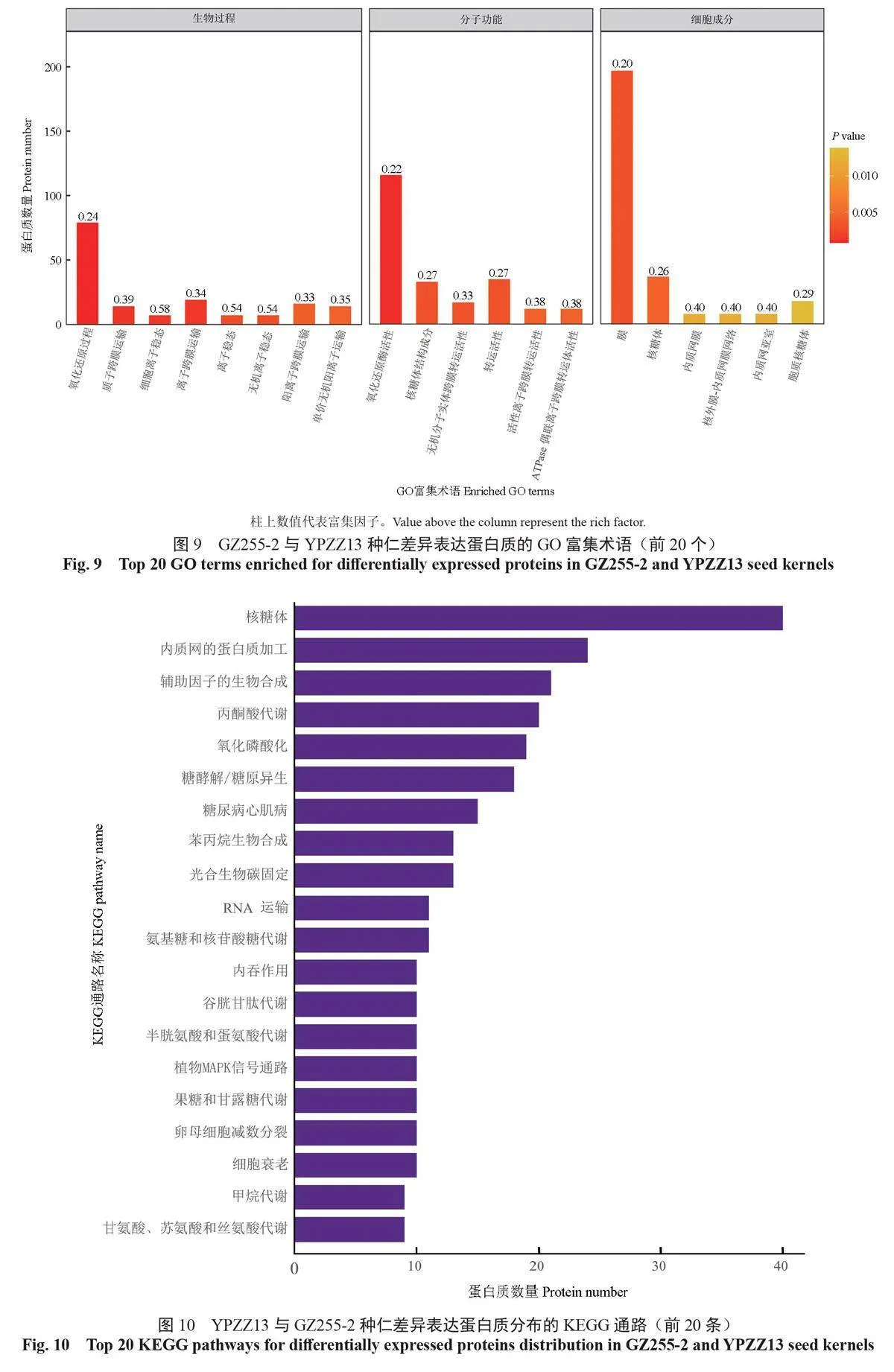
根据GO 数据库对差异表达蛋白质进行生物过程(biological process,BP)、分子功能(molecularfunction,MF)和细胞成分(cellular component,CC)的分类,得到前20 个GO 功能富集术语(图9)。生物过程方面,具有代表性的GO 术语是氧化还原过程(79 个DEPs)和质子跨膜运输(14个DEPs);分子功能方面,氧化还原酶活性(116个DEPs)、核糖体结构成分(33 个DEPs)和无机分子实体跨膜转运活性(17 个DEPs)是具有代表性的GO 术语;细胞成分方面,膜(197 个DEPs)和核糖体(37 个DEPs)是具有代表性的GO 术语。
2.6 种仁差异表达蛋白质的KEGG分析
2.6.1 差异表达蛋白质的KEGG通路注释
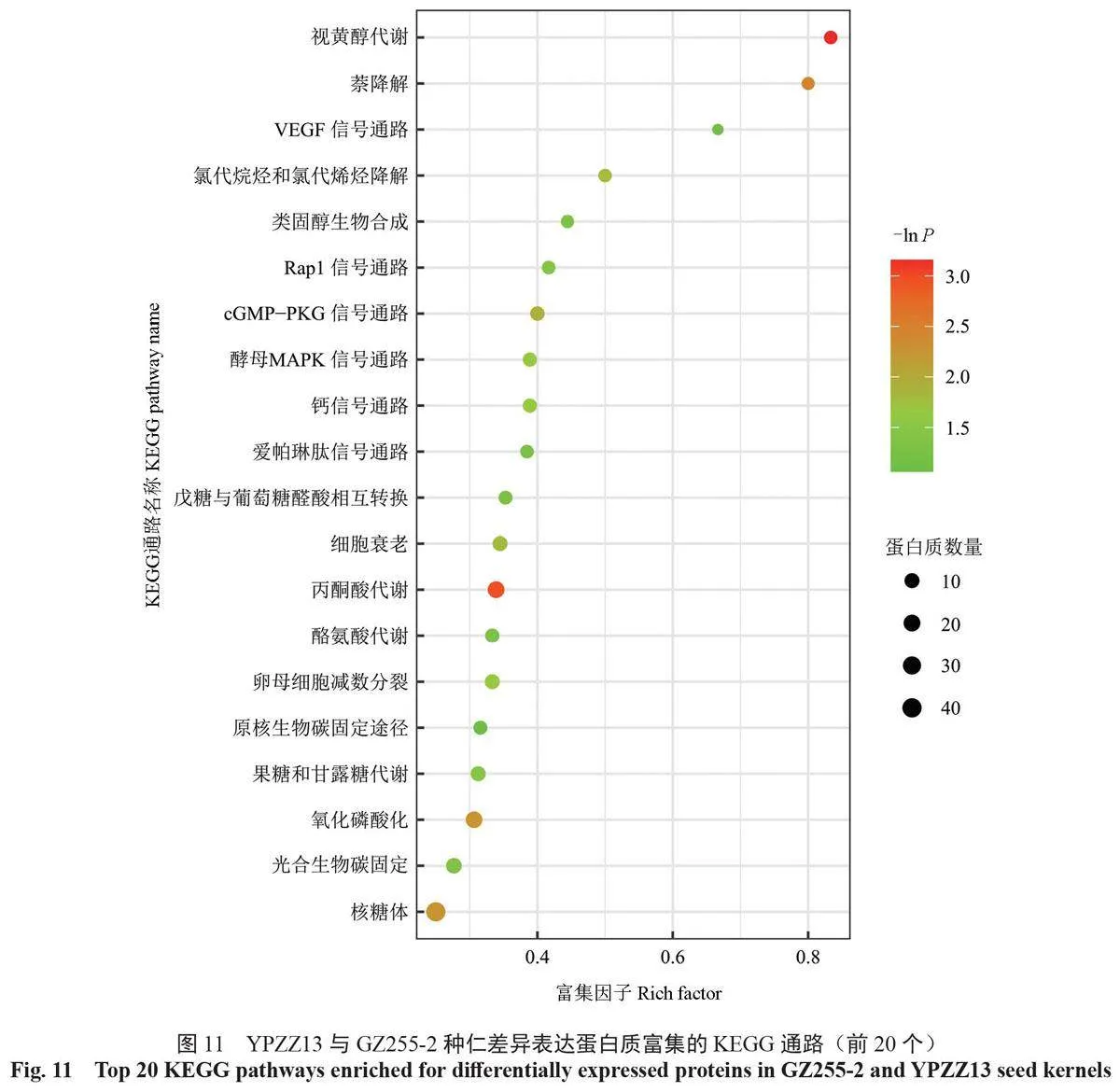
在GZ255-2 和YPZZ13种仁中共检测出179条差异表达蛋白质富集的KEGG通路并进行注释,筛选出差异表达蛋白质富集数量排名在前20 位的通路(图10)。差异表达蛋白质富集的KEGG 通路中,富集数量最多的前5 条通路分别是核糖体通路(40个DEPs)、内质网的蛋白质加工通路(24个DEPs)、辅助因子的生物合成通路(21个DEPs)、丙酮酸代谢通路(20个DEPs)和氧化磷酸化通路(19个DEPs)。
2.6.2 差异表达蛋白质的KEGG富集分析
通过KEGG 富集分析, 筛选出GZ255-2 与YPZZ13 中差异表达蛋白质显著富集的前20 条KEGG 富集通路(图11)。视黄醇代谢通路(5个DEPs)、丙酮酸代谢通路(20 个DEPs)、萘降解通路(4 个DEPs)、氧化磷酸化通路(19 个DEPs)和核糖体通路(40 个DEPs)是显著富集(P<0.05)的前5 条重要通路。其中,丙酮酸代谢通路、氧化磷酸化通路和核糖体通路是属于差异表达蛋白质富集数量排名在前20 位的通路,而视黄醇代谢通路是差异表达蛋白质富集最显著的通路。
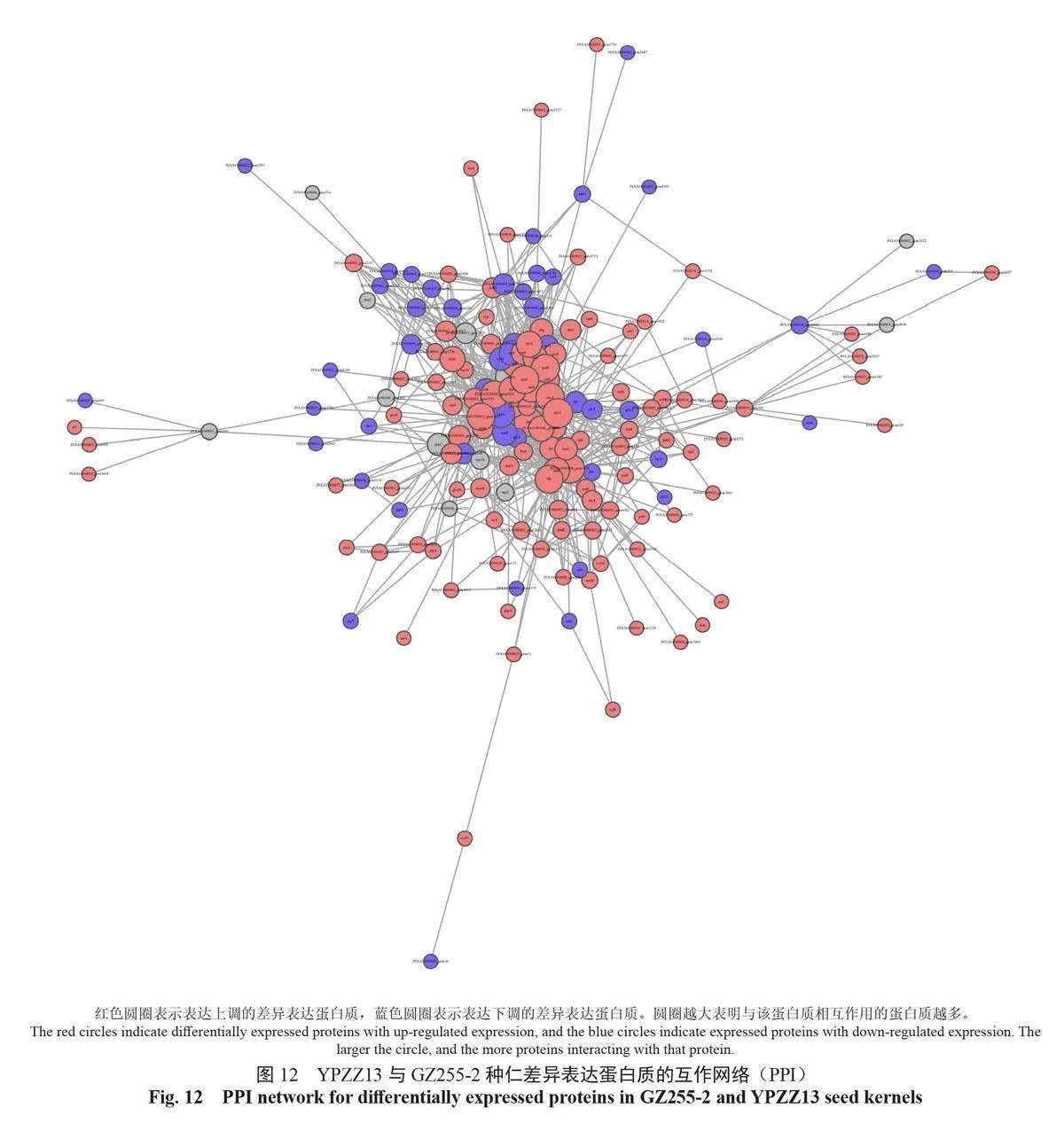
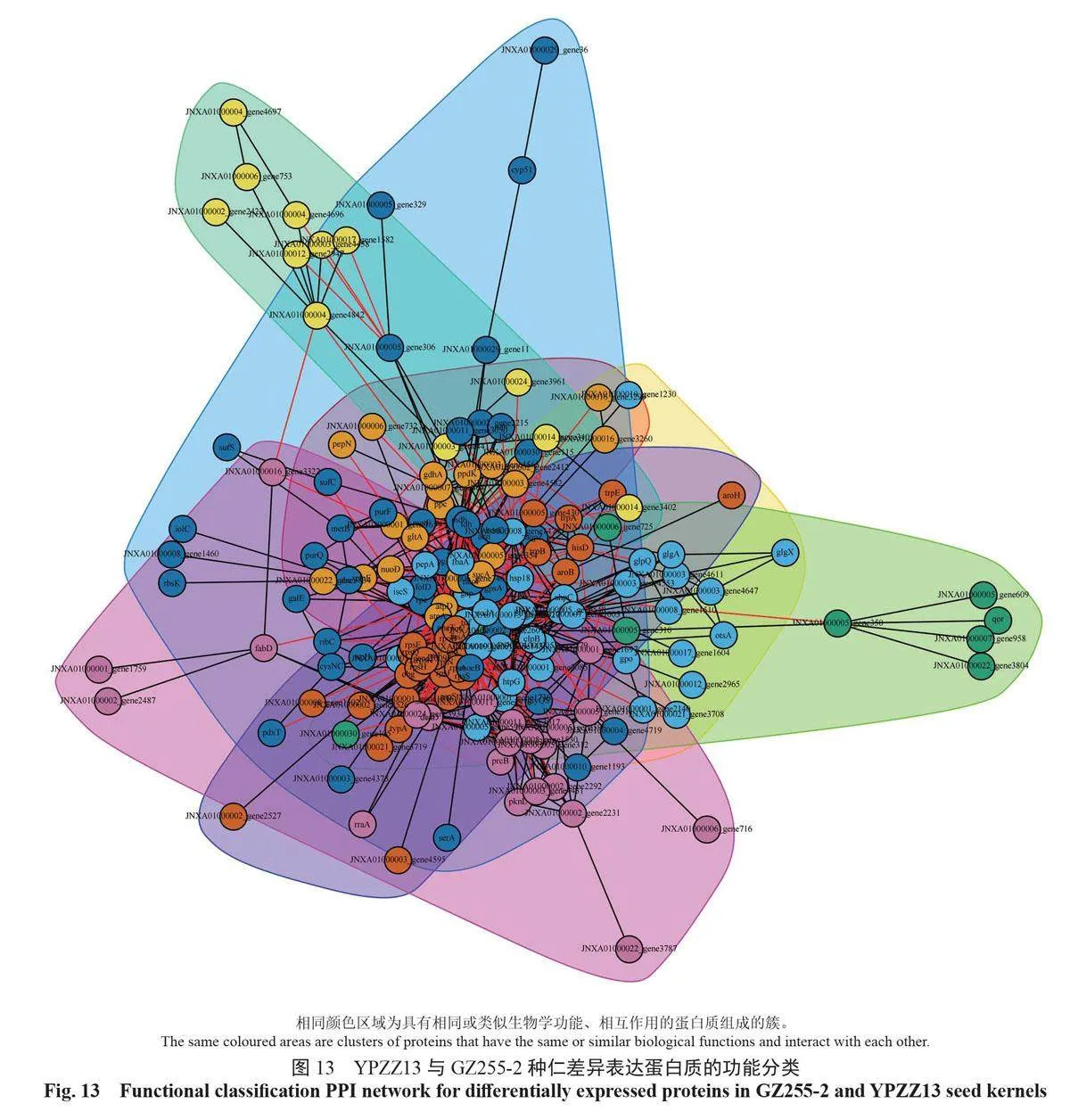
2.7 种仁蛋白质互作的网络分析
蛋白质互作网络是蛋白之间介导的途径,或其形成复合物从而发挥生物学调控作用的机制。以String 数据库中的蛋白质相互作用关系为基础,利用CytoScape 软件构建GZ255-2 与YPZZ13 差异表达蛋白质的相互作用网络图,展示GZ255-2与YPZZ13 差异表达蛋白质之间的相互作用网络(图12)。不同蛋白质高度聚集说明其可能具有相同或相似的功能,能通过协同作用发挥生物学功能。将互作网络中聚集程度高的蛋白质划分为不同簇,进行功能归类分组,如图13所示。
2.8 种仁显著差异表达蛋白质的代谢通路富集分析
通过比较高州油茶和小果油茶种仁中参与油脂合成积累、营养物质合成、活性成分合成等重要通路的显著差异表达的蛋白质,筛选出部分关键的显著差异表达蛋白质。
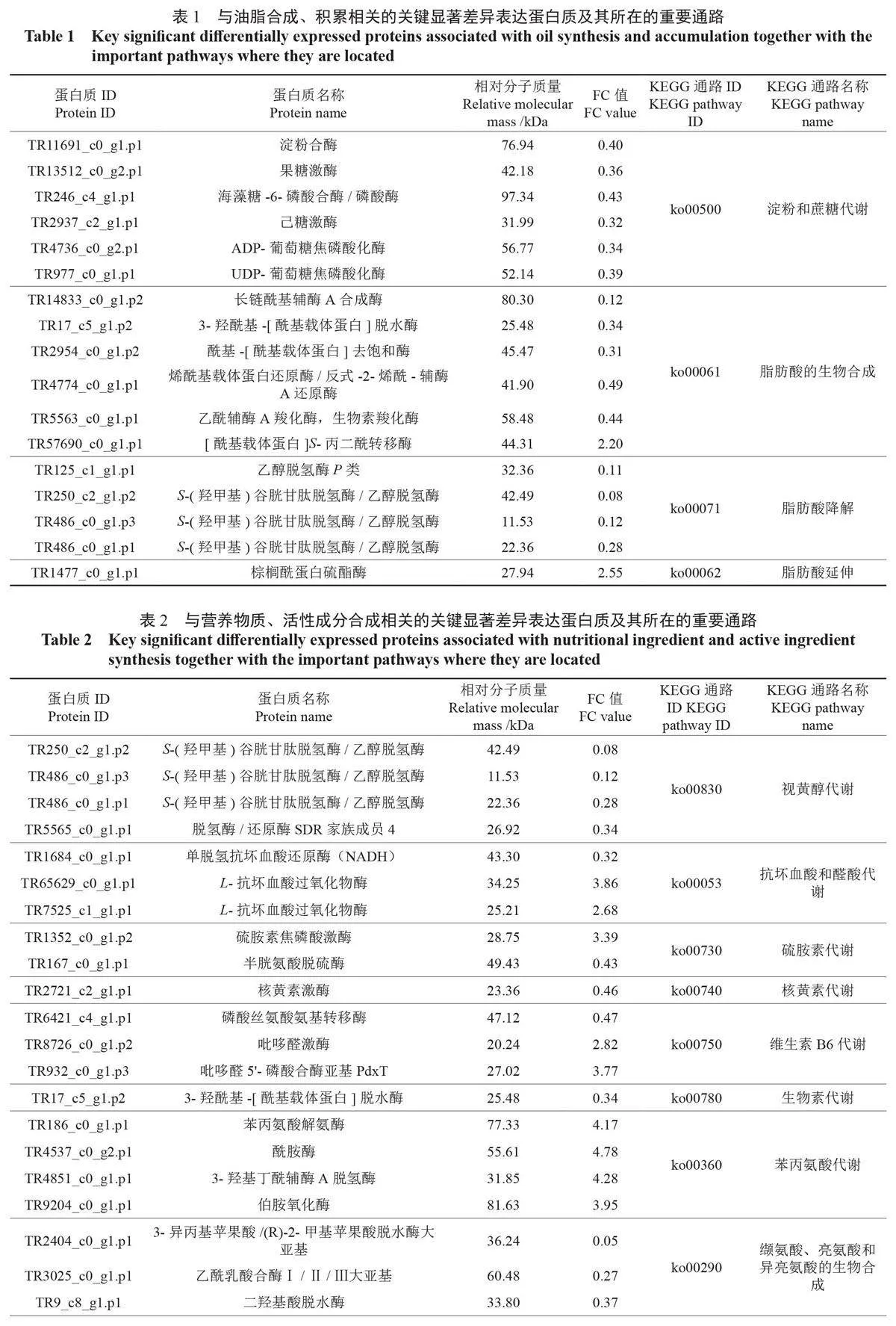
表1中展示了与油脂合成、积累相关的关键显著差异表达蛋白质,及其参与的重要通路。在淀粉和蔗糖代谢、脂肪酸的生物合成、脂肪酸降解、脂肪酸延伸、不饱和脂肪酸的生物合成等通路中鉴定出多个关键的显著差异表达蛋白质,其中长链酰基辅酶A 合成酶同时参与了脂肪酸的生物合成和脂肪酸降解通路,酰基-[ 酰基载体蛋白] 去饱和酶同时参与了脂肪酸的生物合成和不饱和脂肪酸的生物合成通路,烯酰基载体蛋白还原酶/ 反式-2-烯酰- 辅酶A 还原酶同时参与了脂肪酸的生物合成和脂肪酸延伸通路,而在脂肪酸降解通路中有3个S-( 羟甲基) 谷胱甘肽脱氢酶/ 乙醇脱氢酶。
维生素和人体不能合成的必需氨基酸在种仁中的表达情况是影响油茶种仁品质的重要因素。表2 中展示了与营养物质、活性成分合成相关的关键显著差异表达蛋白质,及其参与的重要通路。在视黄醇代谢(维生素A)、抗坏血酸(维生素C)和醛酸代谢、硫胺素代谢(维生素B1)、核黄素代谢(维生素B2)、维生素B6代谢、生物素代谢(维生素B7、维生素H)等通路中共鉴定出14个关键的显著差异表达蛋白质,其中参与视黄醇代谢通路的3个S-( 羟甲基) 谷胱甘肽脱氢酶/乙醇脱氢酶还参与了脂肪酸降解通路,参与生物素代谢的3- 羟酰基-[ 酰基载体蛋白] 脱水酶还参与了脂肪酸的生物合成通路。在必需氨基酸代谢和生物合成的不同通路中,共鉴定出16 个显著差异表达蛋白质,其中酰胺酶同时参与了苯丙氨酸代谢通路和色氨酸代谢通路。
3 结论与讨论
本研究中利用非标记蛋白质组学技术研究了小果油茶和高州油茶种仁的蛋白质组差异,发现740个蛋白质在2 种油茶种仁中呈现表达的差异。通过GO 分析发现,差异表达蛋白质主要参与氧化还原的过程以及核糖体的组成。KEGG 分析结果显示,差异表达蛋白质显著富集的通路是视黄醇代谢通路、丙酮酸代谢通路、萘降解通路、氧化磷酸化通路和核糖体通路,这与GO 分析结果相关。此外,通过对差异表达蛋白质进行挖掘,总结和分析了影响种仁中油脂合成积累、营养物质合成、活性成分合成相关的部分关键的显著差异表达蛋白质,揭示了其在高州油茶和小果油茶种仁中积累模式的差异。
糖类物质是油脂积累的重要前体物质,可溶性糖和淀粉含量与油脂的积累正相关[28-30]。本研究结果表明,6个显著差异表达的蛋白质包括淀粉合酶(glgA)、ADP- 葡萄糖焦磷酸化酶(glgC)、海藻糖-6- 磷酸合酶/ 磷酸酶(TPS)、UDP- 葡萄糖焦磷酸化酶(UGP2)、果糖激酶(scrK)和己糖激酶(HK)。其中,glgA 和glgC 是参与淀粉生物合成的关键酶,其基因表达水平与淀粉积累速率正相关[31-32]。TPS 参与海藻糖代谢,是合成海藻糖的关键酶,其酶活性影响植物新陈代谢、发育进程和胁迫应答的能力[33-35]。UGP2 则是多糖生物合成过程中的关键酶,参与调控植物体内蔗糖的合成与代谢[36],还参与催化生产UDP- 葡萄糖,从而合成蔗糖和促进细胞壁形成[37-38],UGP2 在植物发育和应答胁迫方面也具有重要的作用[39]。此外,Granot 等[40] 经鉴定发现,HK 家族和scrK 家族是催化葡萄糖和果糖基本不可逆磷酸化的2 个酶家族,游离果糖会被scrK 或HK 催化磷酸化,且scrK 与果糖的亲和度更高[41]。与小果油茶相比,在高州油茶种仁中,这6 个显著差异表达蛋白质在淀粉和蔗糖代谢通路中下调,这可能与高州油茶消耗了大量的糖类物质用于合成脂肪酸有关。庄瑞林[4] 经研究认为,在油脂合成和积累的能力上,高州油茶优于小果油茶,这与本研究结果基本一致,说明脂肪酸的合成和积累可能是影响糖类物质代谢的重要因素。
此外,本研究中发现长链酰基辅酶A 合成酶(ACSL)、烯酰基载体蛋白还原酶/ 反式-2- 烯酰- 辅酶A 还原酶(MECR)、酰基-[ 酰基载体蛋白] 去饱和酶(FAB2)参与了与脂肪酸代谢相关的多个通路。ACSL 通过形成酰基辅酶A 中间体激活脂肪酸,参与脂肪酸的生物合成、降解。ACSL 家族酶能将长链或超长链脂肪酸转化为硫酯,用于不同的脂质代谢相关过程,而其活性的改变影响种子萌发、种子含油量以及植物应答胁迫的能力[42]。MECR 参与脂肪酸的生物合成和延伸,能促进脂肪酸的合成,并参与脂肪酸的延伸,使脂肪酸从C4 延伸到C16,甚至进一步拉长成为极长链脂肪酸,改变不同脂肪酸的相对含量[43-44]。FAB2 是一类可溶性酶,是参与不饱和脂肪酸和脂肪酸的生物合成的关键蛋白[45],其基因表达影响植物对生物胁迫调控的反应[46]。与小果油茶相比,高州油茶有9 个显著差异表达蛋白质在脂肪酸的生物合成、脂肪酸降解和脂肪酸延伸通路中下调,有1 个显著差异表达蛋白质在不饱和脂肪酸的生物合成通路中上调,这与糖类物质代谢促进脂肪酸合成的推测结果不一致。高州油茶作为性状变异程度较大的大果油茶,其成熟时间常存在差异,采集时间较晚或种子成熟度较高有可能是导致种仁脂肪酸合成减弱的原因,但脂肪酸的降解也减弱,这与Wang 等[47] 的报道一致,即早熟大果油茶种子成熟末期,脂肪酸的含量先增加,后略有减少。此外,与小果油茶种仁相比,高州油茶种仁中FAB2 在不饱和脂肪酸的生物合成通路中上调,推测在种仁成熟末期,高州油茶种仁中不饱和脂肪酸的合成和积累增加,这与高州油茶油脂高不饱和脂肪酸含量的特征一致。
视黄醇是维生素A中的一种[48],与视觉功能、细胞分化和生长、上皮组织细胞健康、免疫功能及抗氧化能力等相关[49]。视黄醇通常与脂肪酸结合成视黄基酯,视黄基酯和植物性食物中的类胡萝卜素又常与蛋白质结合形成复合物,最终在小肠中释放出脂肪酸、游离的视黄醇及类胡萝卜素[50]。KEGG 富集分析的前20条通路中,差异表达蛋白质最显著富集的通路是视黄醇代谢通路。在视黄醇代谢通路中,共有4个显著差异表达蛋白质富集,其中1个为脱氢酶/ 还原酶SDR家族成员4(DHRS4),另外3个显著差异表达蛋白质均为S-( 羟甲基) 谷胱甘肽脱氢酶/ 乙醇脱氢酶(frmA)。其中,DHRS4 属于短链脱氢酶/ 还原酶(SDR)大家族,SDR 是NAD(P)H 依赖性氧化还原酶,在脂质、氨基酸、糖、辅助因子、激素和异生物代谢以及氧化还原传感机制中发挥着重要作用[51]。SDR基因在种子萌发过程中显著表达,参与了种子的发育[52]。乙醇脱氢酶则参与视黄醇代谢,催化视黄醇和视黄醛的可逆相互转化,视黄醛经还原得到视黄醇,经氧化后得到视黄酸[53]。视黄酸是视黄醇代谢的中间产物,在调节细胞分化和凋亡、胚胎发育和再生、视力发育等方面发挥重要作用[54-55]。与小果油茶种仁相比,高州油茶种仁中显著差异表达蛋白质在视黄醇代谢通路下调,说明小果油茶种仁的维生素A含量可能较高。
试验中笔者采样时对油茶果实成熟度的判断可能存在一定的偏差,这会对油茶种仁蛋白质的鉴定产生一定的影响。后续将进一步分析关键蛋白(酶)的调控基因和最终合成的代谢产物,以验证本研究中的差异蛋白数据。

