薄壳山核桃花粉LTP基因的克隆和功能分析





关键词:薄壳山核桃;花粉离体萌发;脂质转移蛋白;植物内生菌
中图分类号:S664.1 文献标志码:A 文章编号:1003—8981(2024)03—0001—09
山核桃属Carya Nutt. 植物多是重要的坚果和木本油料作物[1],其中原产北美的薄壳山核桃[2]Carya illinoinensis (Wangenh.) K. Koch 和浙江山核桃Carya cathayensis Sarg 是目前山核桃属植物中最具经济价值的两个种[3]。薄壳山核桃作为山核桃属植物[4] 中雌雄同株异花的风媒花异交植物,较早就有对其生殖机理的研究报道,内容多集中在花粉萌发方面,现已建立了较好的花粉离体萌发体系, 是山核桃属花粉研究中一个很好的实验模型。浙江山核桃虽然也是雌雄同株异花,但倾向于无融合生殖[5-6],其花粉的发育和萌发规律尚不清楚,这也是浙江山核桃杂交育种的难点。从进化角度看,虽然薄壳山核桃和浙江山核桃染色体数都是32,但是薄壳山核桃是山核桃组中较为进化的,而浙江山核桃却是比较原始的类型[7]。Sparks[8] 根据分子进化和化石方面的信息,可以将山核桃属植物分为东北美(East North American,简称“ENA”)和东亚(East Asian,简称“EA”)2 个类群,薄壳山核桃和浙江山核桃分别是这两个类群的代表。开展这2 个种生殖机理的比较研究对于揭示山核桃属植物的遗传进化规律具有重要意义。
近年来,蛋白质组学技术在挖掘授粉有关机理方面发挥了重要作用。例如,Teixeira 等[9] 分析了蓖麻花粉成熟、水合和萌发3 个不同阶段的蛋白质组,发现了40 多种在成熟花粉和萌发花粉中差异显著的蛋白质,并且其中的大多数与能量代谢和信号传导有关。ITRAQ(Isobaric tags forrelative and absolute quantitation,同位素标记的相对和绝对定量)是近年来蛋白质组学常用的高通量筛选技术之一,适合进行不同生理状态的蛋白质组差异分析。例如,Shrestha 等[10] 利用ITRAQ和DGE(Digital Gene Expression Profiling, 数字基因表达)技术研究烟草Nicotiana tabacum 花粉独特的发育过程,揭示了早期双细胞花粉、晚期双细胞授粉和6 h 花粉管这3 个阶段的蛋白质和基因变化特点,结果表明了转录后调控在烟草早期和晚期花粉发育中的重要性。Robinson 等[11] 利用ITRAQ 和转录组相结合,对甘蓝型油菜Brassicacarinata 的成熟花粉和柱头进行了无凝胶鸟枪蛋白质组学研究,分别鉴定出5 608 个和7 703 个蛋白,发现两者既存在许多共同的功能和发育目标,也存在与自身细胞特化有关的重要差异。Pei 等[12]利用ITRAQ 相关技术检测雄性不育系和正常辣椒的蛋白质组差异,筛选出1 645 个明显丰度差异的蛋白,发现主要是与叶绿体和细胞质有关的蛋白,推测可能与雄性不育辣椒的败育有关。Robinson等[13] 利用ITRAQ 技术,从小黑麦中筛选出647个在花粉与柱头结合时有差异变化的蛋白。上述研究说明,ITRAQ 蛋白质组在研究花粉和柱头发育方面有着独特的潜力。
在山核桃属植物育种研究过程中,薄壳山核桃花粉离体萌发较为容易,而浙江山核桃花粉离体萌发较为困难。本研究基于ITRAQ 技术比较了薄壳山核桃和浙江山核桃花粉离体萌发前后蛋白质组变化的差异,筛选出显著差异蛋白,据此信息克隆了差异最为显著的非特异脂转移蛋白基因(Non-specific Lipid-Transfer Protein,下简称LTP基因),并研究了部分基因的表达规律和初步功能。
1 材料与方法
1.1 材料
供试山核桃属Carya 叶片与花粉材料于2020年5 月分别采自浙江省林业科学研究院的薄壳山核桃资源圃和浙江省杭州市临安区,薄壳山核桃品种为Pawnee。从树上取下薄壳山核桃和浙江山核桃带有雄花序的枝条,在18 ℃空调室铺开晾过夜,然后将散出的花粉收集混合再分装于2mL 试管,再密闭冻存于-80 ℃备用。用于蛋白质组分析的样品分为萌发前和萌发后两个状态,通过下述方法收集萌发前花粉样品:从-80 ℃取出花粉样品,置于常温干燥箱中处理1 h,将处理后的花粉均匀分散在培养皿表面,然后将培养皿置于饱和硫酸铜上方,在16 ℃条件下水合4 ~ 6 h,收集水合后的花粉冻存于-80 ℃备用。收集萌发后花粉样品的方法为:取0.01 g 水合处理后的花粉样品,将其与50 μL 萌发液充分混合,然后将混合后的液体均匀涂布于固体萌发培养基的玻璃纸上,在25 ℃条件下使样品萌发5 h 左右,随后将萌发后的样品置于显微镜下观测,以确认样品的萌发程度及状态,最后,收集部分萌发后的花粉样品并在-80 ℃条件下保存备用。大肠杆菌表达载体pET32a(+),Trans1-T1(DH5α)、由本实验室保存;TransZol Up、DNase I、TransScript Two-Step RTPCRSuperMix、TransStart Taq DNA Polymerase、Amp (Ampicillin)、X-gal、IPTG、DNA Marker 购自上海生工生物工程有限公司;Hind Ⅲ和BamHI 限制性内切酶购于北京擎科生物有限公司;引物合成和测序由北京擎科生物有限公司完成。
1.2 蛋白质组分析
蛋白质的提取、iTRAQ 标记和液质联用分析按文献要求处理[14-15],反相柱为C18 column (1.8 mm,0.15×100 mm),色谱仪器为Thermo Fisher EasynLC1000,质谱仪器为Thermo Fisher LTQ ObitrapETD, 流动相A 为0.1% 的甲酸水溶液, 流动相B 为100% 乙腈溶液,流速为300 nL/min,扫描质荷比的范围为350 ~ 1 600。数据处理采用Maxquant1.5.8.3 软件,胡桃juglans 属数据库,差异蛋白筛选基于倍数变化,大于2.0 倍的变化判定为上调,小于0.5 倍的被定义为下调。
1.3 LTP基因的克隆
取适量薄壳山核桃叶片或雄花序, 液氮冷冻研磨粉碎后, 采用参照RNA 提取试剂盒操作方法提取总RNA。用反转录试剂盒( 大连TaKaRa 公司) 将提取的总RNA 反转录成cDNA。基于本研究薄壳山核桃转录组数据中的LTP 基因序列设计引物: 上游引物F:5′-ATGGCTGGCTCCTTGGTCCTTAARC-3′;下游引物R:5′-TCATTTCACAGTTTTGCAGTTAGTG-3,以薄壳山核桃cDNA 为模板进行PCR 扩增,总反应体系为20 μL:其中包括1 μL cDNA,上下游引物各1 μL ( 浓度1.0 μmol/L),10 μL Taq mixture,ddH2O 补足20 μL。PCR 扩增参数为95 ℃预变性5 min;94℃ 30 s,55 ℃ 50 s,72 ℃ 1 min,32 个循环,72 ℃延伸10 min,4 ℃保存。扩增产物经电泳回收,连接TA 载体,进行测序。
1.4 LTP基因表达分析
实时定量PCR 按照SYBR Premix Ex Taq 试剂盒(大连TaKaRa 公司)说明书进行,相对定量的计算参照常用的2-ΔΔCT 法。采用Excel2010 软件处理数据,萌发后相对于萌发前的基因表达(即以萌发前相对表达量为1),采用双样本异方差假设的t 检验(双尾)。qRT-PCR 采用SYBR Green法在BIO-RAD IQ5 上完成。为增加相对定量的客观性,GAPDH 和EF1 2 个看家基因为内参,内参基因引物如表1 所示。根据LTP 基因序列对LTP1和LTP2 各设计一对表达检测引物:P-LTP1F7:CCTTAAACTCTCAGGCATGGTTCTG,P-LTP1R7:TTGAGTAACCGTACCCTTGAGGTAGC;P-LTP2F8:TTAAGCTCTCAGGCATGGTGCTTC,P-LTP2R8:ATTGCAGCAGTTTGGAGGGACTT。
1.5 LTP 基因分析和蛋白空间结构预测
LTP基因的序列分析采用vector NTI 10.0(Invitrogen)软件,蛋白质分子量和等电点等采用ProtParam 软件计算,蛋白信号肽采用Signal P6.0 软件分析,跨膜区域预测采用TMHMM2.0 软件,蛋白的疏水性和亲水性采用ProtScale 软件。预测蛋白质二级结构采用PSIPRED 4.0 软件。空间结构预测在xCREATOR 工作台(https://xcreator.tianrang.com/)上进行,采用alphafold2 算法。
1.6 花粉离体萌发体系和LTP基因功能验证
薄壳山核桃花粉离体萌发体系见参考文献[16-17]。利用大肠杆菌体系进行LTP 蛋白的表达,对LTP 基因根据大肠杆菌密码子的偏好和酶切位点的特点进行优化,采用酶切位点BamH Ⅰ、Hind Ⅲ将LTP 基因通过克隆载体pMD19-T 转移到表达载体pET-32a(+)中,该载体在感受态细胞OrigamiB(DE)pLySs 中通过IPTG 诱导表达LTP,表达后的LTP 蛋白为包含His-Tag 的融合蛋白,可以通过亲和柱进行纯化。选取IPTG(1.0 mmol/L)诱导表达后6 h 提取的LTP 蛋白,提取后加入萌发体系探究其对花粉萌发的影响。
2 结果与分析
2.1 薄壳山核桃和浙江山核桃花粉离体萌发前后蛋白谱比较分析
薄壳山核桃的萌发体系较为完善,萌发率较高,而浙江山核桃只有少量萌发,比较两个体系的蛋白差异,共鉴定出蛋白375 个,经同源比对,发现其中只有20 个属于山核桃属植物,其余均是微生物的蛋白。从萌发后相对于萌发前的变化来看,两种植物均未有明显下调的蛋白出现,表明其蛋白变化规律在一定范围内存在一致性,而且萌发后两种植物多数蛋白差异也不十分明显(表2)。就上调的规律而言,在薄壳山核桃中,这20 个蛋白都是上调的,在浙江山核桃中,只有AP1、Putativeextensin、Glutamine synthetase、Protein Ycf2、9-cisepoxycarotenoiddioxygenase 和ATP synthase subunitbeta 这6 个是上调的。对两种植物萌发前后蛋白比值的比较发现,有部分蛋白在两种植物中花粉萌发前后的变化规律是相反的,如Non-specific lipidtransferprotein 和60S acidic ribosomal protein P2。两种植物萌发前后的蛋白变化揭示这些蛋白在两种植物中的活跃程度,如非特异脂蛋白(Non-specificlipid-transfer protein)比值达18.6 倍,表明其在薄壳山核桃中比在浙江山核桃中活跃很多,此筛选结果为后续分离薄壳山核桃花粉萌发有关基因并开展功能研究提供了依据。
2.2 薄壳山核桃LTP 同源基因的克隆和表达分析
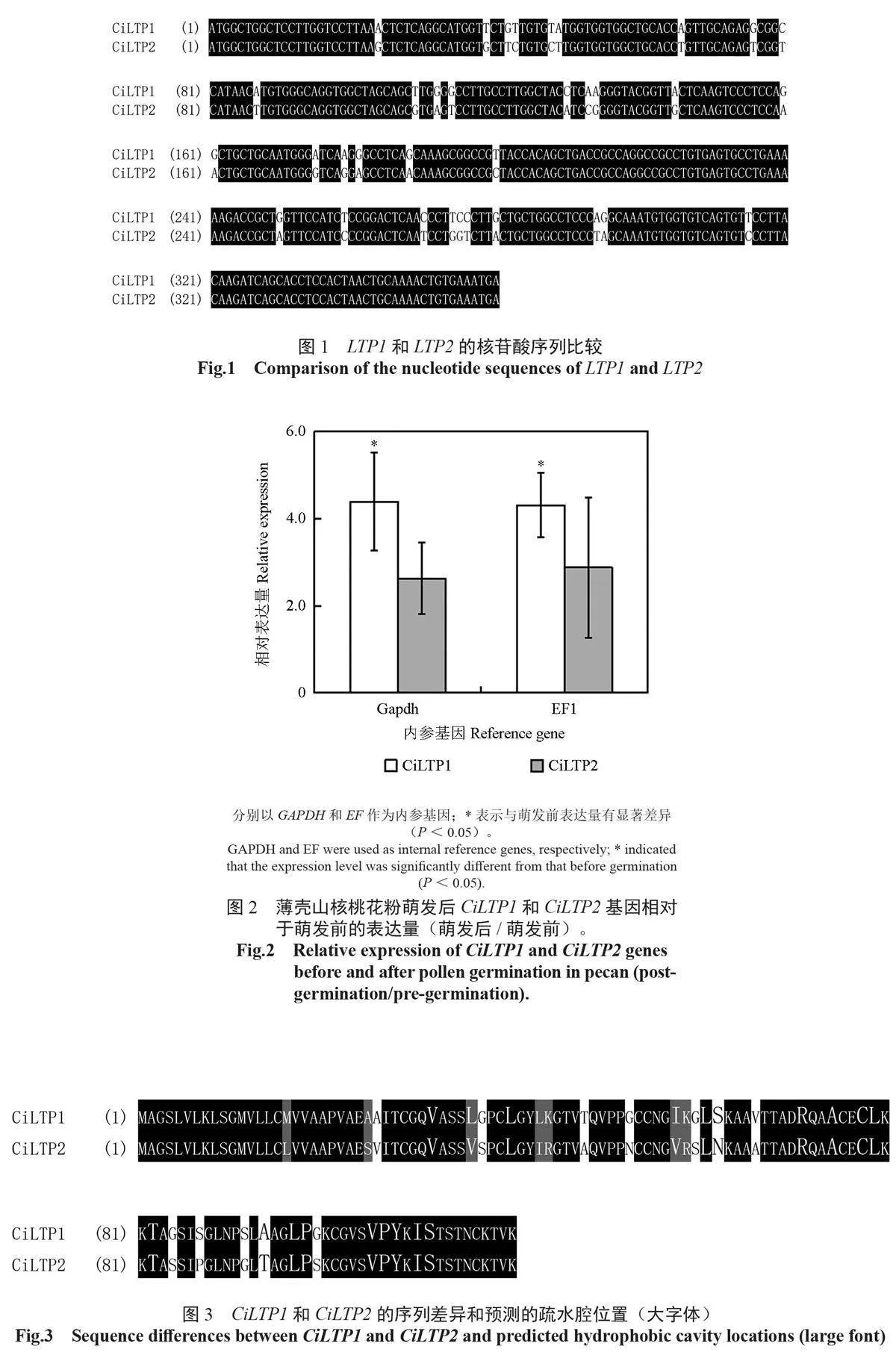
通过蛋白质谱得到的多肽序列为AAATTADR,从Genbank 搜索现有的薄壳山核桃预测蛋白,发现存在两个比较相似的基因位点,针对其编码区设计薄壳山核桃LTP 同源基因的引物,以薄壳山核桃cDNA 为模板,经PCR 扩增后得到两个360 bp的片段,分别命名为LTP1 和LTP2(图1)。为了增加相对定量的客观性和可靠性,本研究同时以Gapdh 和EF1-α 分别为内参基因,通过荧光定量PCR 检测LTP 基因在薄壳山核桃花粉萌发前后相对表达情况,可以发现薄壳山核桃LTP1 和LTP2 基因的总体表达规律相似。CiLTP1 基因在以Gapdh 为内参基因时,花粉萌发后基因表达是萌发前(即相对表达量)4.4 倍(P=0.035 < 0.05),以EF1 为内参基因时, 其相对表达量为4.3 倍(P=0.016 < 0.05),两者结果一致,均为显著上调。而CiLTP2 虽然分别以Gapdh 和EF1 为内参时,相对表达量分别达到2.6(P=0.075 < 0.05)和2.9(P=0.176 < 0.05),但统计表明萌发前后无显著差异(图2)。因此,推测CiLTP1 与花粉萌发有更高的相关性。
2.3 薄壳山核桃LTP 基因的功能分析
序列分析表明, 薄壳山核桃LTP1 和LTP2基因均编码119 个氨基酸,相同氨基酸比例达84%,相似氨基酸高达89.9%(如图3),且其疏水腔所在区域氨基酸位点基本上是相同或相似。总的来说,ProtParam 预测的蛋白质特征差异,主要在稳定性方面LTP1 明显更好一些(表3)。对CiLTP1 深入分析表明,其N 端存在一个27 氨基酸左右的信号肽,具有显著的疏水性,具有跨膜的结构特点(图4)。对LTP 进行空间结构的预测,结果显示薄壳山核桃CiLTP1 主要由α- 螺旋和不规则卷曲组成且该蛋白二级结构不含β- 转角。三级结构通过alphafold2 进行预测,结果显示,LTP 基因编码的蛋白由4 个α- 螺旋和1 个C 末端构成,其中1 个类似口袋状的疏水结构位于中间,以便结合和容纳脂肪酸分子相关[18]。植物LTP 的主要特征是在高度保守的区域(C-Xn-CXn-CCXn-CXC-Xn-C-Xn-C)[19] 中存在8 个半胱氨酸残基,形成4 个稳定的二硫键。山核桃属植物也具备此特征,由此确定此蛋白属于Non-specificlipid-transfer protein type I 类蛋白,不过在第16 位的氨基酸也是半胱氨酸,因此山核桃属植物LTP蛋白中存在9 个半胱氨酸残基。此外,植物LTP的晶体结构由4 个或5 个α 螺旋组成,并在中央疏水腔中发生脂质结合。对LTP 结构域分析表明其存在由保守的脂质结合基序构成的AAL-LTSS超家族保守结构域,此结构域是胰蛋白酶、α– 淀粉酶抑制剂和脂质转移蛋白所共有的特征。
2.4 CiLTP1 蛋白对花粉离体萌发的影响
利用已经建立的薄壳山核桃离体萌发体系来初步验证LTP 在花粉萌发中的功能。在大肠杆菌DE3 菌株中用IPTG(1.0mmol/L)诱导6 小时后,由于LTP 在95 ℃加热仍具有脂质转移特性,在80 ℃加热进一步纯化后,将LTP1 加入花粉萌发体系后发现LTP1 对薄壳山核桃花粉萌发率和花粉管长度无显著影响(表4)。
3 结论与讨论
3.1 结论
通过比较薄壳山核桃和浙江山核桃两者花粉萌发前后的蛋白质谱的差异,筛选出在两种山核桃属植物花粉萌发中表达差异最大的非特异性脂质转移蛋白LTP,克隆了薄壳山核桃CiLTP1 和CiLTP2基因,并分析了其生物学特性和基因表达特点,但在薄壳山核桃花粉离体萌发体系中未发现体外表达的CiLTP1 蛋白有影响花粉萌发的功能。
3.2 讨论
3.2.1 蛋白质组学方法研究花粉萌发的生物学意义
花粉萌发早期的研究结果表明,植物的成熟花粉与萌发花粉蛋白质组成大体相似。例如,将玉米Zea mays L. 的成熟花粉和离体萌发花粉进行蛋白质组学分析表明,花粉萌发前后中高丰度蛋白质表达谱的差异并不明显,萌发过程中花粉结构和代谢的显著变化并没有在蛋白质表达谱上表现出来[20]。本试验中检测到的山核桃属植物的蛋白不多,但在薄壳山核桃中检测到的20 个蛋白均是上调的,表明萌发前后的差异较大,这些蛋白中主要包括参与运输、防御反应、能量代谢、胁迫反应、基因调控、信号转导和细胞壁形成有关的蛋白质,这与以往的研究结果较为相似[21-22]。本研究萌发前后使用质谱数据搜库搜索出的总蛋白数目不多,可能与可供参考的山核桃属蛋白数据库有关。因为,蛋白质组学的定性、定量结果是数据库依赖型的,数据库质量越高,结果越准确。山核桃属目前虽然有部分种类完成了全基因组测序,但是由于存在较多重复序列,得到准确注释的蛋白质数据比较少。另一方面,本研究所用的花粉样品来自野外,携带微生物的蛋白是正常的,但是在结果中发现高达94.7% 的微生物蛋白是令人惊讶的,而这些微生物蛋白绝大多数是来自黄单孢菌Xanthomonas campestris,我们推测该菌可能在核桃属的花粉中广泛存在,且影响萌发。然而,最近对该菌的分离和影响萌发试验并未发现有显著影响,可能其存在其他一些相关性,值得进一步探讨。
3.2.2 研究植物LTP基因的生物学意义
脂质转移蛋白lipid transfer proteins, LTPs 广泛分布于动植物和微生物中,是一类小分子量碱性单体蛋白质。在植物体中由于作用范围广且无专一性又被称为非特异性脂质转移蛋白non-specific lipidtransfer proteins, nsLTPs,占可溶性蛋白的4%,能够转运多种疏水性分子,一般分布于植物器官的皮细胞和外周细胞及器官脱离区[23],该蛋白质热稳定性较高,这与它的独特结构有关[24]。nsLTPs 可分为3 类:nsLTPs Ⅰ、nsLTPs Ⅱ和nsLTPs Ⅲ,是依据其一级结构及分子量的大小进行分类的。本研究发现的CiLTP1 和CiLTP2 都属于Ⅰ类。
对于脂质转移蛋白的功能研究已有大量进展,植物中的非特异LTP(nsLTP)在很多生物过程如角质的合成、胚胎形成、胁迫防御、抑制半胱氨酸蛋白酶与α淀粉酶活性等方面都发挥着十分重要的作用[25],有些甚至具有抗菌、抗真菌、抗病毒和体外抗增殖的作用[26]。脂质转移蛋白对植物的花药生长也有重要影响,主要是涉及花药生长发育阶段脂类的运输过程[27-29]。比如,已经发现了部分Ⅰ类和Ⅲ类nsLTPs 都可在花粉发育过程中(花粉母细胞到小孢子时期)有着高度选择性地表达于绒毡层内[30]。有对脂质转移蛋白信号肽信息的研究,证实了nsLTPs 转运方式为细胞分泌,进入花药室并参与花药壁的发育过程[31]。但对小麦的研究结果表明,一些Ⅲ类nsLTPs 发挥作用的阶段仅在种苗发育环节[32]。黄岳等[30] 研究拟南芥和水稻花药发育发现,脂质转移蛋白在花药发育各个时期大量表现,同时在细胞凋亡途径中也有高水平的表现,细胞凋亡的脂类产物可被运送到其他细胞中去再次利用。裴徐梨等[33] 研究青花菜LTP 基因时发现,LTP 基因特异表达于花蕾中,并且表达量与花蕾发育程度呈负相关。唐征等[34] 研究板栗的脂质转运蛋白发现,短雄花序突变体比正常雄花序中的脂质转移蛋白表达率更高,推断LTP 可以参与胚乳中的脂质再利用或者是充当蛋白酶抑制剂来保护正常生长的子叶。脂质转移蛋白与花粉发育形成具有高度相关性且影响着花粉萌发,因此本试验开展山核桃属植物脂质转移蛋白与花粉萌发关系的研究,对于探明其生殖机理特别是山核桃育种问题显得尤为重要。
为探讨上述重要问题,下一步还需要在多方面改进并进行深入研究。例如,本试验未发现LTP 基因的体外表达产物能影响薄壳山核桃花粉萌发,这可能有多方面的原因。首先,这可能与其未能正确进行细胞定位有关,因为LTP 蛋白通常需要在细胞内发挥作用,充当第二信使提供信号通路[35],而现有体外表达的蛋白很难渗透进入细胞。其次,原核表达的脂质转移蛋白,可能存在与真核生物不同的修饰,导致其难以参与花粉萌发有关的信号通路。还有,花粉自身的状态可能也是影响LTP 作用的因素之一,因为试验重复性的要求,往往采用冷冻保存的花粉,随着冷冻时间的延长,花粉萌发率明显下降,如本试验所用的Pawnee 花粉在刚刚采集时测得萌发率达60%以上,冷冻半年以后下降到20%。另外,未来克隆山核桃属植物其他种的LTP 同源基因也是重要的方向,这样有助于从进化角度分析脂质转移蛋白在山核桃属内不同物种中功能的保守性。

