帕金森病与血管性帕金森综合征患者24 h动态心电图心率变异性指标的差异性

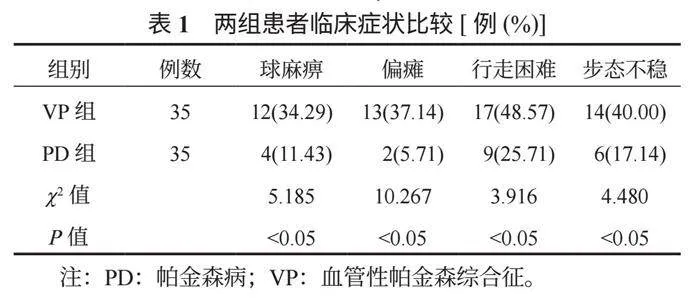
【摘要】目的 探讨帕金森病(PD)与血管性帕金森综合征(VP)的24 h动态心电图心率变异性(HRV)指标的差异性,为临床诊断和鉴别这两种疾病提供参考。方法 回顾性分析2023年4月至2024年4月潮州市中心医院收治的35例PD患者(PD组)与35例VP患者(VP组)的临床资料。比较两组患者的临床症状、HRV指标[低频功率(LF)、高频功率(HF)、低频功率与高频功率的比值(LF/HF)、全部窦性心搏RR间期标准差(SDNN)]及昼夜血压节律变化[各个时间段的平均收缩压(SBP)和舒张压(DBP),包括:24 h平均收缩压(S24 h)、日间平均收缩压(Sd)、夜间平均收缩压(Sn)及24 h平均舒张压(D24 h)、日间平均舒张压(Dd)、夜间平均舒张压(Dn)]。结果 PD组患者球麻痹、偏瘫、行走困难、步态不稳临床症状的发生率、SDNN及各个时间段的平均DBP(D24 h、
Dd、Dn)均低于VP组;LF、HF、LF/HF及各个时间段的平均SBP(S24 h、Sd、Sn)均高于VP组(均P<0.05)。结论 与VP患者相比,PD患者的临床症状更为严重,自主神经系统功能减退及血压异常波动情况更为明显,24 h动态心电图检测HRV指标有利于PD和VP的临床鉴别诊断。
【关键词】帕金森病 ; 血管性帕金森综合征 ; 心电图 ; 心率变异性
【中图分类号】R742.5 【文献标识码】A 【文章编号】2096-3718.2024.19.0111.03
DOI:10.3969/j.issn.2096-3718.2024.19.036
帕金森病(Parkinson's disease, PD)是一种慢性、进行性的神经系统疾病,对患者运动系统影响较大,多表现为静止性震颤、肌肉强直、运动迟缓及姿势平衡障碍等症状,若未及时诊治,可能会进一步引发心脑血管系统疾病,对患者生命健康造成严重影响。血管性帕金森综合征(vascular Parkinsonism, VP)则是一种与血管病变相关的神经退行性疾病,多由多发性脑梗死、脑白质病变等心脑血管疾病引发基底节区多巴胺能神经元受损所致,是一种继发性的帕金森综合征[1]。由于PD本身也可以合并有脑血管病变,而VP在血管性病变发生之前可以仅表现为PD症状,导致临床难以鉴别,易漏诊或误诊,明确鉴别和诊断PD、VP有利于尽早采取针对性措施,促进疾病转归。心率变异性(HRV)即指心率在一段时间内的波动程度和变化情况,其具有直观、检测便捷等优点,是反映自主神经系统功能状态的重要指标,常用于心血管疾病的临床评估和诊断[2]。HRV指标的异常变化通常与自主神经系统功能失调、心血管疾病风险增加等因素有关[3]。在PD患者中,除了静止性震颤、姿势平衡障碍等典型的运动症状表现外,也常伴随嗅觉减退、睡眠障碍等自主神经功能障碍症状,可能引起患者心率及血压的异常变化[4]。但目前,临床关于HRV指标和昼夜血压节律变化在PD与VP患者中的差异性的研究相对较少,鉴于此,本研究旨在对比分析PD与VP患者24 h动态心电图HRV指标及昼夜血压节律变化的差异性,以期为临床鉴别PD和VP提供参考,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2023年4月至2024年4月潮州市中心医院收治的35例PD患者(PD组)与35例VP患者(VP组)的临床资料。PD组患者中男性18例,女性17例;年龄42~83岁,平均(62.45±8.52)岁;BMI 18.5~24.5 kg/m2,平均(21.68±2.53)kg/m2。VP组患者中男性19例,女性16例;年龄43~83岁,平均(62.38±8.51)岁;BMI 18.5~24.5 kg/m2,平均(21.73±2.46)kg/m2。两组患者基本资料比较,差异无统计学意义(P>0.05),可比。纳入标准:⑴PD组与《中国帕金森病治疗指南(第三版)》[5]中PD的相关诊断标准相符;⑵VP组与《中国血管性帕金森综合征诊断与治疗专家共识》[6]的相关诊断标准相符;⑶分+Wh7IMLNE2zRsdq25gnUpg==别经临床检查确诊;⑷病情较稳定,均完成自主神经功能监测。排除标准:⑴合并阿尔茨海默病、运动神经元病等其他神经退行性疾病;⑵存在其他可能导致自主神经功能紊乱的情况,如血容量不足、心律失常或焦虑抑郁等;⑶合并失语、严重痴呆或意识障碍;⑷合并恶性肿瘤、严重心脏病或其他重大疾病;⑸合并其他类型的精神疾病。本研究经潮州市中心医院医学伦理委员会批准。
1.2 监测方法
1.2.1 24 h动态心电图监测 使用动态心电图系统[北京世纪今科医疗器械有限公司,型号:MIC-12H-3]进行24 h动态心电图检测,前胸部进行常规消毒,将电极片粘贴在胸骨和肋骨指定位置,注意捋顺导联线,避免电极片脱落,叮嘱患者随身携带记录盒,不可随意将电极片拔掉。监测期间应指导患者戒烟戒酒、放松心情、避免剧烈运动和食用咖啡因类等食物。将全部窦性心搏相关数据经麦德克斯分析软件进行深入分析与处理,精确计算出两组患者的HRV频域指标[低频功率(LF)、高频功率(HF)、低频功率与高频功率的比值(LF/HF)]及时域指标[全部窦性心搏RR间期标准差(SDNN)],SDNN>100 ms为HRV正常;SDNN 50~100 ms为HRV降低;SDNN<50 ms为HRV明显降低,可能诱发心律失常[7]。
1.2.2 动态血压监测 采用动态血压测量仪[Meditech Kft.,国械注进20152071107,型号:ABPM-05(BP5)]检测两组患者的24 h动态血压变化情况。一般于早晨8: 00至10: 00开始监测血压,并持续监测24 h,其中,在清晨6: 00至晚上23: 00时间段,每隔30 min进行1次血压检测;而在晚上23: 00至次日清晨6: 00时间段,每隔60 min测量1次血压。为确保血压监测的准确性,减少失败测量次数,将袖带置于患者运动较少的手臂上,并鼓励参与者在监测期间保持放松状态。通过这一监测方式测量两组患者各个时间段的平均收缩压(SBP)和舒张压(DBP),具体包括:24 h平均收缩压(S24 h)、日间平均收缩压(Sd)、夜间平均收缩压(Sn)及24 h平均舒张压(D24 h)、日间平均舒张压(Dd)、夜间平均舒张压(Dn)。
1.3 观察指标 ⑴临床症状。观察并比较两组患者球麻痹、偏瘫、行走困难、步态不稳临床症状的发生率。⑵HRV指标。观察并记录两组患者的HRV指标,包括LF、HF、LF/HF、SDNN。⑶昼夜血压节律。采用动态血压监测仪检测并记录两组患者的S24 h、Sd、Sn、D24 h、Dd、Dn。
1.4 统计学方法 采用SPSS 26.0统计学软件分析处理本研究数据,计数资料(球麻痹、偏瘫、行走困难、步态不稳临床症状的发生率)以[例(%)]表示,采用χ2检验;计量资料(HRV指标、昼夜血压节律)经S-W法检验证实符合正态分布,以( x ±s)表示,组间比较采用独立样本t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者临床症状比较 PD组患者球麻痹、偏瘫、行走困难、步态不稳临床症状的发生率均低于VP组,差异均有统计学意义(均P<0.05),见表1。
2.2 两组患者HRV指标比较 PD组患者LF、HF、LF/HF均高于VP组,SDNN低于PD组,差异均有统计学意义(均P<0.05),见表2。
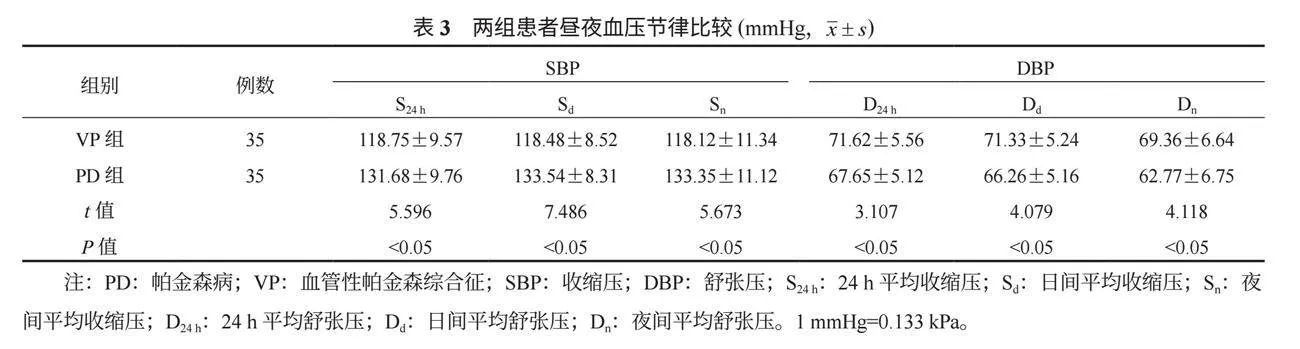
2.3 两组患者昼夜血压节律比较 PD组各个时间段的平均SBP(S24 h、Sd、Sn)均高于VP组,各个时间段的平均DBP(D24 h、Dd、Dn)均低于VP组,差异均有统计学意义(均P<0.05),见表3。
3 讨论
PD是一种多发于老年人的慢性神经退行性疾病,该病的发生、发展多与大脑中黑质多巴胺能神经元的退行性改变、神经系统老化等多种因素有关,由此引发动作迟缓、震颤、睡眠障碍、情绪异常等症状[8]。VP是一种由高血压、多发性脑梗死等脑血管病变所引发的继发性神经系统疾病,病情呈阶梯状进展,其临床表现与PD类似,患者多表现为行走困难、步态不稳等症状。由于PD患者也可能伴随原发性脑血管病变,且PD与VP临床症状相似,易造成临床误诊,因此尽早明确诊断,采取及时有效的针对性措施控制疾病进展是临床治疗这类疾病的关键。
HRV即一定时间内窦性心律的周期性改变现象,是评估心脏自主神经功能的无创性方法,是反映交感神经和副交感神经平衡状态的重要指标。24 h动态心电图主要用于长时间连续记录人体心脏在活动和安静状态下的心电图变化状况,常用于各种心血管疾病的临床鉴别和诊断,对于心肌缺血的定性、定量诊断,药物疗效及起搏器的功能评定等方面具有重要的作用,通过检测24 h动态心电图变化,并将全部窦性心搏相关数据经计算机HRV软件处理后即可计算出HRV指标[9]。昼夜血压节律是一段时间内的机体血压波动情况,能反映出机体血流动力学变化特点。PD患者发病期间除了运动系统损伤之外,自主神经系统功能也可能会受到影响,进而引起心血管调节紊乱,表现为体位性低血压、晕厥、恶心、头痛等症状及嗅觉障碍、情绪异常、心脏节律异常、胃肠道功能紊乱等自主神经功能障碍表现,这与病变累及交感神经节、下丘脑及肾上腺髓质有关[10]。因此,对于PD和VP患者,定期检查心电图,密切关注HRV和血压变化情况,有助于预防和及时发现心脑血管事件,改善患者预后。
在HRV指标中,LF、HF及LF/HF、SDNN是评估自主神经系统活动的重要参数;SDNN代表交感神经功能状态;LF反映了交感神经和副交感神经的共同活动;HF主要反映副交感神经活动;LF/HF可反映机体交感神经与副交感神经的平衡状态。本研究中,PD组患者LF、HF、LF/HF均高于VP组,SDNN和球麻痹、偏瘫、行走困难、步态不稳临床症状的发生率均低于VP组,这提示与VP患者相比,PD患者的临床症状更为严重,自主神经系统功能减退更明显。这种差异可能是两种疾病在病理生理机制上的不同所导致的,也可能与疾病进展的速度有关,PD主要影响黑质 - 纹状体通路,而VP则与脑血管病变相关,是一种继发性的神经退行性改变,患者多无静止性震颤症状,因此HRV指标和临床症状可能与PD存在一定
差异[11]。
本研究中,PD组各个时间段的平均SBP(S24 h、Sd、Sn)均高于VP组,各个时间段的平均DBP(D24 h、Dd、Dn)均低于VP组,这提示PD患者较VP患者的血压异常波动情况更加显著。PD患者昼夜血压节律的异常可能与自主神经系统损伤所致的对血压调节的控制减弱有关,而昼夜血压节律的改变可能进一步对心血管系统的产生影响,增加心血管事件的风险[12]。
综上,对PD与VP患者进行24 h动态心电图心率变异率的对比研究,有助于更好地理解这两种疾病的病理生理机制,还可为疾病的早期诊断和治疗提供新的思路和方法。但本研究仍存在样本量较少、观察周期较短等局限性,可能会对研究结果产生一定偏倚,后续应进一步开展临床研究加以验证。
参考文献
刘亘梁, 冯涛. 血管性帕金森综合征的临床研究进展[J]. 中国卒中杂志, 2023, 18(8): 853-857.
陆胤, 焦玲, 刘伟民. 帕金森病患者心率变异性、血压变异性及交感神经皮肤反应的临床研究[J]. 中国神经免疫学和神经病学杂志, 2020, 27(6): 453-459.
邹巧鸽, 贾东佩, 朱风俊. 不同病程帕金森患者心率及血压变异性水平变化的临床研究[J]. 医学理论与实践, 2022, 35(7): 1200-1203.
杨光, 潘玉君. 心率变异性在慢性心力衰竭合并帕金森病中的变化特点[J]. 心血管康复医学杂志, 2024, 33(1): 107-110.
中华医学会神经病学分会帕金森病及运动障碍学组. 中国帕金森病治疗指南[J]. 3版. 药学与临床研究, 2014, 22(4): 290.
王丽娟, 张玉虎. 中国血管性帕金森综合征诊断与治疗专家共识[J]. 全科医学临床与教育, 2017, 15(4): 364-367.
陈思远, 刘银龙, 古祺, 等. 帕金森病患者颈部迷走神经横截面面积与心血管自主神经功能障碍的关系[J]. 中华实用诊断与治疗杂志, 2024, 38(1): 52-56.
邬莎, 章晓英, 陈洁芳, 等. 帕金森病患者抑郁症状与自主神经功能相关性研究[J]. 医学研究杂志, 2022, 51(11): 110-112, 118.
霍绮雯, 谭峰, 刘亚丽, 等. 补中益气丸联合经颅磁刺激治疗老年帕金森病伴体位性低血压的疗效及安全性评估[J]. 中国老年学杂志, 2023, 43(19): 4619-4622.
陶媚, 王晖, 张力辉. 帕金森病患者心血管自主神经功能障碍的影响因素[J]. 临床与病理杂志, 2022, 42(8): 1937-1944.
彭爱君, 许银苹, 潘召英. 减重步行训练对老年帕金森病患者心肺耐力、平衡能力及生活质量的影响[J]. 上海医药, 2023, 44(6): 51-54.
孙东霞. 血管性帕金森综合征与原发性帕金森病的临床症状和MRI对比分析要点构架[J]. 中国医疗器械信息, 2021, 27(22): 58-59, 164.

