循环血Septin9基因甲基化检测在结直肠癌筛查中的诊断价值



【摘要】目的 探究循环血Septin9基因甲基化检测结果对结直肠癌筛查的价值,为临床筛查结直肠癌提供参考依据。方法 回顾性分析2022年1月至2024年2月江苏省人民医院宿迁医院收治的68例结直肠癌患者的临床资料,作为观察组,同时回顾性分析同期在江苏省人民医院宿迁医院接受相关诊疗的67例非肿瘤的良性肛肠科疾病患者的临床资料,作为对照组。两组患者均进行血清糖类抗原199(CA199)、糖类抗原724(CA724)、癌胚抗原(CEA)、外周血Septin9基因甲基化检测。比较两组患者血清CA199、CA724、CEA水平,外周血Septin9基因甲基化的检测结果;分析观察组Septin9基因甲基化检测结果与TNM分期的关系;以病理诊断结果为金标准,比较CA199、CA724、CEA水平及Septin9基因甲基化对结直肠癌的诊断价值。结果 观察组患者的血清CA199、CA724、CEA水平均高于对照组(均P<0.05);对照组共检出3例Septin9基因甲基化阳性(肛瘘、混合痔、肛裂中各检出1例),阳性检出率为4.48%(3/67);观察组共检出59例Septin9基因甲基化阳性,阳性检出率86.76%(59/68),相较于对照组,观察组患者的阳性检出率更高(P<0.05)。随着结直肠癌患者TNM分期的升高,Septin9基因甲基化阳性检出率也会随之升高;Septin9基因甲基化对结直肠癌的诊断灵敏度、特异度、准确度均高于CA199、CA724、CEA,且CEA的灵敏度、准确度均高于CA199、CA724(均P<0.05)。结论 循环血Septin9基因甲基化检测能够评估结直肠癌的发生、发展,且其诊断价值高于CA199、CA724、CEA,可用于结直肠癌的筛查中。
【关键词】直肠癌 ; 循环血Septin9基因甲基化 ; 癌胚抗原 ; 糖类抗原724 ; 糖类抗原199
【中图分类号】R735.3 【文献标识码】A 【文章编号】2096-3718.2024.19.0107.04
DOI:10.3969/j.issn.2096-3718.2024.19.035
结直肠癌是消化系统常见的恶性肿瘤之一,早期诊断结直肠癌可显著改善患者预后。电子结肠镜是目前临床检测结直肠癌的金标准,但其具有侵入性,易造成肠穿孔、肠道感染等并发症,有些患者难以接受,在初筛阶段难以推广[1]。肿瘤标志物糖类抗原199(CA199)、糖类抗原724(CA724)、癌胚抗原(CEA)是临床筛查结直肠癌患者时较为常用的肿瘤标志分子,在结直肠癌的诊断中具有一定的诊断价值,但其诊断灵敏度和特异度较差,因此,无法满足针对早期结直肠癌筛查的需求[2]。Septin9基因在人体真核细胞内广泛分布,参与细胞膜二次建构、细胞分裂及细胞极化等生物学过程,Septin9基因编码的Septin9蛋白能调节细胞生长,防止细胞分裂过快或不受控制的分裂增殖,具有一定的抑癌作用[3]。DNA甲基化作为一种重要的表观遗传修饰方式,在肿瘤的发生和发展中扮演着关键角色。有研究表明,Septin9基因甲基化可导致抑癌活性丧失,促进结直肠病变向恶性进展,且部分肿瘤细胞出现坏死或凋亡,可代谢进入循环外周血,因此可将循环血Septin9基因甲基化检测应用于结直肠癌的临床筛查中[4]。基于此,本研究主要对循环血Septin9基因甲基化检测结果在结直肠癌筛查中的诊断价值进行探讨,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2022年1月至2024年2月江苏省人民医院宿迁医院收治的68例结直肠癌患者的临床资料,作为观察组,同时回顾性分析同期在江苏省人民医院宿迁医院接受相关诊疗的67例非肿瘤的良性肛肠科疾病患者的临床资料,作为对照组。对照组患者中男性35例,女性32例;年龄53~69岁,平均(58.67±4.07)岁;21例为肛裂,29例为混合痔,17例为肛瘘。观察组患者中男性为36例,女性32例;年龄54~70岁,平均(59.38±5.14)岁;TNM肿瘤分期[5]情况:7例为Ⅰ期,27例为Ⅱ期,28例为Ⅲ期,6例为Ⅳ期。两组患者性别、年龄一般资料比较,差异无统计学意义(P>0.05),组间可比。纳入标准:⑴观察组患者符合《中国结直肠癌诊疗规范(2020年版)》 [6]中结直肠癌的诊断标准;⑵对照组患者符合《肛裂临床诊治中国专家共识(2021版)》 [7]中肛裂或《中国痔病诊疗指南(2020)》 [8]中混合痔或《肛瘘的诊治专家共识(2020版)》 [9]中肛瘘的诊断标准;⑶患者临床资料完整。排除标准:⑴有大型腹部手术治疗既往史;⑵合并其他恶性肿瘤疾病;⑶未行化疗或者放疗。江苏省人民医院宿迁医院医学伦理委员会批准本研究。
1.2 检测方法 医护人员应当嘱咐所有入组者以晨起空腹状态接受血液采集,同时要求其在采集血液前24 h内不可饮酒,在72 h内不可摄入蛋白含量过高的食物、辛辣食物及油腻食物。血液样本采集前,采血人员清洗双手,晾干后佩戴无菌手套,分别使用真空管和抗凝管采集患者空腹静脉血各5 mL。⑴肿瘤标志物检测:真空采血管以1 500 r/min,离心12 min,将上层清液转移至 -80 ℃冰箱保存待测,采用电化学发光法检测血清CA199、CA724及CEA水平。⑵Septin9 基因甲基化检测:抗凝管室温(18~26 ℃)下放置约30 min,待血液凝固、血块收缩后,3 000 r/min的转速离心10 min,分离血浆至离心管中;并标记样本编号、姓名、采血时间、住院号,将合格的样本保存在-80 ℃冰箱,避免反复冻融。具体检验操作如下:①溶液的制备:使用无菌具有刻度100 mL的量筒,分别加60、40 mL无水乙醇到60 mL洗液A浓缩液和7 mL洗液B浓缩液中,颠倒混匀5次,并标记稀释时间及签名;②融化样本:溶液样本应在60 min内完全融化,并在开始融化60 min内进入裂解程序,将3.5 mL血浆样本加入事先标记的15 mL离心管;③裂解:15 mL离心管中加入3.5 mL裂解吸附液,盖好管盖、震荡混匀,室温孵育10 min;④DNA结合:15 mL离心管中加入90 mL磁珠(新鲜悬浮)进行DNA结合;⑤加入洗液进行DNA洗涤;⑥涡旋混匀洗脱液进行DNA洗脱;⑦依次加入亚硫酸盐和保护液置于80 ℃恒温孵育来进行亚硫酸盐转化的DNA进行洗涤、干燥和洗脱;⑧聚合酶链式反应(PCR):将经亚硫酸盐转化的DNA(Bis-DNA)和PCR预反应液涡旋混合加入PCR板对应的孔中,用胶膜密封,进行PCR反应:阶段一为活化,温度设置为94 ℃,时间持续20 min。阶段二为
45个循环,温度设置为62 ℃,时间持续5 s;温度设置为55.5 ℃,时间持续35 s;温度设置为93 ℃,时间持续30 s;阶段三为降温,温度设置为40 ℃,时间持续5 s。Septin9基因甲基化检测所使用试剂盒为人Septin9基因甲基化检测试剂盒[博尔诚(北京)科技有限公司]。⑨结果判读。根据待测样本在PCR仪器上测得的Septin9和ACTB的Ct结果进行判读,Septin9的Ct≤41.0,ACTB的Ct≤32.1判定为阳性;Septin9无Ct或Ct>41.0,ACTB的Ct≤32.1判定为阴性;Septin9的Ct为任何情况,ACTB的Ct>32.1判定为无效[10]。
1.3 观察指标 ⑴比较两组患者血清CA199、CA724、CEA水平。⑵比较两组患者Septin9基因甲基化的检测结果,观察组Septin9基因甲基化检测结果与TNM分期的关系。⑶以病理诊断结果为金标准,比较CA199、CA724、CEA水平及Septin9基因甲基化结果诊断结直肠癌的诊断价值,其中灵敏度=[真阳性例数/(真阳性+假阴性)例数]×100%,特异性=[真阴性例数/(假阳性+真阴性)例数]×100%,准确度=[(真阳性+真阴性)例数/总例数]×100%。肿瘤标志物阳性值:CEA>5.0 ng/mL;CA724 >10 ng/mL;CA199>37 U/mL [11]。
1.4 统计学方法 采用SPSS 23.0统计学软件分析数据,计数资料以[例(%)]表示,两组间比较采用χ2检验,等级资料比较采用秩和检验,多组间计数资料比较采用χ2趋势检验;计量资料首先采用S-W法检验符合正态分布,以( x ±s)表示,两组间比较采取独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者CA199、CA724、CEA水平比较 观察组患者的血清CA199、CA724、CEA水平均高于对照组,差异均有统计学意义(均P<0.05),见表1。
2.2 两组患者Septin9基因甲基化检测结果比较 对照组共检出3例Septin9基因甲基化阳性(肛瘘、混合痔、肛裂中各检出1例),阳性检出率为4.48%(3/67);观察组共检出59例Septin9基因甲基化阳性,阳性检出率86.76%(59/68)。相较于对照组,观察组Septin9基因甲基化阳性检出率更高(χ2=92.017,P<0.05)。随着结直肠患者TNM分期的升高,Septin9基因甲基化阳性检出率也会随之升高,差异有统计学意义(P<0.05),见表2。
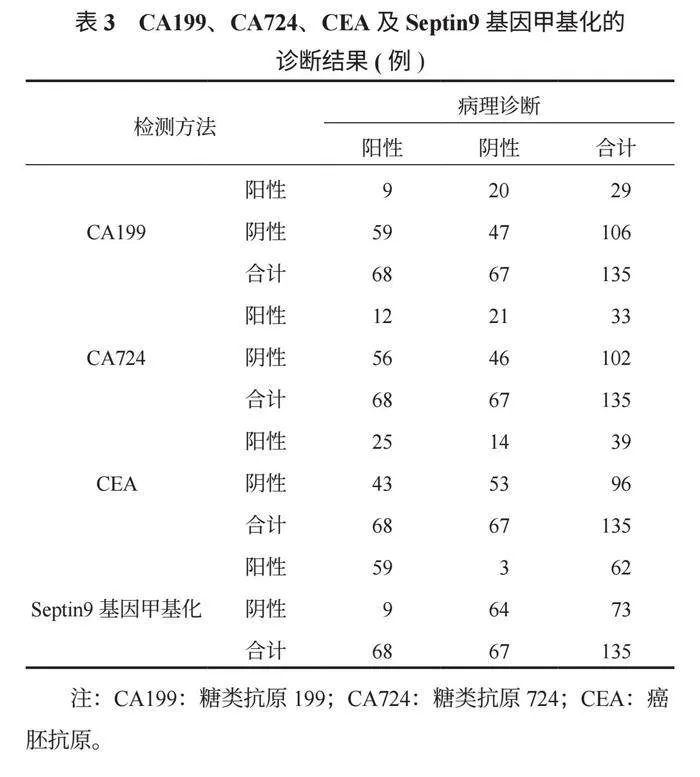
2.3 CA199、CA724、CEA及Septin9基因甲基化对结直肠癌的诊断价值 Septin9基因甲基化对结直肠癌的诊断灵敏度、特异度、准确度均高于CA199、CA724、CEA,且CEA的灵敏度、准确度均高于CA199、CA724,差异均有统计学意义(均P<0.05),见表3、表4。
3 讨论
结直肠癌是消化系统常见的恶性肿瘤之一,早期症状不明显,随着肿瘤的增大而表现排便习惯改变、便血、腹泻、局部腹痛等症状。根治性肿瘤切除手术是目前结直肠癌治疗的主要手段,早期发现及早期治疗可以显著提高患者的生存率并能提高患者生活质量,但是晚期结直肠癌的复发转移仍严重影响术后患者的预后[12]。筛查和早期规范化诊断及治疗是改善结直肠癌患者预后的关键所在。现阶段,临床诊断结直肠癌的金标准即电子结肠镜,但由于该检查方法属于侵入性检查,镜检过程中患者会感到痛苦,且存在一定的并发症风险,因此一些患者难以接受,同时该方法在一些经济发展水平较为落后的地区具有较大的推广难度。
血清中包含有大量的无形成分,如碳水化合物、生长因子、激素、无机物、人体代谢产物等,其所包含的各种化学成分比例相对固定,当出现异常波动时往往预示着生理与病理改变。CEA是一种具有人类胚胎抗原特异性的单体糖蛋白,在结直肠癌、胰腺癌等多种恶性肿瘤中检测水平较高,在正常组织中检测水平较低,虽然其对结直肠癌不具备特异性,但可作为筛查结直肠癌的重要参考指标;血清CA199为胃肠道相关抗原,常用于结直肠癌筛查中,并且在其他消化道肿瘤组织中的表达也明显升高;CA724属于一种非特异性肿瘤标志物,在成人的正常组织中不表达,在结直肠癌、胃癌及胰腺癌等实体瘤中均有表达,因而常用于结直肠癌的检测中[13]。而非肿瘤的良性肛肠科疾病患者伴随有肠道黏膜的损伤或炎症时,CA199、CA724、CEA水平也会存在一定的升高,但并不一定意味着恶性肿瘤的存在,应结合患者的临床表现和其他检查结果进行综合评估[14]。本研究中,观察组患者的血清CA199、CA724、CEA水平均高于对照组,这表明结直肠癌患者体内CA199、CA724、CEA水平高于良性肛肠科疾病患者,可用于筛查结直肠癌。
近年来,分子标志物检查在结直肠癌中也逐渐发展起来,DNA是最常见的分子标志物之一,DNA甲基化的改变是癌症中最早的表观遗传学变化之一,可以控制基因表达,与肿瘤的发生密切相关。DNA的甲基化指在不改变DNA序列的前提下,使基因的表型也发生可遗传的变化,同时调控DNA的重组及特定基因的转录活性,使目的基因启动子区域的甲基化并直接导致相关基因的表达沉默,使该基因转录、翻译特定蛋白的能力下降,进而使细胞的功能发生改变。人类基因组中的Septin基因中共有亚型
13种,而本研究所涉及的Septin9基因,其主要处于17号染色体q25.3上。在Septin9基因编码中,含有一种Septin9蛋白,其能够对细胞生长发挥一定调节作用,避免由于细胞分裂速度过快而导致细胞分裂增殖失去控制,因此Septin9蛋白具有一定抑癌效果[15]。肿瘤抑癌基因的甲基化调控被认为是肿瘤起始过程中的关键步骤,因为DNA甲基化沉默许多肿瘤抑癌基因的转录,从而导致肿瘤细胞的永生化生长;同时,DNA甲基化的状态也随着肿瘤恶性程度的增加而表现明显。Septin9是一组支架蛋白,在细胞分裂过程中提供结构支持,其启动子区域高甲基化伴随转录受损时将导致抑癌活性丧失,促进结直肠病变向恶性进展。因此,外周循环血Septin9基因甲基化检测逐渐被认为是结直肠癌患者特异性的肿瘤标志物,也是一种无创、简便、易行的筛查和早期诊断指标[16]。本研究结果中,相较于对照组,观察组患者的阳性检出率更高,且随着结直肠癌患者TNM分期的升高,Septin9基因甲基化阳性检出率也会随之升高,这表明结直肠癌患者循环血Septin9基因甲基化水平高于良性肛肠科疾病患者,循环血Septin9基因甲基化检测能够评估肿瘤的发生、发展,为患者疾病情况的动态化监测提供有效途径。
此外,本研究结果显示,Septin9基因甲基化对结直肠癌诊断的灵敏度、特异度、准确度均高于CA199、CA724、CEA,且CEA的灵敏度、准确度均高于CA199、CA724,这提示对结直肠癌患者应用外周循环血Septin9基因甲基化检测的诊断价值高于肿瘤标志物。分析其原因在于,CEA、CA199、CA724等肿瘤标志物通常在肿瘤中晚期才显著升高,灵敏度相对较低,且在其他恶性肿瘤中升高,还容易受到其他因素(如炎症、良性病变等)的干扰,特异性相对较低;而Septin9基因甲基化检测在结直肠癌的早期阶段即可以检测出来,具有较高的灵敏度,作为结直肠癌的一个特异性标志物,其检测的特异性相对较高,有助于减少误诊和漏诊的情况[17]。CEA诊断价值高于CA199、CA724的原因分析在于,CEA与多种肿瘤相关,使得CEA在多种肿瘤类型中的阳性率相对较高,且CEA在肿瘤组织中的表达更为普遍或稳定,从而更容易被检测
出来[18]。
综上,循环血Septin9基因甲基化检测能够评估肿瘤的发生发展,且其诊断价值高于CA199、CA724、CEA,可用于结直肠癌的筛查中,有利于结直肠癌的诊断和治疗。
参考文献
陈宏达, 廖先珍, 杜灵彬, 等. 结肠镜、免疫法粪便潜血检测及风险分级筛查策略在结直肠癌筛查中的效果研究: 一项多中心随机对照试验[J]. 协和医学杂志, 2023, 14(1): 114-123.
方宏娇, 李承慧. 胃癌患者血清CA199、CA724及CEA水平与病情严重程度及预后的关系[J]. 川北医学院学报, 2022, 37(2): 248-
251.
刘丹丹, 聂优, 程洋, 等. 血浆Septin9基因甲基化检测对中国人群结直肠癌的诊断价值: 一项Meta分析[J]. 诊断病理学杂志, 2023, 30(12): 1127-1131.
穆剑强, 高海锋. 外周血Septin9基因甲基化和血清CA199联合检测在结直肠癌筛查中的诊断价值[J]. 检验医学与临床, 2pPxuUJOL8XdXcoZlaJMZ5g==022, 19(4): 526-529.
欧文, 胡宇, 阮俊. 超声内镜联合MSCT检查对结直肠癌术前TNM分期诊断价值研究[J]. 中国CT和MRI杂志, 2021, 19(1): 167-168, 174.
中华人民共和国国家卫生健康委员会医政医管局, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2020年版)[J]. 中国实用外科杂志, 2020, 40(6): 601-625.
中国医师协会肛肠医师分会临床指南工作委员会. 肛裂临床诊治中国专家共识(2021版)[J]. 中华胃肠外科杂志, 2021, 24(12): 1041-1047.
中国中西医结合学会大肠肛门病专业委员会. 中国痔病诊疗指南(2020)[J]. 结直肠肛门外科,2020,26(5):519-533.
中国医师协会肛肠医师分会临床指南工作委员会. 肛瘘诊治中国专家共识(2020版)[J]. 中华胃肠外科杂志, 2020, 23(12): 1123-1130.
黄绍群. 探讨外周血Septin9甲基化检测对结直肠癌的诊断价值[D]. 福州: 福建医科大学, 2020.
汤乐毓. 血清CEA、CA199、CA125与CA724联合检测在诊断结直肠癌中的应用价值[J].当代医药论丛, 2020, 18(17): 187-
188.
袁思敏, 李长天. 肿瘤浸润淋巴细胞与结直肠癌患者预后关系的研究进展[J]. 癌症进展, 2023, 21(13): 1408-1412, 1423.
汤俊, 黄春锦, 陈玺. 老年结直肠癌患者血清内CEA、AFP、CA50、CA199和CA724的表达及意义[J]. 实用癌症杂志, 2019, 34(3): 397-399, 406.
陈志林, 徐秋贞, 陈文龙, 等. CT增强在结肠癌分期中的应用及联合血清CEA、CA199、CA724及microRNA-21对良恶性病变的诊断价值[J]. 现代生物医学进展, 2023, 23(20): 3923-3928.
邓燚, 黄美园, 乐文星, 等. 联合检测血浆Septin9基因甲基化及红细胞分布宽度对结直肠癌的诊断价值[J]. 重庆医学, 2022, 51(24): 4230-4235.
宫媛, 王卫华, 杜海涛, 等. 外周血SEPTIN9基因甲基化检测在结直肠癌诊断中的研究进展[J]. 临床输血与检验, 2021, 23(2): 263-268.
张春燕, 于正麟, 王蓓丽, 等. 血浆Septin9基因甲基化检测性能评价及对结直肠癌患者的筛查价值[J]. 临床检验杂志, 2019, 37(2): 152-155.
钟劢文, 何惠平, 许浩生. CEA、CA199、CA724及CA242对结直肠癌的诊断价值[J]. 中国现代医药杂志, 2022, 24(1): 6-9.

