重组日本血吸虫半胱氨酸蛋白酶抑制剂对急性肝损伤小鼠的保护作用及机制

摘要:目的 探讨重组日本血吸虫半胱氨酸蛋白酶抑制剂对LPS/D-GalN诱导的急性肝损伤小鼠的保护作用及机制。方法 将72 只雄性C57BL/6J 小鼠(6~8 周龄)随机分为正常对照组、LPS/D-GaIN模型组、LPS/D-GaIN+rSj-Cys 治疗组和rSj-Cys 对照组(n=18)。LPS/D-GaIN 组和LPS/D-GaIN+rSj-Cys 组小鼠均腹腔注射LPS(10 μg/kg)和D-GaIN(700 mg/kg)造模;造模后30 min,LPS/D-GaIN+rSj-Cys 组及rSj-Cys 对照组小鼠均腹腔注射rSj-Cys(1.25 mg/kg),正常对照组小鼠注射等体积PBS。造模6 h后,每组随机挑选8只小鼠处死,收集小鼠血清及肝组织,进行后续检测,每组剩余10只分别在3、6、12、24 h观察其生存情况,并计算生存率。检测血清丙氨酸转移酶(ALT)、天冬氨酸转移酶(AST)水平,苏木精-伊红(HE)染色观察各组小鼠肝脏组织病理形态,采用ELISA检测小鼠血清炎性因子肿瘤坏死因子(TNF-α)和白细胞介素(IL-6)表达,采用免疫组化法检测肝组织巨噬细胞表面标记物CD68表达水平,采用免疫组化和免疫印迹法检测肝组织Bax、Bcl-2蛋白水平,采用TUNEL检测肝细胞凋亡情况,采用免疫印迹法检测肝组织内质网应激相关蛋白表达水平。结果 模型组小鼠12 h生存率为30%,rSj-Cys治疗组小鼠12 h生存率为80%。模型组小鼠24 h生存率为10%,rSj-Cys治疗组小鼠24 h生存率为60%;与正常对照组相比,LPS/D-GaIN模型组小鼠血清中AST、ALT、IL-6、TNF-α 含量均显著上升(Plt;0.01),病理结构损伤严重,肝脏巨噬细胞标志物CD68 表达明显增强(Plt;0.01),促凋亡蛋白Bax 表达显著增加(Plt;0.01),抗凋亡蛋白Bcl-2 表达显著降低(Plt;0.01),肝细胞凋亡水平显著增加,肝组织内质网应激相关信号通路GRP78、CHOP、NF-κB p-p65 的蛋白表达水平显著上调(Plt;0.05 或Plt;0.01);而LPS/D-GaIN+rSj-Cys治疗组小鼠转氨酶AST、ALT和炎症因子IL-6、TNF-α水平显著下降(Plt;0.01),肝脏病理损伤程度减轻,肝脏巨噬细胞标志物CD68表达明显降低(Plt;0.01),Bax表达显著降低(Plt;0.01),Bcl-2表达显著增强(Plt;0.01),肝组织内质网应激相关信号通路GRP78、CHOP、NF-κB p-p65的蛋白表达水平下调(Plt;0.05或Plt;0.01);rSj-Cys对照组与正常对照组相比,各指标无统计学差异(Pgt;0.05)。结论 rSj-Cys通过抑制内质网应激,减轻炎症和肝细胞凋亡缓解LPS/D-GalN引起的小鼠急性肝损伤。
关键词:急性肝损伤;日本血吸虫半胱氨酸蛋白酶抑制剂;内质网应激;炎症;凋亡
肝脏是人体重要的代谢器官,在机体的免疫防御、物质代谢以及清除体内毒物和药物等方面起到至关重要的作用。然而,由于病毒感染、用药不当、过量摄入食品添加剂、乙醇、摄入有毒食物和辐射损伤等原因,急性肝损伤(ALI)的发生率逐渐增加[1]。ALI是一种突发性肝细胞功能丧失或异常的疾病综合征,以过度炎症,肝细胞凋亡和坏死为主要病理特征,该病发展迅速,若不加以控制,可进展为肝硬化、肝衰竭甚至多器官功能障碍等并发症并导致死亡[2]。因此,开发有效的药物对于早期干预或治疗ALI具有重大意义。脂多糖(LPS)和D-半乳糖胺(D-GalN)的组合常用于诱导ALI 模型,该模型可以模拟临床ALI,并广泛用于研究治疗ALI的药物[3]。
目前研究认为ALI的机制主要包括氧化应激、炎症反应[4]、内质网应激(ERS)[5]等多个方面,可通过抑制这些机制来改善急性肝损伤。关于LPS 联合D-GalN诱导的急性肝损伤发病机制ERS也参与其中,抑制ERS的激活可以减轻疾病损伤程度,这与抑制炎症,改善细胞凋亡密切相关[6]。内质网(ER)是一种重要的细胞器,参与多种生物活动,包括蛋白质合成、折叠和分泌,在维持细胞稳态中起着重要作用。内质网功能紊乱会导致ERS,进而引发未折叠蛋白反应(UPR),UPR主要包括活化转录因子6(ATF6)、蛋白激酶R 样内质网激酶(PERK)、肌醇需求蛋白1(IRE1)3 条经典信号通路[7]。生理情况下,3个跨膜蛋白与内质网应激标志蛋白葡萄糖调节蛋白78(GRP78)结合处于失活状态,ERS时,与GRP78分离的3个跨膜蛋白可以通过不同信号通路最终激活下游信号分子核因子κB(NF‑κB)[8]和C/EBP-同源蛋白(CHOP)[9],从而诱导炎症反应和细胞凋亡,最终导致肝细胞损伤。因此,缓解内质网应激可能是治疗急性肝损伤的一种策略。
自“卫生假说”提出以来,大量流行病学和实验性研究表明,蠕虫入侵宿主后,可以激活宿主体内巨噬细胞、树突状细胞、调节性T细胞等,通过一系列细胞分子机制调控宿主体内免疫应答,进而对多种过敏性疾病和炎症性疾病具有改善作用[10-12]。然而,使用蠕虫虫体感染或口服虫卵具有一定风险,且患者心理上难以接受;研究表明,源自蠕虫体内的半胱氨酸蛋白酶抑制剂是半胱氨酸蛋白酶的高效抑制剂,其在蠕虫体内分布广泛,具有抑制蛋白酶活性,可通过上调抗炎细胞因子,下调促炎细胞因子,调节T细胞反应及促进巨噬细胞的极化来调控机体的免疫反应,发挥抗炎效应,成为研究热点。从日本血吸虫中克隆Cystatin,并将其纯化重组,得到重组日本血吸虫半胱氨酸蛋白酶抑制剂(rSj-Cys),其通过参与免疫应答、炎症反应等来调控脓毒症[13]、动脉粥样硬化性肾损伤[14]、结肠炎[15]等疾病的进展。另外,有研究表明日本血吸虫可通过减轻ERS来减轻右旋糖酐硫酸钠(DSS)诱导的小鼠结肠炎[12],但关于日本血吸虫的衍生物rSj-Cys在ERS作用上暂无报道。因此,本研究通过建立LPS/D-GalN诱导的ALI模型,探讨rSj-Cys对ALI 的保护作用及其潜在作用机制,以期为开发防治LPS/D-GalN诱导的ALI的药物提供可能的候选药物和理论依据。
1 材料和方法
1.1 实验动物
72 只SPF级C57BL/6J 小鼠,雄性,6~8 周龄,体质量20~22 g,购自山西医科大学实验动物中心。本研究获山西医科大学实验动物福利伦理委员会审批通过(伦理批号:2022-202)。
1.2 主要试剂及仪器
LPS、D-GaIN(Sigma-Aldrich);重组日本血吸虫半胱氨酸蛋白酶抑制剂,由蚌埠医科大学杨小迪教授惠赠,相对分子质量为11 000,基因结构为306 bp(碱基对),编码101 个氨基酸;PBS、HE染色试剂盒、肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)试剂盒(北京索莱宝科技有限公司);天门冬氨酸氨基转移酶(谷草转氨酶/AST/GOT测试盒)和丙氨酸氨基转移酶(谷丙转氨酶/ALT/GPT测试盒)(南京建成生物科技有限公司);Bcl-2 相关X蛋白(Bax)、B淋巴细胞瘤-2 基因(Bcl-2)(武汉三鹰生物技术有限公司);抗核因子κB(NF-κB)p65抗体(杭州华安生物技术有限公司);抗NF-κB p-p65抗体、抗GRP78、和抗DDIT3(CHOP)抗体(abcam);β-actin 抗体(湖南艾方生物技术有限公司);SABC免疫组织化学试剂盒(武汉博士德生物公司);SDS-PAGE系统(Bio-Rad);显微镜(Nikon);化学发光成像仪(Bio-Rad)。
1.3 动物造模、分组及给药
72 只雄性C57BL/6J 小鼠随机分为正常对照组、LPS/D-GaIN组和LPS/D-GaIN+rSj-Cys组、rSj-Cys组,18只/组,隔夜禁食不禁水12 h。LPS/D-GaIN组和LPS/D-GaIN+rSj-Cys 组小鼠均腹腔注射LPS(10 μg/kg)和D-GaIN(700 mg/kg)造模,LPS/D-GaIN+rSj-Cys 组小鼠于造模后30 min 腹腔注射rSj-Cys(1.25 mg/kg);rSj-Cys组小鼠注射rSj-Cys(1.25 mg/kg),正常对照组小鼠注射等体积PBS。造模6 h 后,每组各随机取8 只小鼠麻醉,采集小鼠血液和肝脏组织以备后续相关检测。每组剩余10 只在造模后3、6、12、24 h 各时间点观察小鼠存活情况,并计算其生存率。
1.4 各组小鼠血清AST、ALT检测
全血室温静置2 h后,3000 r/min离心10 min,分离得到血清,分装并保存于-80 ℃。采集肝脏组织,并在无菌生理盐水中快速冲洗,采取肝脏左侧小叶放入4%甲醛中固定,剩余肝脏置于-80 ℃保存,以备后用。取分装好的血清进行AST、ALT酶活性检测具体操作步骤按照说明书进行。
1.5 HE染色
取各组小鼠肝脏组织,固定包埋切片后,经二甲苯和乙醇进行脱蜡脱水,分别用苏木素和伊红染液染细胞核和细胞质。蒸馏水冲洗后,脱水透明、中性树胶封片,于显微镜下观察肝脏组织病理改变。
1.6 血清TNF-α和IL-6水平测定
取分装好的血清,按照ELISA检测试剂盒操作说明书,将待测品或标准品、生物素化抗体、酶结合工作液和显色底物依次加至反应孔中,37 ℃避光孵育,最后加入终止液,利用酶标仪测量A值,根据标准曲线计算血清中TNF-α和IL-6水平。
1.7 免疫印迹法检测蛋白表达
冰上称取各组小鼠肝脏组织,裂解研磨,离心后取上清,测定蛋白浓度后,95 ℃变性10 min。蛋白上样后,常规进行SDS-PAGE凝胶电泳、转膜、封闭,按照抗体说明书配制合适比例的一抗,Bax(1∶2000)、Bcl-2(1∶1000)、GRP78(1∶3000)、CHOP(1∶1000)、NF-κB p65(1∶1000)、NF-κB p-p65(1∶1000)、β-actin(1∶1000)。4 ℃摇床过夜孵育,TBST洗膜,二抗室温孵育1 h,TBST洗膜,使用ECL曝光液显影曝光,保存条带并对灰度值进行分析。
1.8 免疫组织化学染色
各组小鼠肝组织石蜡切片烘烤脱蜡,在梯度酒精中进行复水;使用EDTA抗原修复缓冲溶液(pH=9.0)加热进行抗原修复,3%双氧水溶液避光孵育25 min以阻断内源性过氧化物酶;BSA封闭、CD68、Bax、Bcl-2 抗体4 ℃孵育过夜,并用PBS 洗涤3 次(每次5 min),二抗孵育50 min(SABC标记);DAB显色、苏木素复染胞核3 min、自来水反蓝,封片,于显微镜下观察拍照,呈棕色或深棕色的为阳性细胞,用Image J软件进行半定量分析。采用阳性细胞率来反映肝脏组织CD68 表达水平(阳性细胞率=阳性细胞数/视野中细胞总数×100%),采用相对阳性表达面积来反映肝脏组织Bax、Bcl-2 表达水平(相对阳性表达面积=阳性表达面积/整个场面积)。
1.9 TUNEL染色
小鼠肝组织石蜡切片充分脱蜡和水化,利用蛋白酶K进行细胞通透10~30 min,加入TUNEL反应液37 ℃反应2 h,加入1×DAPI反应10 min,PBS充分清洗5次,封片在荧光显微镜下进行观察并拍照。TUNEL阳性细胞呈红色,每张切片随机选3 个不重叠的视野,计算TUNEL阳性细胞率。TUNEL阳性细胞率=TUNEL阳性细胞数/视野中细胞总数×100%。
1.10 统计学分析
应用GraphPad Prism 9.0.0 软件进行统计学分析。多组间分析采用单因素方差分析,实验数据均采用均数±标准差表示,Plt;0.05为差异有统计学意义。
2 结果
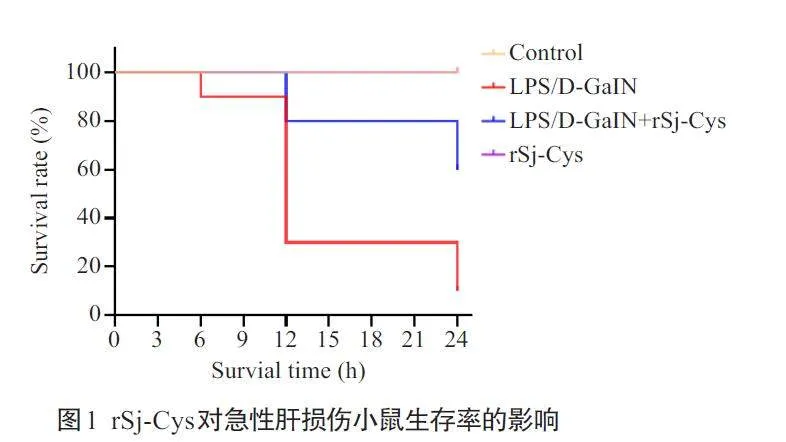
2.1 rSj-Cys对急性肝损伤小鼠生存率的影响
造模后3 h各组小鼠均存活。造模后6 h模型组的小鼠存活率为90%,其余3组的小鼠均存活(图1)。模型组小鼠12 h生存率为30%,rSj-Cys治疗组小鼠12 h生存率为80%。正常对照组和单独给予rSj-Cys对照组小鼠24 h生存率均为100%,模型组小鼠24 h生存率为10%,rSj-Cys治疗组小鼠24 h生存率为60%,是模型组的6倍。
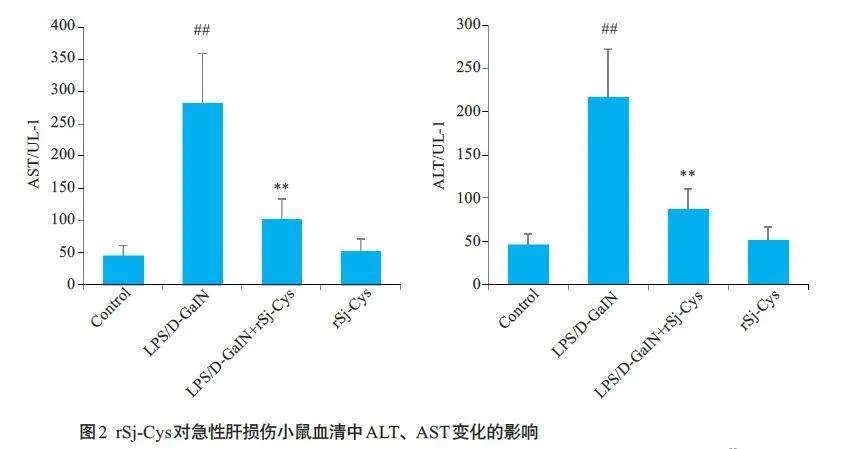
2.2 rSj-Cys对急性肝损伤小鼠肝功能的影响
与正常对照组比较,模型组小鼠血清ALT、AST活性水平显著升高(Plt;0.01);与模型组比较,rSj-Cys治疗组小鼠血清中ALT、AST 活性水平明显降低(Plt;0.01,图2)。而单独给予rSj-Cys 与正常对照组相比无统计学差异(Pgt;0.05)。
2.3 rSj-Cys 对急性肝损伤小鼠血清炎症因子IL-6、TNF-α的影响
与正常对照组相比,LPS/D-GalN 组小鼠血清中IL-6、TNF-α的水平显著增高(Plt;0.01);与模型组相比,治疗组小鼠血清中IL-6、TNF-α的水平显著下降(Plt;0.01,图3);而单独给予rSj-Cys 与正常对照组相比无统计学差异(Pgt;0.05)。
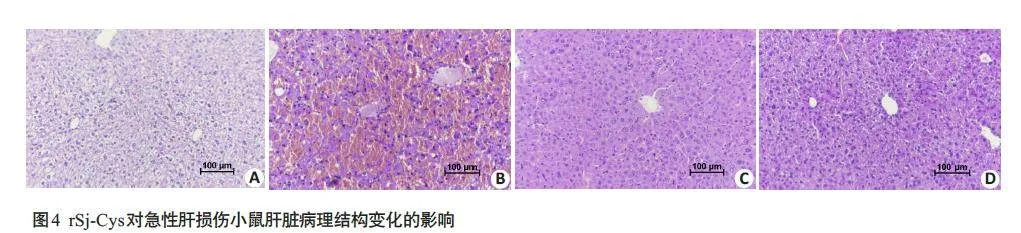
2.4 rSj-Cys对急性肝损伤小鼠肝脏病理结构的影响
正常对照组和单独给予rSj-Cys 组肝小叶结构清晰,肝细胞索排列整齐,以中央静脉为中心,向四周呈放射状排列,肝血窦之间无肿胀,肝细胞大小一致,细胞核呈圆形位于中央,胞浆完整(图4A、D);LPS/D-GalN组肝组织结构严重破坏,肝小叶消失,出现大量红细胞和炎性细胞浸润,红细胞布满整个肝脏,中央静脉消失,可见颜色较浅的环状结构(图4B);与模型组相比,治疗组肝组织结构明显改善,中央静脉和汇管区红细胞和炎症细胞浸润减少(图4C)。
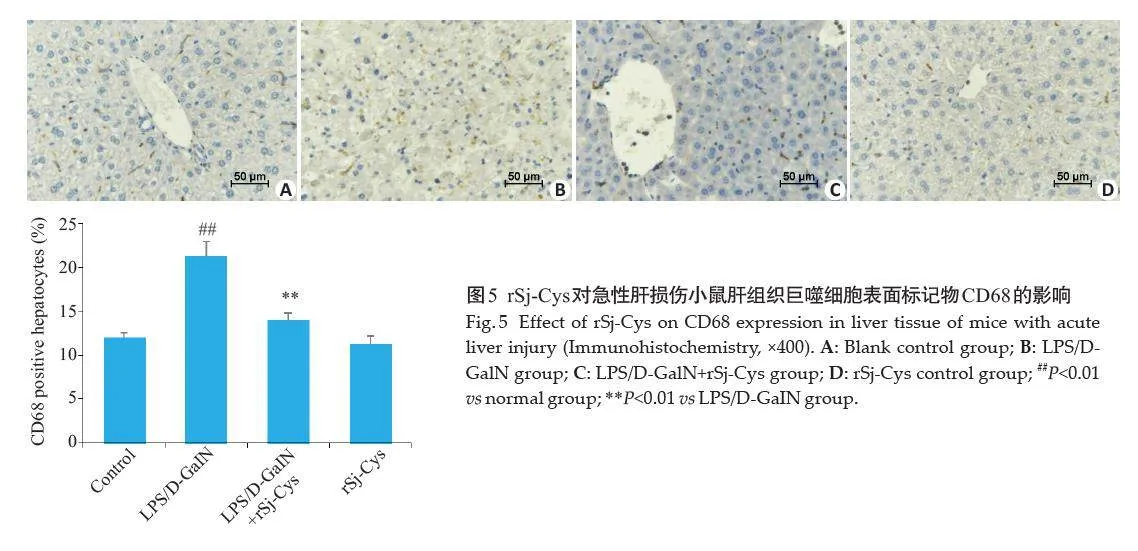
2.5 rSj-Cys对急性肝损伤小鼠肝组织巨噬细胞表面标记物CD68的影响
正常对照组和单独给予rSj-Cys组中仅可见少量巨噬细胞(图5A、D);与正常对照组相比,LPS/D-GalN组小鼠肝组织中CD68 阳性着色细胞数显著增多(Plt;0.01,图5B);与模型组相比,治疗组中rSj-Cys显著减少小鼠肝组织中CD68阳性着色细胞数(Plt;0.01,图5C)。
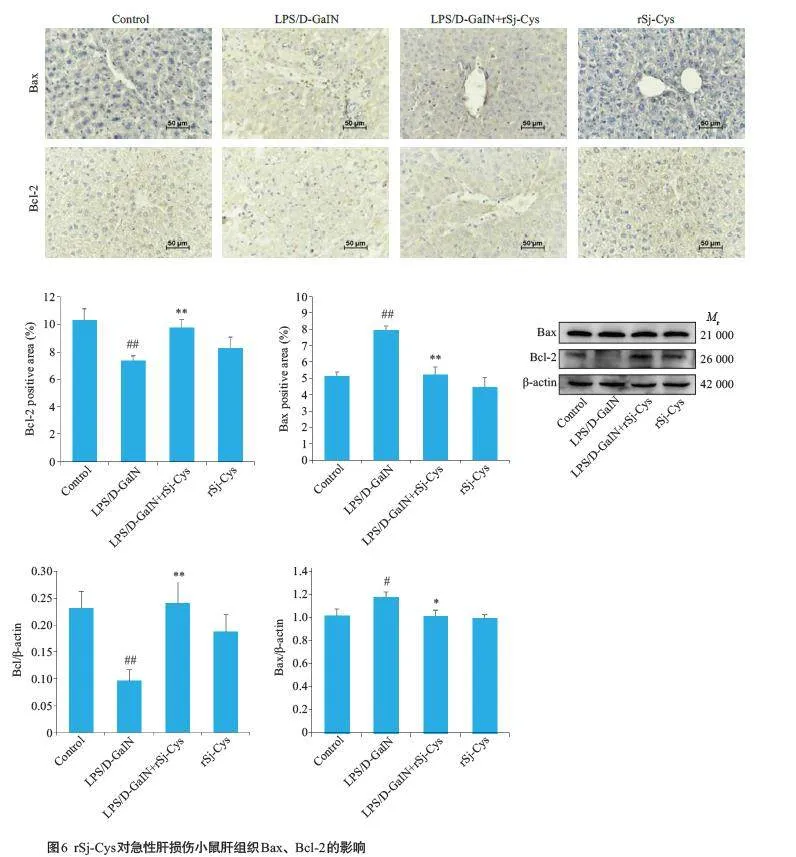
2.6 rSj-Cys对急性肝损伤小鼠肝组织凋亡因子Bcl-2、Bax的影响
免疫组化结果显示,正常对照组和单独给予rSj-Cys组中Bcl-2、Bax蛋白的表达差异无统计学意义(Pgt;0.05);与正常对照组相比,模型组小鼠肝组织促凋亡标志物Bax 蛋白表达增加(Plt;0.01),抗凋亡标志物Bcl-2 蛋白表达显著下降(Plt;0.01);与模型组相比,治疗组中小鼠肝组织促凋亡标志物Bax 蛋白在加入rSj-Cys 后表达降低(Plt;0.01),抗凋亡标志物Bcl-2 蛋白表达水平增高(Plt;0.01)。Western blotting结果显示,与正常对照组比较,模型组肝组织促凋亡标志物Bax蛋白相对表达水平显著增高(Plt;0.05);抗凋亡标志物Bcl-2 蛋白表达显著下降(Plt;0.01);与模型组组比较,LPS/D-GalN+rSj-Cys 治疗组Bax蛋白相对表达水平显著下降(Plt;0.05),Bcl-2蛋白表达水平显著升高(Plt;0.01)。正常对照组和单独给予rSj-Cys组中Bcl-2、Bax蛋白的表达差异无统计学意义(Pgt;0.05)。
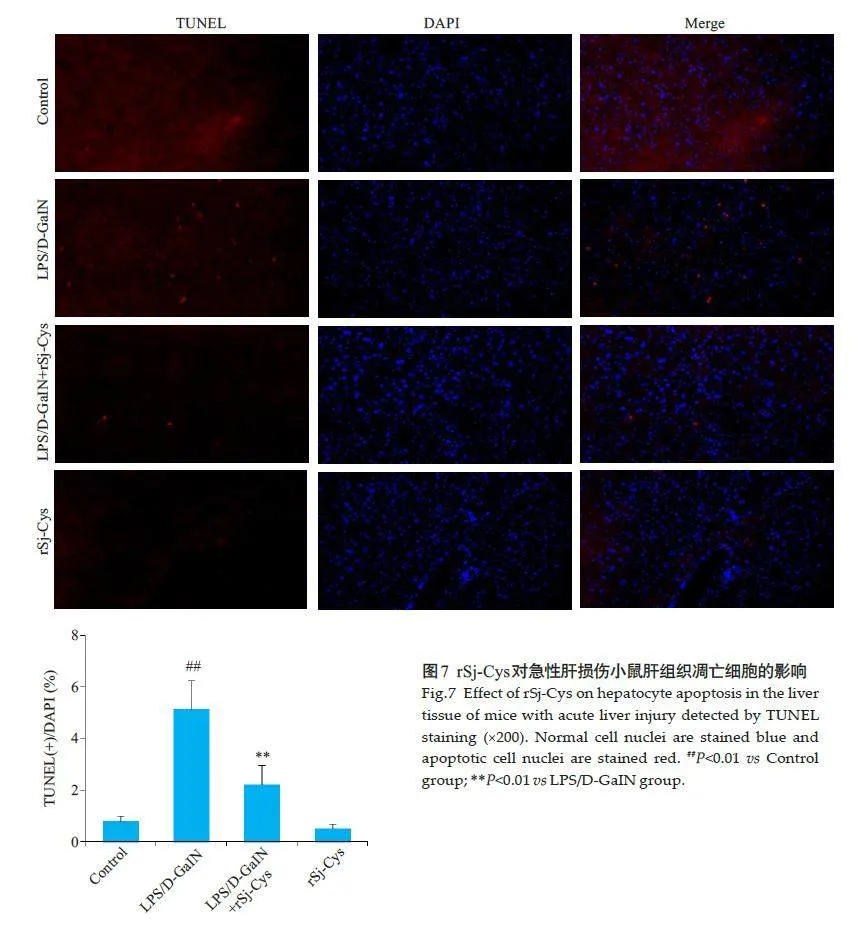
2.7 rSj-Cys对急性肝损伤小鼠肝细胞凋亡的影响
正常对照组和单独给予rSj-Cys组中仅可见少量凋亡细胞;与正常对照组相比,LPS/D-GalN组小鼠肝组织切片中,阳性凋亡着色细胞数显著增多(Plt;0.01);与模型组相比,治疗组中rSj-Cys显著减少小鼠肝组织切片中阳性凋亡着色细胞数(Plt;0.01,图7)。
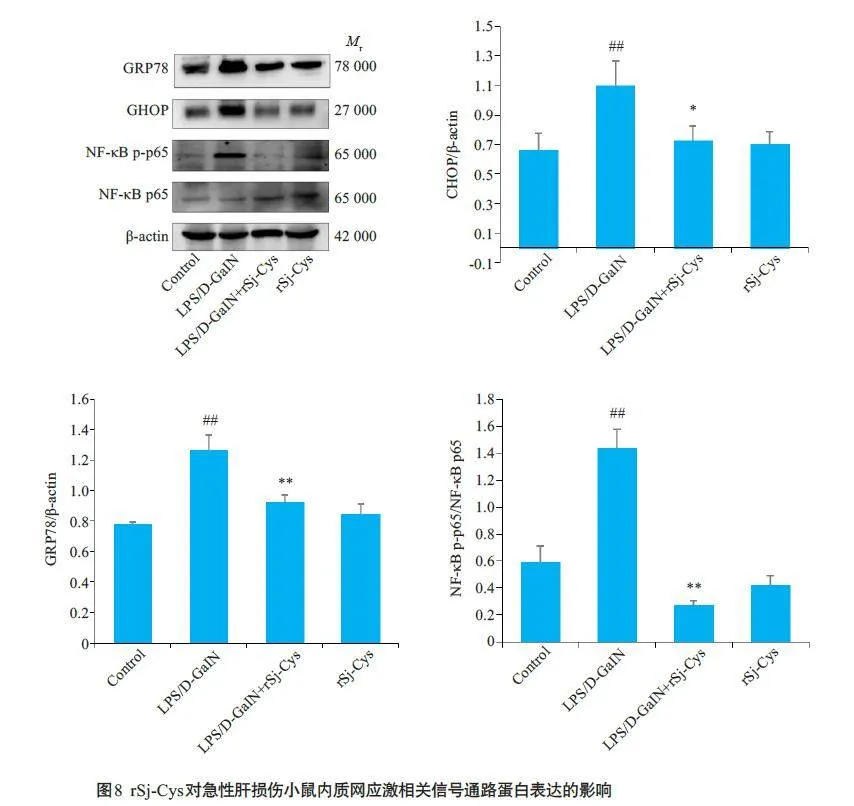
2.8 rSj-Cys对急性肝损伤小鼠内质网应激信号通路相关分子GRP78、CHOP、NF-κB p65、NF-κB p-p65蛋白表达的影响
与正常对照组比较,模型组肝组织ERS信号通路相关分子GRP78、CHOP、NF-κB p-p65蛋白相对表达水平均明显增高(Plt;0.05 或Plt;0.01);与模型组组比较,LPS/D-GalN+rSj-Cys 治疗组GRP78、CHOP、NF-κB pp65蛋白相对表达水平均明显下降(Plt;0.05 或Plt;0.01,图8)。单独给予rSj-Cys与正常对照组相比差异无统计学意义(Pgt;0.05)。
3 讨论
ALI是一种严重的临床综合征,通常由败血症、病毒性肝炎、自身免疫性肝炎、酗酒或药物滥用引起,具有起病隐匿、病死率高、发展快等特点,已经成为了不容忽视的公共卫生问题[16]。目前ALI常见的治疗药物有甘草酸制剂、糖皮质激素类药物、抗氧化剂、多烯磷脂酰胆碱甘草。甘草酸制剂会引起水肿、血压升高、头晕、心悸等副作用[17];激素药物会引起众多全身不良反应;某些患者对抗氧化剂药物和多烯磷脂酰胆碱药物过敏,而且多种保肝降酶药停药后易出现ALT“反跳”。以上药物或多或少都存在一定的副作用且疗效有限,因此我们需要探寻一种安全、高效的治疗ALI 的药物。LPS/DGalN引起的ALI与临床上的急性肝损伤在病理改变和功能损伤上极为相似,所以是目前研究急性肝损伤及其作用机制经典的动物模型。其中LPS 是革兰阴性菌外膜的重要组成部分,可激活巨噬细胞,释放TNF-α、IL-6和IL-1β等炎症因子,从而引起肝细胞凋亡和坏死。D-GalN通过竞争性抑制消耗尿苷磷酸盐,从而抑制核酸和蛋白质的合成,并引起肝细胞损伤[18]。
现有研究表明,血吸虫衍生物rSj-Cys可改善小鼠心肌梗死的炎症反应,对心肌具有保护作用[19],还可以通过调节TLR2/Myd88信号通路,促进巨噬细胞从M1到M2 的极化,显著改善了动脉粥样性肾损伤的肾功能[14]。此外,rSj-Cys 已被用于治疗DSS 诱导的小鼠结肠炎和LPS 诱导的小鼠脓毒症[20]。因此,本实验选用rSj-Cys以研究其对ALI的保护作用及其作用机制。本研究结果表明,rSj-Cys 可以提高ALI 小鼠的24 h 生存率,具有潜在治疗作用。
ERS已被证明参与多种肝脏疾病的进展,包括非酒精性脂肪肝、药物性肝损伤、病毒性肝炎、肝癌等[21-23]。GRP78被认为是ERS的标志性蛋白,正常情况下,IRE-1、PERK、ATF6 与GRP78 结合,呈无活性状态;ERS状态下,未折叠或错误折叠蛋白质大量积聚,使得GRP78与三种感应蛋白解离,IRE-1、PERK、ATF6被激活,通过不同信号通路最终激活下游信号分子CHOP和NF-κB,参与急性肝损伤的发生。
内质网应激的持续过度激活与炎症反应存在相互联系。首先,LPS/D-GalN诱导的小鼠急性肝损伤会导致内毒素血症,LPS可通过TLR4结合激活NF-κB,从而引起IL-6、TNF-α等炎症因子释放,同时募集大量枯否细胞进一步促进炎症细胞聚集活化,进而加重肝损伤[24]。除此之外,内质网应激的过度激活会导致IRE1α-XBP1信号通路被激活,IRE1α磷酸化并与肿瘤坏死因子受体结合因子2 和凋亡信号调节激酶1 形成复合物,诱导NF-κB核移位,引起炎症因子的大量分泌[25]。PERK还通过抑制NF-κB的抑制蛋白的翻译来激活NF-κB[26]。研究发现重组旋毛虫Cystatin和rSj-Cys通过抑制TLR/MyD 88信号通路减轻机体炎症[13, 27]。此外还有研究证实rSj-Cys对LPS刺激的巨噬细胞炎症因子TNF-α、IL-6的分泌也有明显的抑制作用[28],充分证明了rSj-Cys可以抑制炎症反应。本实验研究结果显示模型组肝脏组织GRP78、CHOP、NF-κB p-p65 蛋白水平表达增加,巨噬细胞表面标记物CD68的表达增高,并且血清炎症因子TNF-α、IL-6含量明显增加,肝脏病理结构严重损害,表明LPS/D-GalN诱导强烈的ERS反应和严重的炎症反应。给予rSj-Cys 后显著下调了ERS 生物标志物GRP78、CHOP 蛋白水平的表达,并抑制了NF-κB p65的磷酸化,显著降低了巨噬细胞的炎性浸润程度和小鼠血清促炎性因子IL-6、TNF-α的水平,病理结构改善,表明rSj-Cys抑制急性肝损伤小鼠的ERS和肝脏炎症损害。
ERS可通过激活CHOP来诱导细胞凋亡。磷酸化的IRE1α促进c-Jun氨基末端激酶和p38分裂原激活蛋白激酶的激活,进而激活其下游信号通路分子CHOP、促凋亡蛋白Bax,抑制抗凋亡蛋白Bcl-2的活化,诱导细胞凋亡[29],同样激活后的PERK、ATF6也上调CHOP的表达[30],诱导细胞凋亡。研究发现感染日本血吸虫尾蚴的小鼠可能通过抑制NF-κB信号通路和内质网应激减轻DSS诱导的实验性结肠炎的炎症反应和细胞凋亡[31]。我们的研究表明,LPS/D-GalN在诱导ERS 的同时,诱导小鼠肝组织内促凋亡因子Bax表达,抑制抗凋亡因子Bcl-2表达,肝细胞凋亡细胞数量明显增加;给予Sj-Cys治疗后显著下调了ERS标志物GRP78、CHOP、NF-κBp-p65蛋白水平的表达,显著抑制促凋亡因子Bax表达,增加抗凋亡因子Bcl-2表达,凋亡细胞数量明显下降,表明rSj-Cys抑制ALI小鼠的ERS和肝细胞凋亡。
综上所述,rSj-Cys 可能通过调节ERS,减轻肝细胞凋亡和炎症反应,改善LPS/D-GalN诱导的小鼠ALI。
参考文献:
[1] Yang WC, Wang YX, Zhang CG, et al. Maresin1 protect againstferroptosis-induced liver injury through ROS inhibition and Nrf2/HO-1/GPX4 activation[J]. Front Pharmacol, 2022, 13: 865689.
[2] Lyu Z, Ji XF, Chen G, et al. Atractylodin ameliorateslipopolysaccharide and d-galactosamine-induced acute liver failurevia the suppression of inflammation and oxidative stress[J]. IntImmunopharmacol, 2019, 72: 348-57.
[3] Pang XH, Qiao Q, Vonglorkham S, et al. Asiatic acid amelioratesacute hepatic injury by reducing endoplasmic reticulum stress andtriggering hepatocyte autophagy[J]. Biomedecine Pharmacother,2020, 129: 110375.
[4] Yang WC, Tao KX, Zhang P, et al. Maresin 1 protects againstlipopolysaccharide/d-galactosamine-induced acute liver injury byinhibiting macrophage pyroptosis and inflammatory response[J].Biochem Pharmacol, 2022, 195: 114863.
[5] Hu XW, Li XM, Wang AM, et al. Caffeine alleviates acute liverinjury by inducing the expression of NEDD4L and deceasingGRP78 level via ubiquitination[J]. Inflamm Res, 2022, 71(10/11):1213-27.
[6] Jiang ZQ, Ma YX, Li MH, et al. 5-Hydroxymethylfurfural protectsagainst ER stress-induced apoptosis in GalN/TNF‑α‑injured L02hepatocytes through regulating the PERK-eIF2α signaling pathway[J]. Chin J Nat Med, 2015, 13(12): 896-905.
[7] Jiao ZH, Liu XN, Ma YJ, et al. Adipose-derived stem cells protectischemia-reperfusion and partial hepatectomy by attenuatingendoplasmic reticulum stress[J]. Front Cell Dev Biol, 2020, 8: 177.
[8] Nan B, Yang CY, Li L, et al. Allicin alleviated acrylamide-inducedNLRP3 inflammasome activation via oxidative stress andendoplasmic reticulum stress in Kupffer cells and SD rats liver[J].Food Chem Toxicol, 2021, 148: 111937.
[9] Chen ZY, Liu YL, Yang L, et al. MiR-149 attenuates endoplasmicreticulum stress-induced inflammation and apoptosis innonalcoholic fatty liver disease by negatively targeting ATF6pathway[J]. Immunol Lett, 2020, 222: 40-8.
[10]毕 晟, 丁有权, 齐建国. 蠕虫及蠕虫源性免疫调控性分子应用于自身免疫性疾病治疗的研究进展[J]. 细胞与分子免疫学杂志, 2016, 32(9): 1276-9, 1284.
[11] Elliott DE, Weinstock JV. Helminth-host immunologicalinteractions: prevention and control of immune-mediated diseases[J]. Ann N Y Acad Sci, 2012, 1247: 83-96.
[12]Liu Y, Ye Q, Liu YL, et al. Schistosoma japonicum attenuatesdextran sodium sulfate-induced colitis in mice via reduction ofendoplasmic reticulum stress[J]. World J Gastroenterol, 2017, 23(31): 5700-12.
[13]Xie H, Wu LQ, Chen XZ, et al. Schistosoma japonicum cystatinalleviates sepsis through activating regulatory macrophages[J].Front Cell Infect Microbiol, 2021, 11: 617461.
[14]Yang HJ, Li HQ, Chen WD, et al. Therapeutic effect of Schistosomajaponicum cystatin on atherosclerotic renal damage[J]. Front CellDev Biol, 2021, 9: 760980.
[15]褚 亮, 李徽徽, 王书书, 等. 源自日本血吸虫的半胱氨酸蛋白酶抑制剂对葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎的影响[J]. 中国血吸虫病防治杂志, 2018, 30(3): 269-72, 338.
[16]林子扬, 林泉酉, 刁礼聪, 等. 复方贞术调脂胶囊通过TLR4/NF-κB通路改善脂多糖诱导的小鼠急性肝损伤[J]. 世界科学技术-中医药现代化, 2023, 25(1): 430-7.
[17]甘草酸制剂肝病临床应用专家委员会. 甘草酸制剂肝病临床应用专家共识[J]. 临床肝胆病杂志, 2016, 32(5): 844-52.
[18]Wang HJ, Chen LY, Zhang XY, et al. Kaempferol protects mice fromd-GalN/LPS-induced acute liver failure by regulating the ER stress-Grp78-CHOP signaling pathway[J]. Biomedecine Pharmacother,2019, 111: 468-75.
[19]李燕楠, 杨小迪, 陈思宇, 等. 日本血吸虫重组半胱氨酸蛋白酶抑制剂对小鼠心肌梗死预后的影响及其免疫调节机制[J]. 中国生物制品学杂志, 2022, 35(1): 55-62.
[20]万勇坤, 李徽徽, 左 琳, 等. 日本血吸虫半胱氨酸蛋白酶抑制剂干预脂多糖诱导的小鼠脓毒症[J]. 南方医科大学学报, 2018, 38(5):625-9.
[21]Hu TY, Wang JY, Li WX, et al. Endoplasmic reticulum stress inhepatitis B virus and hepatitis C virus infection[J]. Viruses, 2022, 14(12): 2630.
[22]Cao YP, He W, Li XP, et al. Rosiglitazone protects againstacetaminophen-induced acute liver injury by inhibiting multipleendoplasmic reticulum stress pathways[J]. Biomed Res Int, 2022,2022: 6098592.
[23] Jiang CJ, Li JH. Research progress on mechanism of exerciseimproving non-alcoholic fatty liver disease through regulatingendoplasmic reticulum stress[J]. Sheng Li Xue Bao, 2022, 74(5):816-26.
[24]Remick DG, Ward PA. Evaluation of endotoxin models for the studyof sepsis[J]. Shock, 2005, 24(Suppl 1): 7-11.
[25]Huang SJ, Xing YY, Liu Y. Emerging roles for the ER stress sensorIRE1α in metabolic regulation and disease[J]. J Biol Chem, 2019,294(49): 18726-41.
[26]Tam AB, Mercado EL, Hoffmann A, et al. ER stress activates NF-κBby integrating functions of basal IKK activity, IRE1 and PERK[J].PLoS One, 2012, 7(10): e45078.
[27]Li HH, Qiu DP, Yuan Y, et al. Trichinella spiralis cystatin alleviatespolymicrobial sepsis through activating regulatory macrophages[J].Int Immunopharmacol, 2022, 109: 108907.
[28]谢 红. 过继转移r-SjCystatin诱导的巨噬细胞对小鼠脓毒症的保护作用研究[D]. 蚌埠: 蚌埠医学院, 2020.
[29]Wang YY, Zhou XQ, Zhao D, et al. Berberine inhibits free fatty acidand LPS-induced inflammation via modulating ER stress responsein macrophages and hepatocytes[J]. PLoS One, 2020, 15(5):e0232630.
[30]So JS. Roles of endoplasmic reticulum stress in immune responses[J]. Mol Cells, 2018, 41(8): 705-16.
[31]刘 娅. 日本血吸虫感染对DSS诱导实验性结肠炎的作用与机制研究[D]. 武汉: 武汉大学, 2017.
(编辑:吴锦雅)
基金项目:山西省回国留学人员科研资助项目(2020-074);山西省应用基础研究计划(201901D111196);山西省科技厅基础研究计划(202303021221127);山西省回国留学人员科研资助项目(2020-175)

