CDHR2 过表达通过抑制PI3K/Akt 通路抑制乳腺癌细胞增殖



摘要:目的 研究CDHR2 通过PI3K/Akt 信号通路抑制乳腺癌细胞生长和细胞周期的作用机制。方法 利用生物信息学分析CDHR2在乳腺癌中的表达及生存预后情况,并利用免疫组化验证,采用qRT-PCR、Western blot检测5株乳腺癌细胞株与正常乳腺上皮细胞中CDHR2的表达,并分析CDHR2的表达情况。筛选出CDHR2表达量低的乳腺癌细胞系MDA-MB-231及MCF7进行质粒转染过表达CDHR2,分为NC组(空白质粒对照)和CDHR2组(CDHR2质粒过表达组)。利用CCK-8增殖实验、EdU增殖实验及细胞周期实验探究CDHR2 对乳腺癌细胞生长和细胞周期的影响,通过Western blotting 检测CDHR2 过表达对PI3K/Akt信号通路和周期通路蛋白表达的影响。结果 生物信息学分析显示在乳腺癌及癌旁中CDHR2表达量均较低且两者间差异无统计学意义(Pgt;0.05),但高表达CDHR2乳腺癌患者预后更好(Plt;0.05)。免疫组化、qRT-PCR及Western blot实验提示,CDHR2在乳腺癌组织及乳腺癌细胞中表达均显著下调(Plt;0.01),CDHR2可以抑制乳腺癌细胞增殖及阻滞乳腺癌细胞的细胞周期(Plt;0.01),CDHR2能够抑制PI3K和Akt磷酸化蛋白表达、抑制周期蛋白Cyclin D1的表达。结论 过表达CDHR2可能通过PI3K/Akt信号通路抑制乳腺细胞生长及阻滞乳腺癌细胞的细胞周期。
关键词:乳腺癌;CDHR2;PI3K/Akt 通路;增殖;细胞周期
乳腺癌已超过肺癌成为世界上最常见的癌症和第五大癌症死亡原因[1],尽管乳腺癌的治疗理念随着医学对肿瘤的不断深入认识而逐渐提高,但乳腺癌的发病机制至今仍不明确,乳腺癌患者的长期生存率也不理想。乳腺癌患者根据不同的激素受体表达情况可进分为luminal A、luminal B、HER-2 过表达型以及三阴型4 种类型乳腺癌。对于乳腺癌患者而言,保乳手术、乳腺癌改良根治术和放疗是最常见的治疗方法。同时,还可根据乳腺癌的分期、分子分型、淋巴结分期等进行个体化化疗、靶向治疗和激素治疗等全身性辅助治疗[2]。但目前的临床治疗存在一定局限性,比如激素受体阳性乳腺癌患者存在内分泌耐药且复发率较高等问题,人类表皮生长因子受体2( HER2)阳性型存在靶向治疗耐药[3],三阴性乳腺癌患者的早期复发转移率较高,且靶标部位不明确,肿瘤异质性强,患者只能选择化疗。由于不同的乳腺癌亚型在基因表达模式、治疗策略的选择以及对治疗的反应和预后等方面存在差异。因此,为进一步了解乳腺癌的发病机制,改进治疗方法和延长生存期。寻找理想的靶点和新型生物标志物对于早期诊断、改善预后和开展肿瘤分子靶向治疗具有重要意义[4]。
钙粘蛋白相关家族成员2(CDHR2)也被命名为PCDH24属于原钙粘蛋白家族,PCDH家族在钙依赖性细胞粘着中扮演重要角色[5]。在许多人类癌症(包括乳腺癌,白血病,胃癌,结直肠癌,食道癌和肺癌)中已经报道了一些PCDH家族成员(例如PCDH8,PCDH9,PCDH10,PCDH17 和PCDH20)的表达丧失[6-9],表明 PCDH可以作为人类癌症的肿瘤抑制剂,但目前CDHR2在乳腺癌中尚未有研究。本研究通过阐明CDHR2 抑制PI3K/Akt通路抑制乳腺癌细胞的生长,并进一步阻滞乳腺癌细胞周期,有望为乳腺癌治疗提供新靶点。
1 材料和方法
1.1 材料
选取南方医科大学中西医结合医院手术切除的10例乳腺癌组织及其相应癌旁正常组织,纳入标准:初次确诊为乳腺癌;治疗前未进行放疗、化疗及免疫治疗。本研究通过南方医科大学中西医结合医院伦理委员会批准(伦理审批号:2022-070)。MCF10A、MDAMB-231、MCF7、HCC1937、T47D和SKBR3 细胞系均由南方医科大学中西医结合医院中心实验室保存。
主要试剂:PBS 粉末、Tween20/TBS 溶液(20×TBST,北京雷根公司);RIPA蛋白裂解液(Strong)、蛋白酶抑制剂及磷酸酶抑制剂(康为世纪公司);RPMIDMEM培养基(Biological Industries);MCF10A细胞专用培养基(武汉普诺塞公司);南美源胎牛血清(上海微科公司);Lipofectamine 2000 转染试剂(Invitrogen);PAGE 凝胶快速制备试剂盒、蛋白预染Marker、ECL发光显影剂(上海雅酶公司);PVDF 膜(Millipore);RNA提取试剂盒(FOREGENE),细胞周期检测试剂盒购自Dojindo(日本同仁化学)。
1.2 方法
1.2.1 生物信息学分析
本研究采用GEPIA 数据库(http: //gepia.cancer-pku.cn/)对CDHR2 在乳腺癌组织和正常乳腺上皮组织中表达情况进行对比,通过两独立样本t检验分析两组间表达差异情况,样本量包括癌组织1085 例,正常组织112 例。利用Kaplan-MeierPlotter (https://kmplot.com)对CDHR2 与乳腺癌预后的关系进行分析。使用STRING(https://cn.string-db.org)对CDHR2与PI3K、AKT、CCND1及其他可能存在的蛋白进行相互结合作用预测,网站参数设置:Homosapiens,confidence(0.15)。
1.2.2 免疫组化
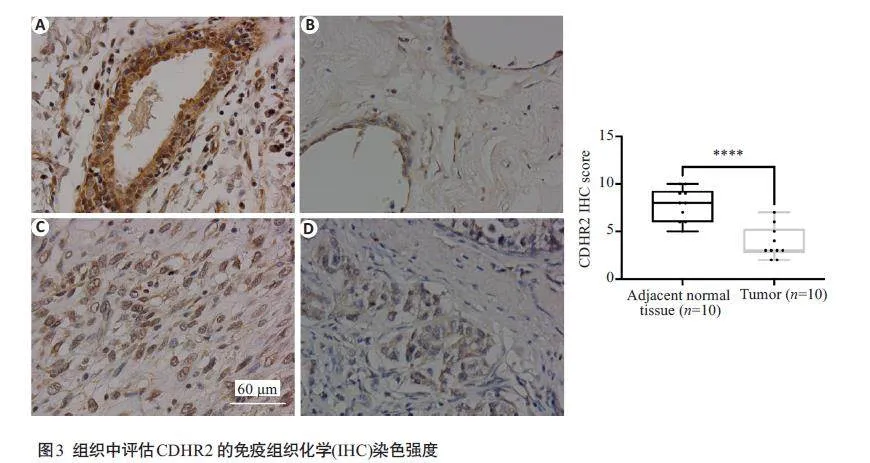
将组织切片置于烤箱60 ℃烘烤120 min,经二甲苯及梯度浓度酒精脱蜡脱水后,向切片滴加适量3% H2O2以阻滞内源性过氧化物酶,室温静置15 min,去离子水洗3次,柠檬酸钠抗原修复液高温处理8 min,于室温条件下自然冷却,室温下山羊血清封闭30 min,加入CDHR2 抗体(1∶2000)4 ℃处理下过夜。PBS清洗3次,将组织切片与带有HRP结合的二抗孵育30 min,DAB显影,细胞核用苏木素进行染色,免疫组化评分:染色强度分为0~3分,阴性0分,弱阳性1分,阳性2分,强阳性3分。染色范围1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分,最终评分=染色强度评分×染色范围评分。
1.2.3 细胞培养
乳腺上皮细胞MCF10A使用专用完全培养基培养,人乳腺癌细胞株MDA-MB-231、MCF7、HCC1937、T47D、SKBR3 均使用含10% 胎牛血清的RPMI DMEM培养,将细胞放置在37 ℃、5%CO2条件下静置培养。每3 d 传代1 次,当细胞生长状态良好、处于对数生长期时,用胰酶消化、离心后使用培养基重悬得到单细胞悬液,然后根据实验需要对细胞进行后续实验。
1.2.4 qRT-PCR
取对数生长期细胞,提取实验细胞中总RNA,检测浓度和纯度合格后取2 μg RNA逆转录合成cDNA,根据试剂盒说明书进行PCR扩增。利用相对量化方法,通过比较2-ΔΔCt来计算基因的倍数变化,将GAPDH作为内参。引物从生工生物工程(上海)股份有限公司合成,引物序列:GAPDH 正向引物CAATGACCCCTTCATTGACC;GAPDH 反向引物GACAAGCTTCCCGTTCTCAG;CDHR2 正向引物CCCCGAAGTTCCTAGCCAAC;CDHR2 反向引物GTCTTCCGCTACCAACCAGA。
1.2.5 Western blot 实验
计算所提取细胞蛋白含量30 μg,以3∶1 的比例蛋白与上样缓冲液4×SDS进行混合,置于95 ℃金属浴锅10 min后放置于冰上2 min。制胶后进行SDS-PAGE 电泳,使其在80 V 电压下保持30 min,而分离胶在120 V下保持90 min。转膜采用湿式转膜法至PVDF膜。置于含有5% BSA的 TBST密封液的平板中,于室温下培养1 h。将一抗用封闭剂稀释,于室温孵育1 h,4 ℃孵育1夜。TBST 洗膜3次,5 min/次。孵育二抗1 h后,TBST洗膜3次,5 min/次,即可加入ECL显色试剂显影拍照记录。CDHR2多克隆抗体(1∶1000)、GAPDH单克隆抗体(1∶50 000)、Akt S473 单克隆抗体(1∶1000)、Cyclin D1 多克隆抗体(1∶5000)、β-Tubulin多克隆抗体(1∶12 000),PI3K T458多克隆抗体(1∶1000,CST)。
Western blotting灰度值分析选用Image J软件协助定量分析,对所有条带进行灰度测定后,获得对应研究基因和内参的区域像素值之和,以研究基因/内参基因之比。最后将目的蛋白灰度值除以内参蛋白的灰度值,进行归一化处理。
1.2.6 细胞转染
通过上海吉凯公司订购CDHR2过表达质粒,当MCF-7 和MDA-MB231 细胞处于对数生长期、细胞状态良好时,消化MCF-7 和MDA-MB231 细胞,进行细胞计数;向六孔板各孔中接种5×105个细胞;转移培养皿至恒温培养箱(37 ℃,5% CO2)。待细胞贴壁后按照Lipofectamine ™2000 转染说明书转染至MCF-7和MDA-MB231细胞。将处理后的细胞分别为对照组(NC组)及过表达CDHR2组(CDHR2组),转染六孔板放至恒温37 ℃,5% CO2培养箱放置6~8 h 后更换新的完全培养基,细胞转染48 h后,可收集瞬时转染的细胞进行Western blotting实验及其他功能试验。
1.2.7 CCK-8实验
CCK8试剂盒购自南京诺唯赞生物公司,将MDA-MB-231 及MCF7 细胞离心计数接种于96孔板中,2000个细胞每孔,在贴壁后0、24、48、72、96 h检测细胞活力。然后每孔加CCK8试剂10 uL,在37 ℃培养箱继续培养2 h,用酶标仪在450 nm处测定各孔的吸光度(A),A值反映了肿瘤细胞的增殖能力。每组重复3次实验,取平均值,记录生长曲线。
1.2.8 EdU实验
采用锐博的Edu 试剂盒进行检测,首先以1∶1000比例对Edu溶液(试剂A)进行稀释,用细胞培养基将其配制为50 μmol/L Edu培养基;在37 ℃恒温培养箱孵育2 h,去除细胞中的培养基;用PBS对细胞进行清洗,每次清洗5 min,清洗3次;在每孔中添加50 μL细胞固定液(即PBS中含有4%的POM),在室温下孵育30 min,去除固定液;添加50 μL 2 mg/mL甘氨酸,在脱色摇床温养5 min,然后丢弃甘氨酸(用于中和的聚甲醛);在每孔中再添加100 μL的PBS,洗涤5 min 的脱色摇床,将PBS 除去;在每孔中添加100 μL 渗透剂(PBS,0.5%Trition-X-100),在脱色摇床孵育10 min,然后用PBS 洗涤5 min 1 次;在每孔中添加100 μL 的Apollo染色剂,避光,在脱色摇床室温育20 min,弃染;添加100 μL渗透剂(PBS,0.5%Trition-X-100),在脱色器中洗涤2~3次,每次10 min,除去渗透剂;在每个孔中添加DAPI 100 μL,在光照下,在脱色摇床室温育5 min,除去染色反应溶液;每孔用100 μL PBS冲洗。
1.2.9 流式细胞术检测细胞周期
细胞从培养箱中取出,PBS洗3遍;加胰酶消化,加含有血清的培基终止消化;移入离心管中静置,离心lt;500 r/min,弃上清; 将细胞重新悬浮在0.5 mL 1×PBS 中,并快速注入3.5 mL70%预冷乙醇中搅拌,室温4 ℃保存1夜,次日将经乙醇提取的细胞进行离心,弃去上清,用1×PBS冲洗3次,除去残余酒精。应用含有0.2 mg RNase A 的1 mL PI/Triton X-100染色液(20 μg PI/0.1% Triton X-100)重悬细胞,37 ℃ 染色15 min。应用流式细胞仪BDFACSCalibur测定细胞周期。
1.2.10 统计学方法
本研究用 SPSS 统计24.0 和GraphPad Prism9.0进行绘图,计量资料以均数±标准差表示,使用两独立样本t检验进行两组间的比较,单因素方差分析用于比较多组数据的差异,生存曲线用Logrank比较,Plt;0.05为差异有统计学意义。
2 结果
2.1 CDHR2在乳腺癌患者中的表达及生存预后
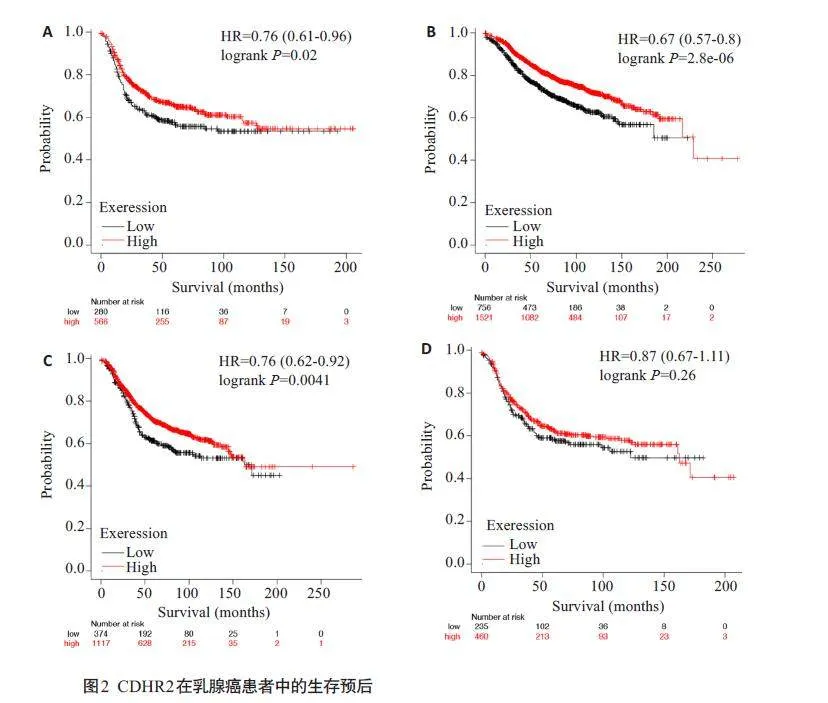
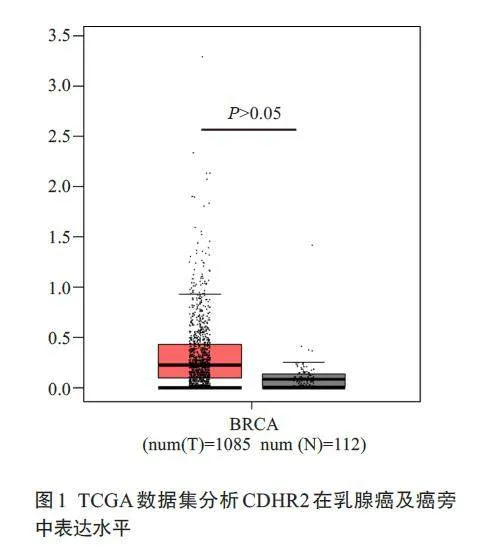
通过TCGA数据集对CDHR2表达进行分析,结果显示在乳腺癌及癌旁中CDHR2 表达量均较低且两者间差异无统计学意义(Pgt;0.05,图1),Kaplan-MeierPlotter在线数据分析CDHR2在乳腺癌患者中的生存预后,发现在三阴型、luminal A型、luminal B型、Her2过表达型乳腺癌患者中,CDHR2高表达患者预后更好,其中CDHR2 过表达的三阴型、luminal A型、luminal B型乳腺癌患者,其总生存期(OS)均高于低表达CDHR2 的乳腺癌患者(Plt;0.05,图2)。免疫组化显示CDHR2蛋白在乳腺癌组织中表达明显下调(图3,Plt;0.0001)。
2.2 CDHR2在乳腺癌细胞系及正常人乳腺上皮细胞中的表达水平
qRT-PCR结果显示CDHR2 在乳腺癌细胞系中表达较正常人乳腺上皮细胞MCF10A相比显著下降,差异有统计学意义(Plt;0.01,图4)。Western blotting检测结果提示,CDHR2在乳腺癌细胞中,尤其是在MDA-MB-231、MCF7细胞中表达水平较低(图5)。
2.3 过表达CDHR2转染结果验证
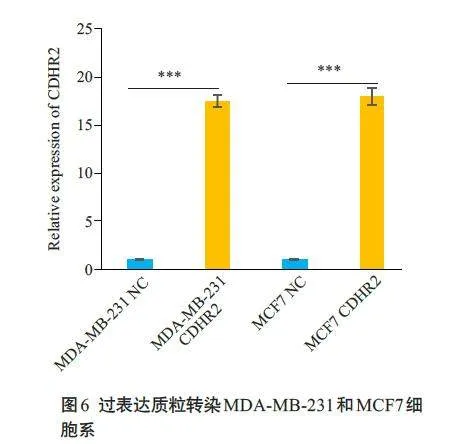
选取MDA-MB-231及MCF7两株细胞进行实验,首先过表达质粒转染乳腺癌细胞系,qRT-PCR测定转染细胞中CDHR2的表达量,在乳腺癌细胞系MDA-MB-231 及MCF7 中,CDHR2 的表达量要远高于对照组(Plt;0.001,图6)。
2.4 过表达CDHR2抑制乳腺癌细胞增殖
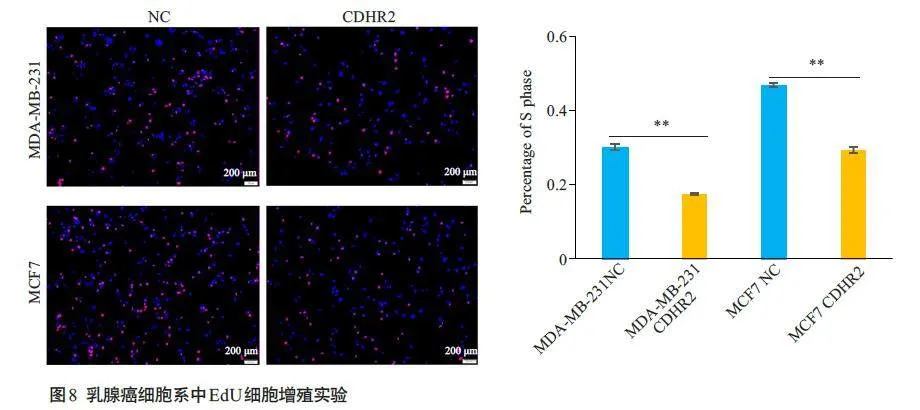
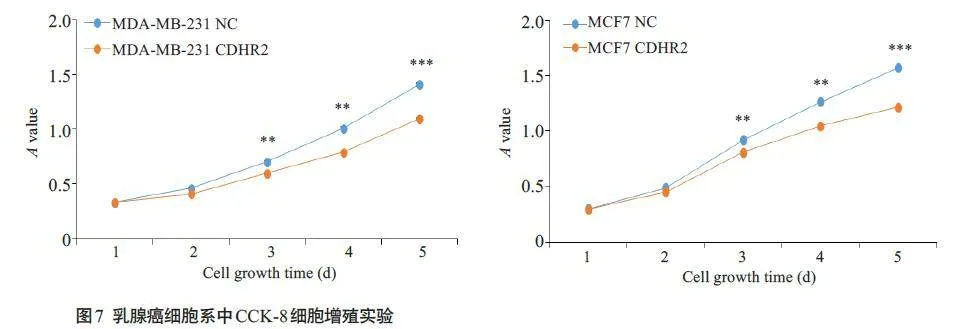
CCK8实验结果显示在MDA-MB-231及MCF7细胞中,CDHR2 高表达组在第3、4、5 天的增殖活力显著降低(Plt;0.01,图7)。相较于对照组,CDHR2过表达组MDA-MB-231 及MCF7细胞中的S期细胞比例显著减少(Plt;0.01,图8)。
2.5 过表达CDHR2抑制乳腺癌细胞的细胞周期
流式细胞术结果显示,过表达CDHR2基因能使细胞周期阻滞在G0/G1期,且过表CDHR2后乳腺癌细胞的S期细胞比例明显减少,最终改变乳腺癌细胞增殖能力,差异具有统计学意义(Plt;0.01,图9)。
2.6 CDHR2 通过PI3K/Akt 通路抑制乳腺癌细胞生长和细胞周期
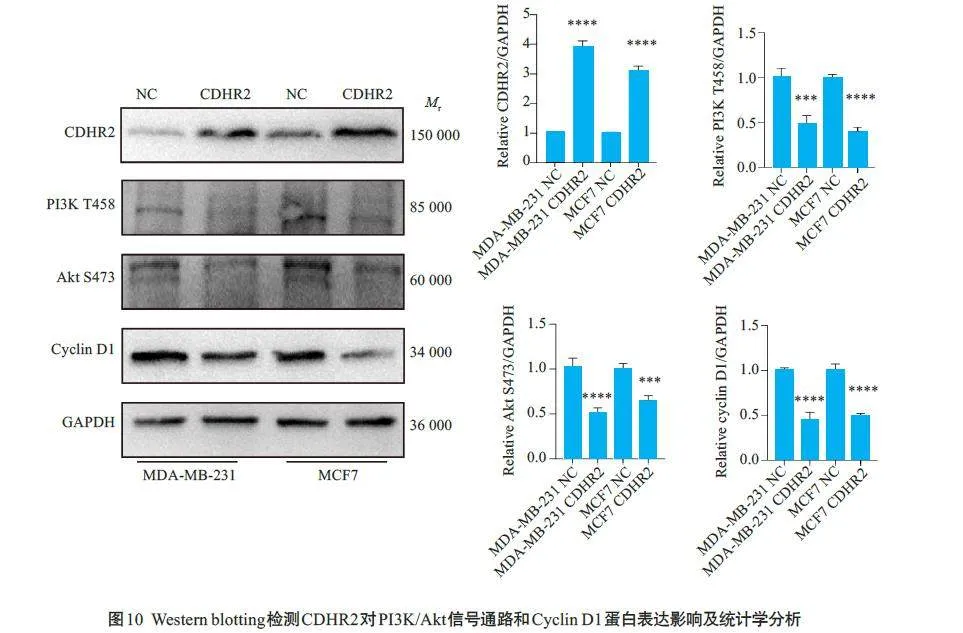
Western blotting检测PI3K/Akt通路和细胞周期相关蛋白的表达变化。结果显示:相较于对照组,过表达CDHR2 可以抑制p-PI3K和p-Akt蛋白的表达,同时对周期蛋白Cyclin D1的表达也具有抑制作用(Plt;0.001,图10)。
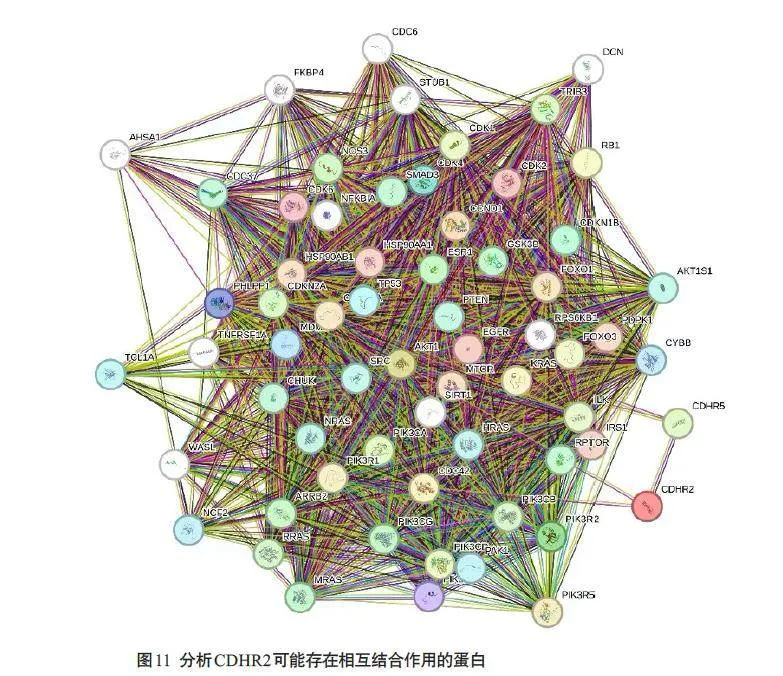
2.7 CDHR2相互结合作用蛋白
STRING在线工具对CDHR2 可能存在的相互结合作用蛋白进行预测(图11),显示CDHR2 与CDC42、CDHR5 基因存在相关性(r=0.115,0.328)。
3 讨论
乳腺癌是全世界女性最常见的癌症类型[10],发病率呈逐年上升,且呈年轻化发展趋势,其病死率在女性恶性肿瘤患者中仅次于肺癌。乳腺癌根据激素受体进行分子分型总共4种。第1种类型是luminal A类型,表示雌激素受体(ER)和孕激素受体(PR)为阳性,而HER-2受体表达为阴性。第2种是luminal B型,即ER和PR均为阳性,而HER-2 也呈阳性。第3 种是HER-2 过表达型,ER 阴性,PR 阴性和HER-2 阳性。第四种类型是ER,PR 和HER-2 均为阴性,也称为三阴型乳腺癌[11]。随着肿瘤手术、放化疗、分子治疗等进展[12, 13],乳腺癌总体预后有了较好的改善,但其复杂的分子机制仍需进一步探讨。
钙粘蛋白相关家族成员2(CDHR2)也被命名为PCDH24属于原钙粘蛋白家族,PCDH 家族在钙依赖性细胞粘着中扮演重要角色[5, 14]。在许多人类癌症(包括乳腺癌,白血病,成胶质细胞瘤,胃癌,结直肠癌,食道癌和辐射诱发的肺癌)中已经报道了一些 PCDH 家族成员( 例如 PCDH8,PCDH9,PCDH10,PCDH17 和PCDH20)的表达丧失,表明PCDH可以作为人类癌症的肿瘤抑制剂[15-17]。研究表明,CDHR2在上皮细胞侧壁的接触抑制过程中发挥着关键的作用,并可能导致接触抑制起到抑癌作用。CDHR2是一种与多种癌症相关的蛋白,其在多种癌症中发挥着重要的抑制或促进作用。例如CDHR2在肝癌和结肠癌中低表达,在肝癌中通过AKT失活以及COX-2表达下调来实现保护作用[18],在HCT116结肠癌细胞中表达升高诱导接触抑制,从而完全消除体内肿瘤的形成[19]。一致的是,CDHR2可以抑制β-连环蛋白介导的细胞-细胞相互作用,导致细胞增殖抑制和肿瘤生长停滞在结直肠癌[20]。然而,CDHR2在乳腺癌癌中的作用及其机制还知之甚少。
本研究首先通过TCGA数据集对CDHR2 表达进行分析,由于CDHR2相对表达量较低,因此在乳腺癌及癌旁中CDHR2表达量差异无统计学意义,查阅已有文献报道,CDHR2 在乳腺癌中亦可能作为抑癌基因起效[15-17]。进一步使用Kaplan-Meier Plotter 在线数据分析CDHR2 在三阴型、luminal A型、luminal B型、Her2过表达型乳腺癌患者中的生存预后,我们发现在4种乳腺癌类型中趋势均为CDHR2高表达患者预后更好,但在Her2过表达型乳腺癌患者的生存曲线尚不具有统计学意义,可能与Her2 过表达型乳腺癌患者样本数量有关,亦或者CDHR2在三阴型乳腺癌或luminal型乳腺癌中发挥作用更加显著,但总的来说CDHR2高表达有利于乳腺癌患者的生存预后。但总的来说CDHR2 高表达有利于乳腺癌患者的生存预后。于是我们利用免疫组化、Western blotting 和qRT-PCR实验进一步证明了CDHR2在乳腺癌组织及细胞中表达下调,在表达较低的乳腺癌细胞MDA-MB-231 和MCF7 中成功过表达CDHR2,通过CCK-8 实验和EdU 实验表明过表达CDHR2能抑制乳腺癌细胞的增殖能力,进一步通过流式细胞术细胞周期实验发现过表达CDHR2 能够使细胞周期阻滞在G0/G1期,从而抑制乳腺癌细胞生长。这提示CDHR2在乳腺癌中是一个抑癌基因。
PI3K/Akt 是调控细胞生长、增殖、迁移、生存及凋亡的重要途径,该通路的异常激活可导致多种肿瘤细胞的存活和增殖[21-23]。CCND1,即G1/S特异性细胞周期蛋白,调节从G1 期向S期过渡的细胞周期过程[24]。越来越多的研究表明,许多基因通过调节 CCND1 影响肿瘤细胞的活力和迁移[25]。有研究表明CDCA2 通过激活 PI3K/AKT途径调节 CCND1 的表达促进结直肠癌细胞增殖[26]。另外,有研究发现多个基因在多种疾病中可以作用于PI3K/AKT信号通路进而影响细胞周期[27]。本研究通过Western blotting 发现过表达CDHR2 可以抑制p-PI3K和p-Akt 蛋白的表达,下调蛋白Cyclin D1的表达,据此,我们提出假说:CDHR2 可能通过调控PI3K/Akt信号途径,下调 CyclinD1的表达,进而影响乳腺癌细胞的增殖和周期。
蛋白质-蛋白质相互作用在细胞的 DNA复制,转录调节,信号转导变异,分子运输以及识别和修饰外来分子等方面发挥着重要作用[28-30]。我们通过String在线分析CDHR2 的候选相互作用蛋白。后续研究中我们可以着眼于蛋白间相互作用,进一步探究细胞内信号传导的分子基础CDHR2调控细胞周期的具体机制。
综合而言,本研究证实了CDHR2在乳腺癌细胞中的表达水平及重要作用,有望为乳腺癌的治疗提供新的靶点和理论依据。
参考文献:
[1] Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J].CA Cancer J Clin, 2023, 73(1): 17-48.
[2] Kawiak A. Molecular research and treatment of breast cancer[J]. IntJ Mol Sci, 2022, 23(17): 9617.
[3] An JS, Peng C, Tang HL, et al. New advances in the research ofresistance to neoadjuvant chemotherapy in breast cancer[J]. Int JMol Sci, 2021, 22(17): 9644.
[4] Barzaman K, Karami J, Zarei Z, et al. Breast cancer: biology,biomarkers, and treatments[J]. Int Immunopharmacol, 2020, 84:106535.
[5] Pancho A, Aerts T, Mitsogiannis MD, et al. Protocadherins at thecrossroad of signaling pathways[J]. Front Mol Neurosci, 2020,13: 117.
[6] Yu JS, Koujak S, Nagase S, et al. PCDH8, the human homolog ofPAPC, is a candidate tumor suppressor of breast cancer[J].Oncogene, 2008, 27(34): 4657-65.
[7] Harada H, Miyamoto K, Yamashita Y, et al. Prognostic signature ofprotocadherin 10 methylation in curatively resected pathologicalstage I non-small-cell lung cancer[J]. Cancer Med, 2015, 4(10):1536-46.
[8] Haruki S, Imoto I, Kozaki KI, et al. Frequent silencing ofprotocadherin 17, a candidate tumour suppressor for esophagealsquamous cell carcinoma[J]. Carcinogenesis, 2010, 31(6): 1027-36.
[9] Fang S, Huang SF, Cao J, et al. Silencing of PCDH10 inhepatocellular carcinoma via de novo DNA methylation independentof HBV infection or HBX expression[J]. Clin Exp Med, 2013, 13(2): 127-34.
[10]Lei SY, Zheng RS, Zhang SW, et al. Global patterns of breast cancerincidence and mortality: a population-based cancer registry dataanalysis from 2000 to 2020[J]. Cancer Commun, 2021, 41(11):1183-94.
[11] Chodosh LA. Breast cancer: current state and future promise[J].Breast Cancer Res, 2011, 13(6): 113.
[12]McDonald ES, Clark AS, Tchou J, et al. Clinical diagnosis andmanagement of breast cancer[J]. J Nucl Med, 2016, 57(Suppl 1):9S-16S.
[13]Griguolo G, Pascual T, Dieci MV, et al. Interaction of host immunitywith HER2-targeted treatment and tumor heterogeneity in HER2-positive breast cancer[J]. J Immunother Cancer, 2019, 7(1): 90.
[14]Vega-Benedetti AF, Loi E, Moi L, et al. Clustered protocadherinsmethylation alterations in cancer[J]. Clin Epigenetics, 2019, 11(1): 100.
[15] Imoto I, Izumi H, Yokoi S, et al. Frequent silencing of the candidatetumor suppressor PCDH20 by epigenetic mechanism in non-smallcelllung cancers[J]. Cancer Res, 2006, 66(9): 4617-26.
[16]Wang CL, Yu GZ, Liu JC, et al. Downregulation of PCDH9 predictsprognosis for patients with glioma[J]. J Clin Neurosci, 2012, 19(4):541-5.
[17]Zhen YL, Pavez M, Li XY. The role of Pcdh10 in neurologicaldisease and cancer[J]. J Cancer Res Clin Oncol, 2023, 149(10):8153-64.
[18]Xia ZY, Huang MJ, Zhu QQ, et al. Cadherin related family member2 acts As A tumor suppressor by inactivating AKT in humanhepatocellular carcinoma[J]. J Cancer, 2019, 10(4): 864-73.
[19]Okazaki N, Takahashi N, Kojima SI, et al. Protocadherin LKC, anew candidate for a tumor suppressor of colon and liver cancers, itsassociation with contact inhibition of cell proliferation[J].Carcinogenesis, 2002, 23(7): 1139-48.
[20]Ose R, Yanagawa T, Ikeda S, et al. PCDH24-induced contactinhibition involves downregulation of beta-catenin signaling[J].Mol Oncol, 2009, 3(1): 54-66.
[21]Luo J, Yao JF, Deng XF, et al. 14, 15-EET induces breast cancer cellEMT and cisplatin resistance by up-regulating integrin αvβ3 andactivating FAK/PI3K/AKT signaling[J]. J Exp Clin Cancer Res,2018, 37(1): 23.
[22]Spangle JM, Dreijerink KM, Groner AC, et al. PI3K/AKT signalingregulates H3K4 methylation in breast cancer[J]. Cell Rep, 2016, 15(12): 2692-704.
[23]Xu JC, Chen TY, Liao LT, et al. NETO2 promotes esophageal cancerprogression by inducing proliferation and metastasis via PI3K/AKTand ERK pathway[J]. Int J Biol Sci, 2021, 17(1): 259-70.
[24]Wang Q, He GP, Hou MM, et al. Cell cycle regulation by alternativepolyadenylation of CCND1[J]. Sci Rep, 2018, 8(1): 6824.
[25]Hermosilla VE, Salgado G, Riffo E, et al. SALL2 represses cyclinsD1 and E1 expression and restrains G1/S cell cycle transition andcancer-related phenotypes[J]. Mol Oncol, 2018, 12(7): 1026-46.
[26]Feng YF, Qian WW, Zhang Y, et al. CDCA2 promotes theproliferation of colorectal cancer cells by activating the AKT/CCND1 pathway in vitro and in vivo[J]. BMC Cancer, 2019, 19(1): 576.
[27]Xie ZZ, Li W, Ai JG, et al. C2orf40 inhibits metastasis and regulateschemo-resistance and radio-resistance of nasopharyngeal carcinomacells by influencing cell cycle and activating the PI3K/AKT/mTORsignaling pathway[J]. J Transl Med, 2022, 20(1): 264.
[28]Zhong Y, Yang LT, Xiong F, et al. Long non-coding RNA AFAP1-AS1 accelerates lung cancer cells migration and invasion byinteracting with SNIP1 to upregulate c-Myc[J]. Signal TransductTarget Ther, 2021, 6(1): 240.
[29]Kar G, Gursoy A, Keskin O. Human cancer protein-proteininteraction network: a structural perspective[J]. PLoS Comput Biol,2009, 5(12): e1000601.
[30]Cho HJ, Hwang YS, Yoon J, et al. EphrinB1 promotes cancer cellmigration and invasion through the interaction with RhoGDI1[J].Oncogene, 2018, 37(7): 861-72.
(编辑:吴锦雅)
基金项目:国家自然科学基金(81872251);广东省自然科学基金(2020A1515010093,2021A1515012104);南方医科大学中西医结合医院院长基金(1202102002)

