澳洲茄碱通过调控Bcl-2/Bax/caspase-3 信号通路促进非小细胞肺癌发生凋亡
摘要:目的 探讨龙葵活性成分澳洲茄碱对非小细胞肺癌细胞PC9 增殖、凋亡的影响。方法 体外培养PC9 细胞,设对照组(0 μmol/L)及澳洲茄碱不同剂量组(0、2、5、10、15、20、25 μmol/L),CCK-8 试剂盒检测澳洲茄碱对PC9 细胞的增殖抑制作用;TMRE 检测线粒膜电位;caspase3/7 活性试剂盒联合GreenNuc ™ Caspase-3/Annexin V-mCherry 染色检测caspase-3 活性;Annexin V-FITC/PI 双染法检测细胞凋亡率;给药处理或者使用PTEN抑制剂后,Western blot 检测细胞中相关蛋白的表达量。结果 与对照组相比,经澳洲茄碱干预24、48、72 h后,PC9细胞的活力均明显降低(Plt;0.05);经澳洲茄碱干预24 h后,细胞线粒体膜电位明显降低,而细胞凋亡比例明显升高(Plt;0.05);caspase-3/7活力、活细胞Caspase-3活性及cleaved caspase-3蛋白表达均显著升高(Plt;0.01);PI3K和Akt磷酸化水平降低(Plt;0.05);而PTEN、Bax蛋白表达上调(Plt;0.05);抗凋亡蛋白Bcl-2蛋白的表达下调(Plt;0.05)。结论 澳洲茄碱可通过调控Bcl-2/Bax/caspase-3通路及其上游蛋白活性而抑制PC9细胞增殖,促进其凋亡。
关键词:澳洲茄碱;肺癌;Bcl-2/Bax/caspase-3 通路;同源性磷酸酶-张力蛋白;细胞凋亡
全球肺癌的新发病率及死亡率高居恶性肿瘤榜首[1, 2]。多数肺癌患者确诊时已属中晚期,癌细胞已经发生侵袭转移,失去手术根除治疗的机会,而非手术治疗(放疗、化疗、靶向治疗、免疫治疗)普遍存在其病理类型的局限性,如放疗/化疗抵抗、耐药、毒副作用明显等。因此,我们需要探索促进肺癌发生、侵袭转移的非特异性分子机制,确定新的临床治疗靶点,提高治疗中晚期肺癌患者的治疗效率。
龙葵是重要的抗癌药物,别名苦葵、山辣椒、天茄子等,在我国各地均有分布。文献报道表明,龙葵具有较广泛、效果较明显的抑制肿瘤生长的作用,龙葵主要抑瘤活性成分有生物碱、多糖、糖蛋白等,龙葵所含的这三类物质在抗肿瘤方面都有较多的研究,其中较有前景的是其生物碱。澳洲茄碱(SS,C45H73O16N)是龙葵的主要活性成分之一,属于甾体生物碱中的胆甾烷衍生物[3, 4],其水解后分解出苷元澳洲茄胺,进而发挥化学活性,具有明确的抗肿瘤作用[5, 6]。既往研究表明[7-14],澳洲茄碱对不同肿瘤细胞系,如小鼠黑色素瘤(B16F10),人结肠癌(HT29),人乳腺癌(MCF-7),人宫颈腺癌(HeLa),人肝细胞肝癌(HepG2)和人胶质母细胞瘤(MO59J,U343和U251)、人非小细胞肺癌(A549、Calu-1)具有明显的抗增殖作用。然而,澳洲茄碱在肺癌治疗中的效果及其分子机制研究仍有欠缺。
PI3K/Akt 通路的持续活化,在肺癌及其他肿瘤细胞的增殖和凋亡中,起到了至关重要的作用[15]。PTEN是一种抑癌基因,负反馈调节PI3K/Akt通路活性[16, 17]。caspase-3 是细胞凋亡途径的关键执行者,cleavedcaspase-3 是其活化状态,介导细胞凋亡。Bcl-2 和Bax是Bcl-2蛋白家族的两个重要成员,在细胞凋亡中起关键作用。Bcl-2 是一种抗凋亡蛋白,抑制caspase-3 活化;而Bax是一种促凋亡蛋白,促进caspase-3活化[18, 19]。最近研究发现[13],澳洲茄碱可能通过抑制caspase-3 通路,进而诱导A549细胞凋亡,但具体分子机制尚未做深入研究。由此,本实验拟从PI3K/Akt信号通路及其上下游因子出发,探讨澳洲茄碱对肺癌PC9细胞增殖和凋亡的影响。
1 材料和方法
1.1 实验材料
1.1.1 细胞
人肺腺癌细胞PC9由广州中医药大学第二附属医院李龙妹博士赠送。PC9,贴壁细胞,培养于含10%胎牛血清和1%双抗(100 μg/mL 链霉素、100 U/L青霉素)的DMEM基础培养基,培养条件为37℃,5%CO2。当细胞汇合度为80%~90%时进行传代或铺板。
1.1.2 药物
澳洲茄碱(纯度≥98.98%,上海陶素生化科技,分子式为C45H73NO16,相对分子质量为884.07),冻干粉状态下-20 ℃冰箱保存。药物储存液制备:采用细胞级DMSO 将澳洲茄碱粉末10 mg 溶解,制备成50 mmol/L储存液,分装后-20℃保存备用,实验时采用完全培养基将其稀释为实验所需的药物浓度。
1.1.3 主要试剂
DMEM基础培养基、胎牛血清、胰酶(Gibco);磷酸盐缓冲液(PBS,HyClone);预染蛋白Marker、BCA蛋白检测试剂盒(Thermo);线粒体膜电位检测试剂盒(TMRE)、GreenNuc™活细胞caspase-3活性检测试剂盒(碧云天);caspase-3/7 活力检测试剂盒(Promega);CCK8 试剂盒(翌圣);Annexin V-FITC/PI(联科生物);cleaved caspase-3、PTEN、PI3Kp85、p-PI3Kp85、Akt、p-Akt、Bcl2、Bax、GAPDH抗体、蛋白上样缓冲液、总蛋白裂解液(CST);发光液、PVDF 膜(Millipore);蛋白酶抑制剂、磷酸酶抑制剂(Roche)。
1.1.4 主要仪器
生物安全柜(苏州安泰空气技术有限公司);二氧化碳培养箱(Sanyo);全自动细胞计数仪(Inno-Aliance);常温离心机(京立离心机);多功能酶标仪(BioTek);冷冻离心机(Eppendorf);流式细胞仪(BD);高灵敏化学发光成像仪、垂直电泳系统、半干转印槽转膜仪(Bio-Rad);全自动倒置荧光显微分析系统(Nikon)。
1.2 实验方法
1.2.1 CCK8 法检测澳洲茄碱对PC9 细胞活力的影响
收集处于对数生长期的PC9细胞,按5×103/孔的标准接种于96孔细胞板中,常规培养24 h后,分组进行给药处理,SS浓度为:0、2、5、10、15、20、25 μmol/L,继续常规培养24、48 和72 h。药物作用后,吸去旧培养液,加入含10%(体积分数)CCK8溶液的新培养基,常规培养箱避光孵育2 h,用酶标仪在450 nm波长下检测各孔吸光值(A),取各复孔平均值,按照以下公式计算细胞活力,绘制PC9细胞在不同浓度SS作用24、48、72 h后的生长曲线并计算出IC50。
细胞活率=(A加药组- A空白组/A对照组- A空白组)× 100%
1.2.2 线粒体膜电位检测
取适量TMRE (×1000),按照每1 μL TMRE(×1000)加入1 mL 检测缓冲液的比例稀释TMRE,混匀后即为TMRE染色工作液。分别收集对照组和经15 μmol/L 澳洲茄碱作用24 h的细胞,1000 r/min离心3 min,PBS洗涤1次后加入1 mL TMRE染色工作液,混匀后于细胞培养箱中孵育30 min,弃上清,用预热的细胞培养液洗涤2次,加入1 mL预热的细胞培养液,置于荧光显微镜下观察橘红色荧光强度,并拍照保存。
1.2.3 流式细胞术检测细胞凋亡情况
收集对数生长期细胞,按细胞浓度2×105/孔接种于6孔板,待细胞贴壁,分为对照组(不加澳洲茄碱)和给药组(澳洲茄碱浓度为15 μmol/L),继续常规培养24 h。药物处理完毕后,收集细胞并根据细胞凋亡试剂盒(联科生物)说明书对各组细胞进行PI染色,继而使用流式细胞仪检测细胞周期。
1.2.4 Caspase-3/7活力检测
按细胞浓度2×104/0.1 mL/孔接种于96孔板中,细胞贴壁后,分为对照组(澳洲茄碱浓度为0 μmol/L )和给药组(澳洲茄碱浓度为10、15、20 μmol/L组),常规培养24 h,加入Apo-ONE caspase-3/7混合液100 μL,常温避光孵育1 h,采用多功能酶标仪检测,记录并计算活力。
1.2.5 活细胞caspase-3 活性的原位荧光显微镜检测
按细胞浓度1×105/孔接种于12 孔板,贴壁后,对照组和经15 μmol/L 澳洲茄碱作用24 h 的细胞,每孔先加入194 μL Annexin V-mCherry Binding Buffer,再加入5 μL Annexin V-mCherry和1 μL GreenNuc™Caspase-3Substrate( 1 mmol/L),轻轻混匀,室温避光孵育30 min,随即在荧光显微镜下观察,拍照并处理图像。
1.2.6 Western blotting法检测澳洲茄碱对PC9细胞蛋白表达的影响
取对数生长期的PC9 细胞以2×105/孔接种于6孔板,待细胞贴壁后,分组给药,药物处理24 h后收集细胞,冰上操作,加入含有磷酸酶抑制剂和蛋白酶抑制剂的裂解液提取总蛋白,BCA 法检测蛋白浓度,加入上样缓冲液并混匀,加热变性,-80 ℃保存。每组样品取25 μg总蛋白上样,80 V电泳20 min后110 V电泳50 min,20 V半干转45 min,用5%脱脂牛奶封闭1 h,洗去封闭液,加入对应蛋白一抗,4 ℃孵育过夜,第2天以TBST洗涤3次后,加入二抗室温孵育1 h,显影成像。
1.2.6 统计学方法
所有实验均至少重复3 次,采用SPSS 23.0进行正态性及方差齐性检验,当满足正态性及方差齐性时,采用单因素方差分析;若不满足正态性或方差齐性时,采用非参数检验。当Plt;0.05 时认为差异有统计学意义。
2 结果
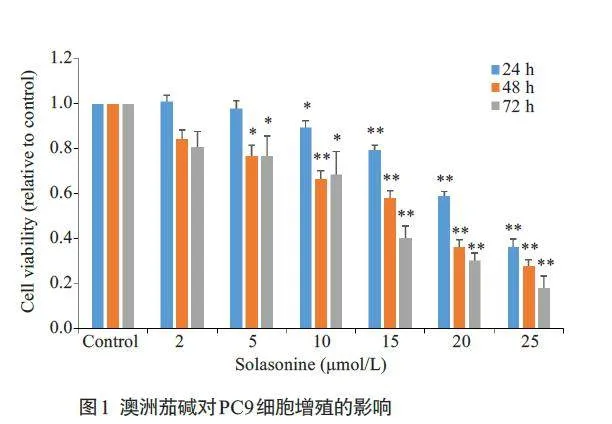
2.1 澳洲茄碱对PC9细胞增殖的抑制作用
CCK8 实验结果显示,与对照组相比,澳洲茄碱组PC9细胞活力明显下降并呈剂量和时间依赖性:澳洲茄碱作用于细胞24 h后,从给药浓度10 μmol/L起,细胞活力的差异具有统计学意义(Plt;0.05),且随浓度的增大而逐渐降低;而澳洲茄碱干预细胞48 h 及72 h 后,从给药浓度为2 μmol/L起,细胞活力的差异具有统计学意义(Plt;0.05),且随浓度的增大而逐渐降低(图1)。经计算,澳洲茄碱对PC9 细胞24、48、72 h 的IC50 分别为21.72、14.60、11.90 μmol/L。
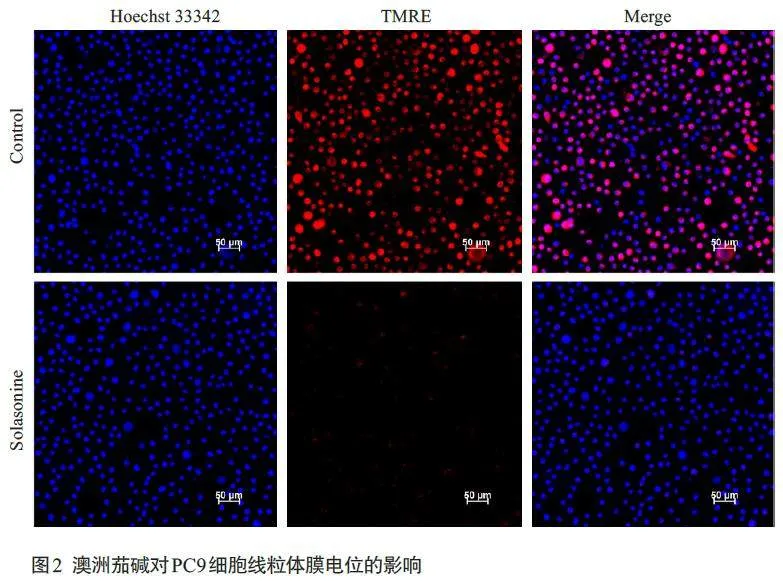
2.2 澳洲茄碱对PC9细胞线粒体膜电位的影响
荧光显微镜下,与对照组相比,经澳洲茄碱(15 μmol/L)作用24 h后,澳洲茄碱组细胞橘红色荧光强度明显减弱,几乎完全消失(图2)。
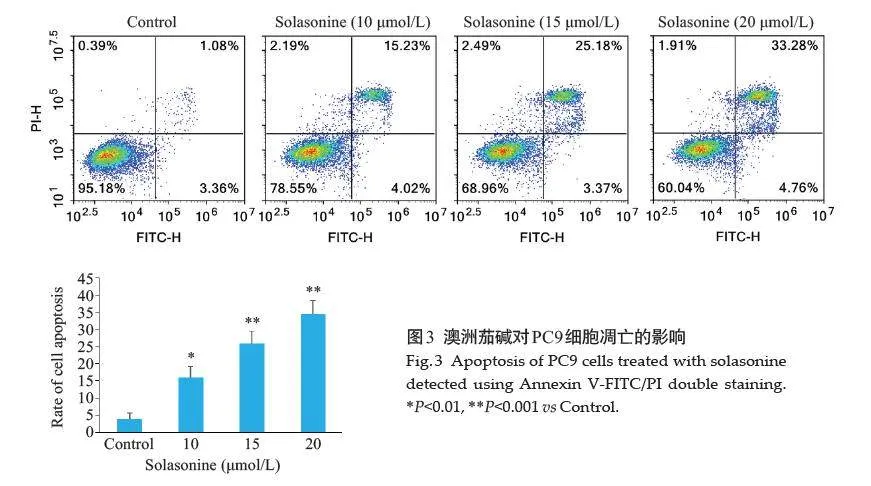
2.3 澳洲茄碱对PC9细胞凋亡的影响
Annexin V-FITC/PI 流式细胞术检测结果显示,与对照组相比,澳洲茄碱各组(10、15、20 μmol/L)细胞早期凋亡比率均增加,且随着药物浓度增加而升高,差异均有统计学意义(Plt;0.05,图3)。
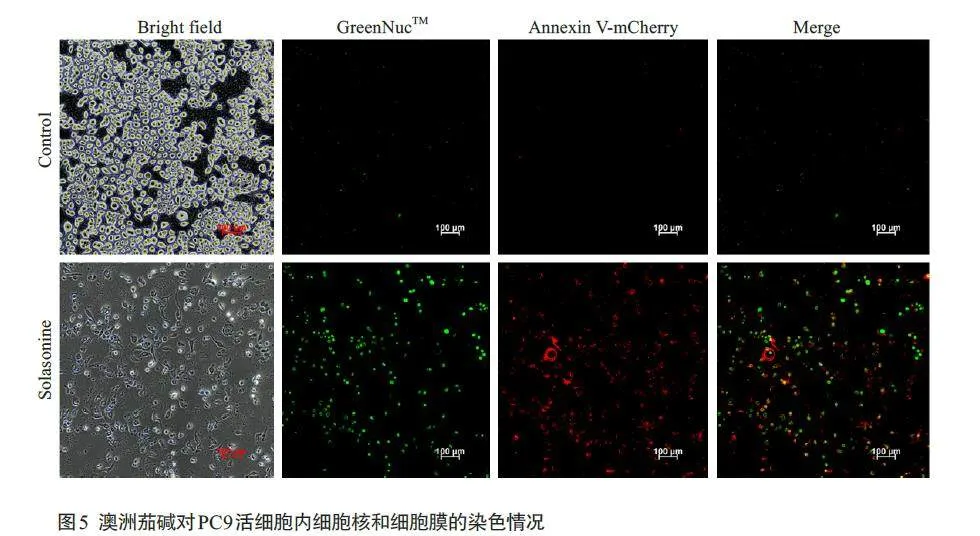
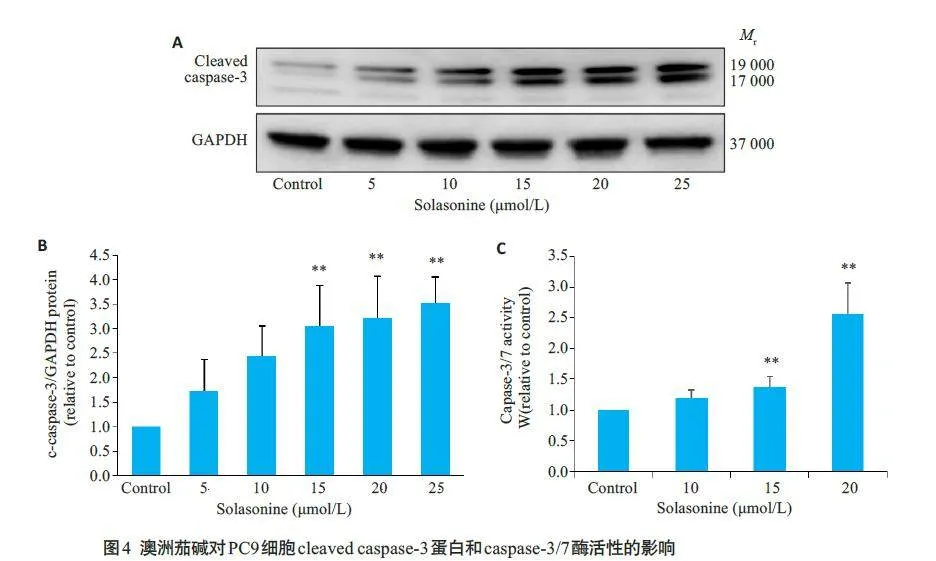
2.4 澳洲茄碱对PC9 细胞cleaved caspase-3 蛋白、caspase-3/7活力和caspase-3活性的影响
Western blotting实验结果显示,与对照组相比,澳洲茄碱各组(5、10、15、20 和25 μmol/L)中PC9 细胞的cleaved caspase-3蛋白表达明显上调,差异均有统计学意义(Plt;0.05),且随着给药浓度的增大,cleaved caspase-3蛋白表达量呈明显上调趋势(图4A、B)。caspase-3/7活性试剂盒检测结果显示,与对照组相比,澳洲茄碱各组(10、15、20 μmol/L)中PC9细胞的caspase-3/7活力明显升高,差异均有统计学意义(Plt;0.05),且随着药物浓度增大而逐渐降低(图4C)。同时GreenNuc ™ caspase-3/Annexin V-mCherry双染结果显示,对照组细胞不会被GreenNuc™和Annexin V-mCherry所染色。澳洲茄碱处理24 h后,PC9细胞内caspase-3活性高的凋亡细胞核呈明亮的绿色荧光,凋亡细胞的细胞膜显示红色荧光(图5)。
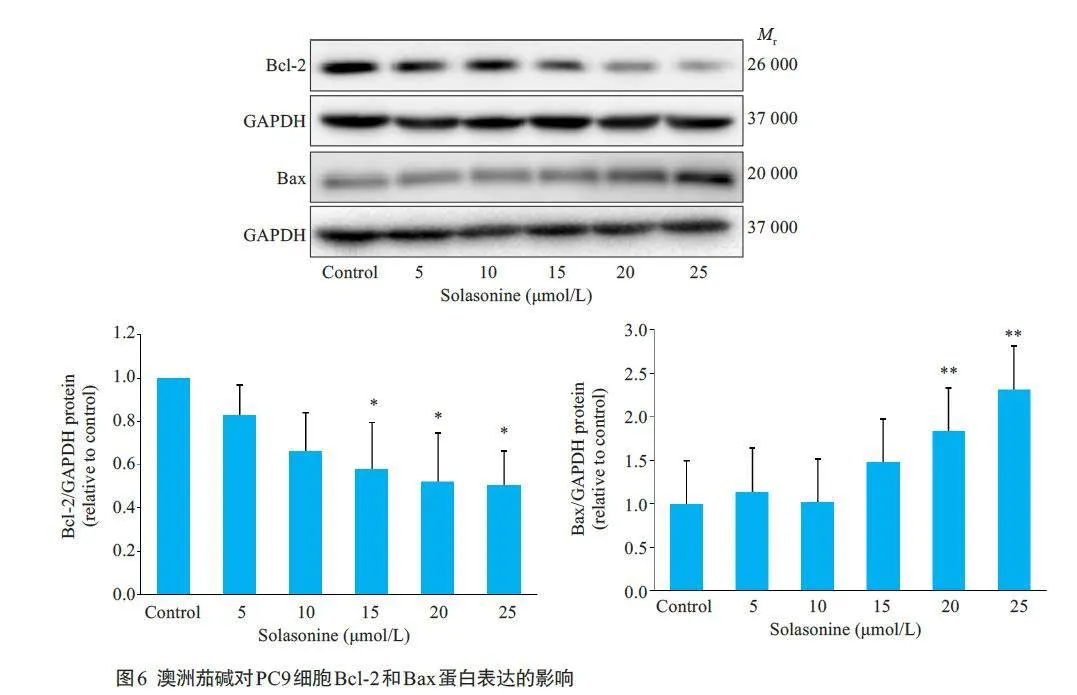
2.5 澳洲茄碱对PC9细胞中Bcl-2、Bax蛋白表达水平的影响
Western blotting结果显示,与对照组相比,澳洲茄碱15、20和25 μmol/L组中PC9细胞的Bcl-2蛋白表达明显下调,而澳洲茄碱20和25 μmol/L组细胞Bax蛋白表达明显上调,差异均有统计学意义(Plt;0.05);且随着给药浓度的增大,Bcl-2 蛋白表达量呈明显下降趋势,Bax蛋白表达量呈明显上升趋势(图6)。
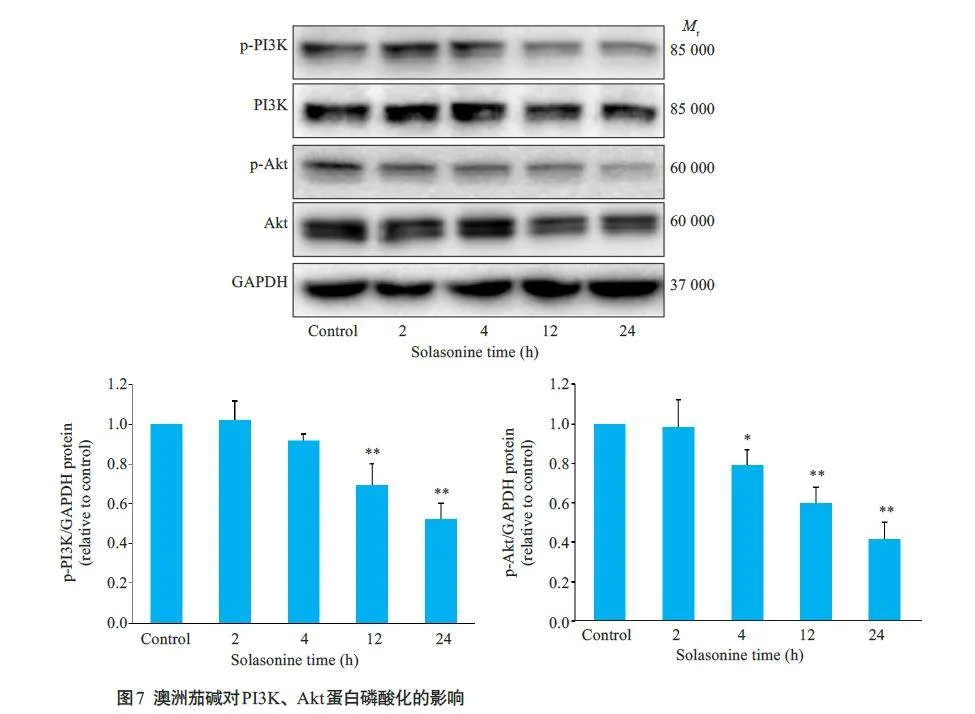
2.6 澳洲茄碱对PC9细胞中PI3K、Akt蛋白磷酸化水平的影响
澳洲茄碱作用4 h 可抑制PI3K 和Akt 的磷酸化(p-PI3K、p-Akt蛋白表达减低),且随着时间的推移抑制作用越明显;与空白对照组相比,澳洲茄碱作用细胞12、24 h后,细胞中p-PI3K、p-Akt 的表达量差异具有统计学意义(Plt;0.05,图7)。
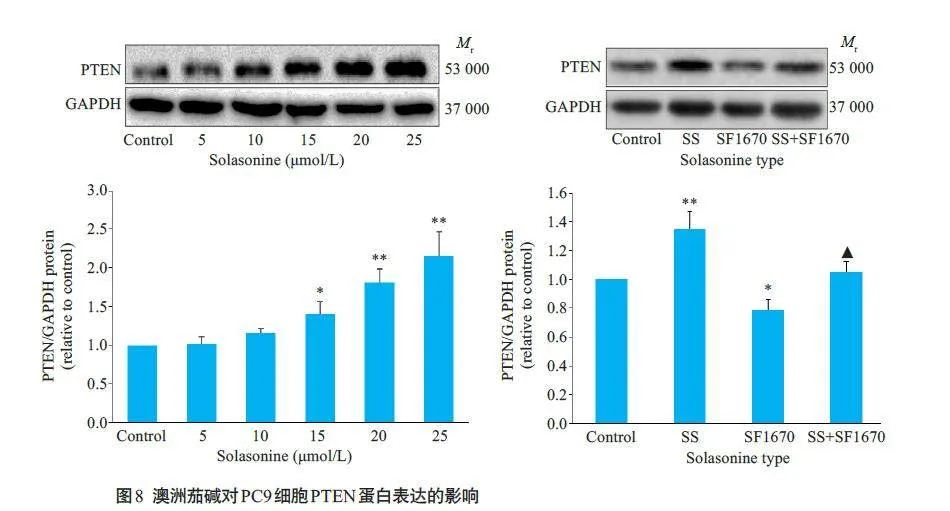
2.7 澳洲茄碱对PC9 细胞中PTEN 蛋白表达水平的影响
药物作用24 h后,澳洲茄碱15、20和25 μmol/L组中PC9细胞的PTEN蛋白表达明显上调,差异有统计学意义(Plt;0.05),且随给药液浓度的增大,PTEN蛋白表达逐渐升高;这种上调趋势可被PTEN 蛋白抑制剂SF1670逆转(图8)。
3 讨论
肺癌仍是我国乃至世界范围内癌症相关性死亡的首要原因[1,2],寻找行之有效的治疗手段及治疗靶点是非常必要的。澳洲茄碱已被证实可以通过线粒体介导的凋亡等不同方式对不同肿瘤类型具有抑制增殖、促进凋亡的作用[4-14,19-21]。在本研究中,以人肺腺癌细胞系PC9作为研究对象,澳洲茄碱作为作为治疗药物,探索了澳洲茄碱在肺癌治疗中的潜力及相关机制。本研究结果显示,澳洲茄碱显著抑制PC9细胞的增殖,且呈剂量依赖性及时间依赖性,对PC9细胞24、48、72 h的IC50分别为21.72、14.60、11.90 μmol/L;且与对照组相比,澳洲茄碱组细胞线粒体膜电位水平显著降低,细胞凋亡比例显著升高。以上结果与既往研究结果一致[13, 14, 22],进一步验证了澳洲茄碱可以通过线粒体介导的凋亡促进癌细胞凋亡,抑制其增殖的结论。
Bcl-2/Bax/caspase-3 信号通路与细胞的凋亡过程密切相关[23, 24]在癌细胞中,高表达的Bcl-2 与Bax 形成异源二聚体,抑制下游caspase-3的激活,抵抗细胞凋亡的发生[25]。李龙妹等[13]研究显示,澳洲茄碱可明显抑制肺腺癌细胞A549 中p65、Bcl-2 蛋白表达,并增强Bik、Bak 蛋白表达,降低pro caspase-3 水平,从而推测澳洲茄碱通过激活caspase-3 通路诱导A549 细胞凋亡。此外,Zeng等[14]研究显示,澳洲茄碱引起肺腺癌细胞A549和Calu-1 中铁死亡和线粒体氧化应激诱导细胞凋亡。本研究结果显示,澳洲茄碱作用于PC9 细胞后,Bax 和cleaved caspase-3蛋白表达显著上调,且caspase-3/7活力及caspase-3活性同样明显升高,而Bcl-2蛋白表达显著下调,且呈现浓度依赖性,对李龙妹等和Zeng等关于澳洲茄碱通过激活caspase-3通路或线粒体相关途径诱导肺癌细胞凋亡的结论进行了细胞类型上的验证和补充,增加了澳洲茄碱抑制肺癌的普遍性。因此我们推测澳洲茄碱对PC9细胞的增殖抑制、凋亡诱导可能通过调控Bcl-2/Bax/caspase-3通路发挥抑癌作用。
多项研究表明PI3K/Akt/Bax信号通路的调控是多种药物抑制肺癌细胞增殖生长的关键[26-29]。Akt 易被PI3K的活化产物PIP3 激活,在苏氨酸308 位点或丝氨酸473 位点发生磷酸化,直接抑制促凋亡蛋白Bax 表达,抵抗细胞凋亡进程[15]。我们推测,澳洲茄碱对PC9细胞中Bax 的上调与PI3K/Akt 通路活性有关。Western blot实验结果显示,澳洲茄碱可以显著抑制p-PI3K、p-Akt蛋白磷酸化,呈时间依赖性,与我们的预期相符。PTEN是PI3K/Akt通路中重要的负调控因子,可下调PI3K/Akt通路活性而抑制肿瘤细胞生长,促进肿瘤细胞凋亡[16]。本研究结果显示,澳洲茄碱剂量依赖性激活PTEN蛋白表达,但这种作用可以被PTEN抑制剂SF1670抵消。综上,澳洲茄碱可能通过上调抑癌基因PTEN的蛋白表达,从而负调节PI3K/Akt通路活性,诱导细胞凋亡。
综上所述,澳洲茄碱确切可以抑制肺腺癌细胞增殖、诱导凋亡。具体可能通过上调PTEN蛋白表达,抑制PI3K/Akt 信号通路的活化,解除Bcl-2 与Bax 的结合,激活caspase-3,进而诱导PC9细胞凋亡,为中草药龙葵治疗肺癌的机制研究中提供了新的思路。本研究尚存在着一定不足:本实验仅进行了细胞层面的实验,未进行动物层面的研究,下一步将构建实验动物模型,进一步确认澳洲茄碱对肺癌的生长抑制作用。此外,在文献中已明确澳洲茄碱可通过不同途径抑制肺癌细胞A549和Calu-1(含H-ras癌基因),而本研究证实澳洲茄碱也可抑制肺癌细胞PC9(EGFR突变型),可见澳洲茄碱针对肺癌的抑制效应具有普遍性。接下来我们将研究澳洲茄碱对肺癌细胞EGFR-TKI药物的原发性及获得性耐药是否具有增效减毒作用。
参考文献:
[1] Siegel R, Miller K, Wagle NS, et al. Cancer statistics, 2023[J]. CACancer J Clin, 2023, 73(1): 17-48.
[2] Luo YH, Chiu CH, Kuo CHS, et al. Lung cancer in republic of China[J]. J Thorac Oncol, 2021, 16(4): 519-27.
[3] Butt G, Romero MA, Tahir F, et al. Emerging themes of regulation ofoncogenic proteins by Solanum nigrum and its bioactive moleculesin different cancers[J]. J Cell Biochem, 2018, 119(12): 9640-4.
[4] Jagadeeshan S, David D, Jisha S, et al. Solanum nigrum Unripe fruitfraction attenuates Adriamycin resistance by down-regulating multidrugresistance protein (Mdr) -1 through Jak-STAT pathway[J].BMC Complement Altern Med, 2017, 17(1): 370.
[5] Wang X, Zou S, Lan YL, et al. Solasonine inhibits glioma growththrough anti-inflammatory pathways[J]. Am J Transl Res, 2017, 9(9): 3977-89.
[6] 闫 霞, 郑佳露, 沈克平, 等. 龙葵抗肿瘤作用及机制研究[J]. 世界中西医结合杂志, 2017, 12(8): 1177-80.
[7] 吴建博. 龙葵碱通过诱导microRNA-138表达促进食管癌细胞对5-FU/DDP的药物敏感性[D]. 郑州: 郑州大学, 2019.
[8] 张福瑞. 龙葵碱增强肺腺癌细胞对顺铂和X射线敏感性及其机制研究[D]. 郑州: 郑州大学, 2016.
[9] Yang J, Huang WJ, Tan WF. Solasonine, A natural glycoalkaloidcompound, inhibits gli-mediated transcriptional activity[J].Molecules, 2016, 21(10): 1364.
[10]Pham MQ, Tran THV, Pham QL, et al. In silico analysis of thebinding properties of solasonine to mortalin and p53, and in vitropharmacological studies of its apoptotic and cytotoxic effects onhuman HepG2 and Hep3b hepatocellular carcinoma cells[J].Fundam Clin Pharmacol, 2019, 33(4): 385-96.
[11] Liu Z, Ma CJ, Tang XJ, et al. The reciprocal interaction betweenLncRNA CCAT1 and miR-375-3p contribute to the downregulationof IRF5 gene expression by solasonine in HepG2 humanhepatocellular carcinoma cells[J]. Front Oncol, 2019, 9: 1081.
[12]Zhong YB, Li SS, Chen LL, et al. In vivo toxicity of solasonine andits effects on cyp450 family gene expression in the livers of malemice from four strains[J]. Toxins, 2018, 10(12): 487.
[13]李龙妹, 黄锦鹏, 河文峰, 等. 龙葵提取物澳洲茄碱诱导A549细胞凋亡的机制研究[J]. 中药新药与临床药理, 2020, 31(12): 1422-7.
[14]Zeng YY, Luo YB, Ju XD, et al. Solasonine causes redox imbalanceand mitochondrial oxidative stress of ferroptosis in lungadenocarcinoma[J]. Front Oncol, 2022, 12: 874900.
[15]Zhang L, Li YD, Wang QC, et al. The PI3K subunits, P110α and P110β are potential targets for overcoming P-gp and BCRPmediatedMDR in cancer[J]. Mol Cancer, 2020, 19(1): 10.
[16]Yehia L, Keel E, Eng C. The clinical spectrum of PTEN mutations[J]. Annu Rev Med, 2020, 71: 103-16.
[17]Álvarez-Garcia V, Tawil Y, Wise HM, et al. Mechanisms of PTENloss in cancer: it's all about diversity[J]. Semin Cancer Biol, 2019,59: 66-79.
[18]Singh R, Letai A, Sarosiek K. Regulation of apoptosis in health anddisease: the balancing act of BCL-2 family proteins[J]. Nat RevMol Cell Biol, 2019, 20(3): 175-93.
[19]Warren CFA, Wong-Brown MW, Bowden NA. BCL-2 familyisoforms in apoptosis and cancer[J]. Cell Death Dis, 2019, 10(3): 177.
[20]Yang DL, He LJ, Ma SQ, et al. Pharmacological targeting of bcl-2induces caspase 3-mediated cleavage of HDAC6 and regulates theautophagy process in colorectal cancer[J]. Int J Mol Sci, 2023, 24(7): 6662.
[21]Gur C, Kandemir FM, Caglayan C, et al. Chemopreventive effects ofhesperidin against paclitaxel-induced hepatotoxicity andnephrotoxicity via amendment of Nrf2/HO-1 and caspase-3/Bax/Bcl-2 signaling pathways[J]. Chem Biol Interact, 2022, 365:110073.
[22]Liu T, Zhang BK, Gao YT, et al. Identification of ACHE as the hubgene targeting solasonine associated with non-small cell lung cancer(NSCLC) using integrated bioinformatics analysis[J]. PeerJ, 2023,11: e16195.
[23]Akbari-Birgani S, Khademy M, Mohseni-Dargah M, et al. Caspasesinterplay with kinases and phosphatases to determine cell fate[J].Eur J Pharmacol, 2019, 855: 20-9.
[24]Cheng YJ, Lee CH, Lin YP, et al. Caspase-3 enhances lungmetastasis and cell migration in a protease-independent mechanismthrough the ERK pathway[J]. Int J Cancer, 2008, 123(6): 1278-85.
[25]Delbridge AR, Strasser A. The BCL-2 protein family, BH3-mimeticsand cancer therapy[J]. Cell Death Differ, 2015, 22(7): 1071-80.
[26]Chen SC, Bie MJ, Wang XW, et al. PGRN exacerbates theprogression of non-small cell lung cancer via PI3K/AKT/Bcl-2antiapoptotic signaling[J]. Genes Dis, 2022, 9(6): 1650-61.
[27]Liu Y, Zhang TQ, Deng J, et al. The cytotoxicity of γδT cells in nonsmallcell lung cancer mediated via coordination of the BCL-2 andAKT pathways[J]. Oncogene, 2023, 42(49): 3648-54.
[28]Bo S, Lai J, Lin H, et al. Purpurin, a anthraquinone induces ROSmediatedA549 lung cancer cell apoptosis via inhibition of PI3K/AKT and proliferation[J]. J Pharm Pharmacol, 2021, 73(8): 1101-8.
[29]Zhou Y, Bai L, Tian L, et al. Iridium(III) -BBIP complexes induceapoptosis via PI3K/AKT/mTOR pathway and inhibit A549 lungtumor growth in vivo[J]. J Inorg Biochem, 2021, 223: 111550.
(编辑:经 媛)
基金项目:国家自然科学基金青年项目(82104456);中国博士后基金资助项目(2020M672745);广州市科技计划项目(202102020205);广东省中医药局中医药科研项目(20244026)

