川芎增强替莫唑胺对小鼠脑转移黑色素瘤脑的抑制作用
摘要:目的 探讨引经药川芎对黑色素瘤B16F10 脑转移的影响。方法 超声下左心室内注射黑色素瘤B16F10 建立C57BL/6J鼠脑转移瘤动物模型,通过小动物活体成像系统监测颅内荧光信号大小,当荧光信号强于5×106 光子/s时,将小鼠按照体质量随机分为2组。对照组:每日灌胃生理盐水;川芎组:每日灌胃给药,川芎饮片水提物以生理盐水溶解,浓度为1 mg/g。与对照组(生理盐水组)相比,考察川芎(1 mg/g)对黑色素瘤B16F10脑转移的影响。通过动物行为学立柱和粘签实验观察川芎对荷瘤小鼠的神经保护作用,以免疫荧光法观察川芎对血脑屏障完整性相关蛋白(ZO-1、Claudin-5、Occludin、P-gp、 TNF-α、AQP4 和PDGFRβ)、对神经元细胞增殖和凋亡的作用以及对小胶质细胞凋亡和活化的作用。通过小动物活体成像监测小鼠脑部荧光信号强度,考察川芎联合化疗药替莫唑胺对B16F10脑转移瘤的疗效。结果 与对照组比较,川芎组小鼠脑转移瘤无明显进展,体质量下降减慢,血脑屏障相关指标ZO-1、Claudin-5、Occludin、P-gp、TNF-α、AQP4 和PDGFRβ 受体蛋白水平下降(Plt;0.05)。动物行为学实验表明,川芎组小鼠木棍停留时间更长(Plt;0.05),取下粘签时间更短(Plt;0.05),免疫荧光结果显示脑部神经元细胞增殖增多(Plt;0.05),凋亡减少(Plt;0.05),小胶质细胞凋亡减少(Plt;0.05)。与对照组相比,川芎组小鼠脑转移瘤微环境中CD86、CD206、IL-4、IL-10水平升高(Plt;0.05),CD163、IL-1β水平降低(Plt;0.05)。川芎(1 mg/g)联合替莫唑胺(25 mg/kg)组脑部荧光信号显著低于替莫唑胺单药组。结论 川芎作为引经药在开放血脑屏障的同时并未促进黑色素瘤脑转移,且与替莫唑胺联用能增强替莫唑胺对脑转移黑色素瘤B16F10的治疗效果。
关键词:川芎;替莫唑胺;黑色素瘤;血脑屏障;脑转移
据国家癌症中心最新报告,仅2016 年,我国有近400万新发癌症病例,约240万患者死亡[1],转移是导致癌症患者死亡的主要原因[2]。随着医疗水平的提升,癌症患者带瘤生存时间延长,越来越多的癌症患者最终会发生脑转移。血脑屏障可限制中枢与外周间物质交换[3, 4],加之脑组织功能的特殊性,以目前的治疗手段难以有效抑制颅内肿瘤进展[5]。
颅内肿瘤为髓海之病,邪恶凝聚于脑。中医认为,脑病位于华盖之上,以引经药为向导, 使药力直达病所为治疗的关键[6, 7],中医引经药能引导其他药物直达病所,提高药物靶向性[8],在临床应用中,曹正柳教授根据不同部位肿瘤选用不同引经药,如肺肿瘤用桔梗、鼻咽癌用辛夷、山豆根,胃肠肿瘤用败酱草等[9],以增强化疗药治疗效果。川芎“引药上行”的功效能增加配伍药物在脑中的分布[10, 11],使其成为脑部疾病常用引经药[12, 13]。与现代医学研究川芎能通过调节紧密连接蛋白开放血脑屏障而增加脑中药物浓度结果一致[14]。由于血脑屏障限制抗肿瘤药物进入脑组织而发挥治疗效果,故临床上常配伍川芎用于脑转移瘤的治疗[15-21]。然而,当川芎用于脑转移瘤患者时,其打开血脑屏障的同时是否会促进颅内进展尚缺乏相关研究。
本研究以B16F10 黑色素瘤建立脑转移动物模型,探索川芎对黑色素瘤脑转移的影响,及肿瘤存在时对血脑屏障的作用,联合化疗药考察川芎用于治疗脑转移瘤的安全性,为临床上运用川芎作为引经药辅助治疗脑转移瘤患者提供实验依据。
1 材料和方法
1.1 材料
1.1.1 细胞
鼠源皮肤黑色素瘤细胞株B16-F10-LUC(中桥新舟)培养于DMEM完全培养基(中桥新舟),置于37 ℃、5 %CO2的培养箱内进行培养。
1.1.2 动物
SPF级C57BL/6J小鼠,雄性,18~22 g,5周龄,由杭州子源实验动物科技有限公司提供,合格证号:20221128Abzz0105000848,适应性饲养1周,自由摄取食物与水源,在温度为20~25 ℃下维持光照和黑暗各12 h,相对湿度为(50±5) %。本研究经蚌埠医科大学实验动物中心和伦理委员会批准(审批号:伦动科批字[2022]第177号)。
1.1.3 主要试剂和仪器
主要试剂:川芎饮片(安徽协和成药业饮片有限公司,产地:四川彭州),经蚌埠医科大学李红梅副教授鉴定为伞形科藁本属植物川芎的干燥根茎。川芎水提物:称取川芎饮片60 g,加300 g的水,浸泡30 min 后,冷凝回流提取2 次,第1 次35 min,第2次30 min。合并2次提取液,过滤。冷冻干燥后将药液浓缩至含生药0.2 g/mL,4 ℃冰箱内存放备用。;胰酶消化液(Biosharp)、青霉素-链霉素(Biosharp)、RIPA裂解液(Biosharp)、DAPI染色试剂(即用型)(Biosharp)、4%多聚甲醛组织固定液(Biosharp);BCA蛋白浓度测定试剂盒(Beyotime) ; CCK-8 (APEBIO) ; ZO-1(Proteintech) 、TNF-alpha (Proteintech) 、PDGFReceptor β 抗体(Proteintech)、P-gp(Proteintech)、Claudin-5 (Proteintech) 、Occludin (Proteintech) 、Aquaporin 4(Proteintech)、CD163(Proteintech)、CD68(Proteintech)、CD86(Proteintech)、Mannose Receptor/CD206(Proteintech)、IL-1 beta(Proteintech)、IL-4(Proteintech)、IL-6(Proteintech)、IL-10(Proteintech);Cleaved- Caspase-3 (Cell Signaling Technology) 、NeuroN(Cell Signaling Technology)、TMEM119(CellSignaling Technology,);山羊抗兔IgG(Abcam)。主要仪器:恒温二氧化碳培养箱(Thermo Fisher);Vevo2100小动物高分辨率超声成像系统(VisualSonics);FX-PRO小动物活体荧光成像系统(Zeiss);AF100 制冰机(SCOTSMAN);IX71倒置荧光显微镜(OLYMPUS)。
1.2 方法
1.2.1 细胞培养
在培养瓶中加入3 mL新鲜DMEM完全培养液,打开恒温水浴锅并预热至37 ℃。将从-80 ℃冰箱取出的细胞在水浴锅中解冻后吸至5 mL离心管并离心(900 r/min,4 min),吸弃上清,以新鲜DMEM完全培养液吹打混匀,将含细胞的培养液加至预先加入3 mL新鲜DMEM完全培养液的培养瓶中,混匀并放置于细胞培养箱中培养。
1.2.2 小鼠造模及分组给药
取Luc标记的处于对数生长期的黑色素瘤细胞B16F10,离心、计数,用PBS调整细胞密度为1×107/mL,用1 mL注射器吸取0.1 mL细胞悬液置于冰上备用。用异氟烷麻醉已提前备皮的小鼠并采取仰卧位固定,在超声下依据心脏长轴找到左心室,用酒精擦拭小鼠脱毛部位消毒,在胸骨左侧3 mm处第3肋间,与体表呈45 °进针,针尖没入小鼠体内3~5 mm,以能在小动物高分辨率超声成像系统上看到一个明显亮点,同时针尖处有红色血柱涌入针管为顺利进针左心室,缓慢匀速将B16F10细胞接种到左心室内,短暂停留后慢慢拔出注射器,以棉签按压止血。种瘤7 d后根据荧光信号将小鼠随机分组(20 只/组)并给药,将川芎以生理盐水溶解,制成浓度为1 mg/g的混悬液,灌胃给药5 d,每只0.2 mL/d,空白对照 组小鼠灌胃等体积生理盐水溶液。观察川芎联合替莫唑胺(25 mg/kg)治疗效果时,对照组为溶剂,。
1.2.3 小动物活体成像系统评价黑色素瘤脑转移
将生理盐水配制的D-荧光素钾盐溶液(15 mg/mL)以0.2 μm滤膜过滤除菌,置于冰上,避光保存备用。小鼠按照体质量计算,以10 μL/g的剂量对小鼠腹腔注射荧光素钾盐溶液,注射后让小鼠自由活动15 min,然后以异氟烷气体诱导麻醉,麻醉后迅速将小鼠置于活体成像系统内曝光成像,通过生物发光的光子信号强度评价脑转移瘤的生长状况。
1.2.4 动物行为学实验观察川芎对荷瘤小鼠神经损伤的保护作用
动物行为学包括粘签实验和立柱实验。粘签实验又称感觉不对称试验,用于评价小鼠皮肤敏感性和感觉功能。将富有粘性的方形胶布(0.3 cm×0.3 cm)贴于小鼠前爪无毛处,记录小鼠撕下胶布的时间,以120 s为时间上限,超过120 s未撕下记录为120 s。立柱实验用于评估小鼠前肢抓握能力和运动协调能力。将一根长90 cm的木棍竖直固定在距离地面约40 cm的位置,木棍下方鼠笼装有垫料,实验时将小鼠头部朝向同一个方向放置于木棍中央,分别记录每只小鼠抓握和爬行所需时间,以60 s为时间上限,超过60 s未跌落记为60 s。动物行为学实验均重复3 次,每次间隔1 h,结果取3次平均值。
1.2.5 免疫荧光染色
对照组与川芎组灌胃给药后30 min,取脑组织在OCT包埋液中进行速冻,切片后置于37 ℃烘箱烘烤10~20 min,固定30 min后,用PBS洗涤3 次, 5 min/次。用组化笔画圈,BSA封闭30 min。4 ℃下孵育一抗过夜,PBS洗涤3次,加对应二抗,室温下避光孵育50 min,PBS洗涤3 次,加DAPI 染液,室温下避光孵育10 min,PBS洗涤3次,加自发荧光淬灭剂B液5 min,流水冲洗10 min,加入抗荧光淬灭封片剂封片。切片置于荧光显微镜下观察并拍照。各抗体稀释比例:ZO-1(1∶1000)、TNF-α(1∶100)、PDGFRβ(1∶3000)、P-gp(1∶200)、Claudin-5(1∶300)、Occludin(1∶1000)、AQP4(1∶100)、TMEM119(1∶300)、NeuroN(1∶100)、Cleaved- Caspase-3(1∶400)、二抗(1∶1000)。
1.2.6 TUNEL染色
冷冻切片于37 ℃烘烤10~20 min,多聚甲醛固定30 min,PBS洗涤3次,滴加蛋白酶K工作液覆盖组织,37 ℃孵育22 min后,PBS洗涤3次。滴加破膜工作液覆盖组织,常温下孵育20 min,PBS 洗涤3次。滴加buffer覆盖组织,常温孵育10 min。滴加tunel试剂覆盖组织,放于湿盒内,37 ℃孵育2 h,PBS 洗涤3次,滴加DAPI 染液,避光室温孵育10 min,PBS洗涤3次,加入抗荧光淬灭封片剂封片。切片于荧光显微镜下观察并采集图像。
1.2.7 免疫组化
冷冻切片于37 ℃烘烤10~20 min,甲醇固定20 min,PBS洗涤3次后置于3 %双氧水溶液中室温避光孵育25 min,PBS洗涤3次,3 %BSA室温封闭30 min,PBS洗涤3次后加入一抗,4 ℃孵育过夜,PBS洗涤3次,滴加二抗,室温孵育50 min,PBS洗涤3次,滴加新鲜配制的DAB显色液,自来水冲洗切片终止显色。苏木素复染3 min,自来水洗,苏木素分化液分化数秒,自来水冲洗,苏木素返蓝液返蓝,流水冲洗。将切片依次放入75 %酒精、85 %酒精、无水乙醇Ⅰ、无水乙醇Ⅱ、正丁醇和二甲苯中各5 min 脱水,封片胶封片后于白光显微镜下观察并采集图像。各抗体稀释比例:CD163(1∶2000)、CD68(1∶100)、CD86(1∶200)、CD206(1∶20000)、IL-1β(1∶100)、IL-4(1∶100)、IL-6(1∶100)、IL-10(1∶200)、二抗(1∶1000)。
1.2.8 统计学分析
每组免疫组化结果选取6个低倍视野(×200),采用 ImageJ 软件进行平均光密度值(OD值)分析,采用 Graphpad Prism 8.0.2 统计软件对数据进行统计分析,结果采用均数±标准差表示。两组间采用LSD-t检验,多组间采用单因素方差分析,以Plt;0.05为差异有统计学意义。
2 结果
2.1 川芎对B16F10黑色素瘤细胞脑转移无影响
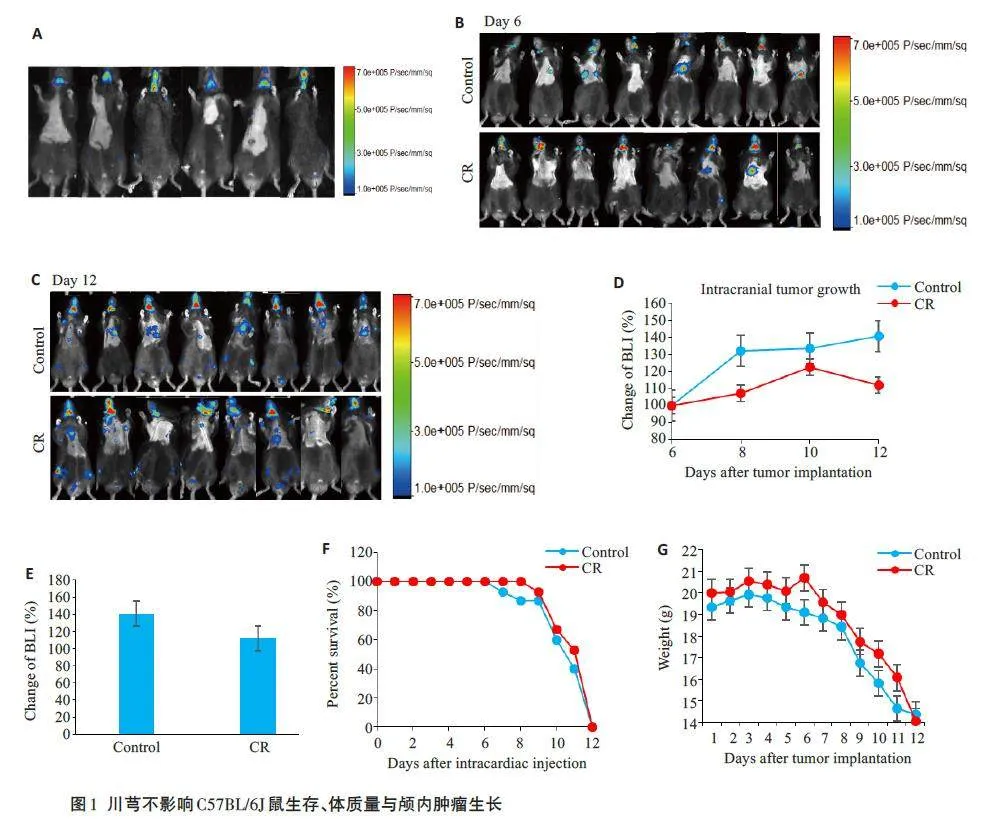
造模6 d后,小动物活体成像结果显示小鼠脑部出现强生物发光信号,表明成功建立B16F10细胞心内注射脑转移瘤动物模型(图1A);造模6 d后各组小鼠均出现脑转移(图1B);第6天开始给药,小动物活体成像结果显示,与对照组相比,川芎组小鼠颅内肿瘤生长受抑制(图1C、D),但差异无统计学意义(图1E),生存时间无明显变化(图1F),小鼠体质量缓慢下降(图1G)。
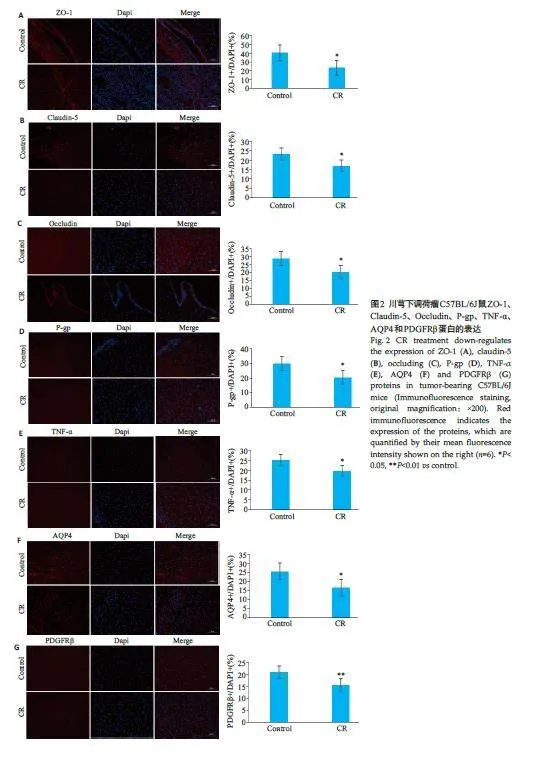
2.2 川芎调节血脑屏障通透性
免疫荧光结果显示,与对照组相比,川芎组小鼠闭锁连接蛋白-1(ZO-1)、密封蛋白-5(Claudin-5)、闭合蛋白(Occludin)、P- 糖蛋白(P-gp)和肿瘤坏死因子α(TNF-α)受体蛋白、水通道蛋白4(AQP4)与血小板衍生生长因子受体β(PDGFRβ)表达显著下调(图2A~G,Plt;0.05)。
2.3 川芎减轻B16F10脑转移小鼠的神经损伤
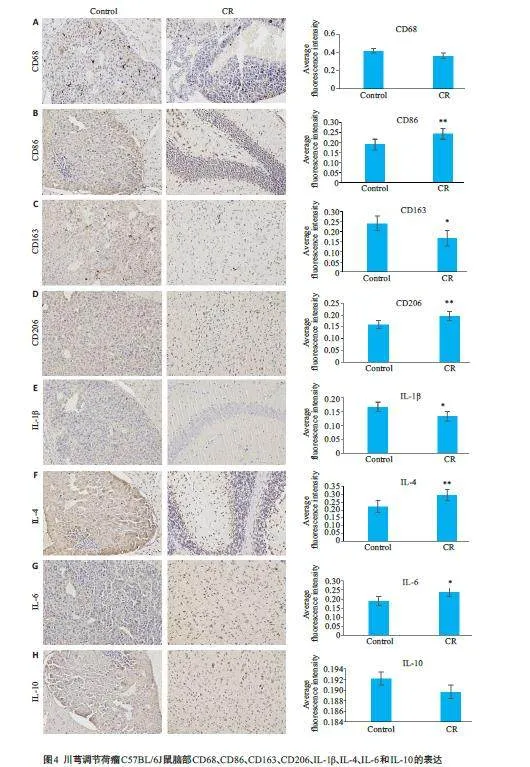
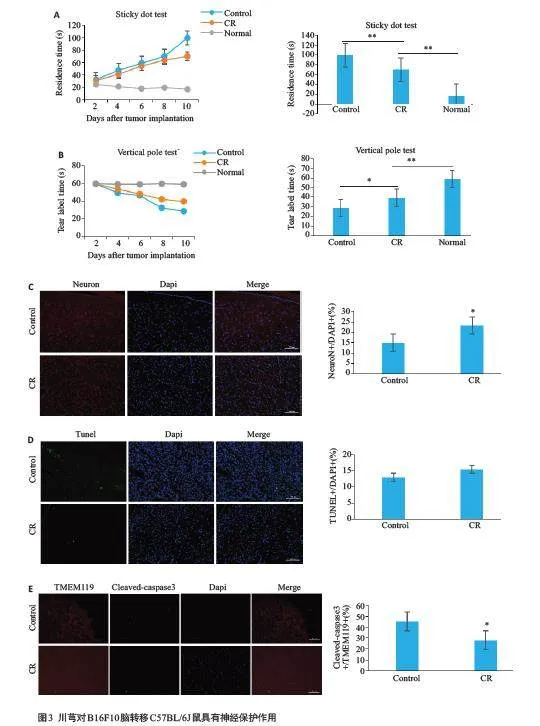
与正常组小鼠相比,对照组小鼠撕下粘签时间显著延长,立柱停留时间显著缩短;与对照组相比,川芎组小鼠撕下粘签时间显著缩短,立柱停留时间显著延长(图3A、B,Plt;0.01),免疫荧光染色显示,与对照组相比,川芎组小鼠脑部神经元细胞增殖显著性增多(图3C,Plt;0.05),神经元细胞凋亡减轻(图3D);胶质细胞凋亡显著减少(图3E,Plt;0.05)。免疫组化染色显示,与对照组相比,川芎组小胶质细胞CD68表达差异无统计学意义(图4A),CD86表达显著升高(图4B,Plt;0.01),CD163表达显著下降(图4C,Plt;0.05)、CD206显著上调(图4D,Plt;0.01),炎症细胞因子IL-1β水平显著下调(图4E,Plt;0.05),IL-6(图4F,Plt;0.01)和IL-4(图4G,Plt;0.05)水平显著升高,IL-10水平差异无统计学意义(图4H,Pgt;0.05)。
2.4 川芎增强替莫唑胺抑制脑转移黑色素瘤B16F10生长的作用
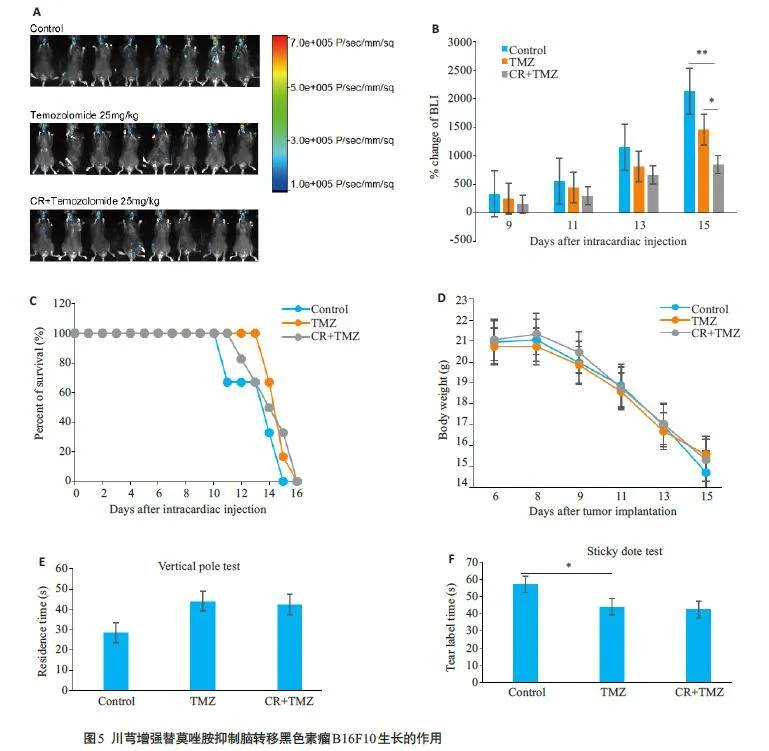
与替莫唑胺单药组相比,川芎联合替莫唑胺组颅内肿瘤生长受到抑制显著(图5A、B,Plt;0.05),小鼠生存周期和体质量差异无统计学意义(图5C、D),粘签实验与立柱实验差异无统计学意义(图5E、F)。
3 讨论
高分辨率超声可以清晰观察到B16F10 细胞被精准注入小鼠左心室内,待脑转移瘤形成后,通过小动物活体成像仪体外监测肿瘤进展[22]。与对照组相比,川芎组小鼠脑部荧光信号增长缓慢,差异无统计学意义。两组小鼠生存曲线差异无统计学意义。川芎组小鼠平均体质量大于对照组,TUNEL染色显示川芎组小鼠脑组织损伤更轻。以上结果提示,川芎并未促进B16F10黑色素瘤颅内进展。
川芎善“上行头目”, 能引诸药直达头部,现代研究发现其具有调节血脑屏障的作用。血脑屏障由血管内皮细胞、星形胶质细胞足突以及周细胞构成,可以防止血浆中毒性物质和病原体等进入大脑[23],也会使临床药物难以进入脑组织发挥治疗效果。ZO-1、Claudin 5、Occludin蛋白在调控血管内皮细胞与脑实质间物质交换上发挥作用,其功能包括调节内皮细胞间紧密连接和细胞间隙[24]。通过免疫荧光观察ZO-1、Claudin 5、Occludin蛋白表达变化可以反映出血管内皮细胞转运功能的变化,结果显示,与对照组相比,川芎组小鼠脑组织ZO-1、Claudin 5、Occludin蛋白表达显著下降。表明川芎可以打开内皮细胞紧密连接,增加血脑屏障的通透性。P-gp蛋白位于血管内皮细胞上,多种化疗药物是其底物,能被主动转运而降低脑中药物浓度,是影响化疗药疗效的重要原因[25, 26],通过免疫荧光观察P-gp蛋白的变化,可以考察川芎是否具有通过抑制P-gp 蛋白而提高化疗药浓度的潜力,结果显示,与对照组相比,川芎组小鼠脑组织P-gp蛋白表达显著下降。当脑转移瘤存在时,内皮细胞TNF-α水平升高,损害血脑屏障的完整性[27]。观察给予川芎后小鼠脑组织TNF-α水平变化,可以考察川芎对脑转移瘤存在时血脑屏障完整性的作用。结果显示,与对照组相比,川芎组小鼠脑组织TNF-α表达显著下降,表明川芎能减轻TNA-α引起的血脑屏障损伤。颅内水肿是脑转移瘤患者常见的临床表现,AQP4是存在于星形胶质细胞足突的水通道转运蛋白4,调控血脑屏障中水运输[28],PDGFRβ为周细胞标志物,周细胞的血管覆盖率影响内皮细胞通透性,与脑部水肿密切相关[29, 30]。通过检测AQP4 与PDGFRβ蛋白表达变化,可以观察川芎对血脑屏障水运输的作用。结果显示,与对照组相比,川芎组小鼠脑组织AQP4 与PDGFRβ蛋白表达显著下降。与既往研究结果一致,川芎可以通过AQP4与PDGFRβ蛋白调节血脑屏障水转运,有利于减轻脑部水肿[31]。以上结果表明,在脑转移瘤存在时,川芎通过作用于血管内皮细胞紧密连接蛋白、P-gp蛋白、TNF-α含量而开放血脑屏障通透性,通过作用于星形胶质细胞足突上AQP4蛋白与周细胞调节血脑屏障功能,且川芎对血脑屏障的开放作用不会增强黑色素瘤脑转移。
脑转移瘤的存在会引起大脑功能受损,导致认知功能障碍[32],通过粘签实验与立柱实验发现,造模后小鼠感觉能力与抓握能力明显降低,表明心内注射形成的黑色素脑转移瘤对小鼠神经造成损伤。由于川芎具有神经保护作用[33],我们通过动物行为学和免疫荧光实验探索给予川芎后对脑转移小鼠神经元细胞损伤的影响。与汤锡锋等人报道的川芎嗪减轻肺癌脑转移瘤带来的脑部负担一致[34],本研究中立柱和粘签实验显示,川芎组小鼠行为学表现更好,脑组织切片染色显示川芎组小鼠神经元细胞增殖增加,凋亡减少。小胶质细胞是中枢神经系统的组织驻留巨噬细胞样先天性免疫细胞[35],TMEM119 为小胶质细胞标志物[36],免疫荧光结果显示,与对照组相比,川芎组小鼠小胶质细胞凋亡显著减少。小胶质细胞在应激状态下能极化形成M1和M2表型[37],M1 小胶质细胞释放促炎因子,表面标志物包括CD68 和CD86 蛋白,M2 小胶质细胞释放抗炎因子,表面标志物包括CD206和CD163[38-40]。本研究结果表明,黑色素脑转移瘤B16F10存在时给予川芎,M1和M2小胶质细胞受到不同程度极化,促炎因子IL-1β水平降低,IL-6水平升高,抗炎因子IL-4水平升高,IL-10含量无明显变化,从整体结果观察,提示川芎发挥抗炎抗肿瘤作用。
替莫唑胺(TMZ)为二代咪唑四嗪类烷基化剂,其作用机制为DNA甲基化和错配修复失败,为临床常用的脑部肿瘤化疗药[41]。本实验中,小动物活体成像仪监测到,与替莫唑胺单药组相比,川芎联合替莫唑胺能显著抑制B16F10 黑色素瘤脑转移。本研究表明,在B16F10黑色素脑转移瘤存在时,川芎能抑制神经元细胞和小胶质细胞凋亡,促进小胶质细胞活化,与抗肿瘤药物替莫唑胺联合能发挥更好的治疗效果。
综上所述,川芎在开放血脑屏障的同时并未促进B16F10黑色素瘤脑转移,可协助其他药物跨过血脑屏障用于脑转移瘤的治疗;川芎能通过神经元细胞和小胶质细胞调节中枢神经系统的功能,介导小胶质细胞对肿瘤细胞的免疫应答;川芎能增强化疗药替莫唑胺对B16F10黑色素脑转移瘤的治疗效果。本课题组将在后期研究中通过微透析法、液质联用法、细胞膜色谱法等深入探索川芎开放血脑屏障和保护脑组织的作用机制,为临床上是否可以将川芎类引经药用于脑部肿瘤的治疗提供实验依据。
参考文献:
[1] 徐睿锋, 孙 鑫, 田 雨, 等.《 2016年中国癌症发病死亡数据》要点解读[J]. 中国胸心血管外科临床杂志, 2024, 31(3): 343-56.
[2] Gerstberger S, Jiang QW, Ganesh K. Metastasis[J]. Cell, 2023, 186(8): 1564-79.
[3] Gampa G, Vaidhyanathan S, Sarkaria JN, et al. Drug delivery tomelanoma brain metastases: can current challenges lead to newopportunities?[J]. Pharmacol Res, 2017, 123: 10-25.
[4] Boire A, Brastianos PK, Garzia L, et al. Brain metastasis[J]. NatRev Cancer, 2020, 20(1): 4-11.
[5] Vogelbaum MA, Brown PD, Messersmith H, et al. Treatment forbrain metastases: ASCO-SNO-ASTRO guideline[J]. J Clin Oncol,2022, 40(5): 492-516.
[6] 马晓依. 中医脑病引经药应用的研究进展[J]. 中西医结合心血管病电子杂志, 2019, 7(34): 13-4.
[7] 张佳慧, 念家云, 于明薇, 等. 基于数据挖掘探讨燕京肿瘤医家秦厚生治疗头颈部恶性肿瘤用药规律[J]. 辽宁中医杂志, 2023, 50(1):134-8, 224.
[8] 张 帅, 赵汉青. 引经报使理论探析[J]. 医学研究与教育, 2023, 40(5): 38-45.
[9] 彭中娟, 曹正柳. 曹正柳教授对恶性肿瘤的认识及治疗经验介绍[J]. 光明中医, 2023, 38(7): 1363-7.
[10]王 平, 王 晨, 楼一层. 冰片、川芎对复方舒郁健脑方剂透过血脑屏障的作用研究[J]. 湖北中医药大学学报, 2011, 13(5): 21-3.
[11]郑 琴, 刘嘉宇, 傅声玲, 等. 川芎对天麻苷元大鼠脑内药动学的影响[J]. 中国新药与临床杂志, 2012, 31(5): 263-6.
[12]陈 龙, 王瑞锋, 张振凯, 等.基于药动学-药效学的中药引经理论现代研究进展与思考[J].中成药, 2023: 网络首发.
[13]于 新, 柴军红, 孔祥文, 等. 基于归经理论指导下川芎治疗头痛的研究进展[J]. 中医药学报, 2023, 51(2): 113-20.
[14]刘明妍, 刘力榕, 冯梦晗, 等. 川芎调节血脑屏障通透性的作用及机制研究[J]. 中草药, 2024, 55(1): 138-47.
[15]阿 丽·赛力克, 张津铖, 程志强. 浅谈中医药辅助治疗结直肠癌脑转移的经验[J]. 中日友好医院学报, 2023, 37(3): 180-1, 189.
[16]邓有金, 万冬桂. 引经理论联合靶向药治疗乳腺癌脑转移[J]. 中华中医药杂志, 2019, 34(10): 4679-82.
[17]管程程. 解毒消积方联合EP方案治疗广泛期小细胞肺癌的临床研究[D]. 济南: 山东中医药大学, 2023.
[18]梁嘉慧. 扶正健脑膏预防气虚痰湿型广泛期小细胞肺癌脑转移的临床研究[D]. 长春: 长春中医药大学, 2023.
[19]秦立梅. 通窍抑瘤方联合放疗治疗恶性肿瘤脑转移的临床研究[J].中西医结合心血管病电子杂志, 2020, 8(4): 151.
[20]余晓琳, 周 强, 唐有瑜, 等. 陈军平主任运用活血化瘀法治疗恶性肿瘤血瘀证经验[J]. 福建中医药, 2021, 52(9): 41-3.
[21]袁梦琪, 罗 璠, 万冬桂. 从“内风暗旋” 论治乳腺癌脑转移经验[J].环球中医药, 2021, 14(4): 714-7.
[22]李荫龙, 张 栋. 小动物活体体内光学成像技术的应用进展[J]. 中国中西医结合杂志, 2015, 35(1): 118-23.
[23]Sweeney MD, Zhao Z, Montagne A, et al. Blood-brain barrier: fromphysiology to disease and back[J]. Physiol Rev, 2019, 99(1): 21-78.
[24]Arvanitis CD, Ferraro GB, Jain RK. The blood-brain barrier andblood-tumour barrier in brain tumours and metastases[J]. Nat RevCancer, 2020, 20(1): 26-41.
[25]吴海霞, 刘姗姗, 胡鹏翼, 等. 川芎挥发油调控P-糖蛋白协同替莫唑胺的胶质瘤治疗作用及机制[J]. 中草药, 2019, 50(22): 5492-8.
[26]郝 雨, 朱宝琛, 薛春苗, 等. 基于P糖蛋白研究仙茅对顺铂耐药非小细胞肺癌细胞的增敏机制[J]. 世界中医药, 2022, 17(24): 3462-6,3471.
[27]Cheng Y, Desse S, Martinez A, et al. TNFα disrupts blood brainbarrier integrity to maintain prolonged depressive-like behavior inmice[J]. Brain Behav Immun, 2018, 69: 556-67.
[28]Nagelhus EA, Ottersen OP. Physiological roles of aquaporin-4 inbrain[J]. Physiol Rev, 2013, 93(4): 1543-62.
[29]Daneman R, Zhou L, Kebede AA, et al. Pericytes are required forblood-brain barrier integrity during embryogenesis[J]. Nature,2010, 468(7323): 562-6.
[30]Miners JS, Schulz I, Love S. Differing associations between Aβaccumulation, hypoperfusion, blood-brain barrier dysfunction andloss of PDGFRB pericyte marker in the precuneus and parietal whitematter in Alzheimer's disease[J]. J Cereb Blood Flow Metab, 2018,38(1): 103-15.
[31]吴德野, 曹 艳, 李恒希, 等. 大麻二酚对创伤性脑损伤大鼠脑组织AQP4表达的影响[J]. 中国临床解剖学杂志, 2023, 41(2): 178-81.
[32]黄进城, 张宗平, 谭 鑫, 等. 脑转移瘤与认知功能障碍研究进展[J].中国医学创新, 2021, 18(9): 168-72.
[33]王 敏, 姚明江, 刘建勋, 等. 川芎对神经细胞保护作用活性成分的研究[J]. 世界中西医结合杂志, 2021, 16(5): 793-8.
[34]汤锡锋, 纪新尊, 吉晓天. 川芎嗪联合贝伐单抗治疗晚期非小细胞肺癌脑转移的临床观察[J]. 中药药理与临床, 2018, 34(2): 115-8.
[35]Prinz M, Jung S, Priller J. Microglia biology: one century ofevolving concepts[J]. Cell, 2019, 179(2): 292-311.
[36]Tsai AP, Dong CP, Lin PB, et al. PLCG2 is associated with theinflammatory response and is induced by amyloid plaques inAlzheimer's disease[J]. Genome Med, 2022, 14(1): 17.
[37]李 磊, 孙秀兰. 代谢重编程对小胶质细胞功能的调节作用[J]. 南京医科大学学报: 自然科学版, 2024, 44(1): 105-14.
[38]Lan X, Han XN, Li Q, et al. Modulators of microglial activation andpolarization after intracerebral haemorrhage[J]. Nat Rev Neurol,2017, 13(7): 420-33.
[39]Wachholz S, Eßlinger M, Plümper J, et al. Microglia activation isassociated with IFN‑α induced depressive-like behavior[J]. BrainBehav Immun, 2016, 55: 105-13.
[40]Zeiner PS, Preusse C, Golebiewska A, et al. Distribution andprognostic impact of microglia/macrophage subpopulations ingliomas[J]. Brain Pathol, 2019, 29(4): 513-29.
[41]Schaff LR, Mellinghoff IK. Glioblastoma and other primary brainmalignancies in adults: a review[J]. JAMA, 2023, 329(7): 574-87.
(编辑:余诗诗)
基金项目:安徽省科技重大专项(201903a07020029);蚌埠医科大学横向课题(2019-BYHX-03);安徽省教育厅高校科研项目(KJ2021a0702);安徽省自然科学基金(1908085QH373);安徽省教育厅自然科学研究项目(KJ2020a0565);安徽省重点研究与开发计划资助项目(202104g01020017);蚌埠医科大学研究生科研创新计划项目(Byycx22059)

